
- DAZ.online
- DAZ / AZ
- DAZ 7/2023
- Potenzielle ...
Lieferengpässe
Potenzielle Eintrittskarte CEP
Wie sich Arzneimittellieferengpässe verhindern lassen könnten – ein Denkmodell
Apotheken sollen, können und dürfen Arzneimittel herstellen und ermöglichen gerade damit eine Versorgung der „von der Norm abweichenden“ Patienten. Und natürlich können die Apotheken das auch bei Lieferengpässen oder Totalausfällen der Industrie und der Zulieferer tun. Die vielfältigen Gründe für die diversen Ausfälle der letzten Zeit wurden in der Fachpresse bereits ausreichend diskutiert und erläutert. Spätestens vor drei Jahren sollte der Politik und der Öffentlichkeit bewusst geworden sein, welchen Vorteil ausreichend viele Einzelbetriebe – wie zum Beispiel Apotheken – haben, wenn sie in kleinteiliger Arbeit die Versorgung der Bevölkerung aufrechterhalten können, während oligopolistisch geprägte Märkte versagen. Im Februar 2020, als die Corona-Welle mit all ihren wirtschaftlichen Verwerfungen in Deutschland angekommen war, wurden schnell die Regale mit Desinfektionsmitteln bei diversen Drogeriemärkten komplett leergekauft. Nicht wenige Apotheken begannen größere Mengen an Isopropanol oder Ethanol sowie entsprechende Abgabebehältnisse zur Herstellung von Desinfektionsmittel zu beschaffen.
Währenddessen wuchs die Liste der Defekte und nicht lieferbaren Fertigarzneimittel weiter. Der Mangel an Schmerz- und Fiebersäften auf Paracetamol- oder Ibuprofen-Basis zeigt seit einigen Monaten ganz deutlich auf, wohin politische Entscheidungen wie die Rabattverträge der Krankenkassen mit Herstellern führen. Unternehmen stoppen (temporär oder dauerhaft) die Produktion oder liefern gar nicht mehr nach Deutschland, weil ihre Produkte in anderen Ländern bessere Margen abwerfen. Steigende Energie- und Logistikkosten bringen dann die mit spitzem Stift und heißer Nadel gestrickten Herstellungs- und Lieferpläne zu Fall. Zurzeit gibt es beim Wirkstoff Paracetamol einen abebbenden chinesischen Ausfuhrstopp. Die Chinesen beanspruchen ihre nationale Paracetamol-Produktion schlichtweg selbst aufgrund der stark ansteigenden Corona-Fälle und zunehmender anderer Atemwegserkrankungen.
Wieder sind es die Apotheken hierzulande, welche versuchen, die Versorgung aufrechtzuerhalten. Es werden aus Tabletten und Kapseln auf Grundlage von NRF-Rezepturen Säfte und Suspensionen zur Versorgung pädiatrischer Patienten hergestellt.
Einige Apotheken versuchen darüber hinaus pragmatisch und lösungsorientiert zur Aufrechterhaltung der Patientenversorgung sogar die entsprechenden Wirkstoffe (Active Pharmaceutical Ingredients, API) einzukaufen oder selbst zu importieren, wenn diese über die einschlägigen Lieferanten nicht mehr erhältlich sind. Hierbei zeigt sich allerdings schnell, dass die Märkte in Europa in immer häufigeren Fällen erschöpft – quasi leergekauft – und nicht mehr lieferfähig sind. Die erweiterte Suche nach Lieferanten führt im Zeitalter der Lockdowns und Lieferengpässe unweigerlich in die sogenannten Drittländer wie China oder Indien. Immerhin können diese fast immer liefern. Allerdings wird es schnell kompliziert, denn es drohen regulatorische Fallstricke.
Drittländer sind Länder, die nicht Mitgliedstaaten der EU oder andere Vertragsstaaten des Abkommens über den Europäischen Wirtschaftsraum sind. Auch finden sich klassische Drittländer wie China und Indien nicht auf der sogenannten „white list“ der Europäischen Kommission.
Bei einer API-Einfuhr aus Herstellungsländern der „white list“ entfällt beispielsweise die Vorlage der Bescheinigungen nach § 72a (1) Nr. 1 oder 2 Arzneimittelgesetz (AMG).
Findet sich das Herstellungsland nicht auf der „white list“ muss eine Bestätigung der zuständigen Behörde des Herstellungslandes vorgelegt werden.
In dieser sogenannten „written confirmation“ müssen unter anderem die folgenden Punkte adressiert werden:
- Bestätigung der ausstellenden Behörde, dass gemäß Good Manufacturing Practice (GMP) der EU oder einem gleichwertigen Standard wie ICH Q7 der WHO gearbeitet wurde.
- Bestätigung der Behörde, dass der Herstellungsbetrieb regelmäßig überwacht wurde und durch wiederholte (auch unangekündigte) Inspektionen überwacht wird.
- Bestätigung der ausstellenden Behörde, dass bei wesentlichen Abweichungen von anerkannten GMP-Regeln die zuständige Behörde der EU informiert wird.
Aus der bisherigen Erfahrung des Autors dieses Beitrags ist eine solche „written confirmation“ fast nie verfügbar. Daher stellt sich in Zeiten des Lockdowns und der vielfältigen und großen Lieferproblematiken ganz dringend die Frage: Wie kann es jetzt weitergehen?
Der Bedarf an API ist zweifellos vorhanden – das kann niemand leugnen. Die Anfragen von Kliniken, Praxen und Patienten häufen sich, regulatorisch sind einem dabei allerdings die Hände gebunden.
Ein Beispiel
In Europa und den Ländern der „white list“ ist ein bestimmter API wie zum Beispiel Valsartan (positiv auf Nitrosamine geprüft) nicht erhältlich. Ein dringender Bedarf ist allerdings gegeben, da einige Patienten aus medizinischen Gründen nicht auf ein anderes Sartan umgestellt werden können. In der Folgezeit sind dann auch Losartan, Olmesartan, Irbesartan und Candesartan von Nitrosamin-Verunreinigungen betroffen.
Häufig bieten dann die Hersteller in China oder Indien ein API an, welches den Anforderungen der gängigen Pharmakopöen entspricht. Denn natürlich haben diese Hersteller auch alle wichtigen Märkte im Blick. Solche API geraten dann gegebenenfalls über Umwege zu uns, da sie oft weder ein GMP-Zertifikat noch eine „written confirmation“ haben. Beliebt ist hier der Umweg über eines der EU-Länder mit weniger strengen Anforderungen oder mehr „Spielräumen“ für den Import. Vom Händler in diesem EU-Land dürfte dann beispielsweise eine deutsche Apotheke – bei Vorliegen der nötigen Dokumente – den jeweiligen Wirkstoff einkaufen.
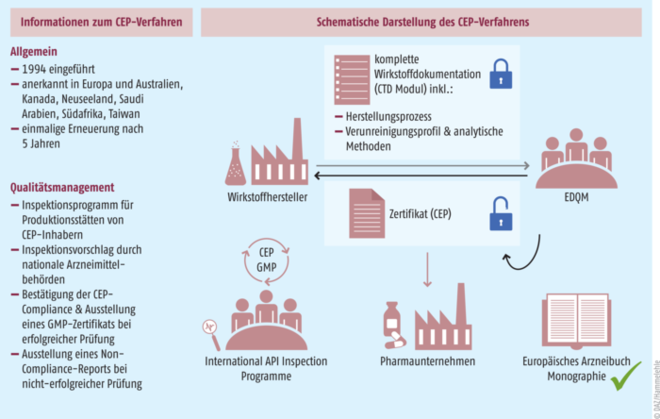
Ablauf des CEP-Verfahrens für active pharmaceutical ingredients (API). Quelle: Mundicare, ProGenerika. Woher kommen unsere Wirkstoffe? Eine Weltkarte der API-Produktion. Finaler Report, 2020. Abruf unter www.progenerika.de/app/uploads/2020/10/Wirkstoffstudie_Langfassung_DE.pdf
Ein Gedankenmodell
Das Dilemma ist bei einer Nichtverfügbarkeit groß, und es stellt sich die Frage, ob hier nicht flexible Lösungen erarbeitet werden könnten oder es an der Zeit wäre, über Erleichterungen im Sinne von „must have“ und „nice to have“ nachzudenken. Ganz dringend muss immer die Qualität der Wirkstoffe gewahrt werden. Es geht bei dem folgenden Gedankenmodell auch nicht um Bestellungen in „normalen Zeiten“. Vielmehr geht es darum, für den „Krisenfall“ klare Prozedere und Abläufe zu definieren, um dann schnell und effektiv handeln zu können.
Sollte man also nicht „prophylaktisch“ über Ausnahmeregeln nachdenken können?
Im Bereich der marktbeherrschenden asiatischen Wirkstoffhersteller wäre es durchaus bedenkenswert, ob eine bereits erteilte Konformitätsbescheinigung für Arzneistoffe oder pharmazeutische Hilfsstoffe (CEP) in einer Krisenlage als Voraussetzung für einen API-Import als ausreichend betrachtet werden könnte. Selbstverständlich müssten dann in Deutschland zur Prüfung weitere Untersuchungen gemäß des Ph. Eur. durchgeführt werden. Es wäre so aber viel leichter möglich, einen Wirkstoff ins Land zu holen, denn die asiatischen Wirkstoffhersteller haben ein natürliches Interesse an der Beantragung und Erteilung eines CEP – es stellt praktisch die „Eintrittskarte“ dar, um mit den großen deutschen, europäischen und globalen Pharmaherstellern ins Geschäft kommen zu können.
Dieses Spiel mit einer CEP als Eintrittskarte haben wir in Deutschland übrigens leider verlernt. Europa hat im Zeitraum von 2000 bis 2020 die Anzahl von CEPs von 348 auf 1260 gesteigert. Asiatische Hersteller erhöhten in diesem Zeitraum von 183 auf 2369 CEPs. Gründe für diese Entwicklung sind unter anderem geringere regulatorische Anforderungen, niedrigere Energie- und Lohnkosten sowie niedrigere Umweltauflagen. Zusätzlich werden die API-Hersteller in Asien gezielt vom Staat gefördert, um neue Marktanteile zu erobern.
Etwa zwei Drittel (Stand 09/2022: MUNDICARE GmbH/progenerika: „Woher kommen unsere Wirkstoffe? Eine Weltkarte der API-Produktion“) der aktuellen CEP-Zulassungen für API befinden sich in den Händen asiatischer Hersteller – vor allem in Indien und China.
Für ein Sechstel der untersuchten APIs gibt es keine europäische Produktion mehr, und für mehr als die Hälfte der betrachteten APIs existieren weltweit nur ein bis fünf Hersteller.
Besitzt ein Wirkstoff/API eines Herstellers ein CEP, wird damit bestätigt, dass dessen Qualität der entsprechenden Monographie des Europäischen Arzneibuches entspricht. Das CEP ist damit praktisch ein Bindeglied zur jeweiligen Ph. Eur. Monographie und wird bei Bedarf im Rahmen eines Zulassungsverfahrens bei den Zulassungsbehörden mit eingereicht. Die jeweiligen Anträge stellt der Wirkstoffhersteller als Halter des CEP. Er ist auch für die gesamte Laufzeit des CEP verantwortlich. Ausstellende Behörde ist das EDQM in Straßburg (European Directorate for the Quality of Medicines & HealthCare). Das EDQM ist das wissenschaftliche Sekretariat der Europäischen Arzneibuch-Kommission und erarbeitet mit seinen Arbeitsgruppen das Europäische Arzneibuch.
Ein Hersteller aus beispielsweise China oder Indien hat einen Wirkstoff lagernd. Der Wirkstoff ist gemäß Ph.Eur. und/oder USP geprüft. Ein CoA (Certificate of Analysis) liegt vor.
Der Hersteller produziert aber (noch) nicht oder nur teilweise unter GMP-Bedingungen.
Damit wäre dieser Hersteller für die Lieferung an eine deutsche Apotheke ungeeignet. Die zuständigen Aufsichtsbehörden der jeweiligen Bundesländer agieren in dieser Sache sehr klar nach den regulatorischen Vorgaben.
Hier könnte zukünftig die angedachte Lösung mit dem CEP helfen – natürlich nur, wenn es genügend Ware mit einem CEP gibt.
Ein Recherchebeispiel: Paracetamol
Paracetamol ist aktuell eine sehr gesuchte Substanz. Wie lassen sich alternative Lieferanten definieren, wenn beispielsweise Caelo, Fagron und EuRho nicht liefern können?
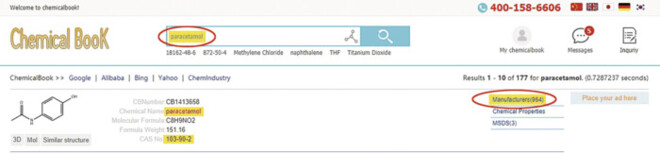
Im Internet gibt es einige „Suchseiten“ für Chemikalien. API sind grundsätzlich auch Chemikalien und lassen sich also darüber finden. Eine bekannte Adresse ist zum Beispiel: www.chemicalbook.com (Abb. 1).
Die Seite zeigt als Suchergebnis insgesamt 962 Suppliers an. Eventuell muss die Suche auch mit dem englischen Substanznamen (hier: Acetaminophen) erfolgen. Es lassen sich auch chemische Eigenschaften ermitteln oder die sogenannte CAS-Nummer (Chemical Abstracts Service). Die Testsuche wurde am 29.01.2023 durchgeführt.
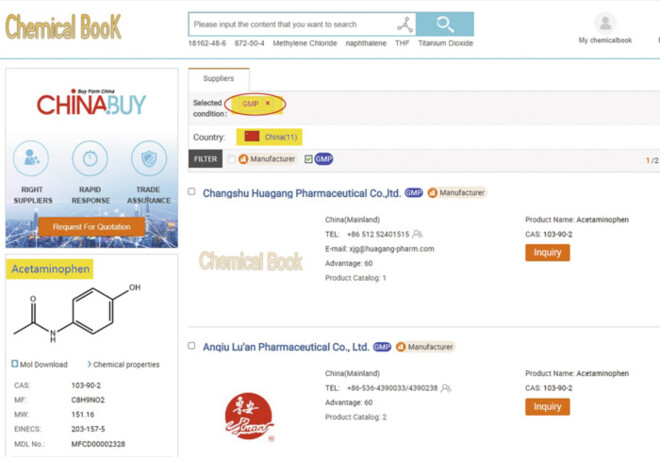
In unserem Paracetamol-Beispiel sind als Einschlusskriterien die Europäischen Staaten, White-List-Staaten sowie China und Indien markiert. Weiterhin lassen sich Reinheitsanforderungen, Zertifikats- und Produktionsanforderungen als auch Mengen selektieren (Abb. 2).
Nach dem Setzen eines Kreuzes im Feld GMP verbleiben gerade einmal noch 11 Suppliers – sämtlich aus China!
Bereits hier lässt sich die chinesische Vorherrschaft bei essenziellen Wirkstoffen gut sehen. Die nun „herausgefallenen“ Suppliers haben vermutlich nicht GMP-zertifizierte Ware oder es versäumt, die entsprechenden Angaben bei www.chemicalbook.com einzufügen (Abb. 3).
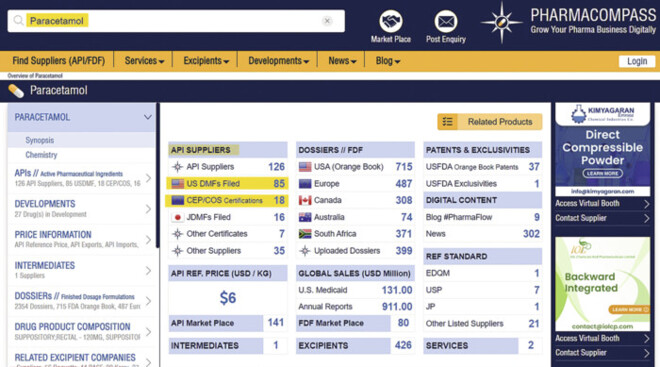
Eine weitere Suchmöglichkeit stellt www.pharmacompass.com dar. Es erfolgte ebenfalls eine Suche nach Paracetamol bzw. Acetaminophen (Abb. 4).
Abb. 4: Suche mit www.pharmacompass.com.
Schnell fällt auf, dass global betrachtet ganz klar die United States Pharmacopoeia USP die größte Relevanz hat. 85 Suppliers halten ein US Drug Master File (USDMF) und 18 halten ein europäisches CEP! Der durchschnittliche Kilopreis beträgt etwa 6 US-Dollar (Stand 29.01.2023).
Das DMF, es gibt neben dem USDMF auch ein europäisches EDMF, ist ein weiteres wichtiges Qualitätsdokument. Es gliedert sich in einen offenen Teil der dem potenziellen Käufer (= Arzneimittelhersteller) zur Verfügung gestellt wird. Hierin finden sich zum Beispiel Daten zur Analytik des API oder zur firmeninternen Qualitätskontrolle.
Im geschlossenen Teil eines DMF – dieser wird nur den Zulassungsbehörden zur Verfügung gestellt – finden sich wichtige Daten zur Synthese, den eingesetzten Edukten oder auch zur Prozessentwicklung. Diese Daten sind sehr wichtig für die Suche und Klassifizierung von eventuellen Nebenprodukten/Verunreinigungen. Deutlich hatte das der Valsartan-Skandal gezeigt, bei dem sich herausgestellt hatte, dass der Syntheseweg ohne Mitteilung geändert worden war. Dadurch entstanden gänzlich andere Verunreinigungen wie auch die aufgefundenen Nitrosamine, wobei bei den Nitrosaminen mittlerweile auch andere Ursachen in Betracht kommen.
Fazit
Auch in Zukunft wird es immer wieder passieren, dass sich aus ökonomischen, regulatorischen oder politischen Gründen Hersteller vom Markt zurückziehen. Eventuell kann es ganz schnell passieren, dass 50 Prozent oder sogar der ganze Markt von einem Unternehmen bedient wird. Solche Wirkstoffe und/oder Produkte müssen schnellstmöglich identifiziert werden und Produktionskapazitäten, Redundanzen oder Vorräte in Europa bereitgestellt werden.
Die weiter oben angesprochene Patientensicherheit beinhaltet nämlich auch eine zügige Versorgung der gegebenenfalls kritischen Patienten mit essenziellen Wirkstoffen!
Es wäre sicherlich kein Fehler, über eine Art „Bypass“ in solchen Fällen nachzudenken und die unbestritten wichtigen regulatorischen Anforderungen in absolut kritische Anforderungen und solche Anforderungen mit eventuellen „Spielräumen“ einzuteilen.
Auch wenn die Politik in Europa und mittlerweile auch in Deutschland erkannt hat, dass wir unsere Abhängigkeiten bezüglich kritischer Wirkstoffe reduzieren müssen – ein Zurück in die 1980er-Jahre wird es nicht geben. Damals firmierte Deutschland noch als „Apotheke der Welt“ und versorgte viele Länder mit Wirkstoffen.
Die früheren Chemiewerke und Produktionsanlagen, welche Basischemikalien zur Synthese herstellten, sind mittlerweile zum großen Teil geschlossen, verlagert oder abgewandert.
Aber gerade für die wichtigsten Wirkstoffe, wie sie sich zum Beispiel auf der WHO-Liste der essenziellen Wirkstoffe finden (https://list.essentialmeds.org/) sollten zumindest im Sinne eines „Groupings“ aus allen Bereichen die wichtigsten Wirkstoffe belastbar gelagert oder eben selbst synthetisiert werden können.
Das alles wird mit Kosten verbunden sein und muss auch politisch gewollt sein. Wenn die verordnenden Ärzte oder herstellenden Apotheken von Regress und Retaxierung bedroht sind, wird niemand das Risiko eingehen, eine entsprechende Rezeptur zu verordnen oder diese Rezeptur anzufertigen beziehungsweise im Vorfeld den entsprechenden Wirkstoff in finanzieller Vorleistung einzukaufen. |
























1 Kommentar
Das Dilemma für die Apotheken
von Dr. Uwe Weidenauer am 18.02.2023 um 17:31 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.