
- DAZ.online
- DAZ / AZ
- DAZ 5/2023
- Vutrisiran neu bei ...
Neue Arzneimittel
Vutrisiran neu bei Transthyretin-vermittelter Amyloidose
Kleine interferierende Ribonukleinsäure legt mRNA-Sequenz still
Das körpereigene Protein Transthyretin (TTR) wird in der Leber und im Plexus choroideus gebildet und ist für den Transport des Schilddrüsenhormons Thyroxin verantwortlich. Ebenso ist es ein Trägerprotein für das Retinol-bindende Protein 4, welches seinerseits Retinol (Vitamin A) im Blut transportiert. Bei Patienten mit angeborener hereditärer Transthyretin-vermittelter Amyloidose liegt Transthyretin in instabiler Form mit veränderter Proteinfaltung vor. Die modifizierten TTR-Amyloidproteine zerfallen und bilden irreversible Ablagerungen im Nervensystem, Herzen, Gastrointestinaltrakt, Knochenmark sowie in den Augen, Nieren und in der Schilddrüse. Hieraus leiten sich in fortgeschrittenen Stadien Polyneuropathien mit Lähmungen und Krämpfen, Kardiomyopathien bis zum Herzversagen, schwere Verdauungsstörungen und andere Symptome wie Sehstörungen, Nierenfunktionsstörungen und Demenz ab. Die Erkrankung führt innerhalb eines Zeitraums von 2,5 bis 15 Jahre nach Symptombeginn zum Tod. Nur für Patienten in sehr frühen Erkrankungsstadien besteht die Möglichkeit der Transplantation einer gesunden Leber, die fortan normales Transthyretin bilden soll. In anderen Fällen müssen alternative unterstützende Therapieversuche erfolgen.
Neue Arzneimittel 2023
In der bisher monatlich erschienenen DAZ-Beilage „Neue Arzneimittel“ stellte Apothekerin Dr. Monika Neubeck neue Wirkstoffe ausführlich vor und ordnete sie in die bestehenden Therapieoptionen ein. Seit Januar 2023 finden Abonnentinnen und Abonnenten der DAZ die neuen Arzneistoffe auf DAZ.online unter www.deutsche-apotheker-zeitung.de/pharmazie/arzneimittel.
Die für die Offizin bedeutsamen Wirkstoffe stellen wir in der Print-Ausgabe der DAZ regelmäßig in unserer Rubrik „Neue Arzneimittel“ vor.
Im Januar 2023 finden Sie auf www.deutsche-apotheker-zeitung.de im Bereich „Pharmazie“ Informationen zu
- Daridorexant
- Difelikefalin
- Faricimab
- Lonafarnib
- Olipudase alfa
- Sotrovimab
- Tezepelumab
- Vutrisiran
Dort steht Ihnen auch ein Archiv mit allen seit 2000 eingeführten Wirkstoffen zur Verfügung.
Vutrisiran hemmt Biosynthese von pathogenen Amyloiden
Vutrisiran ist eine doppelsträngige kleine interferierende Ribonukleinsäure (small interfering RNA, siRNA), die speziell auf Varianten von Transthyretin-mRNA und deren Wildtyp abzielt. Das entsprechende Gen wird aufgrund der RNA-Interferenz stillgelegt und ein katalytischer Abbau der gebildeten TTR-mRNA ausgelöst. Im Wirkstoff-Molekül von Vutrisiran ist ein kovalent gebundener Ligand mit drei N-Acetylgalactosamin-Resten enthalten, der die Aufnahme der siRNA in die Hepatozyten, dem primären Ort der Transthyretin-Biosynthese, begünstigt und damit die Wirkdauer verlängert. Bei hATTR-Patienten wird eine mehr als 80%ige, langfristige Reduktion der TTR-Protein-Serumspiegel von Varianten und Wildtyp erreicht. Der Wirkstoff ist derzeit für Erwachsene im ersten oder zweiten Stadium der Nervenschädigung zugelassen, die noch mit oder ohne Hilfe gehfähig sind.
Anwendung alle drei Monate subkutan
Vutrisiran wird alle drei Monate von Fachpersonal in einer Dosierung von 25 mg subkutan in das Abdomen, den Oberschenkel oder den Oberarm injiziert. Während der Behandlung kommt es sehr häufig zu Arthralgien sowie zu Schmerzen in einer Extremität. Häufig wird über Dyspnoe, Reaktionen an der Injektionsstelle sowie über erhöhte Alkalische-Phosphatase-Werte berichtet. Aufgrund der ansonsten sehr begrenzten Behandlungsoptionen besteht lediglich bei starker Überempfindlichkeit gegen Vutrisiran, die potenziell zu anaphylaktischen Reaktionen führt, eine Kontraindikation.
Vitamin-A-Haushalt und Schwangerschaft
Vutrisiran führt zu einer Verringerung der Vitamin-A-Konzentration im Blut. Bereits vor Einleitung der Therapie sollten daher bestehende Hypovitaminosen A korrigiert und während der Behandlung eine Vitamin-A-Substitutionstherapie durchgeführt werden. Falls die Patienten okuläre Symptome entwickeln, die auf einen Vitamin-A-Mangel hindeuten, wird eine ophthalmologische Abklärung empfohlen. Wegen der potenziellen Teratogenität aufgrund der Hypovitaminose A sollte Vutrisiran während der Schwangerschaft allenfalls bei zwingendem Erfordernis eingesetzt werden. Es ist bislang nicht geklärt, ob eine Vitamin-A-Supplementierung bei weiterhin mit der siRNA behandelten schwangeren Frauen zur Verringerung des Risikos ausreicht. Bei ungeplant schwangeren behandelten Frauen muss Vutrisiran sofort abgesetzt werden. Es kann jedoch keine Empfehlung gegeben werden, ob in diesen Fällen eine Vitamin-A-Ergänzung im ersten Trimenon fortzusetzen ist. Ein exponierter Fötus sollte engmaschig beobachtet werden, insbesondere im ersten Trimenon. Spätestens im zweiten und dritten Trimenon empfiehlt es sich, die Substitution bis zur Normalisierung der Vitamin-A-Spiegel im Serum wieder aufzunehmen. Falls eine Frau nach Beendigung der Vutrisiran-Applikation schwanger werden möchte, sollten sich die Vitamin-A-Plasmaspiegel normalisiert haben. Dies kann jedoch bis zu mehr als einem Jahr nach Therapieende dauern.
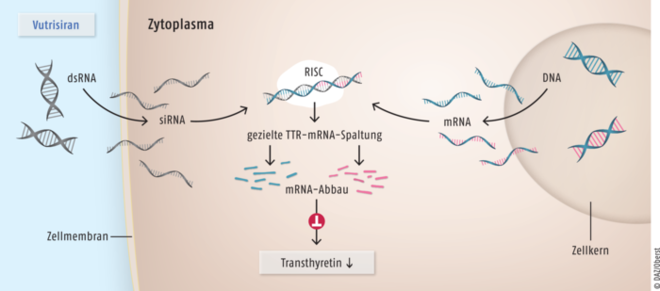
Vutrisiran, eine doppelsträngige, kurze interferierende Ribonukleinsäure (dsRNA, links), wird im Zellinneren gespalten. Im Zytoplasma bindet die nun einsträngige kleine interferierende Ribonukleinsäure (small interfering RNA, siRNA) hochselektiv an einen Protein-Komplex, der als RNA-induced Silencing Complex (RISC) bezeichnet wird (Mitte). Der RIS-Komplex erkennt die mRNA von mutiertem ebenso wie von normalem Wildtyp-Transthyretin (TTR, rechts), die komplementäre Abschnitte zur siRNA besitzt. Als Folge wird das betreffende Gen stillgelegt und die TTR-mRNA im weiteren Verlauf mithilfe des RIS-Proteinkomplexes zerstört. Das RNA-Interferenz(RNAi)-Therapeutikum Vutrisiran imitiert einen körpereigenen Abwehrmechanismus, der normalerweise gegen RNA-Viren gerichtet ist. Bei Patienten mit hereditärer Transthyretin-vermittelter Amyloidose (hATTR) wird auf diese Weise die Produktion fehlgebildeter TTR-Proteine reduziert und die Symptomatik der Erkrankung gelindert.
Neurologische Funktionen in Zulassungsstudien verbessert
Der Nutzen von Vutrisiran wurde im Rahmen der offenen Phase-III-Studie Helios-A geprüft. In die Untersuchung waren 164 hATTR-Patienten mit Symptomen einer nicht Rollstuhl-pflichtigen Polyneuropathie vom Stadium 1 (Gehen ohne Hilfe möglich) und Stadium 2 (Hilfe beim Gehen erforderlich) einbezogen. Die Teilnehmer erhielten alle drei Monate jeweils 25 mg Vutrisiran (n = 122) oder alle drei Wochen 0,3 mg/kg Körpergewicht des weiteren hATTR-Therapeutikums Patisiran (n = 42). Als Vergleich diente eine externe Placebogruppe aus der sehr ähnlich aufgebauten Apollo-Studie zur Untersuchung der Patisiran-Wirksamkeit. Primärer Wirksamkeits-Endpunkt war die Veränderung der neurologischen Funktionen unter Berücksichtigung des modifizierten Neuropathy Impairment Scores+7 (mNIS+7) nach 18-monatiger Behandlungszeit. Unter Vutrisiran konnte eine hochsignifikante mNIS+7-Verbesserung um durchschnittlich 0,5 Punkte erreicht werden, während sich der Wert in der externen Placebogruppe um 28,1 Punkte verschlechterte (p < 0,0001). Die zeitlich gemittelte prozentuale Reduktion der Transthyretin-Talspiegel betrug unter Vutrisiran -84,7% und unter Patisiran-Therapie -80,6%, entsprechend einer Nichtunterlegenheit von Vutrisiran. Hinsichtlich der sekundären Endpunkte Lebensqualität bei diabetischer Neuropathie (Norfolk Quality of Life-Diabetic Neuropathy, QoL-DN), Zehn-Meter-Gehtest, modifizierter Body-Mass-Index und bezüglich der vom Patienten berichteten Fähigkeit, alltägliche Aktivitäten zu verrichten und am gesellschaftlichen Leben teilzunehmen (Rasch-Built Overall Disability Scale), ergab sich jeweils eine hochsignifikante Überlegenheit von Vutrisiran gegenüber der Placebo-Gabe (p < 0,0001 für alle Vergleiche).
Vorteil für Vutrisiran
Mit der Markteinführung des Oligonucleotids Inotersen (Tegsedi®) und des siRNA-Wirkstoffs Patisiran (Onpattro®) stehen seit einigen Jahren zwei effektive Wirkstoffe zur Behandlung von Polyneuropathie der Stadien 1 oder 2 bei erwachsenen hATTR-Patienten zur Verfügung. Der später entwickelte Wirkstoff Vutrisiran besitzt den nahezu identischen Wirkmechanismus wie Patisiran. Während Inotersen in klinischen Studien lediglich das Fortschreiten der Amyloidose verminderte, wurde nach Applikation von Vutrisiran und Patisiran sogar eine geringfügige Verbesserung der Symptomatik erreicht. Weiterhin sind die beiden siRNAs erheblich besser verträglich als Inotersen, das mit schwerwiegenden Nebenwirkungen wie Glomerulonephritis und Thrombozytopenie assoziiert ist. Ein entscheidender Vorteil von Vutrisiran gegenüber Patisiran liegt allerdings in der Tatsache begründet, dass die neuere Substanz nur alle drei Monate subkutan appliziert wird. Das bezüglich der Wirksamkeit ebenbürtige Patisiran wird dagegen alle drei Wochen intravenös gegeben und ist, abgesehen von der damit verbundenen Beeinträchtigung der Lebensqualität, mit schweren, potenziell lebensbedrohlichen infusionsbedingten Reaktionen assoziiert. Im Rahmen weiterer Studien muss geklärt werden, wie die Erkrankungsprogression durch den mehrjährigen Einsatz von Vutrisiran und Patisiran beeinflusst werden kann, ob auch Patienten mit noch weiter fortgeschrittener Erkrankung im Stadium 3 von der Therapie profitieren und inwiefern die Lebenserwartung der Patienten mit hereditärer Transthyretin-vermittelter Amyloidose verbessert wird. |
Literatur
[1] Fachinformation zu Amvuttra®, Stand: September 2022
[2] Adams D, Tournev IL, Taylor MS et al. Efficacy and safety of vutrisiran for patients with hereditary transthyretin-mediated amyloidosis with polyneuropathy: a randomized clinical trial. Amyloid 23;1-9, doi: 10.1080 /13506129.2022.20919852022
[3] EPAR summary for the public. Amvuttra® Vutrisiran. EMA/669739/2022; European Medicines Agency; www.ema.europe.eu























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.