
- DAZ.online
- DAZ / AZ
- DAZ 5/2023
- Neues Impfprinzip zur HIV...
Arzneimittel und Therapie
Neues Impfprinzip zur HIV-Immunisierung
Impfung induziert Superantikörper-Vorstufen
Einer HIV-Infektion steht unser Körper wehrlos gegenüber. Umso wünschenswerter wäre die Aussicht, sich durch eine Impfung vor einer möglichen Infektion schützen zu können. Ein Impfstoff-Kandidat ist trotz jahrzehntelanger Forschung bislang noch nicht gefunden.
Auf der Suche beschreitet man derweil ganz neue Wege, fernab der klassischen Impfstoffe. Dies hat mit sogenannten breit neutralisierenden Antikörpern (broadly neutralizing antibodies, bnAb) zu tun. Schon in den 1990er-Jahren fand man heraus, dass das Immunsystem einiger weniger HIV-Infizierter in der Lage ist, mehrere Jahre nach der Infektion diese „Superantikörper“ zu produzieren. Sie binden an konservierte Epitope, können also verschiedene HIV-Stämme, -Subtypen und aller Voraussicht nach auch zukünftige Varianten an unveränderten Regionen erkennen, die für den Funktionserhalt wichtig und daher allen gemein sind. Nach der Bindung neutralisieren sie das Virus und verhindern so dessen unheilvolle Ausbreitung. Detektiert werden Stellen im trimeren HIV-1-Spikeprotein, auch Envelope (Env) genannt, mit dessen Hilfe sich HI-Viren Zugang zur Wirtszelle verschaffen. Die zufällige, natürliche Bildung von breit neutralisierenden Antikörpern kommt für die Infizierten aber zu spät und ist zudem äußerst selten. Das HI-Virus hat dann schon längst sein Unwesen getrieben.
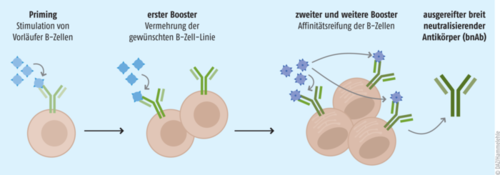
Abb.: Das Germline-Targeting-Impfstoffdesign zur Induktion breit neutralisierender Antikörper (bnAb) fußt auf einer Kombination unterschiedlicher Immunogene in einem sequenziellen, mehrstufigen Prozess. Zunächst wird die Bildung spezieller Vorläufer-B-Zellen aus naiven B-Zellen der Keimbahn (germline) gezielt mit dem ersten Vakzin stimuliert (Priming). Anschließend wird die gerichtete Vermehrung, Selektierung und Affinitätsreifung der B-Zellen durch Impfen mit immer feineren Boostern, die dem natürlichen Antigen zunehmend ähneln, in die gewünschte Richtung gelenkt (Targeting). Dieser Prozess führt dazu, dass der Körper im Falle einer Infektion selbst und schnell die hochpotenten, breit neutralisierenden Antikörper produzieren kann. (nach [2])
Mehrstufiges Impfschema
Gentechnisch hergestellte, breit neutralisierende Antikörper direkt zu injizieren, würde nur zur passiven Immunisierung taugen, der erzielte Schutz wäre nicht langfristig wirksam. Wenn der Körper aber durch eine Impfung in die Lage versetzt werden könnte, eine Immunantwort mit breit neutralisierenden Antikörpern gezielt, schnell und zuverlässig selbst hervorzurufen, wäre er im Falle einer Infektion und unabhängig der übertragenen Variante gut aufgestellt. Idealerweise wäre die humorale Antwort begleitet durch eine breite T-Zell-Antwort. In einer klinischen Studie der Phase I konnten amerikanische Forschende um Erstautor David J. Leggat nun einen Teilerfolg auf dem langen Weg zum erfolgreichen Impfstoffkandidaten auf der Basis von breit neutralisierenden Antikörpern verbuchen. So wurde nun erstmals am Menschen gezeigt, dass eine innovative Methode zur schrittweisen Vorbereitung des Immunsystems bei der Produktion von „Superantikörpern“ gegen HIV funktioniert.
Das zugrunde liegende Impfstoffdesign nennt sich Germline-Targeting und beschreibt ein mehrstufiges Impfkonzept mit mindestens zwei verschiedenen Komponenten (s. Abb.). Bei der Impfung mit dem ersten Vakzin, dem Priming, soll die Aktivierung spezieller Vorläufer-B-Zellen aus naiven B-Zellen der Keimbahn (germline) angeregt werden, die später als ausgereifte Plasmazellen in der Lage sind, breit neutralisierende Antikörper zu produzieren. Welche B-Zellen aus diesem Pool aber ausreifen und sich vermehren, muss in den folgenden Schritten durch Impfung(en) mit dem oder den Booster(n) gelenkt werden. Hierdurch werden die somatische Hypermutation und Affinitätsreifung angestoßen, also die Differenzierung und gezielte Schärfung in Richtung der erwünschten bnAb-produzierenden Zellen, die dann mit hoher Affinität das Antigen binden. Diese Selektierung soll gelingen, indem die zur Boosterung eingesetzten Vakzine dem tatsächlichen Antigen, hier dem Envelope-Protein, zunehmend strukturell ähneln, während das beim Priming verwendete Antigen dies nicht tut, sondern „nur“ den Weg bereitet und den kritischen Schritt der Bildung der seltenen Vorstufen stimuliert.
Adenovirus-basierter HIV-Impfstoff gescheitert
dab | Am 18. Januar 2023 gaben das pharmazeutische Unternehmen Janssen und seine weltweiten Partner bekannt, dass die Phase-III-Studie Mosaico zu einem Adenovirus-basierten HIV-Impfstoff vorzeitig beendet wird. Die Entscheidung wurde damit begründet, dass das unabhängige Data and Safety Monitoring Board zu dem Schluss kam, dass der untersuchte Impfstoff nicht besser als Placebo vor einer HIV-Infektion schützt. Sicherheitsprobleme hätte es nicht gegeben.
Der in der Studie eingesetzte Impfstoff Ad26.Mos4.HIV enthielt „Mosaik“-Immunogene. Damit sind Immunogene gemeint, die Elemente mehrerer HIV-Subtypen beinhalten, um Immunreaktionen gegen viele HIV-Stämme auszulösen. Die Probanden erhielten jeweils vier Impfungen über einen Zeitraum von einem Jahr. Bei den Injektionen drei und vier wurde zusätzlich eine adjuvantierte Formulierung verabreicht, die zwei HIV-Hüllproteine enthielt.
Die Mosaico-Studie wurde 2019 an über 50 Studienorten in Ländern wie Argentinien, Brasilien, Italien, Polen und den USA begonnen. Die letzten Impfungen wurden im Oktober 2022 durchgeführt. Insgesamt waren etwa 3900 Cis-Männer und Transgender-Personen eingeschlossen, die Sex mit Männern und/oder Transgender-Personen haben [3, 4].
Erfolg in Phase-I-Studie
In der nun abgeschlossenen placebokontrollierten Phase-I-Studie konnte durch das Priming bei 35 von 36 Probanden (97%) die Produktion von bnAb-Vorläufer-B-Zellen angeregt werden. Das verwendete Immunogen namens „eOD-GT8 60mer“ basiert auf einer modifizierten CD4-Rezeptor-Bindungsstelle und ist ein sich selbst zusammensetzendes, nanopartikuläres Konstrukt. Es besteht aus 60 verschiedenen Kopien künstlich hergestellter Teile des Envelope-Proteins, bindet besonders gut an B-Zell-Vorläufer und stimuliert diese. Als Adjuvanz dient AS01B, ein Wirkverstärker, der bereits von dem Herpes-Zoster-Impfstoff Shingrix® bekannt ist. Das Priming wurde im Abstand von acht Wochen zweimal durchgeführt, wobei sich die erwünschte Immunantwort schon nach dem ersten Antigenkontakt zeigte. Eine umfassende Sicherheits- und Verträglichkeitsüberprüfung ergab zudem, dass der Impfstoff ein günstiges Sicherheitsprofil aufweist.
Suche nach geeignetem Booster
Die Autoren sehen nach diesem wichtigen Grundsatzbeweis des Germline-Targeting-Impfstoffdesigns noch vielen weiteren Herausforderungen entgegen. So müsse nun erforscht werden, mit welchem Booster die angestoßene Reaktion in die richtige Richtung zur Produktion der gewünschten breit neutralisierenden Antikörper gelenkt werden könne. Man habe aber eindrücklich gezeigt, dass man den Beginn einer konkreten Immunreaktion auf vorhersehbare Weise steuern könne. „Wir glauben, dass diese Strategie für die Entwicklung eines HIV-Impfstoffs von entscheidender Bedeutung sein wird und auch bei der Entwicklung von Impfstoffen für andere schwierige Krankheitserreger hilfreich sein kann“, schlussfolgert Prof. William Schief, Mitautor der Studie. |
Literatur
[1] Leggat DJ et al. Vaccination induces HIV broadly neutralizing antibody precursors in humans. Science 2022;378(6623):eadd6502, doi: 10.1126/science.add6502
[2] Williams WB et al. Strategies for induction of HIV-1 envelope-reactive broadly neutralizing antibodies. J Int AIDS Soc 2021;24 Suppl 7(Suppl 7):e25831, doi: 10.1002/jia2.25831
[3] Janssen and Global Partners to Discontinue Phase 3 Mosaico HIV Vaccine Clinical Trial. Meldung von Johnson und Johnson, 18. Januar 2023
[4] Experimental HIV vaccine regimen safe but ineffective, study finds. Meldung der National Institutes of Health, 18. Januar 2023





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.