
- DAZ.online
- DAZ / AZ
- DAZ 10/2023
- Haarwuchs mit Folgen
Nebenwirkungen
Haarwuchs mit Folgen
Das Post-Finasterid-Syndrom im Spiegel der Wissenschaft
Viele Männer, die im Spiegel ihren Haaransatz verschwinden sehen, wenden sich sorgenvoll an ihren Dermatologen. In den meisten Fällen kann dieser schnell bestätigen, dass der Haarausfall androgenetisch bedingt ist, also durch eine Überempfindlichkeit der Haarfollikel gegenüber Dihydrotestosteron (DHT) entsteht – eine harmlose, aber meist unästhetische Erscheinung des Älterwerdens. Seit 1997 ist in dieser Indikation Finasterid zugelassen, das die Umwandlung des Testosterons in das schädliche DHT durch die 5-Alpha-Reduktase verhindert und das Haar vor dem Ausfallen bewahrt. Finasterid inhibiert hauptsächlich die Typ-II- und Typ-III-Isoformen der Reduktase, die vor allem in Prostata, Haut und Gehirn anzutreffen sind. Das verwandte Dutasterid hemmt auch die Typ-I-Isoform, die bspw. im Gehirn und in der Haut exprimiert wird [1].
Schnell ist das Rezept über die wirksame Substanz ausgestellt und der Haarausfall vorerst gebannt. Für manche Männer gingen damit die Sorgen aber erst richtig los. 2011 tauchten erste Fallberichte über Patienten auf, die schwerwiegende, anhaltende Nebenwirkungen entwickelt haben. Die Betroffenen berichteten z. B. von verringerter Libido (94%), erektiler Dysfunktion (92%), weniger sexueller Erregbarkeit (92%) und Orgasmusstörungen (69%) [2]. 2012 reagierte auch die FDA und fügte dem Beipackzettel einen Hinweis auf die persistierenden Nebenwirkungen zu. Im gleichen Jahr gründete sich in den USA außerdem eine gemeinnützige Organisation, die Post-Finasteride-Syndrome-Foundation, die für das Problem sensibilisieren will und Mittel für die Forschung sammelt. Der Begriff Post-Finasterid-Syndrom wird seitdem für alle nach dem Absetzen von Finasterid anhaltenden Nebenwirkungen verwendet. Denn das Symptomspektrum ist nicht nur auf sexuelle Störungen beschränkt, sondern beschreibt zusätzlich ein ausgeprägtes psychisches und auch physisches Beschwerdebild (s. Tab. 1). Auftreten können die Beschwerden sowohl nach kurzzeitiger Anwendung oder Langzeittherapie. Fallbeschreibungen zeichnen das Leiden der betroffenen Männer: ein 24-Jähriger berichtet bereits nach wenigen Tagen Finasterid-Einnahme von einem kompletten Libidoverlust und einer vollständigen erektilen Dysfunktion, kurz darauf folgt die Depression. Selbst elf Jahre später hat er sich nicht erholt [3].
Solche Berichte stehen im Gegensatz zu den Zulassungsstudien, in denen Merck das Sicherheitsprofil seines Wirkstoffs noch als exzellent bezeichnete. Nur wenige Männer berichteten von verminderter Libido (1,8% vs. 1,3% unter Placebo), erektiler Dysfunktion (1,3% vs. 0,7% unter Placebo) oder Ejakulationsstörungen (1,2% vs. 0,7% unter Placebo), die nach dem Absetzen verschwanden [4].
sexuelle Beschwerden | körperliche Beschwerden | psychische Beschwerden |
|---|---|---|
erektile Dysfunktion | Gynäkomastie | Depression |
verminderte Libido bis zum kompletten Libidoverlust | Fatigue | Angst |
Ejakulationsstörungen | Muskelschmerzen | Panikattacken |
Penisschrumpfung | trockene Haut | Schlafstörungen |
Verminderung Ejakulatmenge | Diabetes | Suizidgedanken |
Hodenschmerzen | kognitive Störungen |
Kontroverse Datenlage
In der Fachwelt trifft die Idee eines Post-Finasterid-Syndroms nicht auf uneingeschränkte Unterstützung. Waren es doch schließlich nur Fallberichte, die von dem Syndrom berichteten, und die stehen nun mal in der Evidenzpyramide weit unten. Bis heute gibt es keine hochwertigen prospektiven Studien, die einen kausalen Zusammenhang herstellen und Angaben über die Prävalenz des Syndroms zulassen. Das Risiko für sexuelle Nebenwirkungen wird von Studie zu Studie mal höher, mal niedriger bewertet, scheint insgesamt aber höher zu liegen als bei den Zulassungsstudien initial festgestellt. Ob die unerwünschten Wirkungen persistierten, ist weniger gut untersucht. Die PLESS-Studie aus dem Jahr 2003, die die Inzidenz von sexuellen Nebenwirkungen einer Behandlung mit 5 mg Finasterid bei Prostatahyperplasie an 3040 Männern untersuchte, gehört zu den wenigen prospektiven Studien zu dieser Thematik [5]. Brachen die Probanden die Studie aufgrund von unerwünschten Wirkungen ab, persistierten die Nebenwirkungen bei der Hälfte der Finasterid-Abbrecher – allerdings auch bei 59% der Placebo-Abbrecher.
Retrospektive Pharmakovigilanzstudien, die keine Aussagen über die Kausalität zulassen, wiederum fanden zumindest eine Korrelation zwischen der Einnahme von Finasterid und persistierenden sexuellen Nebenwirkungen, bspw. in 0,8% der Fälle, wie die elektronischen Patientendaten der Northwestern University in Illinois ergaben [6]. Bei der retrospektiven Auswertung der WHO-Pharmakovigilanz-Datenbank Vigibase zeigten Wissenschaftler von der Harvard Medical School außerdem, dass mit der Einnahme von Finasterid im Vergleich zu allen anderen Datenbankeinträgen fast viermal so häufig von psychiatrischen Nebenwirkungen berichtet wurde und 1,6-mal so viel von Suizidgedanken [7].
Hormone sind unschuldig
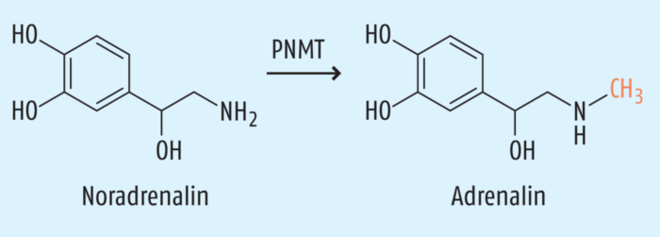
Zu den möglichen mechanistischen Hintergründen werden verschiedene Erklärungsansätze diskutiert. DHT spielt mit seiner Wirkung am Androgenrezeptor eine wichtige Rolle in der Sexualfunktion. Sexuelle Nebenwirkungen sind also schlüssig, aber warum verschwinden sie nicht, nachdem das Medikament abgesetzt wird? Sowohl Testosteron- und DHT-Spiegel von Probanden mit anhaltenden Nebenwirkungen glichen denen von gesunden Freiwilligen, auch Marker für die periphere Androgensensitivität waren unverändert [8]. Abdulmaged Traish, emeritierter Urologieprofessor der Boston University vermutet u. a. strukturelle Veränderungen im Penis als Folge der Finasterid-Einnahme. In einem Übersichtsartikel berichtet er, dass Dutasterid im Tierversuch die Expression der neuronalen NO-Synthase senkte und zu weniger glatten Muskelzellen und mehr Bindegewebszellen im Schwellkörpergewebe führte [9]. Auch Penis-Doppler-Sonografien zeigten veränderte Gefäße bei 17 von 25 untersuchten Betroffenen [10]. Italienische Wissenschaftler demonstrierten zudem, dass Finasterid als Off-Target-Effekt die Phenolethanolamin-N-Methyltransferase inhibiert [11]. Das Enzym methyliert Noradrenalin zum Adrenalin und ist damit für den geschwindigkeitsbestimmenden Schritt der Adrenalin-Synthese verantwortlich (s. Abb. 1). Ungleichgewichte im adrenergen System könnten den Wissenschaftlern zufolge zu den Erektionsschwierigkeiten beitragen.
Mögliche Ursache im Gehirn
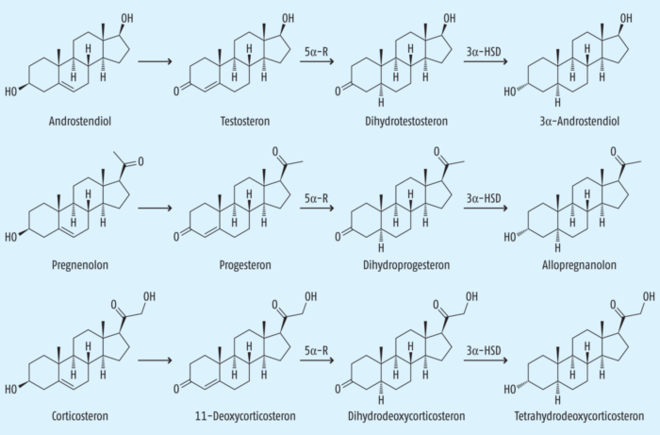
Die 5-Alpha-Reduktase wird außerdem reichlich im Gehirn exprimiert. Dort reduziert das Enzym Testosteron und Progesteron zu ihren Dihydro-Formen, welche zu weiteren Metaboliten, wichtigen Neurosteroiden, verstoffwechselt werden. Hierunter zählen z. B. Allopregnanolon, Pregnenolon, 3-Alpha-Androstandiol oder 3-Beta-Androstandiol (s. Abb. 2). Aus Tierversuchen wissen wir, dass diese Steroide nicht nur an klassische Sexualhormonrezeptoren binden, sondern auch neuronale Transmittersysteme beeinflussen. Sie modulieren bspw. die Aktivität von GABA-Rezeptoren, nikotinischen Acetylcholin-Rezeptoren oder Glutamat-Rezeptoren und spielen so eine entscheidende Rolle für u. a. die Schlafregulation, Stimmung, Angst und das Gedächtnis (s. Tab. 2.) [12]. In diese Neurosteroid-Achse, so wird vermutet, greift Finasterid ein. In der Zerebrospinalflüssigkeit von 16 Betroffenen detektierten Wissenschaftler im Vergleich zu Gesunden signifikant verminderte Spiegel der Neurosteroide Pregnenolon, DHT, Progesteron und dessen Metaboliten sowie erhöhte Testosteron- und 3-Alpha-Androstandiol-Spiegel [13]. Solche Veränderungen könnten den Autoren zufolge den psychischen Symptomen zugrunde liegen. Möglicherweise greift Finasterid dabei nicht nur in den Stoffwechsel der Neurosteroide ein, sondern verändert sogar die Genexpression verschiedener Regulatorproteine, was die anhaltende Natur der Beschwerden erklären könnte [14]. Wissenschaftler der Harvard Medical School stellten zusätzlich mithilfe der funktionellen MRT Veränderungen im Nucleus accumbens und im präfrontalen Cortex fest und damit in Arealen, die für die sexuelle Erregung und Depression wichtig sind [8]. Andere diskutieren den Einfluss der Darm-Hirn-Achse: An Ratten zeigte sich, dass das Absetzen von Finasterid zu einer Darminflammation führte, die mit einer verminderten Allopregnanolon-Produktion im Zusammenhang zu stehen schien [15]. Betroffene wiesen einer Untersuchung zufolge eine weniger diverse Darmflora auf [16].
Abb. 2: Biosynthese ausgewählter Neurosteroide durch die 5-Alpha-Reduktase (angepasst nach [26]). 5α-R = 5-Alpha-Reduktase; 3α-HSD = 3-Alpha-Hydroxysteroid-Dehydrogenase
Oder alles Kopfsache?
Doch nicht jeder ist überzeugt: Kritische Stimmen sehen in dem Syndrom vor allem einen Nocebo-Effekt oder gar eine wahnhafte Störung [17]. Dass Finasterid mit einer ausgeprägten Nocebo-Wirkung verbunden ist, zeigte eine Studie an 107 Teilnehmern, die für ihre Prostatahyperplasie ein Jahr lang 5 mg Finasterid pro Tag einnahmen [18]. Der einen Gruppe wurde lediglich erklärt, sie erhielten eine wirksame Substanz, die andere Gruppe wurde zusätzlich über die möglichen sexuellen Nebenwirkungen aufgeklärt. Nach einem Jahr berichteten 43,6 Prozent der aufgeklärten Teilnehmer sodann von sexuellen Nebenwirkungen, hingegen nur 15,3% derer, die sich dieses Risikos nicht bewusst waren. Auch in retrospektiven Daten zeigt sich, dass die Pharmakovigilanz-Berichte ab 2012 zunahmen, als auch die Berichterstattung in den Medien an Fahrt gewonnen hatte [7, 19]. Vor allem Jüngere, die Finasterid gegen Haarausfall einnehmen, leiden unter den Nebenwirkungen, aber weniger Ältere, die die fünffache Dosis gegen eine Prostatahyperplasie verordnet bekommen [7, 19]. Wirkt der psychisch belastende Haarausfall als Confounder und macht Jüngere vulnerabler? Eine Pilotstudie wies darauf hin, dass mehr als die Hälfte der interviewten 97 Betroffenen bereits eine depressive Erkrankung in der Vorgeschichte aufwies, sodass gerade bei schon bestehenden psychischen Komorbiditäten die Indikationsstellung besonders streng erfolgen sollte [20].
Rezeptor | Neurosteroid | Wirkung auf Rezeptor |
|---|---|---|
GABA-A | Allopregnanolon Deoxycorticosteron Testosteron | stimulierend |
Pregnenolonsulfat DHEA | inhibierend | |
NMDA | DHEA Pregnenolonsulfat | stimulierend |
Estradiol | inhibierend | |
AMPA | Pregnenolonsulfat | inhibierend |
5-HT3 | Estradiol Progesteron Testosteron Pregnenolonsulfat | inhibierend |
nikotinischer Acetylcholinrezeptor | Progesteron | inhibierend |
Ausführliche Aufklärung notwendig
Auch wenn das Post-Finasterid-Syndrom noch kontrovers diskutiert wird, legen die Fallberichte nahe, dass ein gewisser Anteil der Patienten betroffen ist. Und die müssen ernst genommen werden. In einem Rote-Hand-Brief wurde 2018 deshalb darüber informiert, dass Patienten über das Risiko von sexuellen Dysfunktionen, die über zehn Jahre bestehen bleiben können, und über mögliche Stimmungsänderungen informiert werden sollen [21]. Zusätzlich entschied die EMA, die Nebenwirkung Angst mit in die Fachinformation aufzunehmen.
Derzeit gibt es noch keine Therapie gegen die anhaltenden Nebenwirkungen. Eine Testosteron-Substitution scheidet aus, da die Blutspiegel von Testosteron und DHT nicht vermindert sind. Prof. Dr. med. Andreas Zitzmann, Facharzt für Innere Medizin, Endokrinologie und Andrologie sowie Diabetologie und Sexualmedizin des Universitätsklinikums Münster hat nach eigenen Angaben bei seinen Patienten gute Erfahrungen mit der Substitution von Androstendion, DHEA oder humanem Choriongonadotropin erzielt [22]. Bis das Syndrom besser verstanden ist, bleibt das mächtigste Werkzeug aber die Prävention. Zunächst kann bei androgenetischer Alopezie ein Therapieversuch mit topischem Minoxidil unternommen werden. Ob danach orales Finasterid für diese kosmetische Indikation angesichts möglicher bleibender Schäden eingesetzt werden soll, muss besonders sorgfältig erörtert werden.
„Eier ab zwölf“
Die Entwicklung von Finasterid geht zurück auf die Beschreibung der „Guevedoces“ (wörtlich „Eier ab zwölf“) in der Dominikanischen Republik durch die Endokrinologin Julianne Imperato-McGinley. In der Stadt Las Salinas leben Menschen mit einer besonderen Form der Intersexualität [28]. Die intergeschlechtlichen Kinder wachsen mit weiblich aussehenden Geschlechtsteilen auf und werden als Mädchen erzogen. In der Pubertät entwickeln sie männliche Geschlechtsmerkmale – deshalb auch die Bezeichnung „Eier ab zwölf“ – und identifizieren sich dann meist auch als Mann. Die Endokrinologin wies nach, dass für diese Form der Intersexualität ein Defekt der 5-Alpha-Reduktase verantwortlich ist [28]. Durch das fehlende DHT bilden sich die primären männlichen Geschlechtsmerkmale während der Embryonalentwicklung nur unzureichend aus und entfalten sich erst durch die erhöhte Testosteronausschüttung in der Pubertät. Erwachsene Betroffene haben lebenslang meist eine verkleinerte Prostata, spärlichen Bartwuchs und leiden nicht unter androgenetischer Alopezie. Auf diese Ergebnisse wurde Merck aufmerksam und entwickelte den 5-Alpha-Reduktase-Inhbitor Finasterid.
Topische Alternative
Eine neue Behandlungsalternative bietet topisches Finasterid (Fynzur®, 2275 mg/ml), das seit Kurzem in Deutschland auf dem Markt ist. In einer Phase-III-Studie mit 250 Probanden stimulierte das Spray den Haarwuchs signifikant (Haarzuwuchs nach topischer Anwendung von 16,3 Haare/cm2 gegenüber 6,3 Haare/cm2 mit Placebo, p = 0,012) und zeigte ähnliche Effekte wie orales Finasterid (18,7 Haare/cm2) [23]. Dafür betrug die systemische Wirkstoffexposition mit der dermalen Applikation weniger als ein Hundertstel der oralen. Entsprechend weniger stark sanken auch die DHT-Spiegel im Blut (34,5% dermal vs. 55,6% oral), weshalb weniger Nebenwirkungen erwartet werden. Was auf den ersten Blick vielversprechend klingt, erscheint durch eine Analyse des Arznei-Telegramms in einem anderen Licht [24]. Ob das Dermatikum der Tablette in der Wirkung wirklich gleichwertig ist, lässt sich nicht sagen, da die Studie nicht darauf ausgerichtet war, diesen Endpunkt statistisch auszuwerten. Und das ist nur der Auftakt zu den Unzulänglichkeiten. Nur 71% der Probanden überhaupt beendeten die Studie, auswertbare Fotos zur Beurteilung des Therapieerfolgs lagen gar nur bei 55% der Probanden vor. In einer vom BfArM beauftragten Responderanalyse sollten die Probanden außerdem die Verbesserung ihres Haarwachstums selbst bewerten. In der subjektiven Einschätzung taten sich aber keine signifikanten Unterschiede auf (Verbesserung des Haarwachstums bei 39,8% der Männer mit topischem Finasterid, bei 31,0% mit oralem Finasterid und bei 32,0% mit Placebo) [25]. Inwieweit sich die geringere systemische Wirkstoffexposition in ein geringeres Risiko für Nebenwirkungen übersetzen lässt, ist noch unklar. Sexuelle Nebenwirkungen traten zwar nicht häufiger auf als unter Placebo (dermal 2,8%; oral 4,8%; Placebo 3,3%), jedoch lassen sich aufgrund des kleinen Patientenkollektivs laut Arznei-Telegramm kaum verlässliche Aussagen treffen. Erwartet werden müssen solche Nebenwirkungen grundsätzlich trotzdem. In den USA ist topisches Finasterid als Arzneimittel zwar nicht zugelassen, wird aber als Defekturarzneimittel durch Telemedizin-Portale wie forhims.com in den Verkehr gebracht. Die Post-Finasteride-Syndrome-Foundation weist in diesem Zusammenhang auf Nachfrage der DAZ-Redaktion darauf hin, dass Ihnen auch zahlreiche Fälle nach topischer Anwendung bekannt sind. Weitere Forschungen an dem Syndrom bleiben deshalb dringend geboten. |
Literatur
[1] Yamana K et al. Human type 3 5α-reductase is expressed in peripheral tissues at higher levels than types 1 and 2 and its activity is potently inhibited by finasteride and dutasteride. Horm Mol Biol Clin Investig 2010;2:293-299
[2] Irwig MS und Kolukula S. Persistent Sexual Side Effects of Finasteride for Male Pattern Hair Loss. J Sex Med 2011;8:1747-53
[3] Traish AM et al. Adverse side effects of 5α-reductase inhibitors therapy: persistent diminished libido and erectile dysfunction and depression in a subset of patients. J Sex Med 2011;8:872-84
[4] Shapiro J und Kaufman JD. Use of Finasteride in the Treatment of Men With Androgenetic Alopecia (Male Pattern Hair Loss). J Investig Dermatol Symp Proc 2003;8:20-23
[5] Wessels H et al. Incidence and severity of sexual adverse experiences in finasteride and placebo-treated men with benign prostatic hyperplasia. Urology 2003;61:579-84
[6] Kiguradze T et al. Persistent erectile dysfunction in men exposed to the 5α-reductase inhibitors, finasteride, or dutasteride. PeerJ 2017;5:e3020
[7] Nguyen DD et al. Investigation of Suicidality and Psychological Adverse Events in Patients Treated With Finasteride. JAMA Dermatol 2021;157:35-42
[8] Basaria S et al. Characteristics of Men Who Report Persistent Sexual Symptoms After Finasteride Use for Hair Loss. J Clin Endocrinol Metab 2016;101:4669-4680
[9] Traish A. Post-finasteride syndrome: a surmountable challenge for clinicians. Fertil Steril 2020;113:21-50
[10] Khera M et al. Penile vascular abnormalities in young men with persistent side effects after finasteride use for the treatment of androgenic alopecia. Transl Androl Urol 2020;9:1201-1209
[11] Giatti S et al. Three-Dimensional Proteome-Wide Scale Screening for the 5-Alpha Reductase Inhibitor Finasteride: Identification of a Novel Off-Target. J Med Chem 2021;64:4553-4566
[12] Dubrovsky B et al. Neurosteroids, neuroactive steroids, and symptoms of affective disorders. Pharmacol Biochem Behav 2006;84:644-55
[13] Melcangi RC et al. Neuroactive steroid levels and psychiatric and andrological features in post-finasteride patients. J Steroid Biochem Mol Biol 2017;171:229-235
[14] Howell S et al. Differential Gene Expression in Post-Finasteride Syndrome Patients. J Sex Med 2021;18:1479-1490
[15] Diviccaro S et al. Gut Inflammation Induced by Finasteride Withdrawal: Therapeutic Effect of Allopregnanolone in Adult Male Rats. Biomolecules 2022;12:1567
[16] Borgo F et al. Alterations of gut microbiota composition in post-finasteride patients: a pilot study. J Endocrinol Invest 2021;44:1263-1273
[17] Trüeb RM et al. Post-Finasteride Syndrome: An Induced Delusional Disorder with the Potential of a Mass Psychogenic Illness? Skin Appendage Disord 2019;5:320-326
[18] Mondaini N et al. Finasteride 5 mg and sexual side effects: how many of these are related to a nocebo phenomenon? J Sex Med 2007;4:1708-12
[19] Nguyen DD et al. Disproportional signal of sexual dysfunction reports associated with finasteride use in young men with androgenetic alopecia: A pharmacovigilance analysis of VigiBase. J Am Acad Dermatol 2023;88:179-181
[20] Ganzer CA und Jacobs AR. Emotional Consequences of Finasteride: Fool’s Gold. Am J Mens Health 2018;12:90-95
[21] Mögliche Risiken bei der Anwendung finasteridhaltiger Arzneimittel (1 mg und 5 mg Dosierung) sowie Empfehlungen zur Aufklärung Ihrer Patienten. Rote-Hand-Brief des Bundesinstituts für Arzneimittel und Medizinprodukte, 5. Juli 2018, www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2018/rhb-finasterid.pdf;jsessionid=CB9249BDDC993F53D1B4D268753BF3F6.2_cid354?__blob=publicationFile&v=4
[22] Uhl D. Neuroaktive Steroide im Visier. Interview mit Prof. Dr. Michael Zitzmann. DAZ 2018;16:29
[23] Piraccini BM et al. Efficacy and safety of topical finasteride spray solution for male androgenetic alopecia: a phase III, randomized, controlled clinical trial. J Eur Acad Dermatol Venereol 2022;36:286-294
[24] Externes Finasterid (Fynzur) bei androgenetischem Haarausfall. Arznei-Telegramm. 2023;54:11-2
[25] Finjuve für Männer 2,275 mg/ml Spray zur Anwendung auf der Haut, Lösung. Public Assessment Report des BfArm vom 24.3.2021. https://mri.cts-mrp.eu/portal/details?productnumber=DE%2FH%2F6478%2F001
[26] Mendell AL und MacLusky NJ. Neurosteroid Metabolites of Gonadal Steroid Hormones in Neuroprotection: Implications for Sex Differences in Neurodegenerative Disease. Front Mol Neurosci 2018;11:359
[27] Mellon SH und Griffin LD. Neurosteroids: biochemistry and clinical significance. Trends Endocrinol Metab 2002;13:35-43
[28] Imperato-McGinley J et al. Steroid 5alpha-reductase deficiency in man: an inherited form of male pseudohermaphroditism. Science 1974;186:1213-1215























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.