
- DAZ.online
- DAZ / AZ
- DAZ 7/2022
- Wenn Männern Brüste ...
AMTS Spezial
Wenn Männern Brüste wachsen
Auch Arzneimittel unter den Gynäkomastie-Auslösern
Die Brust eines Mannes kann weibliche Formen annehmen, meist begleitend bei allgemeiner Beleibtheit, seltener in Form einer echten Gynäkomastie. Diese beschreibt eine gutartige, ein- oder beidseitig auftretende Hypertrophie des Brustdrüsengewebes beim Mann und geht in der Regel mit Veränderungen an der Brustwarze und dem Warzenhof einher. Physiologisch kann eine Gynäkomastie bei Neugeborenen, in der Pubertät und auch im Alter beobachtet werden. Pathologisch und davon abzugrenzen sind Vergrößerungen der männlichen Brust aufgrund idiopathischer, hormoneller, medikamentöser oder auch krankheitsbedingter Ursachen. Optisch ähnliche Pseudoformen, denen aber keine Brustdrüsenvergrößerung zugrunde liegt, betreffen die durch vermehrt eingelagertes Fettgewebe hervorgerufene Lipomastie bei Adipositas („Männerbusen“) oder das selten auftretende, meist unilaterale Mammakarzinom des Mannes.
Brustdrüsengewebe steht auch bei Männern ebenso wie bei Frauen unter dem Einfluss der Sexualhormone. Grob vereinfacht dargestellt wirken Estrogene über den Estrogen-Rezeptor stimulierend auf die Proliferation des Brustdrüsengewebes beider Geschlechter, Androgene üben hingegen über ihren Rezeptor eine hemmende Wirkung auf Wachstum und Differenzierung der Brustdrüse aus.
Pubertätsgynäkomastie
Dieser Grundsatz lässt sich insbesondere während der Pubertät beobachten: Hier haben Veränderungen im Hormonhaushalt deutlich wahrnehmbare Auswirkungen auf die Entwicklung sekundärer Geschlechtsmerkmale. Dabei können nicht nur Mädchen Brüste wachsen (Thelarche). Auch bei etwa jedem zweiten männlichen Jugendlichen kann es aufgrund von vermehrt gebildeten Wachstumsfaktoren (Insulin-like growth factor 1, IGF-1) und Estrogen-Überschuss zu einer temporären Brustvergrößerung, der Pubertätsgynäkomastie, kommen [1]. Diese ist im weiteren Verlauf der Adoleszenz aufgrund einer zunehmenden Normalisierung des Hormonhaushaltes spontan rückläufig. Allerdings kann es zwischen ein und drei Jahren dauern, bis eine Rückbildung eintritt [1]. Von einer bis ins Erwachsenenalter persistierenden Ausprägung geht man bei weniger als zehn Prozent der Betroffenen aus [2]. Pathologische Formen bei Heranwachsenden und präpubertäre Gynäkomastie sind selten, diesen Fällen liegen endokrine Störungen oder gegebenenfalls ein Substanzmissbrauch mit anabolen Steroiden zugrunde [3]. Unabhängig davon kann auch vermehrtes Fettgewebe zur Ausbildung einer Brust beziehungsweise eines Brustansatzes bei adipösen Kindern und Jugendlichen im Sinne einer Pseudo-Gynäkomastie beitragen. Dabei sind Mischformen aufgrund der gesteigerten Aromatase-Aktivität im peripheren Fettgewebe möglich, welche Androgene in stimulierend wirkende Estrogene umwandelt.
Dysbalance im Hormonhaushalt
Zwischen dem 50. und 80. Lebensjahr ist die Prävalenz einer Gynäkomastie ebenfalls erhöht. Die auch Altersgynäkomastie genannte Form kann sich entwickeln, wenn das Androgen-Estrogen-Gleichgewicht ein weiteres Mal im Leben eines Mannes aus den Fugen gerät. Während hier der altersphysiologische Rückgang der testikulären Testosteron-Produktion, gepaart mit einem zunehmenden Körperfettanteil, ausschlaggebend ist, können auch diverse Krankheitsbilder die Sexualhormonspiegel beziehungsweise deren Verhältnis untereinander pathologisch verändern. Mit einem Testosteron-Mangel gehen beispielsweise das Klinefelter-Syndrom, virale Orchitiden (Mumps) und andere Formen des primären oder sekundären Hypogonadismus einher. Hingegen können gesteigerte Estrogen-Serumkonzentrationen, beziehungsweise ein zu den Estrogenen verschobenes Estrogen-Testosteron-Verhältnis, bei Männern mit bestimmten onkologischen Grunderkrankungen auftreten (testikuläre Sertoli-Leydig-Zell-Tumoren, Bronchial-, Magen-, Nebennierenrinden- oder Leberzellkarzinome, Keimzell- oder Keimstrangtumoren) [4, 5]. Das hierdurch beförderte Brustwachstum ist oft das erste klinisch wahrgenommene Symptom und führt regelmäßig zur Diagnose einer bis dahin unentdeckten malignen Erkrankung [6]. Gleiches gilt für das Chorionkarzinom, einem seltenen Hodentumor. Hier ist der beta-hCG-Spiegel massiv und sekundär dadurch der Estrogen-Spiegel erhöht, wodurch ebenfalls eine sogenannte paraneoplastische Gynäkomastie ausgelöst werden kann. Zudem können Hypophysenadenome, die Prolaktinome, zu einer Überproduktion von Prolaktin führen, wodurch eine geringe Milchsekretion (Galaktorrhö) auftreten kann. Aufgrund der Hyperprolaktinämie kann sich ein sekundärer Hypogonadismus entwickeln, der wiederum mit Brustwachstum einhergehen kann. Bei seltenen kongenitalen Androgenrezeptor-Defekten können dagegen Testosteron und Dihydrotestosteron ihre Wirkung nicht oder nur partiell entfalten (Androgenresistenz). Im Zuge einer Aromatisierung des überschüssigen Testosterons zu Estradiol entwickelt sich dann eine Gynäkomastie. Zusätzlich beobachtet man eine Brustdrüsenhypertrophie sehr häufig bei Leberzirrhose und auch im Rahmen von anderen Allgemeinerkrankungen, wie dialysepflichtiger, terminaler Niereninsuffizienz oder Hyperthyreose.
Symptome und Erscheinungsbild
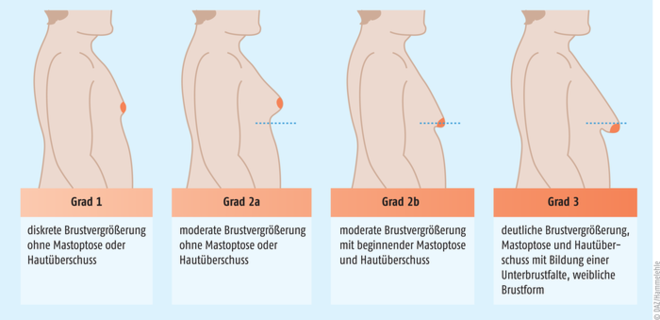
Eine Gynäkomastie wird meist beidseitig, seltener einseitig beobachtet. Neben schmerzfreien Verläufen werden auch schmerzhaft geschwollene Brüste (Mastodynie) und berührungsempfindliche Brustwarzen beklagt. Schmerzen und Spannungsgefühle sind bei raschem Auftreten der Gynäkomastie häufiger, eine schleichende Entwicklung ist hingegen eher asymptomatisch. Vielfach wird aus ästhetischen Gesichtspunkten ein hoher subjektiver Leidensdruck verspürt, der mit einer erheblichen Beeinträchtigung der Lebensqualität einhergehen kann. Insbesondere in der Pubertät kann die psychische Belastung und Angst vor Mobbing groß sein, dennoch muss hier in der Mehrzahl der Fälle eine abwartende Haltung mit Verlaufsbeobachtung eingenommen werden. Die Ausprägung der Gynäkomastie kann nach Simon et al. in vier Stadien eingeteilt werden (siehe Abbildung 1) [7], andere Klassifikationen, zum Beispiel anhand der Tanner-Stadien zur Pubertätsentwicklung, sind möglich. Im ersten Stadium tritt lediglich eine optisch diskrete, aber tastbare Vergrößerung des Brustdrüsengewebes auf, diese ist im zweiten Stadium schon moderat ausgeprägt und es kommt darüber hinaus im dritten Stadium (Grad 2b) zu Hautüberschuss. Das vierte Stadium, mit erheblicher Brustvergrößerung, entspricht einer weiblichen Form (Grad drei). Dieses ist durch deutlichen Hautüberschuss und Mastoptose (Hängebrust, Brustwarze liegt unterhalb der Brustfalte) gekennzeichnet.
Abb. 1: Die Klassifikation der Gynäkomastie nach Simon in vier Stadien orientiert sich an folgenden klinischen Merkmalen: Grad der Brustvergrößerung, Auftreten von Hautüberschuss und Mastoptose (Hängebrüste) [7].
Diagnostik
Betroffene, die wegen einer Vergrößerung der Brust ärztlichen Rat suchen, werden eingehend befragt, körperlich untersucht und es schließen sich Blutuntersuchungen zur hormonellen Diagnostik an [2, 8]. In der Anamnese sollte ermittelt werden, seit wann die körperliche Veränderung besteht, wie der Verlauf war und ob Schmerzen vorliegen. Des Weiteren sollten Informationen zu begleitenden Risikofaktoren (Arzneimittel, Alkohol- oder Drogen-/Anabolikaabusus) und Grunderkrankungen eingeholt werden. Bei einer sorgfältig durchgeführten Tastuntersuchung (Palpation) können Ärzte dann das scheibenförmig unter der Brustwarze gelegene Drüsengewebe nach Lage, Größe und Konsistenz beurteilen und eine Brustdrüsenvergrößerung von einer Pseudo-Gynäkomastie, der Lipomastie, unterscheiden. Sollten Knoten getastet werden oder tritt (blutiges) Sekret aus der Brustwarze aus, muss ein Mammakarzinom mittels bildgebender Verfahren ausgeschlossen werden. Zur diesbezüglichen sonographischen Abklärung bietet sich die Vorstellung in einem Brustzentrum an, bei unklaren Befunden oder erheblicher Brustvergrößerung sollte eine Mammografie oder ein MRT durchgeführt werden. Zu beachten ist, dass eine Gynäkomastie weder eine Vorstufe (Präkanzerose) noch einen Risikofaktor für das männliche Mammakarzinom darstellt! Neben einer Untersuchung der Brust werden obligat auch die Hoden abgetastet und im Ultraschall bezüglich Hodenatrophie oder dem Vorhandensein von testikulären Tumoren begutachtet. Auch sekundäre Geschlechtsmerkmale, wie die Schambehaarung, sollten beurteilt werden. Liegen Hinweise für eine echte Gynäkomastie vor, werden vom Urologen/Andrologen oder Endokrinologen die Serumspiegel von Testosteron (freies Testosteron und gebunden an Sexualhormon-bindendes Globulin, SHBG), Estradiol, LH, FSH, Prolaktin und TSH analysiert. Die Tumormarker beta-hCG und AFP (Alpha-1-Fetoprotein) können je nach klinischem Verdacht in einer erweiterten Diagnostik miteinbezogen werden. Zudem wird die Leber- und Nierenfunktion überprüft.
Arzneimittel-bedingte Gynäkomastie
In etwa jede fünfte Gynäkomastie kann auf eine Arzneimittelanwendung zurückgeführt werden [4, 5]. Die Identifikation eines potenziellen medikamentösen Auslösers entbindet allerdings nicht – gemäß Empfehlungen der Europäischen Gesellschaft für Andrologie – von einer gründlichen Diagnostik [2]. Man beruft sich dabei auf Ergebnisse einer großen dänischen Studie, die bei zwölf Prozent der konsekutiv erfassten Gynäkomastiefälle mehr als einen Auslöser feststellen konnte [4]. Gemäß der endokrin bedingten Pathophysiologie des Brustdrüsenwachstums imponieren bei der Arzneimittel-induzierten Gynäkomastie vorrangig Wirkstoffe, die direkt oder indirekt in den Sexualhormonhaushalt eingreifen. Bei einigen mit Gynäkomastie assoziierten Vertretern ist der Pathomechanismus jedoch unbekannt. Eine Übersicht über beteiligte Wirkstoffe und Wirkstoffgruppen bietet Tabelle 1, ausgewählte Beispiele werden im folgenden Text näher beschrieben.
Erhöhung des Estrogen-Spiegels oder der Estrogen-Wirkung | |
|
|
|
|
|
|
Verminderung des Androgen-Spiegels oder der Androgen-Wirkung | |
|
|
|
|
|
|
Sonstige | |
| |
Spironolacton. Einer der prominentesten Vertreter unter den medikamentösen Auslösern einer Gynäkomastie ist der Mineralocorticoid-Rezeptorantagonist Spironolacton. Entsprechende Zusammenhänge sind bereits seit den 1970er-Jahren bekannt und gleich mehrere Mechanismen scheinen beteiligt zu sein [9]. Durch Blockade peripherer Androgen-Rezeptoren verhindert der Aldosteron-Antagonist die Bindung von Testosteron und Dihydrotestosteron. Darüber hinaus verdrängt der steroidähnliche Wirkstoff Testosteron aus dem Sexualhormon-bindenden Globulin. Das vermehrt zur Verfügung stehende Testosteron wird in der Peripherie per Aromatase in Estradiol überführt, wodurch dessen Serumspiegel steigen. Vermutlich hemmt Spironolacton auch Enzyme, die für die Androgen-Biosynthese in den Hoden wichtig sind. Durch viele Untersuchungen ist belegt, dass die Prävalenz der Gynäkomastie unter Spironolacton dosisabhängig steigt und am häufigsten bei hoch dosierter Gabe zur Behandlung eines primären Hyperaldosteronismus auftritt [9, 10]. Das Risiko, diese unerwünschte Arzneimittelwirkung zu entwickeln, sollte allerdings kein Argument gegen die Anwendung bei schwerer Herzinsuffizienz sein, da Spironolacton das Risiko von Morbidität und Mortalität verringert. Studien und Anwendungsbeobachtungen zeigen jedoch, dass eine unter der Therapie auftretende Vergrößerung der Brust und damit verbundene Schmerzen die Adhärenz schmälert und Therapieabbrüche zur Folge hat. Ein Austausch gegen den selektiver wirkenden Aldosteron-Rezeptorantagonisten Eplerenon ist bei Herzinsuffizienz möglich, unter dem das Phänomen seltener auftritt [9].
Androgen-Entzugstherapie. Die beim fortgeschrittenen Prostatakarzinom eingesetzte Androgen-Deprivation hat zahlreiche unerwünschte Arzneimittelwirkungen, Gynäkomastie ist eine davon. Sie tritt mit hoher Inzidenz bei einer Monotherapie mit nichtsteroidalen Antiandrogenen (Bicalutamid, Flutamid) und ebenfalls, aber seltener, unter GnRH-Analoga (Leuprorelin, Buserelin, Triptorelin), LHRH-Agonisten (Goserelin), GnRH-Antagonisten (Degarelix), Enzalutamid (Inhibitor des Androgen-Rezeptor-Signalweges) und Cyproteronacetat auf [9]. In Abhängigkeit des Wirkmechanismus kommt es zu einer Suppression der testikulären Testosteron-Biosynthese oder einer kompetitiven Hemmung der Androgen-Wirkung an deren Rezeptoren, sowie sekundär zu einer verstärkten Aromatisierung zu Estrogenen. Der antiandrogenen und „pro“-estrogenen Wirkung auf die Brustdrüse kann man im individuellen Heilversuch, das heißt off-label, mit einer begleitenden Gabe von (10 bis) 20 mg Tamoxifen täglich über ein bis zwei Jahre prophylaktisch begegnen [11]. Das Nebenwirkungsprofil von Tamoxifen ist dabei zu beachten, insbesondere Hitzewallungen und erhöhte Neigung zu thromboembolischen Ereignissen. Etwas weniger wirksam zur Risikoreduktion des Auftretens einer Gynäkomastie, aber besser verträglich, ist eine niedrig dosierte Mamillenbestrahlung. Dabei erfolgt die Radiotherapie einmalig mit einer Strahlendosis von zehn bis zwölf Gy (oder in zwei Sitzungen à sechs Gy) [11]. Auch die Kombination von prophylaktischer Radiotherapie der Brust und Tamoxifen-Gabe ist denkbar.
5-Alpha-Reduktasehemmer. Finasterid und Dutasterid hemmen die Verstoffwechslung von Testosteron zu 5-alpha-Dihydrotestosteron, wodurch mehr Testosteron zirkuliert und in peripheren Geweben zu Estrogenen konvertiert werden kann [9, 12]. Zu den bekannten sexuellen Funktionsstörungen (Impotenz, verminderte Libido, erektile Dysfunktion) gesellt sich mit der Gynäkomastie eine weitere, die Lebensqualität und Therapiezufriedenheit mindernde unerwünschte Arzneimittelwirkung. Auch bei der niedrig dosierten Anwendung von Finasterid zur Behandlung der androgenetischen Alopezie wurde über das Auftreten von Gynäkomastie berichtet [9].
Therapie
Nicht jede Gynäkomastie muss behandelt werden, zudem sind die therapeutischen Optionen begrenzt [13]. Ist man bei der Ursachensuche fündig geworden, gilt es zunächst, kausale Faktoren, wie zugrunde liegende Erkrankungen zu behandeln oder auslösende Arzneimittel oder Drogen abzusetzen [2]. Nur bei echtem Testosteron-Mangel, zum Beispiel aufgrund eines primären Hypogonadismus, sollte eine Substitutionstherapie erwogen werden, andernfalls kann sich die Gynäkomastie aufgrund verstärkter Aromatisierung weiter verschlechtern [2]. Gelingt es, verantwortliche Arzneimittel abzusetzen oder zu ersetzen, was nicht immer leicht möglich ist, sind die Erfolgsaussichten gut. In einer Zusammenfassung mehrerer Studien war die Remissionsrate der Gynäkomastie mit 80 Prozent nach Absetzen des Verursachers hoch [10], eine Linderung der Beschwerden kann unmittelbar im ersten Monat festgestellt werden [14]. Ob sich die Brustvergrößerung nach Ausschalten des oder der Auslöser spontan zurückbildet, hängt aber entscheidend davon ab, wie lange sie schon besteht. Zunächst erfolgt das Drüsenwachstum über einen Zeitraum von circa zwölf Monaten proliferativ und ist in dieser Akutphase noch reversibel. Im späteren Verlauf kann jedoch ein chronischer Zustand mit zunehmender Gewebefibrose eintreten, der irreversibel ist und bei entsprechendem Leidensdruck nur operativ zu behandeln ist. In der Frühphase können Schmerzen und Schwellungen mit einer medikamentösen Behandlung mit 10 bis 20 mg Tamoxifen für drei bis sechs Monate (off label) gemindert und gegebenenfalls eine Remission erreicht werden [2, 13]. |
Literatur
[1] Mieritz MG et al. A Longitudinal Study of Growth, Sex Steroids, and IGF-1 in Boys With Physiological Gynecomastia. J Clin Endocrinol Metab 2015;100(10):3752-9. doi: 10.1210/jc.2015-2836.
[2] Kanakis GA et al. EAA clinical practice guidelines – gynecomastia evaluation and Management. Andrology 2019;7:778-793. doi: 10.1111/andr.12636
[3] Lemaine V et al. Gynecomastia in Adolescent Males. Semin Plast Surg 2013;27:56-61.
[4] Mieritz MG et al. Gynaecomastia in 786 adult men: clinical and biochemical findings. Eur J Endocrinol 2017;176:555-566.
[5] Stumpf M et al. Gynäkomastie – Diagnostische und therapeutische Aspekte. Gynäkologische Endokrinologie 2004;2:139-144. DOI 10.1007/s10304-004-0069-2
[6] Daniels IR und Layer GT. Testicular tumours presenting as gynaecomastia. Eur J Surg Oncol 2003;29:437-439.
[7] Simon BE, Hoffman S, Kahn S. Classification and surgical correction of gynecomastia. Plast Reconstr Surg 1973;51(1):48-52.
[8] Schanz S et al. S1-Leitlinie Gynäkomastie im Erwachsenenalter. AWMF Registernummer 013-039. J Dtsch Dermatol Ges 2017;15(4):465-472. doi: 10.1111/ddg.13080_g.
[9] Bowman JD et al. Drug-Induced Gynecomastia. Pharmacotherapy 2012;32(12):1123-1140.
[10] Nuttal FQ et al. Gynecomastia and drugs: a critical evaluation of the literature. Eur J Clin Pharmacol 2015;71:569-578.
[11] Ghadjar P et al. Treatment strategies to prevent and reduce gynecomastia and/or breast pain caused by antiandrogen therapy for prostate cancer. Strahlenther Onkol 2020;196:589-597. https://doi.org/10.1007/s00066-020-01598-9
[12] Trinchieri A et al. Drug-induced gynecomastia: A systematic review and meta-analysis of randomized clinical trials. Arch Ital Urol Androl 2021;93(4):489-496. doi: 10.4081/aiua.2021.4.489.
[13] Jacobeit JW, Kliesch S. Diagnostik und Therapie der Gynäkomastie. Nicht jede Brustdrüsenvergrößerung des Mannes ist eine Gynäkomastie, aber jede Gynäkomastie ist abklärungsbedürftig. J Reproduktionsmed. Endokrinol 2009;6(2):63-67.
[14] Eckman A und Dobs A. Drug-induced gynecomastia. Expert Opin. Drug Saf. 2008;7(6):691-702, DOI: 10.1517/14740330802442382























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.