
- DAZ.online
- DAZ / AZ
- DAZ 7/2022
- Auf der Zielgeraden – ...
Pandemie Spezial
Auf der Zielgeraden – Nuvaxovid®
Was man über den Protein-basierten COVID-19-Impfstoff wissen sollte
Am 21. Februar 2022 ist es so weit: Laut Bundesgesundheitsminister Karl Lauterbach soll die erste Tranche des adjuvantierten Protein-basierten COVID-19-Impfstoffs Nuvaxovid® 1,75 Millionen Dosen umfassen. Bis zum 20. März sollen dann in Deutschland voraussichtlich 3,8 Millionen Dosierungen erhältlich sein. Eine Packung ist dabei mit zehn Vials á 5 Milliliter Impfstoff bestückt, dabei entspricht ein Vial zehn Impfdosen (0,5 ml). Seit Beginn des Rolling-Review-Verfahrens am 3. Februar 2021 ist einige Zeit ins Land gegangen. Nachdem zwischenzeitlich auch von Produktionsproblemen (s. DAZ 2021, Nr. 38, S. 42 „Die Novavax-Vakzine, der ewige Hoffnungsträger“) berichtet wurde, warteten vor allem Kritiker der mRNA- und Vektorimpfstoff-Technologie sehnsüchtig auf die Zulassung von Nuvaxovid®. Am 20. Dezember letzten Jahres war es dann so weit, und die Europäische Kommission hat der Vakzine die bedingte Zulassung erteilt (Zulassungs-Nr.: EU/1/21/1618/00). Diese impliziert die Verpflichtung des Herstellers, weitere Daten zum Impfstoff nachzureichen. Seit dem 20. Januar 2022 wird Nuvaxovid® von der Ständigen Impfkommission STIKO zur Grundimmunisierung von Personen ab 18 Jahren – mit Ausnahme von Schwangeren und Stillenden – empfohlen. Diese erfolgt als zweimalige intramuskuläre Applikation in den Oberarm im Abstand von drei Wochen.
Wirksamkeit gegen Omikron unbekannt
Die Zulassung beruht auf den Ergebnissen von zwei großen randomisierten, kontrollierten Phase-III-Studien (2019nCoV-301 und 2019nCoV-302) an mehr als 45.000 Probanden. Während in 2019nCoV-301 die Probanden in Mexiko und den USA 2 : 1 randomisiert die Protein-basierte Vakzine oder ein Placebo erhielten, erfolgte die Randomisierung im Vereinigten Königreich nach dem 1 : 1-Prinzip. In der ersten Studie traten sieben Tage nach Applikation der zweiten Dosis 14 symptomatische SARS-CoV-2-Infektionen in der Verum-Gruppe (n = 17.312) und 63 symptomatische SARS-CoV-2-Infetionen in der Placebo-Gruppe (n = 8140) auf. Dies entspricht einer Schutzwirkung von 90,4%. Dabei ist darauf hinzuweisen, dass nur bei einem Teil der Infizierten die auslösende Virusvariante sequenziert wurde (79%). Die Infektionen waren vor allem auf die von der Weltgesundheitsorganisation als besorgniserregend eingestuften Alpha- (51%), Beta- (4%) und Gamma-Varianten (4%) zurückzuführen. Die übrigen Infektionen wurden durch Varianten von Interesse (Iota: 13% und Epsilon: 5%) ausgelöst. In der in Großbritannien durchgeführten Studie zeigte die Vakzine einen Schutzeffekt von 89,7%. In einer Subgruppen-Analyse bei älteren Personen (65 bis 84 Jahre) betrug er 88,9%. Mit 90% waren auch in dieser Studie die meisten Infektionen auf die Alpha-Variante zurückzuführen. Aktuell existieren noch keine Daten, ob und wie stark Nuvaxovid® auch vor Infektionen mit der Omikron-Variante schützen kann. Ebenso lässt sich bisher nicht sagen, wie lange die Schutzdauer anhält. Das Follow-Up der Studienteilnehmer soll aber bis zu zwei Jahre andauern. Die dokumentierten Nebenwirkungen verliefen meist mild bis moderat und besserten sich wenige Tage nach der Immunisierung (s. Tab. 1). Bei älteren Personen wurde in den ersten drei Tagen nach der Immunisierung mit 1% etwas häufiger ein erhöhter Blutdruck gemessen als in der Placebogruppe (0,6%).
Systemorganklasse | sehr häufig (≥ 1/10) | häufig (≥ 1/100, < 1/10) | Gelegentlich (≥ 1/1.000, < 1/100) |
|---|---|---|---|
Erkrankungen des Blutes und des Lymphsystems | Lymphadenopathie | ||
Erkrankungen des Nervensystems | Kopfschmerzen | ||
Gefäßerkrankungen | Hypertonie | ||
Erkrankungen des Gastrointestinaltrakts | Übelkeit und Erbrechen1 |
| |
Erkrankungen der Haut und des Unterhautgewebes | |||
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
| ||
allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
|
| Jucken an der Injektionsstelle |
1 häufiger nach der zweiten Dosis beobachtet. | |||
Saponine zur Wirkverstärkung
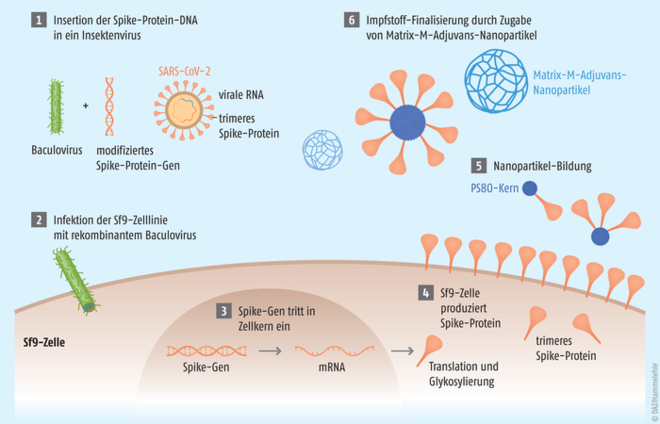
Als Antigen dient in Nuvaxovid® das rekombinant hergestellte Spike-Protein von SARS-CoV-2. Zur Produktion nutzt man die Sf9-Zellkulturen der Nachtfalterart Spodoptera frugiperda, die zuvor mit modifizierten Baculoviren infiziert wurden (s. Abb.). Die auf der Oberfläche der Sf9-Zellen gebildeten Spike-Proteine werden abgeerntet, mit Polysorbat 80 versetzt und bilden so kugelförmige Nanopartikel mit einem Durchmesser von 50 Nanometern. Ein Nanopartikel besteht dabei aus etwa 14 Spike-Proteinen und wird vom Immunsystem als „Virus“ erkannt (Virus-like-Particle). Zudem enthält Nuvaxovid® das Saponin-basierte Adjuvans Matrix M. Dieses besteht aus den Fraktionen A und C von gereinigten Extrakten aus der Rinde des Quillaja saponaria-Molina-Baums, die die Aktivierung der Zellen des angeborenen Immunsystems erleichtern und damit die Immunantwort auf die Vakzine verstärken sollen. Pro Dosis (0,5 ml) sind fünf Mikrogramm rekombinant hergestelltes Spike-Protein sowie 42,5 Mikrogramm Fraktion A und 7,5 Mikrogramm Fraktion C in dem Impfstoff enthalten.
Abb.: Nuvaxovid®-Impfstoffherstellung. Die für das Spike-Protein codierende DNA wird in Insekten-infizierende Baculoviren verbracht (1), die dann im nächsten Schritt Zellen der Insekten-Zelllinie Sf9 infizieren. Die für das Spike-Protein codierende DNA wird im Sf9-Zellkern transkribiert, die mRNA verlässt den Zellkern (3) und leitet die Produktion des Spike-Protein-Trimers in die Wege (4). Diese verlassen die Zellen, werden mit einem Kern aus Polysorbat 80 (PS80) versetzt, an den sie binden und Nanopartikel bilden (5). Für die Impfstoff-Finalisierung wird noch das Matrix-MTM-Adjuvans ebenfalls in Form von Nanopartikeln zugegeben (6). [Quelle: Novavax]
Weitere Inhaltsstoffe
Der Impfstoff enthält folgende Hilfsstoffe:
- Dinatriumhydrogenphosphat 7 H2O
- Natriumdihydrogenphosphat 1 H2O
- Natriumchlorid
- Polysorbat 80
- Natriumhydroxid (zur Einstellung des pH-Werts)
- Salzsäure (zur Einstellung des pH-Werts)
- Wasser für Injektionszwecke
Hilfsstoffe des Adjuvans (Matrix-M):
- Cholesterol
- Phosphatidylcholin (einschließlich all-rac-α-Tocopherol)
- Kaliumdihydrogenphosphat
- Kaliumchlorid
- Dinatriumhydrogenphosphat 2 H2O
- Natriumchlorid
- Wasser für Injektionszwecke
Personen mit Allergien gegen einen oder mehrere dieser Inhaltsstoffe dürfen nicht mit Nuvaxovid® immunisiert werden. Auch Personen, die die erste Impfdosis Nuvaxovid® nicht vertragen haben, sollten keine zweite Impfstoffdosis erhalten.
Hinweise zur Handhabung in der Apotheke
Ungeöffnet kann der Impfstoff für bis zu neun Monate bei Kühlschranktemperaturen zwischen 2 und 8 °C gelagert werden (s. Tab. 2). Um ihn vor Licht zu schützen, sollten die Vials bis zum eigentlichen Gebrauch im Umkarton aufbewahrt werden. Ein Einfrieren des Impfstoffs ist zu vermeiden. Kurzfristig kann das ungeöffnete Vial (z. B. aus Transportgründen) auch für maximal zwölf Stunden bei bis zu 25 °C aufbewahrt werden. Nach der ersten Dosis-Entnahme kann das geöffnete Vial für maximal sechs Stunden bei Temperaturen zwischen 2 und 8 °C aufbewahrt werden. Aus mikrobiologischer Sicht sollten die Reste des Impfstoffs schnellstmöglich aufgebraucht werden.
Zustand des Vials | maximale Lagerungsdauer | Lagerungstemperatur | besondere Hinweise |
|---|---|---|---|
ungeöffnet | neun Monate | 2 bis 8 °C | vor Licht geschützt im Umkarton aufbewahren, nicht einfrieren |
zwölf Stunden | 2 bis 25 °C | ||
geöffnet | sechs Stunden ab dem ersten Kontakt mit einer sterilen Nadel | 2 bis 25 °C |
Vorbereitung und Verimpfung
Der Impfstoff wird als gebrauchsfertige Lösung geliefert und darf nicht mit anderen Impfstoffen oder Arzneistoffen gemixt oder gelöst werden. Um die Vakzine vor Licht zu schützen, sollte das Vial erst unmittelbar vor dem Gebrauch aus dem Karton und dem Kühlschrank entnommen werden. Anschließend ist zu überprüfen, ob die Flüssigkeit frei von Partikeln und Verfärbungen ist. Die Dispersion sollte dabei farblos bis leicht gelb und klar bis leicht opalisierend sein. Auf dem Etikett sind Datum und Uhrzeit der ersten Dosis-Entnahme zu vermerken, das angebrochene Vial muss dann innerhalb von sechs Stunden verbraucht werden. Vor Entnahme jeder Impfstoff-Dosis muss das Vial leicht geschwenkt werden, ein Schütteln ist jedoch zu vermeiden. Mit einer sterilen Nadel oder Spritze kann anschließend eine Dosis (0,5 ml) aus dem Vial entnommen werden und intramuskulär in den Deltamuskel des Oberarms injiziert werden. Die anschließende Überwachung des Geimpften sollte mindestens 15 Minuten betragen. Jedes Vial enthält etwas mehr Volumen als zehn Impfstoffdosen. Der entstandene Rückstand muss verworfen werden und darf nicht aus mehreren Vials zusammengeführt werden. Um die Rückverfolgbarkeit von biologisch hergestellten Arzneimitteln zu gewährleisten, müssen sowohl Name als auch Charge des Impfstoffs dokumentiert werden.
Nicht zusammen mit Influenza-Impfung
Die Impfung mit Nuvaxovid® sollte nicht zusammen mit der Immunisierung gegen Influenza erfolgen. Hintergrund dafür sind die Ergebnisse einer Subgruppen-Analyse der klinischen Studien, in der einige Probanden parallel zu Nuvaxovid® einen inaktivierten Grippeimpfstoff erhalten hatten. Hier konnte festgestellt werden, dass diese Probanden weniger bindende Antikörper gegen SARS-CoV-2 bildeten. Die klinische Bedeutung dieses Effekts ist jedoch unbekannt. Eine simultane Verimpfung von Nuvaxovid® und anderen Vakzinen wurde nicht untersucht.
Besondere Patientengruppen
Aktuell dürfen Kinder nicht mit Nuvaxovid® geimpft werden, der Hersteller plant aber, zu einem späteren Zeitpunkt klinische Studien mit jüngeren Menschen durchzuführen. Ebenso ist der Impfstoff derzeit nicht für die Immunisierung von Schwangeren geeignet. Zwar haben Tierversuche keine gravierenden Nebenwirkungen aufgezeigt, klinische Daten sind jedoch limitiert. Wünscht die Schwangere dennoch eine Impfung mit Nuvaxovid®, so sollte diese nur unter strenger Abwägung des Nutzen-Risiko-Profils und unter ärztlicher Überwachung erfolgen. Es ist nicht bekannt, ob Nuvaxovid® bei Stillenden über die Muttermilch ausgeschieden wird.
Auch immunsupprimierte Menschen können mit Nuvaxovid® immunisiert werden. In den klinischen Studien konnten keine besonderen Sicherheitsbedenken in dieser Personengruppe festgestellt werden, es ist jedoch damit zu rechnen, dass der Impfschutz geringer ausfällt. Besonders vorsichtig sollte die Vakzine bei Personen appliziert werden, die eine antikoagulative Therapie erhalten oder die unter einer Blutgerinnungsstörung leiden, da sonst Blutungen und Blutergüsse die Folge sein können. Die Immunisierung von Personen, die unter einer akuten fieberhaften Erkrankung oder Infektion leiden, sollte auf einen späteren Zeitpunkt verschoben werden. Bei leichteren Erkältungen und/oder leichtem Fieber kann die Impfung wie geplant erfolgen. |
Literatur
Empfehlung zur Grundimmunisierung von Personen ab 18 Jahren mit dem COVID-19-Impfstoff Nuvaxovid der Firma Novavax, Pressemitteilung der Ständigen Impfkommission STIKO, 3. Februar 2022
Jötten F. Die Novavax-Vakzine, der ewige Hoffnungsträger. Deutsche Apotheker Zeitung 2021, Nr. 38, S. 42
EMA recommends Nuvaxovid for authorisation in the EU, Pressemitteilung der European Medicine Agency, 20. Dezember 2021
Nuvaxovid. CHMP assessment report. Informationen der European Medicine Agency, 4. Januar 2022
Nuvaxovid. Annex I, Summary of product characteristics. Informationen der European Medicine Agency, www.ema.europa.eu/en/documents/product-information/nuvaxovid-epar-product-information_en.pdf, Abruf am 14. Februar 2022




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.