
- DAZ.online
- DAZ / AZ
- DAZ 51/2022
- Neue Arzneimittel 2022
Neue Arzneimittel
Neue Arzneimittel 2022
Analgetika
Eptinezumab
Der Calcitonin-Gene-related-Peptide (CGRP)-Antikörper Eptinezumab (Vyepti®) ist zur prophylaktischen Anwendung bei Erwachsenen mit mindestens vier Migränetagen pro Monat vorgesehen. Der Wirkstoff wird in zwölfwöchigen Abständen intravenös appliziert. Der humanisierte monoklonale IgG1-Antikörper ist hochspezifisch gegen beide Isoformen α- und β-CGRP gerichtet, sodass eine Interaktion mit dem zugehörigen Rezeptor nicht mehr stattfindet und die Kopfschmerz-Frequenz signifikant reduziert wird. Eptinezumab ist nach derzeitigem Kenntnisstand nicht als therapeutischer Fortschritt einzustufen. Weder hinsichtlich Wirksamkeit oder Verträglichkeit noch hinsichtlich der Medikationskosten ist ein Vorteil erkennbar, zudem muss der Antikörper intravenös gegeben werden, während für die älteren Wirkstoffe subkutane Zubereitungen zur Selbstapplikation zur Verfügung stehen.
Antiadiposita
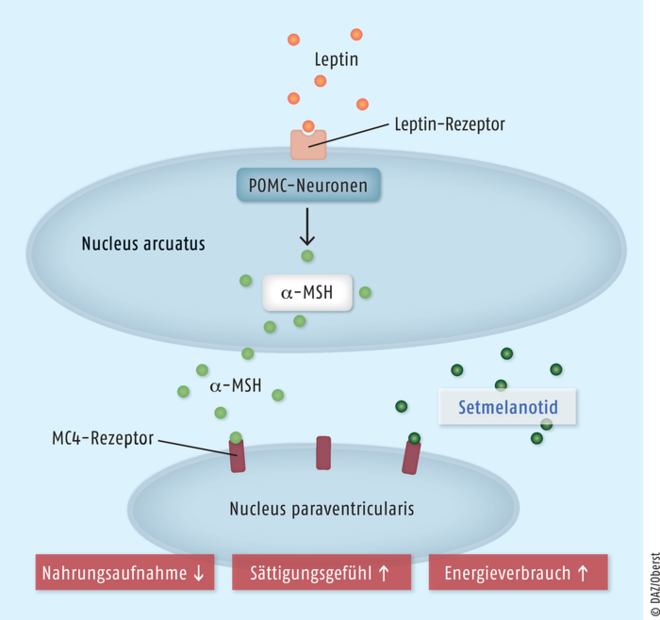
Setmelanotid
Erwachsene und Kinder ab sechs Jahren mit Adipositas und unkontrolliertem Hungergefühl können mit dem Melanocortin-4(MC4)-Rezeptor-Agonisten Setmelanotid (Imcivree®) behandelt werden. Die Therapie kommt für Personen mit genetisch bedingtem Proopiomelanocortin- oder Leptin-Rezeptor-Mangel infrage, die unter schwerem Übergewicht, starken Hungergefühlen sowie verschiedenen Komorbiditäten wie Herz-Kreislauf-Erkrankungen oder Diabetes mellitus leiden. Die verfügbaren Wirkstoffe sind bei schwerer Adipositas nicht ausreichend effektiv und meist mit kardiovaskulären Nebenwirkungen assoziiert. Der selektive Melanocortin-4-Rezeptor-Agonist Setmelanotid stellt einen relevanten therapeutischen Fortschritt dar. Über eine Wiederherstellung der Aktivität des MC4-Rezeptor-Signalwegs ist es mit dem innovativen Ansatz möglich, das Hungergefühl signifikant zu reduzieren sowie durch verringerte Kalorienzufuhr und erhöhten Energieumsatz eine Gewichtsabnahme von etwa 10% herbeizuführen. Offen ist, ob die Wirksamkeit von Setmelanotid auch über längere Zeiträume anhält, ob die Substanz auch für jüngere Kinder angewendet werden kann und welche potenzielle Gefahr von den Substanz-assoziierten Hyperpigmentierungen ausgeht.
Setmelanotid Leptin stimuliert den zugehörigen Leptin-Rezeptor am Nucleus arcuatus (Medulla oblongata) und führt zur Bildung des Melanozyten-stimulierenden Hormons α (α-MSH) aus Proopiomelanocortin (POMC). α-MSH bewirkt seinerseits eine Stimulation von Melanocortin-4-Rezeptoren (MC4-R) im Nucleus paraventricularis und löst neben einem erhöhten Energieverbrauch ein Sättigungsgefühl aus, das zu einer reduzierten Nahrungsaufnahme führt. Bei Patienten mit genetisch bedingtem Funktionsverlust von Proopiomelanocortin- oder Leptin-Rezeptoren kann kein α-MSH gebildet werden, sodass ein dauerhaftes starkes Hungergefühl besteht. Durch die Applikation des MC4-Rezeptor-Agonisten Setmelanotid wird fehlendes α-MSH ersetzt und damit das bei Patienten mit POMC- oder LEPR-Mangel ausbleibende Sättigungsgefühl wieder herbeigeführt. Aufgrund der nun reduzierten Nahrungsaufnahme und des gesteigerten Energieverbrauchs ist eine relevante Gewichtsabnahme möglich.
Antibiotika
Eravacyclin
Für Erwachsene mit komplizierten intraabdominalen Infektionen steht das neue vollsynthetisch hergestellte, fluorierte Tetracyclin-Antibiotikum Eravacyclin (Xerava®) zur Verfügung. Sein Wirkmechanismus beruht auf einer Störung der bakteriellen Proteinbiosynthese durch Bindung an die ribosomale Untereinheit 30S. Das vorwiegend bakteriostatisch wirkende Eravacyclin unterscheidet sich von natürlich vorkommenden oder halbsynthetischen Tetracyclinen durch seine Substituenten an C-7 und C-9. Kreuzresistenzen zwischen Eravacyclin und anderen Antibiotika-Klassen wie Chinolonen, Penicillinen, Cephalosporinen und Carbapenemen bestehen nicht. Eravacyclin gilt nach derzeitigem Kenntnisstand nur als mäßiger therapeutischer Fortschritt, da der Wirkmechanismus nicht innovativ ist.
Antidepressiva
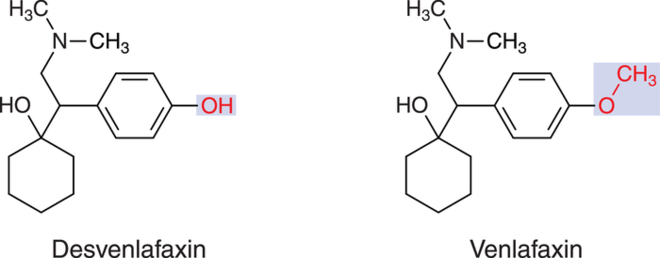
Desvenlafaxin
Episoden einer Major Depression bei Erwachsenen können nun auch in Deutschland mit Desvenlafaxin (Desveneurax®) behandelt werden. Der Serotonin-Noradrenalin-Reuptakehemmer (SNRI) wird in den USA bereits seit einigen Jahren eingesetzt. Die Substanz ist der aktive Metabolit des bereits etablierten Serotonin-Noradrenalin-Wiederaufnahmehemmers Venlafaxin. Die Substanz gilt nicht als therapeutischer Fortschritt, da intensiv erprobte und stabil wirksame Arzneistoffe in ausreichender Zahl zur Verfügung stehen. Selbst das bereits seit vielen Jahren im Handel befindliche Desvenlafaxin-Prodrug Venlafaxin ist bei nahezu identischem Sicherheitsprofil zuverlässiger wirksam als der aktive Metabolit Desvenlafaxin.
Desvenlafaxin (links) ist der Hauptmetabolit von Venlafaxin. Es besitzt eine Methylgruppe weniger im Molekül.
Antihämorrhagika
Lusutrombopag
Der neue Wirkstoff Lusutrombopag (Mulpleo®) führt zu einer Stimulation der Thrombozyten-Bildung. Er ist für die Behandlung von Erwachsenen mit schwerer Thrombozytopenie aufgrund einer chronischen Lebererkrankung vorgesehen, bei denen das Blutungsrisiko erhöht und ein invasiver Eingriff geplant ist. Lusutrombopag ist ein oral wirksamer, kleinmolekularer Thrombopoetin-Rezeptor-Agonist. Er bewirkt eine Stimulation der Proliferation und Differenzierung von Megakaryozyten aus Knochenmarkvorläuferzellen und als Folge eine verstärkte Bildung von Thrombozyten. Die Thrombozyten-Zahlen steigen innerhalb einer Woche nach Behandlungsbeginn und gehen im Zeitraum von ein bis zwei Wochen nach dem Absetzen von Lusutrombopag wieder zurück. Mit Avatrombopag und Eltrombopag gibt es bereits Thrombopoetin-Rezeptor-Agonisten für spezielle Indikationen. Ob Lusutrombopag einen therapeutischen Fortschritt darstellt, ist derzeit nicht eindeutig zu beantworten. In klinischen Studien wurde bisher lediglich die Überlegenheit gegenüber Placebo nachgewiesen.
Antineoplastische Mittel
Asciminib
Für die Behandlung von Erwachsenen mit Philadelphia-Chromosom-positiver chronischer myeloischer Leukämie in der chronischen Phase steht der Tyrosinkinase-Inhibitor Asciminib (Scemblix®) zur Verfügung. Asciminib ist ein potenter Inhibitor der aufgrund einer Translokation exprimierten ABL/BCR::ABL1-Tyrosinkinase. Er bindet spezifisch an die Myristoyl-Bindungstasche von ABL1. Das Molekül imitiert die autoinhibitorische Wirkung eines am mutierten ABL1-Protein nicht mehr vorhandenen myristoylierten N-terminalen Rests und führt so zum Abbruch der Signalkaskade. Dadurch kommt es zur Apoptose der Tumorzellen und zur Tumorregression. Der Wirkmechanismus von Asciminib mit der Myristoyl-Bindungstasche als Target ist völlig innovativ, es ist ein relevanter therapeutischer Fortschritt für CML-Patienten.
Capmatinib
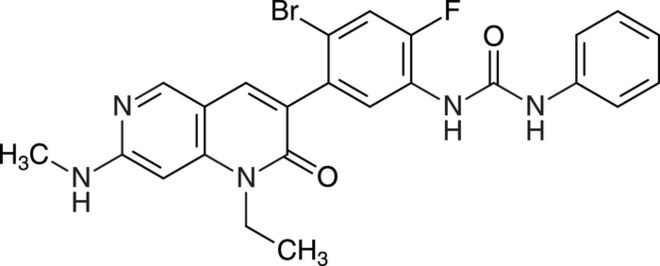
Capmatinib (Tabrecta®) ist als Monotherapeutikum bei fortgeschrittenem nicht-kleinzelligem Lungenkarzinom indiziert. Der Mesenchymal-epithelialer-Transitionsfaktor(MET)-Inhibitor kommt bei Mutationen des für MET codierenden Gens infrage, die bereits erfolglos eine Platin-basierte Chemotherapie oder eine Immuntherapie erhalten haben. MET-Mutationen führen zu einem verstärkten Tumorwachstum, da die nachgeschalteten Signalwege dauerhaft aktiviert sind. Capmatinib ist ein hochselektiver, reversibler Inhibitor der MET und reguliert dosisabhängig die MET-abhängige Signaltransduktion über verschiedene Signalwege herunter, sodass die Tumorproliferation reduziert wird. Da Capmatinib den gleichen Wirkmechanismus wie das im März 2022 eingeführte Tepotinib (Tepmetko®) mit gleicher Indikation hat, gilt es nicht als relevanter therapeutischer Fortschritt.
Duvelisib
Der γ- und δ-spezifische Phosphoinositid-3-Kinase(PI3K)-Inhibitor Duvelisib (Copiktra®) kann bei Erwachsenen mit rezidivierter oder refraktärer chronischer lymphatischer Leukämie (CLL) oder follikulärem Lymphom eingesetzt werden. Die Phosphatidylinositol-3-Kinase (PI3K) besitzt neben einer regulatorischen eine katalytische Untereinheit, die in vier Isoformen (α, β, γ und δ) vorkommt. Ihre Aktivierung führt zur Bildung von Second Messengern. Diese regen wiederum verschiedene Enzyme an, die für Proliferation, Motilität und Überleben von Zellen verantwortlich sind. Bei B-Zell-Lymphomen ist häufig der PI3Kδ-Signalweg aktiviert, was zu einer verstärkten Proliferation von malignen B-Zelllinien führt. Die PI3Kγ nachgeschaltete Kaskade spielt bei der Aufrechterhaltung einer unterstützenden Tumor-Mikroumgebung eine Rolle. Duvelisib ist der erste Wirkstoff, der diese beiden PI3K-Isoformen inhibiert.
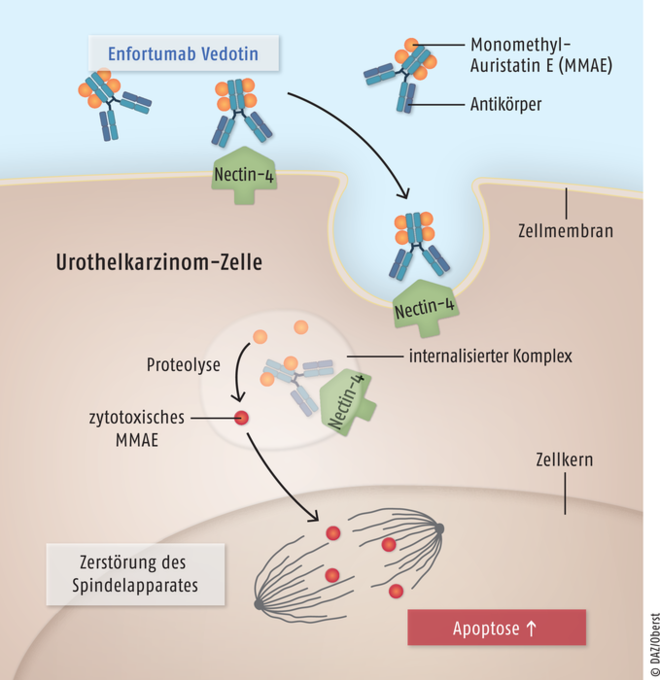
Enfortumab Vedotin
Das Antikörper-Wirkstoff-Konjugat Enfortumab Vedotin (Padcev®) ist für Erwachsene mit lokal fortgeschrittenem oder metastasiertem Urothelkarzinom vorgesehen, die bereits eine Chemotherapie und einen Programmed Death Receptor-1- oder Programmed Death Ligand-1-Inhibitor erhalten haben. Enfortumab Vedotin ist ein Konjugat aus dem Mitosehemmstoff Monomethyl-Auristatin E (MMAE) und einem über einen Peptid-Linker kovalent gebundenen, vollständig humanen IgG1-κ-Antikörper. Er ist gegen das auf Urothelkarzinom-Epithelzellen überexprimierte Transmembranprotein Nectin-4 gerichtet. Enfortumab Vedotin bindet an Nectin-4-positive Zellen, im Zellinneren wird dann die zytotoxische Komponente MMAE abgespalten. Das Spindelgift bindet während der Zellteilung an das Mikrotubuli-Netzwerk, zerstört dieses und löst Apoptose aus. Urothelkarzinome sind die häufigsten invasiven Harnblasenkarzinome. Die Prognose ist schlecht, die zu erwartende Gesamtüberlebenszeit liegt bei nur etwa sieben Monaten. Für Personen mit austherapiertem Urothelkarzinom ist das Antikörper-Wirkstoff-Konjugat eine Option, mit der eine signifikante Verlängerung der Überlebenszeit erreicht wurde, allerdings nur um etwa vier Monate gegenüber einer weiteren Chemotherapie.
Enfortumab Vedotin ist ein Antikörper-Wirkstoff-Konjugat, das mit seinem Antikörperbereich an das Transmembranprotein Nectin-4 auf Urothelkarzinom-Epithelzellen bindet. Dieser Komplex wird zusammen mit dem kovalent an den Antikörper gebundenen Spindelgift Monomethyl-Auristatin E (MMAE) in die Zelle aufgenommen. Durch Proteolyse des Peptid-Linkers wird die zytotoxische Komponente vom Antikörper abgespalten. Monomethyl-Auristatin E bindet während der Zellteilung an Mikrotubuli des Spindelapparates, zerstört diese und löst Apoptose aus. So wird bei Patienten mit Urothelkarzinom eine gezielte Eliminierung der Tumorzellen erreicht.
Idecabtagen Vicleucel
Für die Behandlung des rezidivierten und refraktären multiplen Myeloms steht das CAR-T-Zell-Präparat Idecabtagen Vicleucel (Abecma®) zur Verfügung. Die für jeden Patienten individuell hergestellte „lebende“ Immunzell-Therapie auf Basis autologer T-Zellen wird nach mindestens drei erfolglosen systemischen Behandlungen eingesetzt. Bei dieser autologen Immunzell-Therapie macht man sich zunutze, dass alle Plasmazellen wie auch Myelom-Zellen auf ihrer Oberfläche das B-Zell-Reifungsantigen (B-Cell Maturation Antigen, BCMA) exprimieren. Aus dem Blut von Myelom-Patienten werden mittels Apherese T-Zellen gewonnen und außerhalb des Körpers so umprogrammiert, dass sich ihre zytotoxische Aktivität gegen BCMA-positive Zellen richtet. Das neu in die T-Zellen eingeführte Transgen kodiert für einen chimären Antigenrezeptor (chimeric antigen receptor, CAR), der aus mehreren Strukturelementen besteht: Die extrazelluläre Domäne, ein Einzelketten-Antikörperfragment, erkennt BCMA-exprimierende Zellen und stellt mit diesen eine Verbindung her. Die intrazelluläre Komponente CD3ζ aktiviert die umprogrammierten T-Zellen und leitet deren zytotoxische Wirkung gegen die Plasmazellen ein. Die ebenfalls intrazelluläre kostimulatorische Signaldomäne 4-1BB bewirkt eine verbesserte Expansion und Persistenz der T-Zellen und sorgt so für einen starken und anhaltenden antitumoralen Effekt. Allerdings tragen auch gesunde Zellen das Oberflächenprotein BCMA, sodass Idecabtagen Vicleucel diese Plasmazellen ebenfalls zerstört. Die Prognose von Patienten mit multiplem Myelom, die bereits gegen eine Behandlung mit CD38-Antikörper, Immunmodulatoren und Proteasom-Inhibitoren refraktär sind, ist extrem schlecht. Das neue CAR-T-Zell-Präparat Idecabtagen Vicleucel gilt daher als therapeutischen Fortschritt, es führt bei 67% der Behandelten zu einer Response, 30% erreichen sogar ein vollständiges Ansprechen. Der Mechanismus von Idecabtagen Vicleucel ist identisch mit dem der CAR-T-Zell-Präparate Tisagenlecleucel (Kymriah®), Axicabtagen-Ciloleucel (Yescarta®) und Brexucabtagen-Autoleucel (Tecartus®).
Lisocabtagen maraleucel
Für die Behandlung verschiedener rezidivierter oder refraktärer Lymphomarten wurde mit Lisocabtagen maraleucel (Breyanzi®) ein weiteres CAR-T-Zell-Präparat eingeführt, das für jeden Patienten auf Basis autologer T-Zellen individuell hergestellt wird. Auch bei der autologen Immunzell-Therapie mit Lisocabtagen maraleucel werden aus dem Blut von Patienten mit B-Zell-Lymphom/Leukämie T-Zellen mittels Apherese gewonnen und außerhalb des Körpers mithilfe retroviraler Transduktion so umprogrammiert, dass sich ihre zytotoxische Aktivität gegen CD19-positive B-Zellen richtet (s. Idecabtagen Vicleucel). Nach Verschwinden des Tumors können die CAR-T-Zellen länger im Patienten persistieren und bei dessen Wiederauftreten erneut aktiv werden. Die Behandlung von B-Zell-Malignomen mit Lisocabtagen maraleucel ist sehr effektiv. Der Wirkmechanismus mit gegen CD19-positive Tumorzellen gerichteten körpereigenen T-Zellen ist aber identisch mit den bereits 2018/19 eingeführten CAR-T-Zell-Präparaten. Wie lange eine Remission durch die umprogrammierten T-Zellen anhält, muss in längerfristigen Studien geklärt werden. Nicht immer sind die sehr teuren CAR-T-Zell-Therapien die eindeutig überlegenen Regime.
Mosunetuzumab
Der bispezifische CD20/CD3-Antikörper Mosunetuzumab (Lunsumio®) ist für die Behandlung von Erwachsenen mit rezidivierendem oder refraktärem follikulärem Lymphom vorgesehen. Der IgG1-Antikörper besitzt zwei Domänen, wovon eine gegen das transmembranäre Phosphoprotein CD20 auf B-Zellen gerichtet ist. Die andere Domäne bindet an die auf polyklonalen T-Lymphozyten vorkommenden CD3-Rezeptoren. Durch die Verbindung der drei Elemente – B-Zellen, Mosunetuzumab und polyklonale T-Zellen – nähern sich malige B-Zellen und zytotoxische T-Zellen an und es bildet sich eine immunologische Synapse. Als Folge werden die gebundenen T-Zellen aktiviert und deren zytotoxische Wirkung unmittelbar auf CD20-positive B-Zellen umgeleitet. Auf diese Weise ist über die T-Zell-Aktivierung eine gezielte Zerstörung von CD20-positiven Tumorzellen des follikulären Lymphoms möglich. Der bispezifische CD20/CD3-Antikörper Mosunetuzumab gilt als erheblicher therapeutischer Fortschritt, auch wenn das Wirkprinzip nicht innovativ ist. Auch der bidirektionale Antikörper Blinatumomab und das Fusionsproteins Tebentafusp haben diesen Wirkmechanismus.
Pralsetinib
Die Wirkung von Pralsetinib (Gavreto®) beruht auf einer selektiven Hemmung der RET-Rezeptor-Tyrosinkinase. Die Substanz ist zur Behandlung von Erwachsenen mit Rearranged-during-Transfection(RET)-Fusions-positivem, fortgeschrittenem nicht-kleinzelligem Lungenkarzinom indiziert. Bestimmte Mutationen, chromosomale Neuanordnungen oder Fusionen der RET-Rezeptor-Tyrosinkinase können die Bildung von aktivierten, chimären RET-Fusionsproteinen auslösen, die wiederum als onkogene Treiber agieren und die Proliferation von Tumorzellen verstärken. Pralsetinib hemmte mehrere onkogene RET-Fusionen potenter als Kinasen ohne dieses Merkmal (Off-Target-Kinasen). Die gezielte Ausschaltung dieser onkogenen Tyrosinkinase gilt als vielversprechender therapeutischer Ansatz zur Behandlung fortgeschrittener Krebserkrankungen.
Ripretinib
Der Tyrosinkinase-Inhibitor Ripretinib (Qinlock®) ist für die Behandlung von Erwachsenen mit fortgeschrittenen gastrointestinalen Stromatumoren vorgesehen. Der Wirkstoff wird eingesetzt, wenn die Behandlung mit drei oder mehr Kinase-Hemmern einschließlich Imatinib nicht mehr greift.
Ripretinib hemmt sowohl die PDGFRA- als auch die KIT-Protoonkogen-Rezeptor-Tyrosinkinase, einschließlich des Wildtyps sowie primärer und sekundärer Mutationen. Als Folge werden die Signalwege inaktiviert und somit eine gezielte Zerstörung von gegen Standardmedikationen wie Imatinib, Sunitinib und Regorafenib bereits resistenten GIST-Zellen ermöglicht. Gastrointestinale Stromatumoren wachsen meist nicht in die Organe hinein, sondern breiten sich über lange Zeit unbemerkt in den Bauchraum aus. Werden sie erkannt, sind oft bereits Metastasen nachweisbar, die Patienten sprechen nach einiger Zeit aufgrund von weiteren Mutationen nicht mehr auf Standardtherapeutika an. In diesem Personenkreis kann das Viertlinien-Therapeutikum Ripretinib – zeitlich jedoch sehr begrenzt – die Erkrankungsprogression aufhalten.
Sacituzumab Govitecan
Erwachsene mit nicht resezierbarem oder metastasiertem triple-negativem Mammakarzinom können mit dem Antikörper-Wirkstoff-Konjugat Sacituzumab Govitecan (Trodelvy®) behandelt werden. Das gesamte Antikörper-Wirkstoff-Konjugat wird in die Zellen internalisiert und das zytotoxische SN-38 durch Hydrolyse des Linker freigesetzt. SN-38 bewirkt, dass vom Enzym Topoisomerase I selbst induzierte DNA-Einzelstrangbrüche nicht wieder verschlossen werden und letztlich Apoptose ausgelöst wird. Ob das neue Antikörper-Wirkstoff-Konjugat als therapeutischer Fortschritt eingeordnet werden kann, ist derzeit offen. Die Substanz ist zur Drittlinien-Therapie bei dreifach negativem Brustkrebs bestimmt. Der Wirkmechanismus ist nicht innovativ. In klinischen Studien war Sacituzumab Govitecan Standardtherapien für fortgeschrittene Brustkrebserkrankungen zwar signifikant überlegen, allerdings betrug die gewonnene Zeit ohne Fortschreiten der Erkrankung nur wenige Monate.
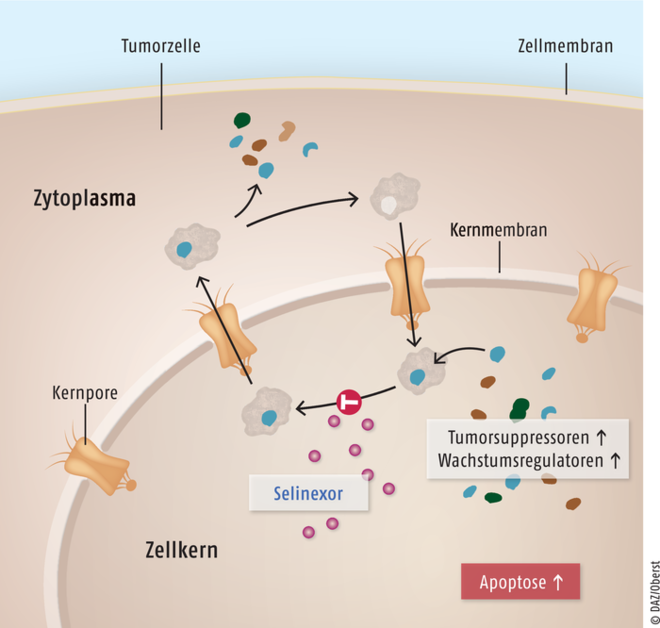
Selinexor
Bei Patienten mit refraktärem multiplem Myelom kann der selektive Inhibitor des nukleären Exports Selinexor (Nexpovio®) eingesetzt werden. Selinexor ist ein reversibler, kovalenter, selektiver Inhibitor von Exportin 1. In Kombination mit Dexamethason, mit oder ohne den Proteasom-Inhibitor Bortezomib wurden in murinen Xenotransplantat-Modellen des multiplen Myeloms durch Selinexor eine synergistische zytotoxische Wirkung und in vivo eine erhöhte Anti-Tumor-Aktivität festgestellt. Patienten mit multiplem Myelom, die bereits gegen Therapieregime mit CD38-Antikörpern, Immunmodulatoren und Proteasom-Inhibitoren refraktär sind, haben eine extrem schlechte Prognose. Anfang 2022 wurde für diesen Personenkreis mit dem individuell hergestellten und nur einmalig zu applizierenden CAR-T-Zell-Präparat Idecabtagen Vicleucel ein Therapeutikum zugelassen, dessen Wirkung auf einer spezifischen Bindung an das B-Zell-Reifungsantigen beruht. Die zu erwartende Gesamtüberlebenszeit wird derzeit auf etwa 20 Monate geschätzt. Angesichts dieser sehr guten Ergebnisse ist es derzeit fraglich, ob der neue XPO1-Inhibitor Selinexor ein therapeutischer Fortschritt ist. Selinexor hat einen völlig innovativen Wirkmechanismus auf und führt dazu, dass körpereigene Tumorsuppressor- und Wachstumsregulations-Proteine nicht hinausgeschleust werden, sondern ihre krebshemmende Wirkung im Zellkern ausführen können. Ein Vorteil für Selinexor oder Idecabtagen Vicleucel kann nur durch einen Head-to-Head-Vergleich herausgearbeitet werden.
Selinexor ist ein selektiver Inhibitor von Exportin 1 (XPO1), das als ein Trägerprotein den Molekültransport zwischen Zellkern und Zytoplasma durch die Kernporen ermöglicht. Das bei vielen Tumoren überproduzierte Exportin 1 führt dazu, dass die Konzentration von Proteinen zur Tumorsuppression und Wachstumsregulation im Zellkern niedrig bleibt, sodass ein unkontrolliertes Wachstum erfolgt. Selinexor unterbindet den Auswärtstransport von Tumorsuppressoren und Wachstumsregulatoren aus dem Zellkern und begünstigt damit bei den Tumorzellen die Auslösung von Apoptose.
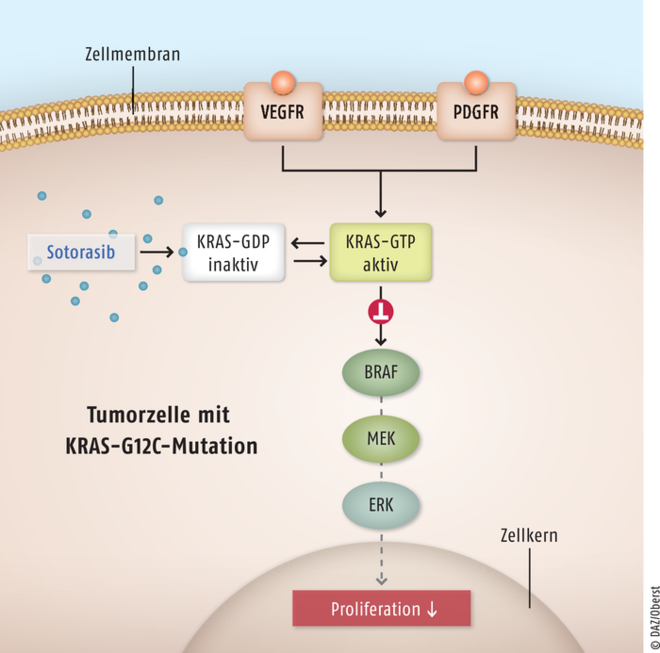
Sotorasib
Für Erwachsene mit fortgeschrittenem nicht-kleinzelligem Lungenkarzinom (NSCLC) und KRAS-G12C-Mutation steht mit Sotorasib (Lumykras®) eine hochspezifische Therapieoption zur Verfügung. Bei etwa 15% der Patienten mit nicht-kleinzelligem Lungenkarzinom sind Mutationen im Codon 12 des für das KRAS-Protein codierenden Gens feststellbar. KRAS-G12C ist eine Guanosin-Triphosphatase, die aufgrund des Austauschs der Aminosäure Guanin gegen Cytosin dauerhaft aktiviert ist und als Treiber für ein unkontrolliertes Tumorwachstum gilt. Das kleine Molekül Sotorasib ist ein selektiver und irreversibler Inhibitor von onkogenem KRAS-G12C. Hierdurch wird das Protein in seiner inaktiven Konformation fixiert und die Transformation in die aktive gebundene Form verhindert. Die nachgeschaltete Signalkaskade wird blockiert und Wachstum und Überleben von Tumorzellen werden gehemmt. Die Apoptose-Auslösung findet selektiv bei Zellen mit KRAS-G12C-Mutation statt. Das nicht-kleinzellige Lungenkarzinom mit G12C-Mutationen des für KRAS codierenden Proteins ist schwer zu behandeln. Trotz moderner Therapeutika wie den Checkpoint-Inhibitoren kann das Tumorwachstums nicht relevant eingedämmt werden. Mittlerweile versucht man, über die spezifische Ausschaltung dieses onkogenen Treiberproteins KRAS-G12C einen neuen spezifischen Therapieansatz zu finden. Das neue Sotorasib ist die erste zugelassene Behandlungsoption, die genau dieses Ziel erreicht. Es unterscheidet anhand einer geringen Abweichung auf der Oberfläche zwischen gesundem KRAS- und mutiertem KRAS-G12C-Protein, so bleiben im Organismus die gesunden Zellen erhalten. Mit Sotorasib steht für diese größte Subgruppe der NSCLC-Patienten eine völlig innovative, hochspezifische und dabei vergleichsweise gut verträgliche Behandlungsoption zur Verfügung.
BRAF: B-Raf-Protein (rapidly accelerated fibrosarcom); MEK: Mitogen-aktivierte Signal-regulierte Kinasen; ERK: extrazelluläre Signal-regulierte Kinasen; KRAS: Kirsten-Rat-Sarcoma-Virus-Protein, das im Tierversuch bei Ratten Sarkome hervorrief und von Werner Kirsten erstmals identifiziert wurde.
Tebentafusp
Tebentafusp (Kimmtrak®) ist ein bispezifisches Fusionsprotein, das als Monotherapeutikum bei Erwachsenen mit inoperablem oder metastasiertem uvealem Melanom eingesetzt wird. Der Wirkstoff ist für Patienten geeignet, deren Tumor das humane Leukozyten-Antigen-A*02:01 exprimiert, das heißt HLA-A*02:01-positiv ist. Das insgesamt sehr selten auftretende uveale Melanom entwickelt sich meist direkt in der Aderhaut aus entarteten Melanozyten und wird im Gegensatz zum kutanen Melanom nicht erstrangig durch UV-Strahlung ausgelöst. Der kleine Tumor wird meist nur zufällig im Rahmen von augenärztlichen Untersuchungen entdeckt. Die primäre Behandlung erfolgt in der Regel durch Bestrahlung, Kryo- oder Lasertherapie sowie durch chirurgische Entfernung. Bei etwa der Hälfte der Betroffenen kommt es allerdings innerhalb von etwa zehn bis 15 Jahren zu einer Metastasierung, meist in der Leber. Da bislang kein für das uveale Melanom zugelassenes Präparat verfügbar war, wurden unspezifische Chemotherapeutika wie Dacarbazin oder Immuntherapeutika wie Ipilimumab sowie Pembrolizumab eingesetzt. Deren Wirksamkeit ist jedoch für diese Tumorform sehr begrenzt. So lag die Ein-Jahres-Überlebensrate von Patienten mit metastasiertem uvealem Melanom bei nur etwa 50 bis 60%. Der nun neu auf dem Markt eingeführte Wirkstoff Tebentafusp, mit völlig innovativem Wirkmechanismus, stellt nach derzeitigem Kenntnisstand, zumindest für den Patientenanteil mit HLA-A*02:01-positivem Tumor, einen gewissen therapeutischen Fortschritt dar. Das bispezifische Fusionsprotein wird den sogenannten Immtacs (Immune Mobilizing Monoclonal T-Cell Receptors Against Cancer), einer neuen Klasse von Antitumortherapeutika, zugeordnet.
Tepotinib
Tepotinib (Tepmetko®) ist als Monotherapeutikum zur Behandlung von Erwachsenen mit fortgeschrittenem nicht-kleinzelligem Lungenkarzinom indiziert. Der Mesenchymal-epitheliale-Transitionsfaktor(MET)-Inhibitor kommt für Patienten mit Exon-14-Mutationen des für MET codierenden Gens infrage, die bereits erfolglos eine Platin-basierte Chemotherapie oder eine Immuntherapie erhalten haben. Als Folge werden die entsprechenden Signalkaskaden herunterreguliert, und es kommt zu einer Reduktion der Tumorproliferation. Die ausgeprägte antitumorale Aktivität von Tepotinib wurde in Tumoren mit onkogener MET-Aktivierung wie METex14-Skipping-Mutationen nachgewiesen.
Trastuzumab-Deruxtecan
Gegen inoperable und/oder metastasierte HER2-positive Mammakarzinome wurde das Antikörper-Wirkstoff-Konjugat Trastuzumab-Deruxtecan (Enhertu®) als Monotherapeutikum für Erwachsene eingeführt, die bereits mindestens zwei gegen den humanen epidermalen Wachstumsfaktor-Rezeptor HER2 gerichtete Vorbehandlungen erhalten haben. Trastuzumab-Deruxtecan ist ein Konjugat aus dem spezifisch gegen HER2 gerichteten rekombinanten IgG1-Antikörper Trastuzumab und dem zytotoxischen Topoisomerase-I-Inhibitor Deruxtecan (DXd). Das gesamte Antikörper-Wirkstoff-Konjugat wird in die Zellen internalisiert und zytotoxisches Deruxtecan freigesetzt. Es verhindert, dass die DNA-Einzelstrangbrüche, die vom körpereigenen Enzym Topoisomerase I induziert wurden, nicht wieder verschlossen werden und es letztlich zur Apoptose kommt. Ein Teil der Wirkung von Trastuzumab-Deruxtecan ist auch auf die Blockade des Wachstumsfaktor-Rezeptors HER2 durch die spezifische Bindung des Antikörperanteils zurückzuführen. Damit gilt das neue Antikörper-Wirkstoff-Konjugat Trastuzumab-Deruxtecan als relevanter therapeutischer Fortschritt.
Zanubrutinib
Der Bruton-Tyrosinkinase(BTK)-Inhibitor Zanubrutinib (Brukinsa®) ist eine neue Option für Patienten mit Morbus Waldenström, die mindestens eine vorherige Therapie erhalten haben, oder zur Erstlinien-Therapie bei Patienten, die für eine Chemo-Immuntherapie nicht geeignet sind. Beim Morbus Waldenström entarten B-Lymphozyten maligne. Die Zellen erhalten über B-Zell-Rezeptoren wichtige Wachstumsimpulse, es kommt zur Aktivierung von Signalwegen, die für die Migration, die Chemotaxis und die Adhäsion der Zellen notwendig sind. Die Bruton-Tyrosinkinase (BTK) ist ein wichtiges Signalmolekül in dieser Reaktionskaskade. Als BTK-Inhibitor bindet Zanubrutinib kovalent an einen Cystein-Rest im aktiven Zentrum der Kinase und bewirkt eine dauerhafte Hemmung ihrer enzymatischen Aktivität. Als Folge werden die Proliferation und das Überleben maligner B-Zellen sowie die Migration und Substratadhäsion dieser Zellen effektiv gehemmt. Nach Ibrutinib ist Zanubrutinib der zweite Bruton-Tyrosinkinase-Inhibitor, er gilt als moderater therapeutischer Fortschritt.
Diagnostika
Macimorelin
Bei Erwachsenen mit Wachstumshormon-Mangel wird das in der Hypophyse gebildete und im Hypophysenvorderlappen zwischengespeicherte Peptidhormon Somatropin nicht ausreichend produziert bzw. ausgeschüttet. Zur Funktionsdiagnostik steht das Peptidomimetikum Macimorelin (Ghryvelin®) zur Verfügung. Analog zum körpereigenen Ghrelin fördert es durch agonistische Wirkung am Wachstumshormon-sekretagogen Rezeptor in der Hypophyse und im Hypothalamus die Sekretion von Somatropin. Die maximale Stimulation wird etwa 45 bis 60 Minuten nach der Einnahme von Macimorelin erreicht. Der neue Somatropin-Stimulationstest mit Macimorelin kann nach derzeitigem Kenntnisstand als mäßiggradiger Fortschritt gewertet werden. Macimorelin ist im Gegensatz zu den älteren Diagnostika peroral verfügbar und akzeptabel verträglich, gewisse Bedenken bestehen lediglich bei Arrhythmie-Neigung.
Dermatika
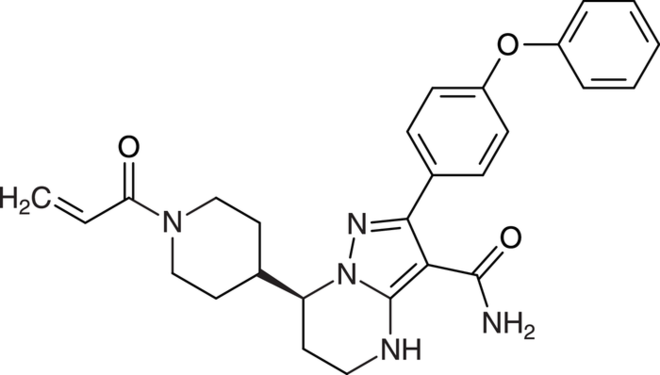
Abrocitinib
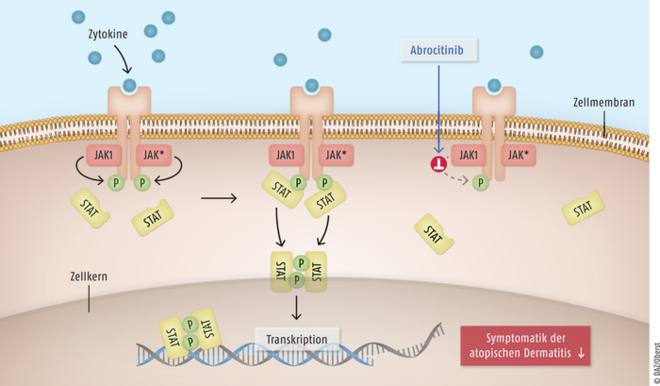
Januskinasen (JAK) sind zytoplasmatische Tyrosinkinasen. Sie leiten Signale von Zytokinen und Wachstumsfaktoren weiter, die unter anderem eine wichtige Rolle bei immunologischen und inflammatorischen Prozessen sowie bei der Hämatopoese spielen. Die Januskinase 1 vermittelt insbesondere die Signaltransduktion von proinflammatorischen Zytokinen und ist damit für die Pathogenese der atopischen Dermatitis von Bedeutung. Abrocitinib (Cibinqo®) ist ein selektiver Inhibitor von JAK1 und hemmt somit bevorzugt die zytokininduzierte STAT-Phosphorylierung durch JAK-Signalpaare, an denen JAK1 beteiligt ist. Die Relevanz dieser selektiven enzymatischen Hemmung spezifischer JAK-Enzyme für die klinische Wirkung bei atopischer Dermatitis ist derzeit allerdings nicht bekannt. Die Erkrankung ist mit einem als besonders quälend empfundenen Juckreiz verbunden, der zu permanentem Kratzen verleitet und häufig Schlafstörungen zur Folge hat. Als Standardtherapeutika werden derzeit Emollienzien, topische Corticosteroide und Calcineurin-Inhibitoren wie Tacrolimus und Pimecrolimus sowie systemisches Ciclosporin und Antihistaminika eingesetzt. Seit 2017 steht für Erwachsene mit mittelschwerer bis schwerer atopischer Dermatitis der spezifisch gegen die IL-4Rα-Untereinheit an Typ-I- und Typ-II-Rezeptoren gerichtete Antikörper Dupilumab zur Verfügung, der die über IL-4 und IL-13 ausgelösten Reaktionskaskaden hemmt. 2021 kam der sehr ähnlich wirkende, gegen IL-13 gerichtete Antikörper Tralokinumab hinzu. Die beiden Substanzen zeichnen sich durch sehr gute Wirksamkeit und Verträglichkeit aus. Im letzten Jahr wurden mit Baricitinib und Upadacitinib zwei JAK-Inhibitoren als neue Wirkstoffgruppe für die mittelschwere bis schwere atopische Dermatitis zugelassen. Inwiefern der weitere JAK-Inhibitor Abrocitinib einen therapeutischen Fortschritt darstellt, ist derzeit schwer zu beurteilen.
Abrocitinib Zytokine bewirken durch Andocken an den entsprechenden Rezeptor die Phosphorylierung von STAT-Proteinen (Signaltransduktoren und Aktivatoren der Transkription) durch Januskinasen (JAK). Die phosphorylierten dimeren STAT-Proteine stimulieren nun ihrerseits die Replikation spezifischer Zielgene im Zellkern. Der JAK1-Inhibitor Abrocitinib führt zu einer reduzierten Phosphorylierung von STAT-Proteinen und unterbindet die Aktivierung des nachgeschalteten Signalwegs mit Beteiligung von JAK1. Als Folge wird bei Patienten mit atopischer Dermatitis eine Verbesserung der Erkrankungssymptome erreicht. JAK* steht für JAK1, JAK2, JAK3 oder TYK2.
Die Substanz hemmt genau wie Upadacitinib selektiv JAK1, während Baricitinib ein JAK1- und JAK2-Inhibitor ist. Direkt vergleichende Untersuchungen liegen nicht vor, sodass derzeit keinem der JAK-hemmenden Wirkstoffe ein Vorteil eingeräumt werden kann.
Diuretika
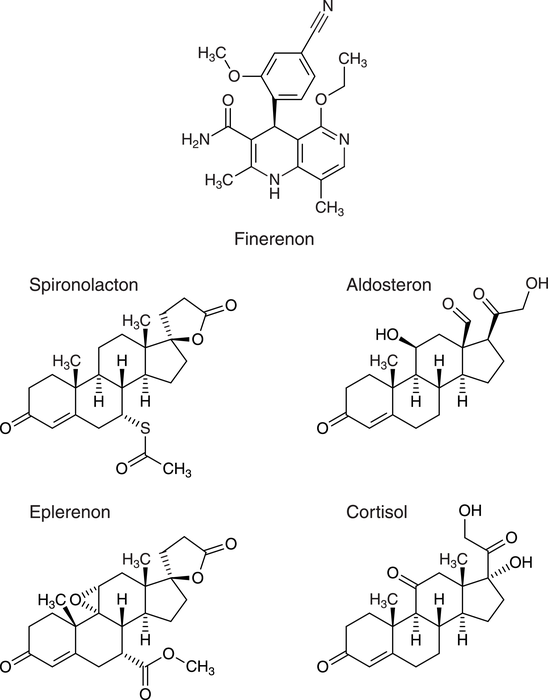
Finerenon
Erwachsene mit einer chronischen Nierenerkrankung im Stadium 3 bis 4 und Albuminurie aufgrund eines Diabetes mellitus Typ 2 können nun mit dem Mineralocorticoid-Rezeptor-Antagonisten Finerenon (Kerendia®) behandelt werden. Bei Patienten mit Diabetes mellitus entwickelt sich in vielen Fällen eine chronische Nierenerkrankung, die auf einer Überaktivierung von Mineralocorticoid-Rezeptoren zurückzuführen ist, die metabolische und hämodynamische Veränderungen, ein verstärktes Entzündungsgeschehen sowie die Entwicklung von Fibrosen zur Folge hat. Finerenon ist ein Mineralocorticoid-Rezeptor- bzw. Aldosteron-Antagonist, der anders als ältere Substanzen dieser Wirkstoffklasse wie Eplerenon oder Spironolacton keine Steroidstruktur aufweist. Er unterbindet die Rezeptoraktivierung durch die körpereigenen Liganden Aldosteron und Cortisol. Als Folge ist die Expression proinflammatorischer und profibrotischer Mediatoren vermindert. Der therapeutische Stellenwert von Finerenon ist derzeit noch nicht endgültig einzuschätzen.
Finerenon ist ein Mineralocorticoid-Rezeptor-Antagonist, der im Gegensatz zu den weiteren Substanzen aus dieser Wirkstoffgruppe Eplerenon und Spironolacton sowie den endogenen Rezeptorliganden Aldosteron und Cortisol keine Steroidstruktur aufweist.
Enzymersatztherapie
Avalglucosidase alfa
Patienten mit Morbus Pompe leiden unter einem genetisch bedingten Mangel an saurer α-Glucosidase. Für die langfristige Enzymersatztherapie steht nun Avalglucosidase alfa im Präparat Nexviadyme® zur Verfügung. Diese Form der sauren α-Glucosidase weist im Gegensatz zum genuinen Enzym etwa 15-mal so viele Mannose-6-Phosphat(M6P)-Reste auf und bindet daher besser an M6P-Rezeptoren auf der Zelloberfläche von Muskelzellen. Hierdurch werden das Eindringen des Enzyms in die Zelle und der nachfolgende Transport in die Lysosomen erleichtert, Folge ist eine Steigerung der proteolytischen Aktivität. Bei den Betroffenen verbessern sich kardiologische, respiratorische und motorische Funktionen. Avalglucosidase alfa stellt möglicherweise vor allem für die Patienten mit infantiler Erkrankung einen gewissen therapeutischen Fortschritt dar.
Immunsuppressiva
Anifrolumab
Der humane monoklonale Immunglobulin-G1-kappa-Antikörper Anifrolumab (Saphnelo®) ist als Therapeutikum für eine schwere systemische Lupus-Erkrankung vorgesehen, wenn Standardtherapeutika nicht ausreichen. Der Antikörper bindet hochspezifisch an die Untereinheit 1 des Typ-1-Interferonrezeptors (IFNAR1) und blockiert so den nachgeschalteten Signalweg. Dieser Effekt wird durch eine von Anifrolumab induzierte Internalisierung von IFNAR1 verstärkt, sodass weniger Interferon-Rezeptoren auf der Zelloberfläche zur Verfügung stehen. Insgesamt werden von körpereigenen Interferonen ausgelöste inflammatorische und immunologische Effekte unterbunden. Auch wenn mittlerweile viele Substanzen zur Therapie der chronisch-entzündlichen Autoimmunerkrankung Lupus erythematodes zur Verfügung stehen, ist es nicht möglich, alle Patienten zufriedenstellend zu therapieren. Für diesen Personenkreis stellt der neue Antikörper Anifrolumab als Add-on-Behandlungsoption einen gewissen Fortschritt dar. In klinischen Studien wurde im Vergleich zu Placebo in allen betroffenen Organen die Krankheitsaktivität verringert. Zudem konnten systemische Glucocorticoide eingespart und das Risiko von Organschäden verringert werden.
Avacopan
Erwachsene mit schwerer aktiver Granulomatose und (mikroskopischer) Polyangiitis können nun mit Avacopan (Tavneos®) behandelt werden. Der Komplement-5a-Rezeptor(C5aR)-Antagonist ist als Add-on-Therapeutikum in Kombination mit einem Rituximab- oder Cyclophosphamid-Dosierungsschema indiziert. Bei den meisten Patienten wird eine Besserung der Gefäßentzündung (Vaskulitis) erreicht. Avacopan ist ein selektiver Antagonist am Komplement-5a-Rezeptor C5aR. Er hemmt kompetitiv die Interaktion zwischen C5aR und seinem Liganden C5a und unterbindet somit dessen proinflammatorische Wirkungen im Rahmen des vaskulitischen Prozesses. Dieser innovative Wirkmechanismus stellt durchaus einen therapeutischen Fortschritt dar. Das kleine Molekül wirkt als selektiver Antagonist am C5a-Rezeptor und unterdrückt somit die Pathogenese von ANCA-assoziierten Vaskulitiden. Die antiphlogistische Wirkung erfolgt dabei selektiver als beim Einsatz von Glucocorticoiden.
Diroximelfumarat
Erwachsene mit schubförmig remittierender multipler Sklerose (MS) können nun mit Diroximelfumarat (Vumerity®) therapiert werden. Die entzündungshemmenden und immunmodulatorischen Wirkungen des peroral verfügbaren Fumarsäureesters beruhen auf dem pharmakologisch aktiven Metaboliten Monomethylfumarat. Die Schubtherapie der multiplen Sklerose erfolgt normalerweise mit Glucocorticoiden. Zur verlaufsmodulierenden Therapie werden Immunmodulatoren sowie Immunsuppressiva eingesetzt, bei Patienten ohne dauerhafte Erkrankungskontrolle zudem Sphingosin-1-Phosphat(S1P)-Rezeptor-Modulatoren sowie CD20-Antikörper. Im Hinblick auf diese sehr vielfältigen Behandlungsoptionen stellt der neue Wirkstoff allenfalls einen mäßiggradigen therapeutischen Fortschritt dar. Ein gewisser Vorteil für Diroximelfumarat besteht offenbar bezüglich der gastrointestinalen Verträglichkeit. Magenempfindliche Patienten könnten also von der neuen Medikation durchaus profitieren. Eine verbesserte Beeinflussung des Erkrankungsverlaufs und der weiteren Sicherheitsparameter ist dagegen nicht zu erwarten.
Efgartigimod alfa
Für Erwachsene mit generalisierter Myasthenia gravis steht mit dem Antikörperfragment Efgartigimod alfa (Vyvgart®) ein neues Add-on-Therapeutikum zu einer Standardtherapie zur Verfügung. Der Wirkstoff ist gegen den neonatalen Fc-Rezeptor auf IgG-Antikörpern gerichtet und kann bei Patienten mit körpereigenen Acetylcholin-Rezeptor-Antikörpern eingesetzt werden. Die Autoimmunerkrankung Myasthenia gravis ist mit einer gestörten neuromuskulären Signalübertragung assoziiert, die zu einer muskulären Schwäche führt, die alle Muskelgruppen betreffen kann. Für Patienten mit generalisierter Myasthenia gravis besteht weiterhin ein hoher Bedarf an effektiven und dabei akzeptabel verträglichen Medikationen. Der neue FcRn-Antikörper Efgartigimod alfa mit innovativem Wirkmechanismus stellt nach derzeitigem Kenntnisstand einen relevanten therapeutischen Fortschritt dar. In der Zulassungsstudie konnte eine signifikante Verbesserung der Symptomatik gezeigt werden. Anders als bei Eculizumab lag die Inzidenz von Nebenwirkungen meist auf Placebo-Niveau. Efgartigimod alfa wird derzeit bei weiteren, durch IgG vermittelten Autoimmunerkrankungen wie idiopathischer thrombozytopenischer Purpura und chronischer inflammatorischer demyelinisierender Polyneuropathie geprüft.
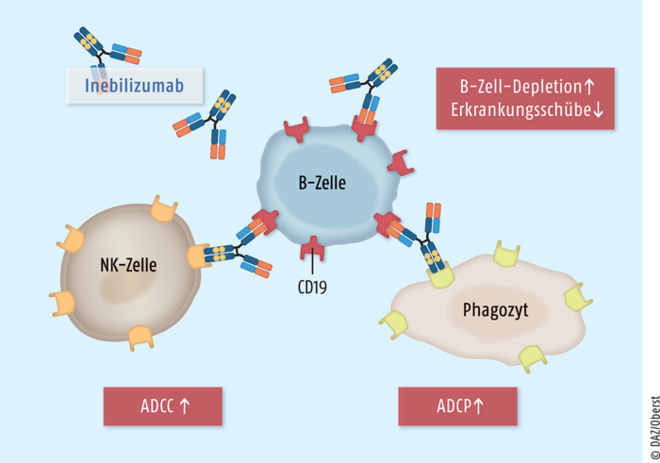
Inebilizumab
Inebilizumab (Uplizna®) ist als Monotherapeutikum zur Behandlung von Erwachsenen mit Neuromyelitis-optica-Spektrum-Erkrankungen indiziert. Der Antikörper richtet sich gegen das Oberflächenprotein CD19 auf B-Zellen und ist für Patienten vorgesehen, die Anti-Aquaporin-4-Immunglobulin-G-seropositiv sind. Bei der NMOSD-Pathogenese spielen offenbar B-Zellen eine zentrale Rolle. Der humanisierte monoklonale Antikörper Inebilizumab bindet hochspezifisch an das Oberflächenprotein CD19 auf Prä-B- und reifen B-Zell-Lymphozyten. Als Folge werden die Antikörper-abhängige zelluläre Zytolyse (antibody-dependent cellular cytolysis, ADCC) und die Antikörper-abhängige zelluläre Phagozytose (antibody-dependent cellular phagocytosis, ADCP) unterstützt, sodass eine B-Zell-Depletion resultiert. Der Wirkmechanismus von Inebilizumab ist noch nicht vollständig verstanden. Inwiefern der neue CD19-Antikörper einen therapeutischen Fortschritt bedeutet, ist derzeit unklar. Genau wie Eculizumab und Satralizumab konnte Inebilizumab in der zulassungsrelevanten Studie das Schub-Risiko hochsignifikant reduzierent. Direkt vergleichende Untersuchungen mit den anderen beiden Wirkstoffen wären wünschenswert. Vorteil von Inebilizumab ist, dass der Wirkstoff nur in sechsmonatigen Abständen appliziert werden muss.
Inebilizumab ist ein Antikörper, der gegen das CD19-Antigen auf B-Zellen gerichtet ist. Nach derzeitigem Kenntnisstand wird vor allem über eine verstärkte antikörperabhängige zelluläre Zytotoxizität (ADCC), in erster Linie über natürliche Killerzellen (NK-Zellen), sowie über eine antikörperabhängige zelluläre Phagozytose (ADCP) eine über Monate anhaltende B-Zell-Depletion erreicht. Bei Patienten mit Neuromyelitis-optica-Spektrum-Erkrankungen kann die Inzidenz von Erkrankungsschüben hochsignifikant reduziert werden.
Pegcetacoplan
Für Erwachsene mit paroxysmaler nächtlicher Hämoglobinurie (PNH) wurde Pegcetacoplan (Aspaveli®) eingeführt. Bei der sehr seltenen lebensbedrohlichen Erkrankung kommt es als Folge der assoziierten Hämolyse häufig im ganzen Körper zu schmerzhaften Thrombosen, die zu schweren Organschädigungen und zum Tod führen können. Das pegylierte Peptid ist gegen das Komplementprotein C3 gerichtet und für PNH-Patienten geeignet, die nach Behandlung mit einem C5-Inhibitor für mindestens drei Monate weiterhin anämisch sind. Durch die Therapie sind signifikant weniger Bluttransfusionen notwendig. Pegcetacoplan schützt nicht nur die intravasalen Erythrozyten in den Blutgefäßen, sondern auch die extravasalen in der Milz und der Leber vor Zerstörung. Bislang standen mit Eculizumab und Ravulizumab zwei C5-Inhibitoren zur Verfügung, die sich hinsichtlich der Applikationshäufigkeit unterscheiden. Während Eculizumab alle zwei Wochen infundiert wird, muss Ravulizumab aufgrund seiner längeren Halbwertszeit nur alle acht Wochen gegeben werden. Das neue Pegcetacoplan ist als relevanter therapeutischer Fortschritt anzusehen. Die Substanz ist für das Drittel von PNH-Patienten vorgesehen, das trotz Behandlung mit C5-Inhibitoren weiterhin anämisch ist. Der Wirkmechanismus mit zielgerichteter Hemmung des C3-Komplements ist innovativ. Die Kaskade des Komplementsystems wird durch Pegcetacoplan an früherer Stelle unterbrochen als durch Eculizumab und Ravulizumab, da C3 dem Komplementfaktor C5 vorgeschaltet ist. In einer direkt vergleichenden klinischen Studie hat sich der C3-Inhibitor dem C5-Hemmer Eculizumab als signifikant überlegen erwiesen. Ein gewisser Nachteil liegt in der Tatsache begründet, dass das pegylierte Protein das Risiko für schwere Infektionen erhöht.
Entgiftungsmittel für die Behandlung mit Zytostatika
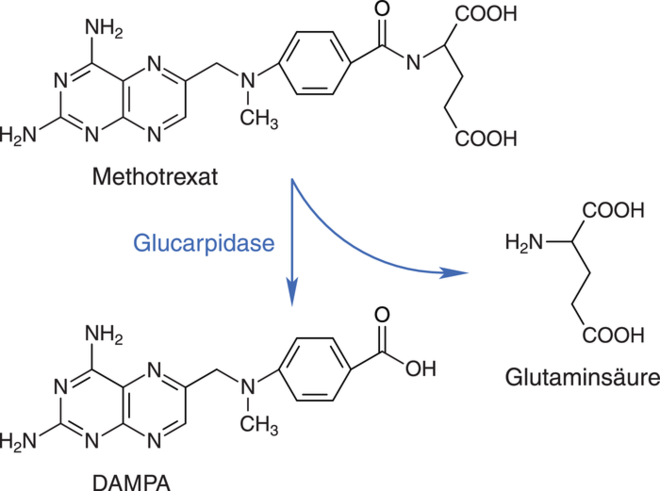
Glucarpidase
Erwachsene und Kinder im Alter ab 28 Tagen, die Methotrexat erhalten und ein erhöhtes Toxizitätsrisiko aufgrund einer verzögerten Ausscheidung dieses Zytostatikums haben, können mit dem Antidot Glucarpidase (Voraxaze®) behandelt werden. Aufgrund der Verringerung toxischer MTX-Plasmakonzentrationen ist es in vielen Fällen möglich, die potenziell lebensrettende Therapie weiterzuführen. Zur Unterdrückung der Methotrexat-assoziierten Nebenwirkungen erfolgt die Applikation des Folsäure-Antagonisten bei einer Hochdosistherapie normalerweise zusammen mit Folinsäure bzw. Calciumfolinat. Insbesondere bei Patienten mit Niereninsuffizienz besteht durch das in erster Linie renal eliminierte, selbst nephrotoxisch wirkende Methotrexat dennoch die Gefahr einer lebensbedrohlichen Toxizität. Für diese Personen ist das neue MTX-Antidot Glucarpidase ein großer therapeutischer Fortschritt. Die Carboxypeptidase Glucarpidase ist ein rekombinant hergestelltes bakterielles Enzym, das den carboxyterminalen Glutamat-Rest von Folsäure und strukturell verwandten Molekülen wie MTX hydrolysiert. Aus Methotrexat entsteht der inaktive Metabolit 2,4-Diamino-N10-methylpteroinsäure (DAMPA), der im weiteren Verlauf hepatisch biotransformiert wird. Auf diese Weise ist es für eine Reihe von Patienten möglich, die potenziell lebensrettende MTX-Therapie weiterzuführen bzw. abzuschließen. Durch eine zeitlich versetzte Anwendung von Glucarpidase kommt dennoch die erwünschte Wirkung von Methotrexat zum Tragen. Glucarpidase kann auch als Antidot verwendet werden, wenn aus anderen Gründen das Risiko einer Methotrexat-Toxizität besteht, beispielsweise nach Überdosierung.
Glucarpidase ist ein rekombinant hergestelltes, bakterielles Enzym, das als Carboxypeptidase eine Abspaltung des carboxyterminalen Glutamat-Rests von Methotrexat (MTX) bewirkt. Es entstehen die pharmakologisch inaktiven Metaboliten DAMPA (2,4-Diamino-N10-methylpteroinsäure) und Glutaminsäure. Anders als MTX werden diese Biotransformationsprodukte nicht renal, sondern über die Leber eliminiert. Hiervon profitieren Patienten mit Nierenfunktionsstörung unter einer MTX-Hochdosistherapie.
Hämatologika
Voxelotor
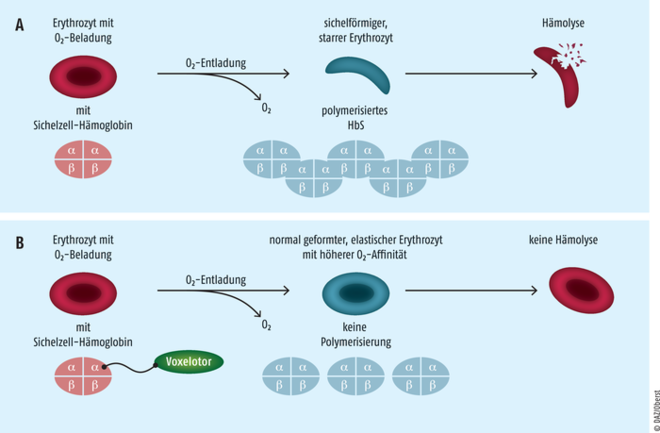
Für die Behandlung von hämolytischen Anämien infolge einer Sichelzellkrankheit steht nun der Hämoglobin-S(HbS)-Polymerisationshemmer Voxelotor (Oxbryta®) zur Verfügung. Der peroral applizierbare Wirkstoff kann als Monotherapeutikum oder in Kombination mit Hydroxycarbamid eingesetzt werden und ist derzeit für Erwachsene und Kinder ab zwölf Jahren erprobt. Voxelotor ist ein Polymerisationsinhibitor für das Hämoglobin S (HbS). Er dringt in Erythrozyten ein, bindet 1:1 an das Sichelzell-Hämoglobin-Molekül und führt zu einem dosisabhängigen Anstieg der Affinität von HbS zu Sauerstoff. Somit unterbleibt die Polymerisation, sodass die Sichelbildung der Erythrozyten und deren vorzeitiger Untergang verhindert werden kann. Aufgrund der erhaltenen Verformbarkeit der roten Blutzellen treten zudem seltener Vasookklusionen auf. In klinischen Studien wurden ein Anstieg der Hämoglobin-Spiegel sowie eine Reduktion von Hämolyse-Markern nachgewiesen. Die Wirkung des nun neu auf dem Markt eingeführten HbS-Polymerisationshemmers Voxelotor greift mit völlig innovativem Mechanismus an einer ganz anderen Stelle der Pathogenese ein. Bei den Patienten wird bei guter Verträglichkeit die Bildung der Sichelzellen verhindert und eine anhaltende Erhöhung des Hämoglobin-Werts erreicht. Während Crizanlizumab die Adhäsion der Erythrozyten unterbindet, bewirkt Voxelotor, dass eine geringere Anzahl der fehlgebildeten Blutzellen zirkuliert. Anders als Crizanlizumab ist Voxelotor peroral verfügbar, sodass die intravenöse Gabe umgangen werden kann.
Voxelotor Sobald die Erythrozyten von Patienten mit Sichelzellkrankheit nicht mehr mit Sauerstoff beladen sind, polymerisiert das Sichelzell-Hämoglobin (HbS). Die zuvor runden Erythrozyten verändern ihre Form zu starren Sicheln. Aufgrund der nun spröderen Hülle kommt es verstärkt zur Hämolyse (A). Voxelotor ist ein HbS-Polymerisationsinhibitor. Er dringt in Erythrozyten ein, bindet an die N-terminale α-Kette des Sichelzell-Hämoglobins und führt zu einem dosisabhängigen Anstieg der Affinität von HbS zu Sauerstoff. Als Folge unterbleibt die Polymerisation und damit die Sichelbildung der Erythrozyten. Die Verformbarkeit der roten Blutzellen bleibt bei reduzierter Hämolyse-Tendenz erhalten (B).
Kombinationsarzneimittel bei erektiler Dysfunktion
Aviptadil
Seit nahezu 25 Jahren gelten die oral verfügbaren Phosphodiesterase-5-Hemmer Avanafil, Sildenafil, Tadalafil und Vardenafil bei erektiler Dysfunktion als Mittel der Wahl. Der Stellenwert des nun neu verfügbaren Kombinationspräparats Invicorp® mit den sich ergänzenden Wirkstoffen Phentolamin und Aviptadil mit innovativem Wirkmechanismus ist derzeit schwer einzuschätzen. Die Applikation erfolgt durch eine nicht besonders komfortable intrakavernöse Injektion. Möglicherweise werden lediglich Männer diese Anwendungsform wählen, wenn die erprobten und diskret oral anwendbaren PDE-5-Hemmer nicht ausreichend wirksam oder kontraindiziert sind. So dürfen Avanafil, Sildenafil und Vardenafil beispielsweise nicht bei Personen mit schwerer Leberinsuffizienz eingesetzt werden. Die neue Zubereitung aus Aviptadil und Phentolamin hat sich in klinischen Studien gegenüber einer Placebo-Injektion als überlegen erwiesen, direkt vergleichende Untersuchungen mit PDE-5-Inhibitoren liegen jedoch nicht vor. Daher können die Anwender derzeit nur experimentell feststellen, ob das neue Präparat einen Vorteil bietet. Das Sicherheitsprofil der verfügbaren Therapieregime ist auf den ersten Blick ähnlich. Inwiefern Wirkungseintritt und Verträglichkeit durch die lokale intrakavernöse Applikation von Aviptadil und Phentolamin gegenüber den systemischen PDE-5-Inhibitoren verbessert ist, muss in Head-to-Head-Vergleichen untersucht werden.
Gentherapeutika
Eladocagene exuparvovec
Das körpereigene Enzym aromatische L-Aminosäure-Decarboxylase (AADC) katalysiert unter anderem die Umwandlung von Levodopa zu Dopamin. Patienten im Alter ab 18 Monaten mit genetisch bedingtem schwerem AADC-Mangel können nun das Gentherapeutikum Eladocagene exuparvovec (Upstaza®) erhalten, sodass die Enzymaktivität zumindest teilweise wiederhergestellt und eine Verbesserung der motorischen Fähigkeiten erreicht wird. Das neue Gentherapeutikum auf der Grundlage eines rekombinanten Adeno-assoziierten Virus vom Serotyp 2 (AAV2) enthält die humane cDNA für das DDC-Gen. Das Vektorgenom wird in menschlichen embryonalen Nierenzellen mittels rekombinanter DNA-Technologie hergestellt. Die Applikation erfolgt unmittelbar in das Putamen, den äußeren Linsenkern des Großhirns. Durch die Expression der aromatischen L-Aminosäure-Decarboxylase wird die Dopamin-Produktion initiiert und die Beeinträchtigung der motorischen Funktionen bei Patienten mit AADC-Mangel abgemildert. Die Behandlung eines AADC-Mangels beschränkte sich bisher auf die symptomorientierte Gabe von Dopamin-Agonisten und Monoaminoxidase-Inhibitoren sowie von Vitamin-B6-Präparaten. Die erzielbaren Erfolge sind jedoch sehr limitiert, sodass die Patienten dauerhaft pflegebedürftig sind und häufig bereits im Kindesalter versterben. Nun ist mit Eladocagene exuparvovec erstmals eine kausale Behandlungsoption verfügbar. Das Gentherapeutikum bewirkt, dass der Organismus die fehlende aromatische L-Aminosäure-Decarboxylase nun selbst biosynthetisieren kann. Die Substanz wird direkt in das Putamen im Großhirn injiziert. Eladocagene exuparvovec hat sich in klinischen Studien als gut wirksam erwiesen, sodass derzeit von einem relevanten therapeutischen Fortschritt auszugehen ist.
Eladocagene exuparvovec ist ein viraler Vektor, der ein gesundes Dopa-Decarboxylase(DDC)-Gen trägt. Mit ihm gelingt es, das Gen in die Zellen zu schleusen und bei Patienten mit erblich bedingtem Aromatische-L-Aminosäure-Decarboxylase-Mangel den Neurotransmitter-Biosyntheseschritt von L-Dopa zu Dopamin zu induzieren.
Valoctocogen Roxaparvovec
Bei Erwachsenen mit schwerer Hämophilie A (kongenitalem Faktor-VIII-Mangel) kann Valoctocogen Roxaparvovec (Roctavian®) eingesetzt werden. Die überwiegend männlichen Patienten mit Hämophilie A weisen verschiedene Mutationen im für den Gerinnungsfaktor VIII codierenden Gen auf. Aufgrund des resultierenden Mangels an funktionsfähigem Faktor VIII kommt es zu Einblutungen in Weichteile und Gelenke, die zu chronischen Schmerzen und eingeschränkter Mobilität führen. Der neu entwickelte genetische Vektor Valoctocogen Roxaparvovec stellt einen erheblichen therapeutischen Fortschritt dar. Das erste Gentherapeutikum zur Hämophilie-A-Therapie wird nur einmalig verabreicht und macht die herkömmliche Dauerbehandlung bei den meisten der teilweise noch sehr jungen Betroffenen überflüssig. Allerdings lässt die Wirkung des genetischen Vektors offenbar nach einiger Zeit nach. Möglicherweise könnte daher eine wiederholte Applikation von Valoctocogen Roxaparvovec erforderlich werden. Ein gewisses Problem stellt zudem die Substanz-assoziierte Hepatotoxizität dar.
Mittel zur Behandlung von Knochenerkrankungen
Vosoritid
Bei Patienten mit Achondroplasie ist das Knochenwachstum gestört, und es kommt zu disproportioniertem Kleinwuchs mit verkürzten Extremitäten. Das Analogon des C-natriuretischen Peptids Vosoritid (Voxzogo®) kann bei Betroffenen ab zwei Jahren mit noch nicht geschlossenen Epiphysen eingesetzt werden. Es kommt zu einer signifikanten Steigerung der Wachstumsgeschwindigkeit. Bei den meisten Patienten mit der häufigsten Form des genetisch bedingten Kleinwuchses liegt eine Neumutation des FGFR3-Gens vor, ohne Zusammenhang mit dem elterlichen Genom. In nahezu allen Fällen beruht die Achondroplasie auf einer G(1138)A-Punktmutation im FGFR-3-Gen, die eine Störung der Knorpelbildung sowie eine frühzeitige Verknöcherung der Epiphysenfugen bewirkt. Bislang beschränkte sich die Therapie auf physiotherapeutische und orthopädische Maßnahmen. Die Behandlung mit Wachstumshormonen hat nur eine begrenzte Auswirkung auf die Körpergröße. Der neue Wirkstoff Vosoritid stellt als erste kausale Behandlungsoption einen erheblichen therapeutischen Fortschritt dar. Die Wirkung beruht auf einer direkten Beeinflussung der erkrankungsauslösenden FGFR3-Reaktionskaskade. In klinischen Untersuchungen konnte bei Achondroplasie-Patienten eine signifikante Steigerung der Wachstumsgeschwindigkeit um etwa 50% gezeigt werden.
Allergen-Extrakte
Erdnussprotein
Das Erdnussprotein-haltige Präparat Palforzia® ist zur Hyposensibilisierung von Patienten mit Erdnussallergie vorgesehen. Die Zubereitung für Kindern und Jugendlichen im Alter von vier bis 17 Jahren bewirkt, dass zumindest in kleinen Mengen versehentlich eingenommene Erdnüsse nicht mehr zu einer lebensbedrohlichen Anaphylaxie führen. Palforzia® enthält Erdnussprotein von Arachis hypogaea L. Über eine langsame Steigerung der zugeführten Dosis kann eine Hyposensibilisierung erreicht werden, wobei die weitere Ernährung der Patienten in dieser Therapiephase strikt erdnussfrei erfolgen muss. Für den Fall, dass dennoch während der Therapie eine stärkere Anaphylaxie auftritt, darf Palforzia® nur zusammen mit einem Adrenalin-Pen verordnet werden. Palforzia® kann nach derzeitigem Kenntnisstand als relevanter therapeutischer Fortschritt angesehen werden. In klinischen Studien wurde gezeigt, dass nach etwa halbjährlicher Anwendung des oralen Immuntherapeutikums mehr als 50% der Behandelten etwa zwei bis drei Erdnüsse tolerieren. Das Therapieverfahren ist innovativ, da es sich um eine standardisierte orale Hyposensibilisierung nach Einnahme des Nahrungsmittelallergens handelt. Das mit der Zubereitung assoziierte Anaphylaxie-Risiko erscheint vertretbar, da die möglicherweise ausgelösten Reaktionen leichter vorhersehbar sind als solche durch versehentliche Erdnussexpositionen im Alltag eines Allergikers.
Hypophysen- und Hypothalamushormone
Relugolix
Für Frauen im gebärfähigen Alter mit mäßigen bis starken Beschwerden aufgrund von Uterusmyomen wurde Ryeqo® entwickelt. An der Pathogenese der gutartigen Neubildungen des Myometriums, die vorwiegend aus glatten Muskelzellen bestehen, sind insbesondere Estrogene und Progesteron beteiligt. Die Zubereitung enthält den Gonadotropin-Releasing-Hormon(GnRH)-Rezeptorantagonisten Relugolix in fixer Kombination mit Estrogen und Norethisteronacetat und bewirkt eine Linderung von schmerzhaften Monatsblutungen. Die Datenlage für die Behandlung von Uterusmyomen ist sehr begrenzt. Das neue Relugolix stellt nach derzeitigem Kenntnisstand einen moderaten therapeutischen Fortschritt dar. Der peroral verfügbaren GnRH-Rezeptorantagonist, dessen Nebenwirkungen wie vasomotorische Symptome, Verlust der Knochendichte und Endometriumshyperplasie durch die fixen Kombinationspartner Estrogen und Norethisteronacetat abgefangen werden sollen, hat sich als gut wirksam erwiesen. Bereits nach vier Wochen war der menstruelle Blutverlust signifikant verringert und nahm im Therapieverlauf weiter ab. Das Myomvolumen konnte allerdings nicht signifikant reduziert werden. Langzeituntersuchungen müssen weitere Informationen zum Sicherheitsprofil liefern.
Somatrogon
Der Wachstumsfaktor Somatrogon (Ngenla®) ist für die Behandlung von Kindern und Jugendlichen ab einem Alter von drei Jahren mit Wachstumsstörungen aufgrund einer unzureichenden Ausschüttung von Wachstumshormon zugelassen. Bei etwa einem von 4000 bis 10.000 Kindern besteht ein Mangel an somatotropem Hormon. Die Betroffenen sind proportioniert kleinwüchsig mit einem verzögerten Knochenalter. Seit vielen Jahren stehen Injektionszubereitungen mit rekombinant erzeugtem Somatropin zur kausalen Therapie zur Verfügung. Bei den Patienten wird damit die Bildung des Insulin-ähnlichen Wachstumsfaktors 1 (IGF-1) in der Leber stimuliert, der die Zellteilung in den Knorpelschichten der Wachstumsfugen fördert. Ein gewisser Nachteil einer Somatropin-Behandlung ist, dass die Kinder bis zum Schluss der Epiphysenfugen eine einmal tägliche Injektion benötigen. Insbesondere bei Spritzenangst stellt das neue Wachstumsfaktor-Präparat Somatrogon einen therapeutischen Fortschritt dar. Die Wirkweise ist prinzipiell identisch mit der von Somatropin. Aufgrund seiner Struktur ist jedoch eine einmal wöchentliche Anwendung ausreichend.
Monoklonale Antikörper
Amivantamab
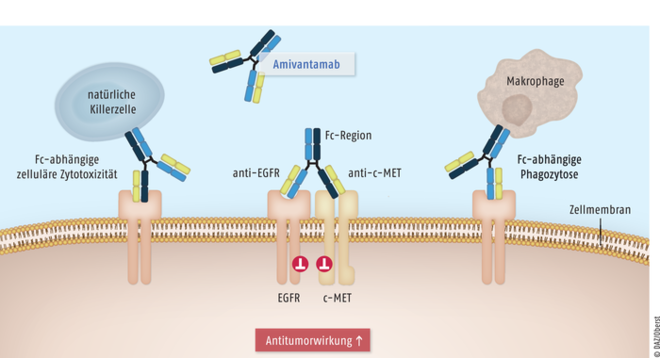
Amivantamab (Rybrevant®) ist als Monotherapeutikum zur Behandlung von Erwachsenen mit fortgeschrittenem nicht-kleinzelligem Lungenkarzinom (NSCLC) indiziert. Der Antikörper kommt für Patienten mit aktivierenden Exon-20-Insertionsmutationen des epidermalen Wachstumsfaktor-Rezeptors nach Versagen einer Platin-basierten Therapie infrage. Mutationen der Tyrosinkinasen epidermaler Wachstumsfaktor-Rezeptor (EGFR) und mesenchymal-epithelialer Transitionsfaktor (c-MET) führen zu einem verstärkten Tumorwachstum, da die nachgeschalteten Signalwege dauerhaft aktiviert sind. Bestimmte Formen des nicht-kleinzelligen Lungenkarzinoms (NSCLC) sind mit Exon-20-Insertionsmutationen von EGFR assoziiert. Amivantamab ist ein vollhumaner, auf Immunglobulin G1 basierender Antikörper. Er ist bispezifisch gegen die extrazellulären Komponenten von EGFR und c-MET gerichtet. Aufgrund der blockierten Ligandenbindung werden die zugehörigen Signalkaskaden herunterreguliert, und es kommt zu einer verstärkten Degradierung bzw. Internalisierung der beiden Rezeptor-Tyrosinkinasen, als Folge wird die Tumorproliferation reduziert. Mit dem Antikörper Amivantamab ist erstmals auch ein zielgerichteter Wirkstoff für Patienten mit Exon-20-Insertionsmutation verfügbar. Der Wirkmechanismus mit kombinierter Hemmung der EGFR- und c-MET-Signalwege und zusätzlicher zellulärer Zytotoxizität sowie Phagozytose durch natürliche Killerzellen und Makrophagen ist ebenfalls innovativ. Amivantamab ist zudem akzeptabel verträglich, sodass insgesamt durchaus von einem therapeutischen Fortschritt für die Gruppe von NSCLC-Patienten ausgegangen werden kann.
Amivantamab ist ein bispezifischer Antikörper, der bei NSCLC-Tumorzellen mit aktivierender Mutation die Ligandenbindung an die Tyrosinkinasen epidermaler Wachstumsfaktor-Rezeptor (EGFR) und mesenchymal-epithelialer Transitionsfaktor (c-MET) blockiert und damit die nachgeschalteten tumorfördernden Signalkaskaden. Zur Antitumorwirkung tragen eine verstärkte EGFR- und c-MET-Degradierung und eine Fc-Domänen-vermittelte zelluläre Zytotoxizität und Phagozytose durch natürliche Killerzellen und Makrophagen bei.
Behandlung von COVID-19-Patienten
Molnupiravir
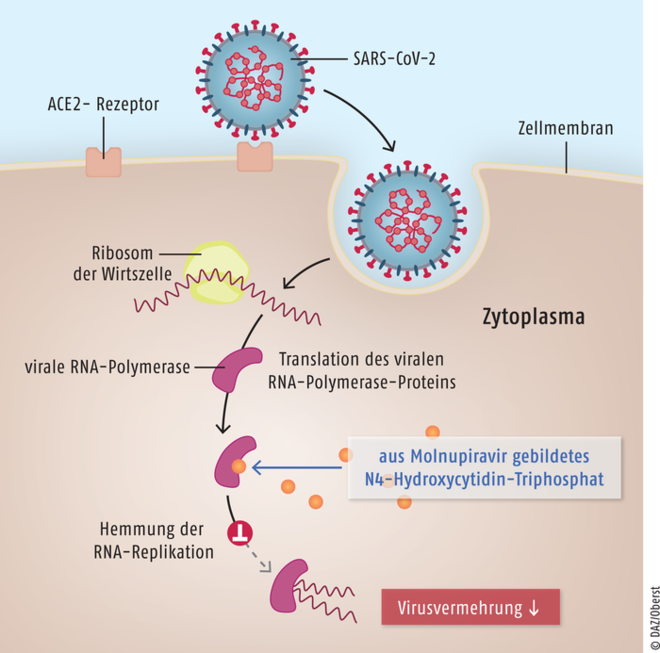
Der als Nukleosid-Analogon fungierende Wirkstoff Molnupiravir (Lagevrio®) ist für die Behandlung von erwachsenen COVID-19-Patienten vorgesehen, die keinen zusätzlichen Sauerstoff benötigen und ein erhöhtes Risiko für einen schweren Erkrankungsverlauf haben. Das Prodrug wird im Organismus zunächst in das Ribonukleosid-Analogon N4-Hydroxycytidin umgewandelt und dann in den Wirtszellen zum aktiven Ribonukleosid-Triphosphat phosphoryliert, das dann durch die virale RNA-Polymerase in die virale RNA eingebaut wird. Als Folge kommt es im viralen Genom zu vielen Kopierfehlern und damit zu einer Replikationshemmung. Das Prodrug sollte innerhalb von fünf Tagen nach Symptombeginn einer SARS-CoV-2-Infektion eingesetzt werden. Molnupiravir hat sich in mehreren Studien gegen Coronaviren wie SARS-CoV, MERS-CoV und SARS-CoV-2 als wirksam erwiesen. Allerdings besteht dabei die Gefahr, dass es durch Mutationen verstärkt zur Bildung neuer Virusvarianten kommt, die nicht mehr auf die derzeit verfügbaren Impfstoffe ansprechen. Durch Molnupiravir konnten in klinischen Studien die Hospitalisierungs- und/oder Sterberaten um 50% reduziert werden, im Vergleich zu 90% unter Nirmatrelvir. Auch hinsichtlich der Verträglichkeit ist dem spezifisch gegen SARS-CoV-2 gerichteten Nirmatrelvir ein Vorteil einzuräumen, da Molnupiravir mutagene und teratogene Effekte zeigt und möglicherweise das Knochen- und Knorpelwachstum beeinträchtigt. Offenbar führt Molnupiravir zu einer steigenden Mutationslast im viralen Genom. Nur bei Patienten, die CYP3A-Substrate als Begleittherapeutika erhalten, könnte Molnupiravir bevorzugt werden, da Nirmatrelvir derzeit stets zusammen mit der Boostersubstanz Ritonavir eingesetzt wird.
Das SARS-CoV-2-Virus dringt nach Andocken über den ACE2-Rezeptor in die Zelle ein. Das im menschlichen Organismus aus Molnupiravir entstehende pharmakologisch aktive N4-Hydroxycytidin-Triphosphat konkurriert im Rahmen der viralen RNA-Replikation mit den körpereigenen Nukleosiden und bildet nicht nur mit Guanosin, sondern auch mit Adenosin Basenpaare. Es resultiert eine große Zahl an Ablesefehlern, wodurch die Replikation viraler RNA unterbunden und die Virusvermehrung inhibiert wird.
Nirmatrelvir
Erwachsene mit erhöhtem Risiko, einen schweren COVID-19-Verlauf zu entwickeln, können mit dem SARS-CoV-2-Hauptprotease-Inhibitor Nirmatrelvir (Paxlovid®) behandelt werden. Der Wirkstoff ist für Personen mit Vorliegen eines positiven Antigen-Schnell- oder PCR-Tests indiziert, die keine zusätzliche Sauerstoffzufuhr benötigen. Die virale Hauptprotease (Main Protease, Mpro) des SARS-CoV-2-Virus ist an der Bildung des Replikationskomplexes beteiligt und damit ein Schlüsselenzym bei der Virusvermehrung. Nirmatrelvir ist ein Peptid-ähnlicher Inhibitor der SARS-CoV-2-Hauptprotease. Die Wirkung beruht auf einer kovalenten Bindung der Nitril-Gruppe von Nirmatrelvir an die Thiolgruppe eines Cysteins im aktiven Zentrum der Hauptprotease SARS-CoV-2-Mpro, sodass die Virusreplikation verhindert wird. Nirmatrelvir wird zusammen mit dem CYP3A-Inhibitor Ritonavir als Boostersubstanz verabreicht. Durch die Hemmung des für Nirmatrelvir maßgeblichen Biotransformationsenzyms CYP3A4 können höhere Plasmakonzentrationen erreicht werden. Der Hauptprotease-Inhibitor Nirmatrelvir kann als bedeutsamer klinischer Fortschritt eingeordnet werden. Es ist die erste zugelassene Substanz mit einem spezifisch gegen SARS-CoV-2 gerichteten Wirkmechanismus. In der zulassungsrelevanten Studie an Patienten mit erhöhtem Risiko für einen schweren Erkrankungsverlauf waren die Hospitalisierungs- und Sterberaten durch Nirmatrelvir gegenüber Placebo um nahezu 90% reduziert. Problematisch erscheint die zusammen mit Nirmatrelvir angewendete Boostersubstanz Ritonavir. Durch ihr erhebliches Interaktionspotenzial ist das Therapieregime bei vielen Begleittherapien kontraindiziert und darf auch dann nicht gegeben werden, wenn ein solcher Wirkstoff gerade erst abgesetzt wurde.
Tixagevimab plus Cilgavimab
Zur Präexpositionsprophylaxe einer SARS-CoV-2-Infektion wurde das Antikörperpräparat Evusheld® eingeführt. Die beiden enthaltenen Antikörper Tixagevimab und Cilgavimab werden bei Erwachsenen und Jugendlichen ab zwölf Jahren eingesetzt, bei denen aufgrund von Komorbiditäten oder Allergien kein adäquater COVID-19-Impfschutz erreicht werden kann. Für Personen, die nicht geimpft werden können, stellt das kombinierte Antikörperpräparat Evusheld® zumindest auf den ersten Blick einen entscheidenden Fortschritt dar. Die beiden rekombinanten humanen monoklonalen IgG1-κ-Antikörper Tixagevimab und Cilgavimab sind gegen zwei nicht überlappende Regionen der Spike-Protein-Rezeptor-Bindungsdomäne des SARS-CoV-2-Virus gerichtet. Durch die Bindung wird das Andocken des Virus an den ACE2-Rezeptor und damit das Eindringen in die Zellen verhindert, die Virusreplikation kann unmittelbar unterbunden werden. In der placebokontrollierten Zulassungsstudie an Risikopatienten wurde eine 77%ige Reduktion des Erkrankungsrisikos erreicht. In-vitro-Versuche deuten auf eine eingeschränkte Wirksamkeit gegen die Omikron-Varianten BA.1 und BA.1.1 hin. Zu den aktuell vorherrschenden Virustypen Omikron BA.4 und BA.5 liegen noch keine präklinischen und klinischen Daten vor. Im Notfall muss der Nutzen von Evusheld® derzeit empirisch geprüft werden. |
Informationen zu neuen Wirkstoffen
In der bisher monatlich erschienenen Beilage „Neue Arzneimittel“ stellte Apothekerin Monika Neubeck neue Wirkstoffe ausführlich vor und ordnete sie in die bestehenden Therapieoptionen ein. Ein Archiv mit den seit 2000 eingeführten Wirkstoffen finden Sie auf DAZ.online unter www.deutsche-apotheker-zeitung.de im Bereich „Pharmazie“.
Ab Januar 2023 werden die Neuen Arzneimittel nur noch Online auf www.deutsche-apotheker-zeitung.de vorgestellt.
Substanz | Handelsname | Gruppe | Hersteller/Vertrieb | Einführungsdatum | NA Nr.-Jahr |
|---|---|---|---|---|---|
Abrocitinib | Cibinqo® | andere Dermatika, Mittel zur Behandlung der atopischen Dermatitis, exkl. Corticosteroide | Pfizer Pharma GmbH | 15. Januar 2022 | 3-2022 |
Amivantamab | Rybrevant® | monoklonale Antikörper und Antikörper-Wirkstoff-Konjugat | Janssen-Cilag GmbH | 15. Januar 2022 | 4-2022 |
Anifrolumab | Saphnelo® | Immunsuppressiva, selektive Immunsuppressiva | AstraZeneca GmbH | 1. April 2022 | 6-2022 |
Asciminib | Scemblix® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Novartis Pharma GmbH | 1. Oktober 2022 | 12-2022 |
Avacopan | Tavneos® | noch nicht zugewiesen | Fresenius Medical Care Nephrologica GmbH | 15. Februar 2022 | 4-2022 |
Avalglucosidase alfa | Nexviadyme® | andere Mittel für das alimentäre System und den Stoffwechsel, Enzyme | Sanofi-Aventis Deutschland GmbH | 1. August 2022 | 10-2022 |
Aviptadil | Invicorp® | Kombinationsarzneimittel bei erektiler Dysfunktion | Evolan Pharma, Danderyd (S) | 15. März 2022 | 6-2022 |
Capmatinib | Tabrecta® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Novartis Pharma GmbH | 15. August 2022 | 10-2022 |
Chondrozyten-Sphäroide | Spherox® | andere Medikamente gegen Störungen des Muskel-Skelett-Systems | Codon AG | 1. Juli 2022 | 9-2022 |
Cilgavimab | Evusheld® (mit Tixagevimab) | Immunsera und Immunglobuline, antivirale monoklonale Antikörper | AstraZeneca AB (S) | 15. Juni 2022 | 8-2022 |
Desvenlafaxin | Desveneurax® | andere Antidepressiva | Neuraxpharm Arzneimittel GmbH | 1. August 2022 | 10-2022 |
Diroximelfumarat | Vumerity® | Immunsuppressiva, andere Immunsuppressiva | Biogen GmbH | 1. Januar 2022 | 3-2022 |
Duvelisib | Copiktra® | antineoplastische Mittel, Phosphatidylinositol-3-Kinase(PI3K)Inhibitoren | Secura Bio Limited (IRL) | 1. Februar 2022 | 4-2022 |
Efgartigimod alfa | Vyvgart® | Immunsuppressiva, selektive Immunsuppressiva | Argenx BV (B) | 1. September 2022 | 11-2022 |
Eladocagene exuparvovec | Upstaza® | noch nicht mitgeteilt | PTC Therapeutics International Limited (IRL) | 15. August 2022 | 10-2022 |
Enfortumab Vedotin | Padcev® | antineoplastische Mittel, monoklonale Antikörper | Astellas Pharma GmbH | 1. Juni 2022 | 8-2022 |
Eptinezumab | Vyepti® | Analgetika, Calcitonin-Gene-related-Peptide(CGRP)-Antagonist | Lundbeck GmbH | 1. September 2022 | 11-2022 |
Eravacyclin | Xerava® | Antibiotika zur systemischen Anwendung, Tetracycline | Paion Deutschland GmbH | 1. August 2022 | 9-2022 |
Erdnussprotein | Palforzia® | Allergen-Extrakte, Nahrungsmittel | Aimmune Therapeutics Ireland Ltd. (IRL) | 15. Oktober 2021 | 1-2022 |
Finerenon | Kerendia® | Diuretika, Aldosteron-Antagonisten | Bayer Vital GmbH GB Pharma | 1. Oktober 2022 | 12-2022 |
Glucarpidase | Voraxaze® | Entgiftungsmittel für die Behandlung mit Zytostatika | Serb SAS (F) | 15. April 2022 | 7-2022 |
Idecabtagen Vicleucel | Abecma® | sonstige antineoplastische Mittel | Bristol-Myers Squibb GmbH | 1. Januar 2022 | 3-2022 |
Inebilizumab | Uplizna® | Immunsuppressiva, selektive Immunsuppressiva | Horizon Therapeutics Ireland DAC (IRL) | 1. August 2022 | 9-2022 |
Lisocabtagen maraleucel | Breyanzi® | andere antineoplastische Mittel | Bristol-Myers Squibb Pharma EEIG (IRL) | 1. September 2022 | 11-2022 |
Lusutrombopag | Mulpleo® | Antihämorrhagika, andere systemische Hämostatika | Shionogi B.V. (NL) | 1. Dezember 2021 | 1-2022 |
Macimorelin | Ghryvelin® | Diagnostika, Tests für die Hypophysenfunktion | Consilient Health Limited (IRL) | 15. Juni 2022 | 8-2022 |
Molnupiravir | Lagevrio® | Behandlung von COVID-19 bei Erwachsenen, die keinen zusätzlichen Sauerstoff benötigen und ein erhöhtes Risiko haben, einen schweren COVID-19-Verlauf zu entwickeln | MSD Sharp & Dohme GmbH | 3. Januar 2022 | 5-2022 |
Mosunetuzumab | Lunsumio® | antineoplastische Substanzen, andere antineoplastische Substanzen, monoklonale Antikörper | Roche Pharma AG | 1. Juli 2022 | 9-2022 |
Nirmatrelvir | Paxlovid® | noch nicht zugeteilt | Pfizer Pharma GmbH | 25. Februar 2022 | 5-2022 |
Pegcetacoplan | Aspaveli® | Immunsuppressiva, selektive Immunsuppressiva | Swedish Orphan Biovitrum GmbH (S) | 1. April 2022 | 6-2022 |
Pneumokokken-Impfstoff | Apexxnar® | Impfstoffe, Pneumokokken-Impfstoffe | Pfizer Pharma GmbH | 15. April 2022 | 7-2022 |
Pralsetinib | Gavreto® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Roche Pharma AG, Grenzach-Wyhlen | 15. Dezember 2021 | 2-2022 |
Relugolix | Ryeqo® | Hypophysen- und Hypothalamushormone und Analoga, Gonadotropin-Releasing-Hormonantagonisten | Gedeon Richter Pharma GmbH | 1. September 2021 | 1-2022 |
Ripretinib | Qinlock® | antineoplastische Mittel, andere Proteinkinase-Inhibitoren | Diciphera Pharmaceuticals B.V. (NL) | 1. Januar 2022 | 3-2022 |
Sacituzumab Govitecan | Trodelvy® | antineoplastische Mittel, monoklonale Antikörper und Antikörper-Wirkstoff-Konjugate, andere monoklonale Antikörper | Gilead Sciences GmbH | 15. Dezember 2021 | 2-2022 |
Selinexor | Nexpovio® | antineoplastische Mittel, andere antineoplastische Mittel | Stemline Therapeutics B.V. (NL) | 1. Oktober 2022 | 12-2022 |
Setmelanotid | Imcivree® | Antiadiposita, exkl. Diätetika | Rhythm Pharmaceuticals Netherlands B.V. (NL) | 1. Juni 2022 | 8-2022 |
Somatrogon | Ngenla® | Hypophysen- und Hypothalamushormone und Analoga, Somatropin und Somatropin-Agonisten | Pfizer Pharma GmbH | 1. April 2022 | 6-2022 |
Sotorasib | Lumykras® | antineoplastische Mittel | Amgen GmbH | 15. Februar 2022 | 4-2022 |
Tebentafusp | Kimmtrak® | antineoplastische Mittel, andere antineoplastische Mittel | Immunocore Ireland Limited (IRL) | 1. Mai 2022 | 7-2022 |
Tepotinib | Tepmetko® | antineoplastische Mittel, andere Proteinkinase-Inhibitoren | Merck Health Care GmbH | 15. März 2022 | 5-2022 |
Tixagevimab | Evusheld® (mit Cilgavimab) | Immunsera und Immunglobuline, antivirale monoklonale Antikörper | AstraZeneca AB (S) | 15. Juni 2022 | 8-2022 |
Trastuzumab-Deruxtecan | Enhertu® | antineoplastische Mittel, Humane-epidermaler-Wachstumsfaktor-Rezeptor-2(HER2)-Inhibitoren | Daiichi Sankyo | 1. Februar 2022 | 4-2022 |
Valoctocogen Roxaparvovec | Roctavian® | noch nicht zugewiesen | Biomarin International Ltd. (IRL) | 15. September 2022 | 11-2022 |
Vosoritid | Voxzogo® | Mittel zur Behandlung von Knochenerkrankungen, andere Mittel mit Einfluss auf die Knochenstruktur und Mineralisierung | Biomarin International Ltd. (IRL) | 1. Oktober 2021 | 1-2022 |
Voxelotor | Oxbryta® | andere Hämatologika | Global Blood Therapeutics Netherlands B.V. (NL) | 15. Mai 2022 | 7-2022 |
Zanubrutinib | Brukinsa® | antineoplastische Mittel, Bruton-Tyrosinkinase(BTK)-Inhibitoren | Beigene Germany GmbH | 15. Dezember 2021 | 2-2022 |
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.