
- DAZ.online
- DAZ / AZ
- DAZ 43/2022
- Gentherapeutikum für ...
Arzneimittel und Therapie
Gentherapeutikum für schwere Hämophilie A zugelassen
Valoctocogen Roxaparvovec könnte lebenslange Dauertherapie ersparen
Die überwiegend männlichen Patienten mit Hämophilie A weisen verschiedene Mutationen im für den Gerinnungsfaktor VIII codierenden Gen auf. Aufgrund des resultierenden Mangels an funktionsfähigem Faktor VIII kommt es zu Einblutungen in Weichteile und Gelenke, die zu chronischen Schmerzen und eingeschränkter Mobilität führen. Etwa eines von 5000 männlichen Neugeborenen ist betroffen. Insbesondere bei Unfällen oder im Rahmen von Operationen besteht trotz regelmäßiger Substitution mit rekombinanten Gerinnungsfaktoren die Gefahr lebensbedrohlicher Durchbruchblutungen.
Leberselektive Genfähre
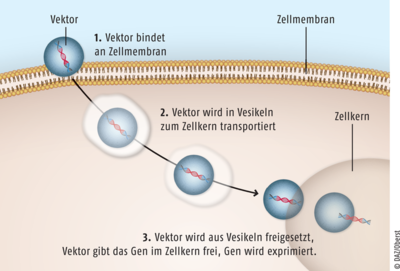
Zur Entlastung der teilweise noch sehr jungen Patienten hat man bereits seit Jahren versucht, eine kausale Gentherapie zu entwickeln. Dies ist nun mit dem rekombinanten genetischen Vektor Valoctocogen Roxaparvovec auf Basis eines Adeno-assoziierten Virus des Serotyps 5 (AAV5) gelungen. Die Genfähre enthält die cDNA, die für eine B-Domänen-deletierte SQ-Form des humanen Gerinnungsfaktors VIII (hFVIII-SQ) codiert. Das Gen wird von einem spezifischen Promotor gesteuert, sodass der modifizierte Faktor VIII ausschließlich in der Leber synthetisiert wird. Nach Applikation von Valoctocogen Roxaparvovec kommt es zur Ausbildung von vollständigen Transgenen, überwiegend in Form von stabilen, nicht in die DNA integrierten Plasmiden. In den ersten fünf bis sechs Monaten wird ein rascher Anstieg der Faktor-VIII-Aktivität beobachtet, gefolgt von einem zunächst schnellen und anschließend allmählicherem Rückgang. Die wiederholte Anwendung des genetischen Vektors wurde bislang nicht untersucht. Bei etwa 20% der Hämophilie-A-Patienten liegen neutralisierende Antikörper gegen das als Genfähre fungierende Adeno-assoziierte Virus 5 vor, sodass die Gefahr einer eingeschränkten Wirkung besteht. Auch sollten Personen mit Faktor-VIII-Inhibitoren in der Vorgeschichte, akuten oder unkontrollierten, chronischen aktiven Infektionen sowie mit signifikanter Leberfibrose oder -zirrhose den genetischen Vektor nicht erhalten.
Valoctocogen Roxaparvovec ist ein viraler Vektor, der ein gesundes Gen für die B-Domänen-deletierte SQ-Form des humanen Gerinnungsfaktors VIII trägt. Mit ihm gelingt es, das Gen in die Zellen zu schleusen und bei Patienten mit erblich bedingter Hämophilie A den Biosyntheseschritt des funktionalen modifizierten Gerinnungsfaktors VIII zu induzieren.
Leberfunktion überwachen!
Valoctocogen Roxaparvovec wird einmalig in einer Dosierung von 6 × 1013 Vektorgenomen pro Kilogramm Körpergewicht langsam intravenös verabreicht. Beim Auftreten von infusionsbedingten Reaktionen ist eine Verlangsamung der Applikationsrate oder eine zeitweise Unterbrechung der Infusion angeraten. Nach dem Einsatz von Valoctocogen Roxaparvovec muss weiterhin mit einer Erhöhung von Leberenzym-Werten gerechnet werden. Engmaschige Kontrollen der Leberfunktion und der Faktor-VIII-Aktivität sind daher unbedingt erforderlich, da nicht bekannt ist, inwieweit eine verringerte Anzahl transduzierbarer Leberzellen die Wirksamkeit von Valoctocogen Roxaparvovec beeinträchtigt. Auch bei Patienten mit vorgeschädigter Leber oder kombiniert eingesetzten hepatotoxisch wirkenden Substanzen wie Isotretinoin, Efavirenz oder Alkohol ist Vorsicht geboten. Falls erhöhte Alanin-Aminotransferase(ALT)-Werte auftreten, muss eine immunsuppressive Behandlung in Betracht gezogen werden, um entzündliche hepatische Reaktionen zu kontrollieren und eine potenzielle Abnahme der Transgen-Expression zu verhindern.
Thrombosegefahr
Die erwünschte Zunahme der Faktor-VIII-Aktivität kann mit einem erhöhten Risiko für venöse und arterielle thrombotische Ereignisse assoziiert sein. Aufgrund derzeit fehlender Erfahrungen muss nach einer Behandlung mit Valoctocogen Roxaparvovec die Spende von Blut, Organen, Geweben und von Zellen für die Transplantation unterbleiben. Zum Einsatz des genetischen Vektors bei Patienten mit aktiven Infektionen oder abwehrgeschwächten Personen liegen keine Daten zur Sicherheit und Wirksamkeit vor. Auch wurden Personen mit Faktor-VIII-Inhibitoren bislang von der Teilnahme an klinischen Studien ausgeschlossen. Falls insbesondere kurz nach erfolgter Valoctocogen-Roxaparvovec-Therapie invasive Verfahren oder operative Eingriffe durchgeführt werden müssen oder Traumata bzw. Blutungen auftreten, sollten erforderlichenfalls Faktor-VIII-Konzentrate oder Hämostatika angewendet werden.
Risiko durch Vektorintegration?
Die cDNA des hFVIII-SQ-Gens wird sowohl in die DNA der Leber als auch in die Erbsubstanz anderer Körperzellen integriert. Obwohl die klinische Relevanz bisher nicht bekannt ist, könnten diese Integrationsereignisse zu einem erhöhten Malignitätsrisiko beitragen. Auch schwangeren Frauen wird wegen bislang fehlender präklinischer und klinischer Daten von einer Anwendung des genetischen Vektors Valoctocogen Roxaparvovec abgeraten, da durch eine mögliche vertikale Übertragung ein theoretisches Risiko einer viralen Vektorintegration in fetale Zellen besteht. Allerdings sind Frauen nur sehr selten von einer Hämophilie A betroffen. Da transgene DNA nach Verabreichung des genetischen Vektors an Männer vorübergehend im Sperma nachgewiesen wurde, müssen behandelte, zeugungsfähige Patienten und ihre Partnerinnen im gebärfähigen Alter über einen Zeitraum von sechs Monaten nach Applikation mithilfe einer Doppelbarrieremethode eine Schwangerschaft verhüten. Zudem dürfen diese Männer keinen Samen spenden.
Studiendaten
Der Nutzen von Valoctocogen Roxaparvovec wurde in einer offenen, einarmigen Phase-III-Studie an 134 männlichen Erwachsenen mit schwerer Hämophilie A geprüft. Nach einmaliger Applikation des genetischen Vektors wurde innerhalb eines Jahres eine Steigerung der Faktor-VIII-Aktivität von ursprünglich weniger als 1 IE/dl auf durchschnittlich mehr als 40 IE/dl festgestellt (p < 0,001). Die Anzahl der jährlichen Blutungsepisoden reduzierte sich um mehr als 80%. Nur in Ausnahmefällen war eine zusätzliche Faktor-VIII-Substitutionstherapie erforderlich. Etwa zwei Jahre nach der Behandlung wurde bei 75,4% der Patienten noch immer eine durchschnittliche Faktor-VIII-Aktivität von mindestens 5 IE/dl gemessen, entsprechend einer leichten Hämophilie.
Fazit
Der neu entwickelte genetische Vektor Valoctocogen Roxaparvovec stellt – zumindest nach derzeitigem Kenntnisstand – einen erheblichen therapeutischen Fortschritt dar. Er macht bei den meisten Betroffenen die herkömmliche Dauerbehandlung überflüssig. Allerdings lässt die Wirkung der Genfähre offenbar nach einiger Zeit nach. Möglicherweise könnte daher eine wiederholte Applikation von Valoctocogen Roxaparvovec erforderlich werden. In weiteren Studien sollte ein möglicher Einsatz bei Kindern geprüft werden, einer Patientengruppe, die besonders unter der klassischen intravenösen Substitutionstherapie leidet. Zudem wäre zu untersuchen, in welchem Ausmaß mit einer Integration der Vektor-DNA in die Wirts-DNA gerechnet werden muss und ob dies mit der Gefahr einer onkogenen Transformation assoziiert ist. Entsprechende Erkenntnisse wären auch für die Sicherheit anderer Genfähren von großer Relevanz. |
Literatur
[1] Fachinformation zu Roctavian®, Stand September 2022
[2] Ozelo MC, Mahlangu J, Pasi KJ, Giermasz A et al. Valoctocogene roxaparvovec gene therapy for hemophilia A. N Engl J Med 2022;386:1013-1025
[3] Roctavian: EPAR – Medicine Overview. Ein Übersichtsartikel der Europäischen Arzneimittel-Agentur, EMA/654780/2022, 6. September 2022





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.