
- DAZ.online
- DAZ / AZ
- DAZ 40/2022
- Mit Tirzepatid gegen Typ-...
Arzneimittel und Therapie
Mit Tirzepatid gegen Typ-2-Diabetes
GIP-/GLP-1-Rezeptoragonist wird bald auch in der EU zur Verfügung stehen
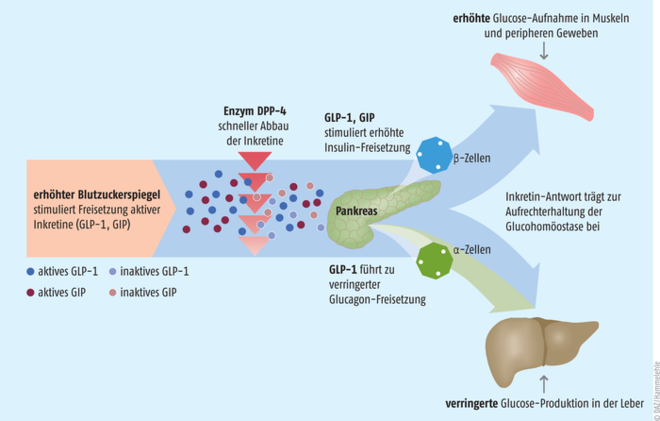
Für die Behandlung von Erwachsenen mit unzureichend eingestelltem Typ-2-Diabetes wurde mit Tirzepatid eine neue subkutane Therapieoption in der EU zugelassen. Das Präparat mit dem Handelsnamen Mounjaro® soll ergänzend zu Diät und Bewegung eingesetzt werden – entweder in Monotherapie, falls Metformin nicht vertragen wird oder kontraindiziert ist, oder als Kombinationspartner zusätzlich zu anderen Antidiabetika. Tirzepatid ist ein GIP-(glucoseabhängiges insulinotropes Peptid-) und GLP-1-(Glucagon-like-Peptide-1-)Rezeptor-Agonist und damit ein Vertreter einer neuen Substanzklasse. Durch das duale Wirkprinzip sollen Blutzuckerspiegel und Körpergewicht effektiver gesenkt werden (s. Abb).
Abb.: Die Inkretine GIP (Glucose-abhängiges insulinotropes Peptid) und GLP-1 (Glucagon-like peptide) sind entscheidend an der Glucohomöostase beteiligt. Ein erhöhter Blutzuckerspiegel induziert ihre Freisetzung. GLP-1-Rezeptoragonisten (Liraglutid, Lixisenatid, Dulaglutid, Exenatid und Semiglutid) und DPP-4-Hemmer (Linagliptin, Sitagliptin, Saxagliptin und Vildagliptin) sind wirksame Antidiabetika. Der neue duale GIP/GLP-1-Rezeptoragonist Tirzepatid erweitert das therapeutische Spektrum.
Die SURPASS-Studien
Tirzepatid wurde in den fünf zulassungsrelevanten klinischen Studien SURPASS-1 bis -5 getestet, und zwar in Monotherapie und in Kombinationen, unter anderem mit Metformin, SGLT-2-Inhibitoren, Sulfonylharnstoffen oder Insulin glargin, sowohl gegen Placebo als auch gegen Semaglutid, Insulin degludec und Insulin glargin. Dabei wurde Tirzepatid jeweils einmal wöchentlich in den Dosierungen 5 mg, 10 mg oder 15 mg subkutan verabreicht. In allen Studien konnte eine statistisch signifikante Reduktion des HbA1c-Werts und des Körpergewichts gezeigt werden. Die durchschnittliche Senkung des HbA1c lag bei der 5-mg-Dosierung zwischen 1,87 und 2,24 Prozent, bei 10 mg zwischen 1,89 und 2,59 Prozent sowie bei 15 mg zwischen 2,07 und 2,59 Prozent.
Bei 23 bis 69 Prozent der Studienteilnehmer konnte innerhalb von 40 Wochen ein Gewichtsverlust von mindestens 10 Prozent registriert werden. Bei letzteren Daten handelt es sich um geschätzte Mittelwerte aus einer modifizierten Intention-to-treat-Population.
Nebenwirkungen meist gastrointestinal
Das Verträglichkeitsprofil des neuen GIP-/GLP-1-Rezeptor-Agonisten soll dem der GLP-1-Rezeptor-Agonisten ähneln. Als häufigste Nebenwirkungen werden Übelkeit, Erbrechen und Durchfall angegeben, welche meist leicht bis moderat ausgeprägt waren. Sie kamen häufiger bei Dosissteigerungen vor und reduzierten sich im Verlauf der Behandlung.
Für die Zulassung in den USA und der EU wurde eine Metaanalyse zur kardiovaskulären Sicherheit gefordert. Dabei war für Tirzepatid kein erhöhtes Risiko für die vier schwerwiegenden unerwünschten kardiovaskulären Ereignisse (MACE-4) kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall und stationär zu behandelnde instabile Angina pectoris erkennbar. Die Hazard Ratio lag hierfür bei 0,80 (95%-Konfidenzintervall [KI] = 0,57 – 1,11).
Die Anwendung
Zu Therapiebeginn werden einmal wöchentlich 2,5 mg Tirzepatid für vier Wochen subkutan mit einem Fertigpen injiziert. Nach vier Wochen sollte die Dosis auf einmal wöchentlich 5 mg gesteigert werden. Weitere Dosisanpassungen können nach Bedarf in 2,5-mg-Schritten nach jeweils vierwöchiger Anwendung erfolgen. Die vom Hersteller empfohlene Erhaltungsdosis liegt bei einmal wöchentlich 5 mg, 10 mg oder 15 mg. |
Literatur
[1] Tirzepatid erhält EU-Zulassung zur Therapie von Erwachsenen mit Typ-2-Diabetes. Pressemitteilung der Lilly Diabetes GmBH vom 23. September 2022
[2] Europäische Kommission, 2022. Verfügbar unter: https://ec.europa.eu/health/documents/community-register/html/h1685.htm (Stand: 23.09.2022)
[3] Rosenstock J et al. Efficacy and Safety of Once Weekly Dual GIP/GLP-1 Receptor agonist Tirzepatide Versus Placebo in People with Type 2 Diabetes Inadequately Controlled with Diet and Exercise (SURPASS-1): A Double-blind, Randomised Controlled Trial. Lancet. 2021 Jul 10; 398(10295): 143-155. DOI: 10.1016/S0140-6736(21)01324-6. Epub 2021 Jun 27.
[4] Ludvik B. et al. Once-weekly tirzepatide versus once-daily insulin degludec as addon to metformin with or without SGLT2 inhibitors in patients with type 2 diabetes (SURPASS-3): a randomised, open-label, parallel-group, phase 3 trial. Lancet. 2021 Aug 14; 398(10300): 583-598. DOI: 10.1016/S0140-6736(21)01443-4. Epub 2021 Aug 6.
[5] Del Prato S, et. al. Tirzepatide versus insulin glargine in type 2 diabetes and increased cardiovascular risk (SURPASS-4): a randomised, open-label, parallelgroup, multicentre, phase 3 trial. Lancet. 2021 Nov 13; 398(10313): 1811-1824. DOI: 10.1016/S0140-6736(21)02188-7. Epub 2021 Oct 18.
[6] Frias JP et al. Tirzepatide vs. Semaglutide Once Weekly for Patients with Type 2 Diabetes. N Engl J Med. 2021 Aug 5; 385(6): 503-515. DOI: 10.1056/NEJMoa2107519. Epub 2021 Jun 25.
[7] Dahl D. et al. Effect of Subcutaneous Tirzepatide vs Placebo Added to Titrated Insulin Glargine on Glycemic Control in Patients With Type 2 Diabetes. The SURPASS-5 Randomized Clinical Trial JAMA.2022;327(6): 534-545. DOI:10.1001/ja[8] Sattar N et al. Tirzepatide cardiovascular event risk assessment: a pre-specified meta-analysis. Nat Med. 2022; 28, 591–598. DOI: https://doi.org/10.1038/s41591-022-01707-4.
[8] Nauck MA, Meier JJ. The incretin effect in healthy individuals and those with type 2 diabetes: physiology, patho-physiology, and response to therapeutic interventions. Lancet Diabetes Endocrinol. 2016; 4(6): 525-536. DOI: 10.1016/S2213-8587(15)00482-9.
[9] Nauck MA, Meier JJ. GIP and GLP-1: stepsiblings rather than monozygotic twins within the incretin family. Diabetes. 2019; 68(5): 897-900. DOI: 10.2337/dbi19-000





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.