
- DAZ.online
- DAZ / AZ
- DAZ 37/2022
- Riss in der ...
Medizin
Riss in der Hauptschlagader
Wissenswertes rund um die Aortendissektion
Eine Aortendissektion bzw. Aneurysma dissecans aortae (lat. dissecare = zerschneiden) ist eine potenziell lebensbedrohliche Erkrankung, bei der die innere Schicht der Aorta einreißt. Davon sind rund 3 von 100.000 Menschen pro Jahr betroffen, Männer etwa dreimal so oft wie Frauen. Die Erkrankung kommt in höherem Lebensalter häufiger vor, wobei die Patientinnen und Patienten zum Zeitpunkt der Diagnose im Mittel etwa 60 Jahre alt sind [1]. Aus noch unbekannten Gründen treten Aortendissektionen bevorzugt in den Wintermonaten auf und ereignen sich meistens am Vormittag zwischen 6:00 und 12:00 Uhr [2].
Verschiedene Formen der Aortendissektion
Je nachdem, welche Abschnitte der Hauptschlagader betroffen sind, können verschiedene Formen der Aortendissektion unterschieden werden, wobei hier mehrere Klassifikationssysteme gebräuchlich sind. Demnach differenziert die DeBakey-Klassifikation folgende Typen der Aortendissektion [3]:
- Typ I: Der primäre Einriss liegt in der aufsteigenden Hauptschlagader (Aorta ascendens) und breitet sich über den Aortenbogen bis zum absteigenden Teil der Aorta (Aorta descendens) aus.
- Typ II: Hier liegt der primäre Einriss in der Aorta ascendens ohne weitere Ausbreitung.
- Typ III: Bei dieser Form ist der primäre Einriss in der Aorta descendens lokalisiert, wobei noch unterschieden wird, ob die Ausbreitung nur bis oberhalb (Typ IIIa) oder bis unterhalb des Zwerchfells (Typ IIIb), das heißt bis in den abdominalen Bereich der Hauptschlagader (Aorta abdominalis), reicht.
Während bei der DeBakey-Klassifikation die Lokalisation des primären Einrisses und dessen Ausdehnung wichtige Bestandteile sind, definiert die Stanford-Klassifikation eine Aortendissektion nur nach deren Ausbreitung, ohne dass der primäre Einriss berücksichtigt wird [3]. Demnach unterscheidet man
- Stanford A: Dissektionen, die die Aorta ascendens inklusive des Aortenbogens betreffen,
- Stanford B: Dissektionen, die sich im Bereich der Aorta descendens ausbreiten, dem absteigenden Teil der Hauptschlagader, der sich unmittelbar an den Aortenbogen (Arcus aortae) anschließt.
Im klinischen Alltag wird die Aortendissektion meist nach der Stanford-Klassifikation beurteilt, da die Typ-A-Form akut lebensbedrohlich ist und daher auch anders behandelt werden muss als die Typ-B-Form [3, 4]. Bei rund 65% der Patientinnen und Patienten betrifft der Riss die Aorta ascendens, bei zwischen 5 bis 10% den Aortenbogen und in ungefähr 20 bis 25% der Fälle die Aorta descendens. Die Aorta abdominalis ist bei 5 bis 10% der Patienten involviert [1].
Neben der Lokalisation des primären Einrisses und dessen Ausbreitung kann auch der zeitliche Verlauf als Basis einer Klassifikation dienen. So ist die Aortendissektion akut, wenn zwischen dem Beginn der Symptomatik und dem aktuellen Status maximal 14 Tage liegen [3]. Beträgt der zeitliche Abstand zwischen 15 und 90 Tagen, spricht man von einer subakuten Form und darüber hinaus von einem chronischen Verlauf [3].
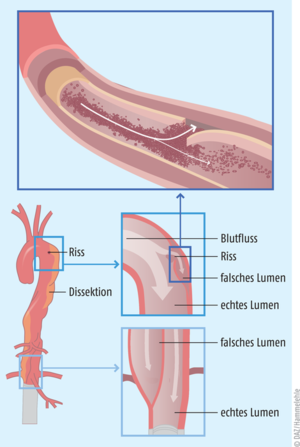
Abb. 1: Entstehung und Ausbreitung der Aortendissektion Die innerste Wandschicht der Aorta (Intima) reißt ein, sodass zwischen die darunterliegenden Wandschichten Blut gelangt (A). In der Folge bildet sich neben dem eigentlichen Lumen ein falsches Lumen aus, was letztlich zur Minderdurchblutung von Organen führen kann (modifiziert nach [2, 13]).
Wie kommt es zu der Erkrankung?
Eine Aortendissektion wird durch einen Riss in der aus Gefäßzellen bestehenden inneren Schicht der Hauptschlagader (Intima) verursacht [1]. Dadurch kann Blut zwischen die Intima und die mittlere Schicht eindringen, was wiederum dazu führt, dass sich die innere Schicht der Gefäßwand von der mittleren bzw. äußeren Schicht trennt (Abb. 1). So bildet sich – neben dem ursprünglichen blutführenden Lumen − ein weiteres „falsches Lumen“ aus. Dies wiederum kann letztlich dazu führen, dass abgehende Gefäßäste zu wenig Blut enthalten und Organe aufgrund der Minderdurchblutung nicht mehr ausreichend mit Sauerstoff und Nährstoffen versorgt werden [1]. Bei der Aortendissektion vom Typ A können Herz und Gehirn betroffen sein, bei der Aortendissektion vom Typ B die Organe im Bauch sowie die Beine. Zudem kann infolge des hohen Drucks in der Gefäßwand die Außenwand der Aorta aufplatzen, das heißt, es kommt zur Aortenruptur.
Welche Risikofaktoren gibt es und wie kann einer Aortendissektion vorgebeugt werden?
Ein Riss in der Intima entsteht als Folge einer geschwächten Aortenwand. Dies wiederum kann verschiedene Ursachen haben, aus denen sich eine Reihe von Risikofaktoren ableiten. Hierzu gehören:
- Grunderkrankungen wie Arteriosklerose, arterielle Hypertonie, Aortenaneurysma, Diabetes mellitus
- genetisch bedingte Veränderungen, z. B. Bindegewebserkrankungen (Marfan-Syndrom, Ehlers-Danlos-Syndrom), Turner-Syndrom, angeborene Herzklappenfehler und Mutationen an Genen, die für Wandkomponenten der Aorta oder wandmodifizierende Proteine kodieren
- ungesunder Lebensstil wie Rauchen, Kokain- oder Amphetamin-Missbrauch
- Traumata (z. B. Verkehrsunfall, Sturz aus großer Höhe)
- Operationen (Eingriffe an der Aorta)
Daneben sind männliches Geschlecht, höheres Alter sowie eine positive Familienanamnese weitere Faktoren, welche die Bildung einer Aortendissektion begünstigen [1, 3, 5].
Die Risikofaktoren geben auch Hinweise darauf, wie sich einer Aortendissektion vorbeugen lässt. Hier spielt eine gesunde Lebensweise wie Rauchverzicht, gesunde und ausgewogene Ernährung sowie körperliche Bewegung eine wichtige Rolle [1]. Übergewicht bzw. Adipositas kann die Gefäße schädigen, daher sollte das Körpergewicht bei Bedarf dementsprechend reduziert werden. Zudem ist es wichtig, Hypertonie und Hyperlipidämie adäquat zu behandeln. Da eine Aortendissektion auch als Folge eines Unfalls entstehen kann, sollte man sich während des Autofahrens anschnallen, um Verletzungen im Brustbereich zu vermeiden. Ein Aortenaneurysma kann ebenfalls zu einer Aortendissektion führen. Entsprechende Kontrolluntersuchungen per Ultraschall bei Risikopersonen wie Raucherinnen und Rauchern ab 65 Jahren können hier frühzeitig Hinweise auf die Erkrankung geben.
Wie macht sich eine Aortendissektion bemerkbar und wie wird sie diagnostiziert?
Leitsymptom bei einer akuten Aortendissektion ist ein plötzlich einsetzender, extrem starker Schmerz (Vernichtungsschmerz) im Brustbereich [1]. Zusätzlich können die Schmerzen in den Nacken- und Schulterbereich bzw. in den Bauch, den Rücken oder die Beine (Verdacht auf Dissektion der Bauchaorta) ausstrahlen. In einigen Fällen treten auch kolikartige Schmerzen im Nabelbereich auf, was darauf hindeutet, dass die Eingeweidegefäße blockiert sind. Die verminderte Durchblutung von Organen infolge der Aortendissektion kann eine Reihe weiterer Symptome verursachen. Hierzu gehören unter anderem Atemnot, starke Bauchschmerzen bei Mangeldurchblutung des Darms oder der Nieren, Schocksymptome bei einem Riss in der Nähe des Herzens, neurologische Ausfälle (Lähmung, Sprach- und Sehstörungen) sowie Symptome eines Herzinfarkts oder eines akuten Nierenversagens [1].
Was die Diagnose betrifft, werden die behandelnden Ärzte die betroffene Person − wenn sie ansprechbar ist − im Rahmen der Anamnese zunächst nach den Symptomen befragen [1, 3]. Anschließend erfolgt die klinische Untersuchung mit Puls- und Blutdruckmessung. So weist ein plötzlicher Blutdruckunterschied an den Extremitäten in Kombination mit Brustschmerzen auf eine Aortendissektion hin. Ein Abhören der Herzgeräusche mit einem Stethoskop sowie eine Überprüfung der Arm- und Beinbeweglichkeit gehören ebenfalls zur körperlichen Untersuchung [1]. Zudem wird eine elektrokardiografische Untersuchung (EKG) durchgeführt, um die Herztätigkeit zu überprüfen. In Laboruntersuchungen werden unter anderem die Blutwerte für D-Dimere bestimmt. Des Weiteren können im Rahmen der Diagnose mehrere bildgebende Verfahren eingesetzt werden [1, 3, 5–7]. Hierzu gehören:
- CT-Angiografie: Mit diesem Verfahren können Blutgefäße im Körper per Computertomografie (CT) dargestellt werden. Heutzutage wird dazu die Mehrschicht-Computertomografie (MSCT) eingesetzt, mit der sich während einer Untersuchung mehrere Schichten gleichzeitig aufzeichnen lassen, sodass die Scandauer kürzer und die untersuchten Scanabschnitte länger sind. Um die Bilder auf die Pumpbewegung des Herzens abzustimmen, wird die Untersuchung EKG-getriggert durchgeführt. Dieses Verfahren gilt als Goldstandard bei Verdacht auf akute Aortendissektion.
- MR-Angiografie: Alternativ zur CT-Angiografie kann auch eine Gefäßdarstellung mittels Magnetresonanztomografie durchgeführt werden.
- transthorakale Echokardiografie (TTE): Bei dieser Form der Ultraschalluntersuchung wird der Schallkopf außen auf den Brustkorb aufgesetzt, sodass die Schallwellen die Thoraxwand passieren müssen. Die dabei entstehenden Reflexionen der Schallwellen können jedoch zu Artefakten führen.
- transösophageale Echokardiografie (TEE): Bei dieser Ultraschalluntersuchung wird ein Endoskop mit einem Schallkopf über die Speiseröhre eingeführt. Die Nähe des Schallkopfs zum untersuchten Gewebe verbessert die sonografische Darstellung des Herzens bzw. der Aorta und damit die Aussagekraft der Methode.
- Röntgen-Thorax: Hierbei wird ein Röntgenbild des Brustkorbs erstellt. Dieses Verfahren wird eingesetzt, wenn das Risiko gering ist, dass eine akute Aortendissektion vorliegt.
Darüber hinaus lässt sich anhand des Aortic Dissection Detection Risk Score (ADD-RS) das Risiko für das Vorliegen einer Aortendissektion abschätzen [3, 5]. Dabei werden die drei Kategorien Anamnese, Schmerzcharakteristik und klinische Untersuchung bewertet:
Anamnese
- Familienanamnese
- Bindegewebserkrankungen
- Aortenerkrankungen
- Aortenklappenerkrankungen
- thorakales Aortenaneurysma
- Zustand nach Operation an der Aorta
Schmerzcharakteristik
Brust-, Rücken- oder abdominelle Schmerzen mit
- abruptem Beginn
- starker Intensität
- reißendem Charakter
klinische Untersuchung
- Nachweis eines Perfusionsdefizits (Pulsdefizit, systolische Blutdruckdifferenz, fokales neurologisches Defizit)
- aortales Diastolikum
- Hypotension/Schock
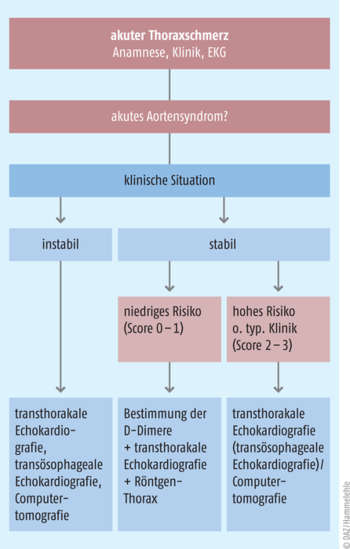
Abb. 2: Algorithmus für die Vorgehensweise bei der Diagnose einer Aortendissektion (modifiziert nach [3]).
Demnach wird für jede der drei Kategorien Anamnese, Schmerzcharakteristik und klinische Untersuchung ein Punkt vergeben, wenn mindestens einer der darunter aufgeführten Hochrisiko-Faktoren zutrifft. Dabei ist es unerheblich, ob ein, zwei oder mehrere Faktoren pro Kategorie nachgewiesen werden, es kann immer nur maximal 1 Punkt/Kategorie vergeben werden. Anhand der Gesamtpunktzahl (maximal 3 Punkte) kann dann der ADD-RS bestimmt werden. Dabei bedeuten 0 Punkte ein niedriges, 1 Punkt ein intermediäres und 2 bis 3 Punkte ein hohes Risiko für das Vorliegen einer Aortendissektion. Einen Überblick über die Vorgehensweise bei der Diagnose einer Aortendissektion gibt Abb. 2.
Welche Therapiemöglichkeiten gibt es?
Bei der Behandlung der Aortendissektion muss zwischen Typ A und Typ B gemäß Stanford unterschieden werden.
Aortendissektion vom Typ A
Akute Aortendissektionen vom Typ A sind lebensbedrohliche Notfälle, die möglichst schnell operiert werden müssen [1, 2, 4, 7]. Hierzu ist ein chirurgischer Eingriff am offenen Herzen notwendig, bei dem der betroffene Abschnitt der Aorta durch eine Gefäßprothese ersetzt wird. Gegebenenfalls muss auch eine künstliche Aortenklappe eingesetzt werden.
Aortendissektion vom Typ B
Hier müssen die unkomplizierte und die komplizierte akute Verlaufsform unterschieden werden. Dabei gilt eine Dissektion als kompliziert bei einem Durchmesser der Aorta von > 60 mm bzw. bei schneller Größenzunahme des Durchmessers sowie bei retrograder Ausdehnung, verminderter Durchblutung von Organen bzw. Extremitäten, Zeichen einer bestehenden bzw. drohenden Ruptur oder auch bei therapierefraktären Schmerzen trotz Schmerzmittel [5]. Patienten mit chronischer Aortendissektion werden gesondert behandelt. Die aktuellen Leitlinien der Deutschen Gesellschaft für Gefäßchirurgie und Gefäßmedizin (DGG) empfehlen für die Therapie dieser Gruppen die folgende Vorgehensweise [3]:
unkomplizierte akute Typ-B-Dissektion: Besteht der Verdacht auf eine akute Aortendissektion vom Typ B oder wurde diese nachgewiesen, sollten die Betroffenen in ein Zentrum mit entsprechender Expertise überwiesen werden [3]. Bei Patienten mit unkomplizierter Typ-B-Dissektion werden Blutdruck, Herzfrequenz und Schmerzen konservativ mit der bestmöglichen medikamentösen Therapie behandelt. Dabei sollte die Blutdrucksenkung so lange fortgesetzt werden, bis das systolische Blutdruckziel von 100 bis 120 mmHg sowie eine Herzfrequenz von < 60/Minute erreicht sind und keine Anzeichen für eine verminderte Organdurchblutung mehr bestehen. Hierzu erhalten die Betroffenen intravenöse Betablocker. Führt dies nicht zum Ziel, werden Calciumkanal-Antagonisten eingesetzt. Wichtig dabei ist, dass die Vitalfunktionen regelmäßig überwacht werden. Patientinnen und Patienten im subakuten Stadium können unter bestimmten Umständen mit einem endovaskulären Eingriff behandelt werden.
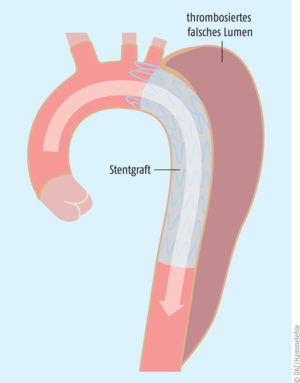
komplizierte akute Typ-B-Dissektion: Diese Patientinnen und Patienten sollten − neben einer medikamentösen Therapie – auch operativ behandelt werden, wobei die endovaskulären Verfahren, wenn möglich und sinnvoll, gegenüber einem offenen chirurgischen Eingriff zu bevorzugen sind. Die endovaskuläre Therapie der Wahl ist die minimalinvasive Implantation einer behüllten Gefäßstütze (Stentgraft) − ein Verfahren, das auch als thorakale endovaskuläre Aortenreparatur (TEVAR) bezeichnet wird (siehe Abb. 3). Dadurch wird der Einriss abgedichtet und der normale Blutfluss im ursprünglichen Lumen wiederhergestellt.
Abb. 3: Thorakale endovaskuläre Aortenreparatur (TEVAR) einer Aortendissektion vom Typ B. Hierbei wird eine Endoprothese (Stentgraft) eingesetzt, um die geschädigte Aorta zu stabilisieren und den Eingang zum falschen Lumen zu versiegeln, was zur Rekonstruktion des echten Lumens mit anschließender Thrombose des falschen Lumens führt (modifiziert nach [14]).
chronische Aortendissektion: Weisen Patienten mit chronischer Aortendissektion einen maximalen thorakalen Aortendurchmesser > 5,5 cm auf oder ist der Durchmesser innerhalb eines Jahres um mehr als 1 cm angewachsen, dann ist eine operative Therapie indiziert. Die Behandlungsmethode (endovaskulär oder offen) wird hier auf Basis der Risikofaktoren und anatomischen Gegebenheiten ausgewählt, wobei im Fall einer verminderten Durchblutung, einer Aortenruptur oder eines schnellen Fortschreitens der Dissektion primär endovaskulär behandelt werden sollte.
Nachsorge und Rehabilitation sind wichtige Bestandteile des Genesungsprozesses
Patientinnen und Patienten mit Aortenerkrankungen benötigen eine lebenslange Betreuung − unabhängig davon, wie die Erkrankung behandelt wird [8]. Dabei sollten die Betroffenen mit offen operierten, Stent-versorgten oder konservativ behandelten Erkrankungen der Aorta grundsätzlich an einer angiologischen bzw. kardiologischen Rehabilitation teilnehmen [3]. Bei einer Aortendissektion stehen hier eine adäquate Blutdruckeinstellung, regelmäßige Kontrolluntersuchungen sowie an die jeweiligen Bedürfnisse angepasste Rehabilitationsmaßnahmen im Vordergrund. Nach einem operativen Eingriff an der Aorta kann auch der Betroffene selbst durch entsprechende Verhaltensmaßnahmen das Risiko für Komplikationen reduzieren (siehe Kasten „Tipps für das Leben nach einer Aortenoperation“).
Tipps für das Leben nach einer Aortenoperation
- Innerhalb der ersten sechs Wochen nach der Operation sollte auf das Fahren von Auto, Fahrrad und weiteren Fahrzeugen verzichtet werden. Als Bei- oder Mitfahrer sollte stets der Sicherheitsgurt angelegt werden, um das Brustbein im Falle eines Unfalls möglichst zu schonen.
- Möglichst nicht rauchen, da dies als starker Risikofaktor für arteriosklerotische Bindegewebsveränderungen gilt, die wiederum zu einer erneuten Aortendissektion führen könnten.
- Patientinnen und Patienten können etwa drei Monate nach der Operation bzw. nach Abschluss der knöchernen Heilung des Brustbeins wieder körperlich aktiv werden. Um Blutdruckspitzen zu vermeiden, sollte dabei auf eine möglichst konstante Belastung wie z. B. beim Schwimmen, Walken oder Radfahren geachtet werden. Krafttraining sollte nur mit moderater Intensität durchgeführt werden.
- Das Sexualleben ist nach einer Operation an der Aorta nicht beeinträchtigt. Allerdings sollte auch hier auf übermäßige körperliche Anstrengungen verzichtet werden, um so erhöhte Blutdruckwerte zu vermeiden.
- Größere Reisen sollten frühestens drei Monate nach der Operation unternommen werden. Dabei sind stärkere Belastungen wie das Heben schwerer Gepäckstücke zu vermeiden. Höhenaufenthalte bis 2000 Meter über dem Meeresspiegel sind in der Regel unproblematisch.
- Um die Wundheilung nicht zu gefährden, sollte mindestens drei Monate nach dem Eingriff mit dem Besuch einer Sauna oder eines Schwimmbads gewartet werden.
- Nach erfolgreicher Therapie besteht in der Regel eine Arbeitsunfähigkeit für etwa drei Monate bzw. bis zum Abschluss der knöchernen Heilung. Wurde die Erkrankung der Aorta durch die Operation vollständig beseitigt, können die Patientinnen und Patienten ohne Beeinträchtigung am öffentlichen Leben teilnehmen. Chronische Aortendissektionen können allerdings den (Berufs-)Alltag beeinträchtigen und somit eine Behinderung darstellen.
(modifiziert nach [8])
Aortendissektion vom Typ A
Es wird empfohlen, Patienten nach der chirurgischen Behandlung ihrer Typ-A-Aortendissektion in ein Nachsorgeprogramm einzubinden, das entweder im Erstbehandlungszentrum oder in einem überregionalen Aortenzentrum stattfindet [9]. Dort sollten regelmäßig, das heißt vor der Entlassung aus dem Krankenhaus, nach sechs bzw. zwölf Monaten und ab dann – bei regulärem Verlauf – jährlich, eine klinische Untersuchung, eine TTE und eine CT- bzw. MR-Angiografie durchgeführt werden [9]. Dabei ist es wichtig, dass der Blutdruck engmaschig kontrolliert und effizient eingestellt wird. Hier wird die Gabe von Betablockern empfohlen. Diese strikte Nachsorge ist unerlässlich, da zwei von fünf Patienten nach ihrer Operation ein Aneurysma entwickeln, das an einem bisher unbehandelten Aortensegment lokalisiert ist und behandelt werden muss [9]. Zudem wurde festgestellt, dass eine fehlende CT-Untersuchung in der Nachsorge der stärkste unabhängige Prädiktor für die Langzeitsterblichkeit von Patientinnen und Patienten nach einer überlebten Aortendissektion vom Typ A ist [10].
Aortendissektion vom Typ B
Auch bei diesen Patienten ist eine regelmäßige Blutdruckmessung bzw. -einstellung essenziell [3]. Dabei sollte der Blutdruck in Ruhe immer bei < 140/90 mmHg, besser noch bei < 130/80 mmHg liegen [3]. Die blutdrucksenkende Therapie wird beim Typ B ebenfalls in erster Linie mit Betablockern durchgeführt, da diese das Risiko für die Entwicklung eines Aneurysmas und somit die Notwendigkeit eines chirurgischen Eingriffs reduzieren. Ergänzend können Calciumkanal-Antagonisten und Hemmer des Renin-Angiotensin-Aldosteron-Systems (RAAS) – und hier insbesondere Angiotensin-1-Antagonisten (Sartane) – eingesetzt werden [3]. Um zu überprüfen, ob der Blutdruck tatsächlich angemessen kontrolliert ist, sollte während der Rehabilitation mindestens einmal eine automatische 24-Stunden-Blutdruckmessung erfolgen. Unter der Voraussetzung, dass der Blutdruck in Ruhe adäquat kontrolliert ist, wird zudem empfohlen, nach Operation oder Stentgraft-Versorgung der Aorta zu Beginn und am Ende der Rehabilitation einen kontrollierten Belastungstest mit EKG- und Blutdruckkontrolle durchzuführen [3]. Insbesondere ist auch darauf zu achten, ob Zeichen oder Symptome möglicher Komplikationen wie eines Malperfusions-Syndroms oder einer zunehmenden Aortendilatation vorliegen. Hierzu gehören z. B. zeitweises Hinken (Claudicatio intermittens), Schmerzen im Ober- oder Mittelbauch (Angina intestinalis), wiederkehrende Rückenschmerzen, neu auftretende Heiserkeit oder Schluckstörungen (Dysphagie) [3].
Was die eigentlichen Rehabilitationsmaßnahmen betrifft, sollten die Trainingsintensitäten entsprechend einem zu Beginn der Reha durchgeführten Belastungstest so begrenzt werden, dass auch während des Trainings ein systolischer Blutdruck von 160 mmHg nicht überschritten wird [3]. Dabei ist Ergometer-Training zu bevorzugen, weil sich hier der Blutdruck einfach messen lässt. Bei allen Trainingseinheiten (Ausdauer- und dynamisches Kraftausdauertraining) wird empfohlen, zu Beginn und während des Trainings Blutdruckkontrollen durchzuführen. Belastende Sportarten wie Wettbewerbssport, Kontaktsportarten, Sprintbelastungen, isometrische Belastungen und Anstrengungen, die zu Pressatmung führen, müssen vermieden werden [3].
Auf einen Blick
- Bei einer Aortendissektion reißt die innere Schicht der Aorta ein, und dadurch bildet sich ein falsches Lumen. Dies kann dazu führen, dass die abgehenden Gefäße die Organe nicht mehr ausreichend versorgen können. Nach Stanford werden der akut lebensbedrohliche Typ A und der Typ B unterschieden.
- Alle Faktoren, die zur Schwächung der Aortenwand beitragen, erhöhen das Risiko für die Entstehung, z. B. Arteriosklerose und Bluthochdruck, aber auch Traumata und Operationen. Durch gesunde Lebensweise wie ausgewogene Ernährung und körperliche Bewegung kann einer Aortendissektion vorgebeugt werden.
- Leitsymptom bei einer akuten Aortendissektion ist ein plötzlich einsetzender, extrem starker Schmerz im Brustbereich. Die Diagnose erfolgt auf Basis der Anamnese und der klinischen sowie der bildgebenden Untersuchungen.
- Zur Behandlung einer Aortendissektion vom Typ A ist eine Operation am offenen Herzen notwendig. Bei einer Typ-B-Dissektion kann eine medikamentöse Blutdrucksenkung mit regelmäßiger Überwachung ausreichen. Bei komplizierten akuten Formen bzw. bei chronischen Formen kann ein offener oder endovaskulärer Eingriff erforderlich sein.
- Rehabilitation ist ein wesentlicher Bestandteil des Genesungsprozesses, die regelmäßige Kontrolle und medikamentöse Einstellung des Blutdrucks spielen eine entscheidende Rolle. Als Rehabilitationsmaßnahme kommt z. B. ein gut steuerbares Ergometer-Training infrage, stark belastende Sportarten sind zu meiden.
- Wichtig in der Rehabilitation ist die psychische Stabilisierung der Betroffenen, die häufig unter Depressionen, Angststörungen oder posttraumatischen Belastungsstörungen leiden.
Psychische Reaktionen im Rahmen einer Aortendissektion müssen berücksichtigt werden
Auch die psychische Stabilisierung der Betroffenen trägt zu einer erfolgreichen Rehabilitation nach einer Aortendissektion bei. Die Diagnose und Therapie von psychischen Begleiterkrankungen wie Depressionen, Angststörungen oder posttraumatischen Belastungsstörungen sollten daher in die Planungen für die Nachsorge miteinbezogen werden [3]. Daher wird empfohlen, die Patienten im Krankheitsverlauf wiederholt im Rahmen eines ärztlichen Gesprächs nach etwaigen psychischen Beschwerden zu befragen. Hierzu können auch standardisierte Fragebögen eingesetzt werden (siehe Tab. 1) [3]. Wenn sich Hinweise auf eine vorliegende psychische Erkrankung ergeben, sollten die Betroffenen zunächst Angebote im Rahmen der psychosomatischen Grundversorgung erhalten. Hier kann beispielsweise der behandelnde Arzt in Einzelgesprächen mit den Betroffenen die Zusammenhänge des Krankheitsgeschehens erfassen und analysieren [11]. Auch Entspannungstechniken wie autogenes Training oder die Relaxationstherapie nach Jacobson (progressive Muskelrelaxation) können ebenso wie ein an die jeweiligen Bedürfnisse angepasstes körperliches Training helfen, die psychischen bzw. psychosomatischen Begleiterkrankungen einer Aortendissektion zu lindern. Sind diese Maßnahmen nicht ausreichend, werden leitliniengerechte psychotherapeutische Verfahren empfohlen [3]. Hier besteht auch die Möglichkeit einer psychokardiologischen Akutbehandlung bzw. Rehabilitation, die sowohl die internistisch-kardiologische Versorgung als auch eine intensive psychosomatische Diagnostik und Behandlung umfasst [3, 12]. Eine medikamentöse Therapie sollte erst dann eingesetzt werden, wenn die nichtpharmakologischen Maßnahmen ausgeschöpft sind und eine psychiatrische oder psychosomatische Konsultation erfolgt ist [3]. |
Komorbidität | Screening-Fragen | standardisierte Fragebögen |
|---|---|---|
Depression |
|
|
generalisierte Angststörung |
|
|
posttraumatische Belastungsstörung |
|
|
Literatur
[1] Aortendissektion. Informationen des Universitätsspitals Zürich (USZ), www.usz.ch/krankheit/aortendissektion/
[2] Aortendissektion. Informationen des Deutschen Herzzentrums Berlin (DHZB), www.dhzb.de/ratgeber/aortendissektion
[3] Typ-B-Aortendissektion. S2k-Leitlinie der Deutschen Gesellschaft für Gefäßchirurgie und Gefäßmedizin (DGG), AWMF-Register-Nr.: 004-034, Stand: 19. Mai 2022, www.awmf.org/uploads/tx_szleitlinien
[4] Leitlinie Akutes Aortensyndrom 2018. Informationen des Klinikums Karlsburg, Stand: 1. Februar 2018, www.klinikum-karlsburg.de/siteflow/scripts/core/file.php?id=1236
[5] Aortendissektion. Amboss, www.amboss.com/de/wissen/aortendissektion/
[6] Mehrschicht-CT. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Mehrschicht-CT
[7] Aortendissektion. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Aortendissektion#Therapie
[8] Patientenratgeber Aorta – Erkrankungen, Diagnostik und Therapie. Informationen des Deutschen Herzzentrums Berlin (DHZB), www.dhzb.de/fileadmin/user_upload/relaunch/11_Downloads/Patientenratgeber_Aorta_02-2019.pdf
[9] Behandlung der Thorakalen Aortendissektion Typ A. S2k-Leitlinie der Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie (DGTHG), AWMF-Register-Nr. 011/018, Stand: Februar 2021, www.awmf.org/uploads/tx_szleitlinien/011-018l_S2k_Behandlung-der-thorakalen-Aortendissektion-Typ-A_2021-02_1.pdf
[10] von Kodolitsch Y, Wilson O, Schüler H, Larena-Avellaneda A, Kölbel T, Wipper S, Rohlffs F, Behrendt C, Debus ES, Brickwedel J, Girdauskas E, Detter C, et al. Warfarin anticoagulation in acute type A aortic dissection survivors (WATAS). Cardiovasc Diagn Ther 2017;7:559–571
[11] Psychosomatische Medizin. DocMedicus – Gesundheitsportal der Deutschen Gesellschaft für Nährstoffmedizin und Prävention (DGNP) e.V., www.gesundheits-lexikon.com/Therapie/Psychosomatische-Grundversorgung/
[12] Christoph H-L, Kleiber C. Psychokardiologie – medizinische Experten. leadingmedicine guide, Stand: 10. März 2017, www.leading-medicine-guide.com/de/behandlung/psychokardiologie
[13] Hauptschlagader, Rissbildung. Informationen des Arztinformationssystems Deximed – Hausarztwissen online. , Stand: 24. Januar 2016, https://deximed.de/home/klinische-themen/herz-gefaesse-kreislauf/patienteninformationen/gefaesserkrankungen/hauptschlagader-rissbildung
[14] Thoracic Aaortic Aneurysm (TAA). University of Utah Health, https://healthcare.utah.edu/cardiovascular/programs/aortic-disease/thoracic-aortic-aneurysm/























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.