
- DAZ.online
- DAZ / AZ
- DAZ 13/2022
- Finerenon schützt Nieren...
Arzneimittel und Therapie
Finerenon schützt Nieren und Herz
Erster nichtsteroidaler Mineralcorticoid-Rezeptor-Antagonist für Typ-2-Diabetiker zugelassen
Die chronische Nierenerkrankung ist eine häufige Folgeerkrankung bei Typ-2-Diabetikern – weltweit sind mehr als 160 Millionen Diabetiker betroffen. Die bisherigen Therapieoptionen basieren auf einer optimalen Blutzucker- und Blutdruck-Einstellung und beinhalten u. a. die Einnahme eines Renin-Angiotensin-Aldosteron-System-Blockers (z. B. ACE-Hemmer, AT1-Antagonisten) und eines SGLT(Sodium dependent glucose co-transporter)-2-Hemmers z. B. Empagliflozin. Trotz den bisher zur Verfügung stehenden Behandlungsmöglichkeiten kommt es bei vielen Patienten zum Fortschreiten der Erkrankung bis hin zur dialysepflichtigen Niereninsuffizienz oder vorzeitigem Tod. Anlass zur Hoffnung gibt Finerenon (Kerendia®, Bayer), das vor Kurzem von der Europäischen Kommission zur Behandlung von chronischer Nierenerkrankung (Stadium 3 und 4 mit Albuminurie) bei erwachsenen Typ-2-Diabetikern zugelassen wurde. Die Tabletten werden in zwei Stärken (10 und 20 mg) auf dem Markt erhältlich sein. Eine Zulassungserweiterung für Typ-2-Diabetiker in frühen Stadien der chronischen Nierenerkrankung ist bereits von Bayer beantragt.
Nichtsteroidaler Antagonist überzeugt
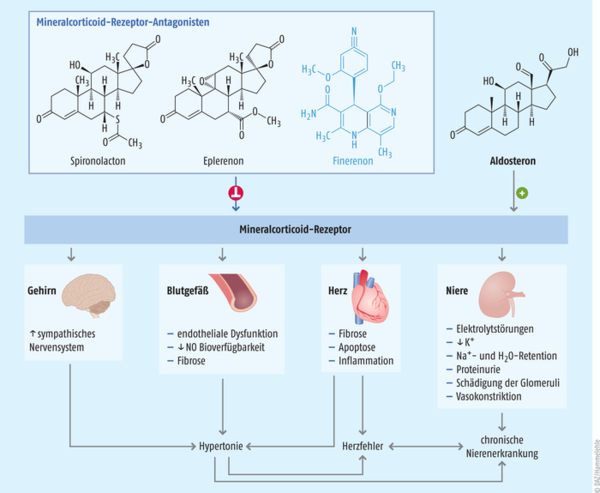
Finerenon ist anders als Spironolacton und Eplerenon ein selektiver, nichtsteroidaler Antagonist am Mineralcorticoid-Rezeptor (MRA). Durch die Blockade des Rezeptors wird die Rekrutierung transkriptioneller Coaktivatoren gehemmt – infolgedessen wird die Produktion proinflammatorischer und profibrotischer Mediatoren vermindert (s. Abb.).
Abb.: Als nichtsteroidaler Antagonist blockiert Finerenon ähnlich wie das steroidal aufgebaute Spironolacton und Eplerenon den Mineralcorticoid-Rezeptor und wirkt so der Entstehung einer chronischen Nierenerkrankung entgegen (nach Lytvyn et al.).
In der zulassungsrelevanten Phase-III-Studie FIDELIO-DKD kam es unter Finerenon zu einer signifikanten Reduktion des Fortschreitens der Nierenerkrankung und zu einer Verringerung des Risikos für kardiovaskuläre Ereignisse. In die Studie wurden mehr als 5600 Typ-2-Diabetiker (mittleres Alter 66 Jahre, 70% männlich) mit chronischer Nierenerkrankung eingeschlossen. Einschlusskriterien waren u. a. ein Albumin-Kreatin-Quotient im Urin (urine albumin-to-creatinine ratio, UACR) von 30 bis 5000 mg/g, eine geschätzte glomeruläre Filtrationsrate (eGFR) von 25 bis 75 ml/min/1,73 m2 und ein Serum-Kalium-Wert ≤ 4,8 mmol/l. Darüber hinaus mussten die Studienteilnehmer beim Screening bereits mit einem ACE-Hemmer oder AT1-Antagonisten vorbehandelt sein. Zur Baseline wiesen mehr als die Hälfte der Teilnehmer eine eGFR von < 45 ml/min/1,73 m2 auf; der mediane UACR lag bei 852 mg/g und der mittlere HbA1c-Wert bei 7,7%.
Reduktion renaler und ...
Die Teilnehmer wurden 1 : 1 randomisiert und erhielten neben der Standardbehandlung einmal täglich oral Finerenon (10 mg oder 20 mg, in Abhängigkeit der eGFR) oder Placebo. Die Follow-up-Zeit betrug 2,6 Jahre; nach 24 Monaten erhielten in der Finerenon-Gruppe mehr als 67% der Teilnehmer die höhere Dosis von 20 mg.
Primärer Endpunkt war eine Kombination aus der Zeit bis zum Auftreten von Nierenversagen (definiert als chronische Dialyse für mehr als 90 Tage, Nierentransplantation oder eine anhaltende eGFR von < 15 ml/min/1,73 m2 über mindestens vier Wochen), einer anhaltenden Abnahme der eGFR um ≥ 40% im Vergleich zur Baseline über mindestens vier Wochen oder renalem Tod. Hier konnte Finerenon im Vergleich zu Placebo überzeugen – die Einnahme führte zu einer signifikanten Reduktion des kombinierten renalen Endpunkts unabhängig vom HbA1c-Wert zur Baseline oder Insulin-Gabe. Der Endpunkt trat in der Finerenon-Gruppe bei 17,8% ein versus 21,1% unter Placebo (Hazard Ratio [HR] 0,82; 95%-Konfidenzintervall [KI]: 0,73 bis 0,93; p = 0,0014).
... kardiovaskulärer Ereignisse
Der wichtigste sekundäre Endpunkt war eine Kombination aus der Zeit bis zum kardiovaskulären Tod, nicht tödlichem Myokardinfarkt, nicht tödlichem Schlaganfall oder Hospitalisierung aufgrund einer Herzinsuffizienz. Der sekundäre kombinierte kardiovaskuläre Endpunkt trat bei 13% der Finerenon-Anwendern versus 14,8% unter Placebo ein (HR = 0,86; 95%-KI: 0,75 bis 0,99; p = 0,0339). Nach vier Monaten zeigte sich unter der Finerenon-Therapie eine placebokorrigierte relative Reduktion des Albumin-Kreatin-Quotients im Urin von mehr als 30%.
Kein Grapefruitsaft
Die Einnahme der Tabletten erfolgt nahrungsunabhängig – bei Schluckproblemen können die Tabletten vor der Anwendung zerstoßen und mit Wasser oder Apfelmus gemischt werden. Die Metaboliten von Finerenon sind alle pharmakologisch inaktiv. Die Eliminationshalbwertszeit liegt bei zwei bis drei Stunden. Da Finerenon zu 90% über CYP3A4 (10% über CYP2C) verstoffwechselt wird, sollte während der Finerenon-Therapie generell auf den Verzehr von Grapefruit(-saft) verzichtet werden. Grund ist die irreversible Hemmung von CYP3A4 durch Inhaltsstoffe der Grapefruit, die bis zur Neusynthese von CYP3A4 anhält, und erhöhte Plasmakonzentrationen von Finerenon zur Folge haben kann. Ebenso ist die gleichzeitige Behandlung mit starken CYP3A4-Inhibitoren (z. B. Ketoconazol, Ritonavir, Clarithromycin) kontraindiziert. Bei Morbus Addison oder schwerer Leberfunktionsstörung darf keine Finerenon-Therapie erfolgen.
Cave Interaktionen
Die gleichzeitige Anwendung von starken bis moderaten CYP3A4-Induktoren (z. B. Rifampicin, Carbamazepin, Phenytoin, Phenobarbital, Johanniskraut, Efavirenz) wird nicht empfohlen – die Wirkung von Finerenon kann deutlich abgeschwächt werden. Auch die begleitende Einnahme von Arzneistoffen, die den Serum-Kalium-Wert erhöhen können (z. B. Kalium-sparende Diuretika oder andere Mineralcorticoid-Rezeptor-Antagonisten) sollte vermieden werden. Vorsicht ist geboten bei schwachen bis moderaten CYP3A4-Inhibitoren wie Erythromycin, Verapamil oder Fluvoxamin: Hier sollte der Serum-Kalium-Wert engmaschig überwacht werden. Bei der gleichzeitigen Einnahme von Finerenon und Trimethoprim bzw. Trimethoprim/Sulfamethoxazol ist mit einem Anstieg des Hyperkaliämie-Risikos zu rechnen – unter Umständen muss ein vorübergehendes Aussetzen der Finerenon-Therapie in Erwägung gezogen werden. Ebenfalls muss der Blutdruck bei gleichzeitiger Einnahme anderer blutdrucksenkender Medikamente überwacht werden – das Hypotensions-Risiko steigt an.
Achtung Hyperkaliämien!
Insgesamt weist Finerenon ein positives Sicherheitsprofil auf – die am häufigsten gemeldete Nebenwirkung war Hyperkaliämie. Darüber hinaus traten bei den Studienteilnehmern häufig eine Hyponatriämie, Hypotonie, Pruritus und eine verminderte glomeruläre Filtrationsrate auf. Gelegentlich wurde auch ein verminderter Hämoglobinwert festgestellt. Finerenon hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Sicher verhüten
Frauen im gebärfähigen Alter sind darauf hinzuweisen, dass unter der Finerenon-Therapie eine zuverlässige Verhütungsmethode anzuwenden ist. Bisher liegen keine Daten zur Anwendung von Finerenon bei Schwangeren vor – tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Während der Schwangerschaft darf Finerenon nicht eingenommen werden, es sei denn, eine Therapie ist aufgrund des klinischen Zustandes der Frau unvermeidbar – die Schwangere ist über die potenziellen Risiken für das ungeborene Kind aufzuklären. In der Stillzeit ist Finerenon kontraindiziert. |
Literatur
Bayer beantragt Indikationserweiterung in der EU für Finerenon zur Behandlung von Patienten in frühen Stadien der chronischen Nierenerkrankung in Verbindung mit Typ-2-Diabetes, Pressemitteilung der Bayer AG, 16. März 2022
Finerenon (Kerendia®): Anhang I, Zusammenfassung der Merkmale des Arzneimittels. Informationen der EMA, https://ec.europa.eu/health/documents/community-register/2022/20220216154593/anx_154593_de.pdf, Abruf am 12. März 2022
Rossing P et al. Finerenone in Patients With Chronic Kidney Disease and Type 2 Diabetes According to Baseline HbA1c and Insulin Use: An Analysis From the FIDELIO-DKD Study. Diabetes Care 2022. doi: 10.2337/dc21-1944
Lytvyn Y et al. Mineralocorticoid Antagonism and Diabetic Kidney Disease. Current Diabetes Reports 2019. doi:10.1007/s11892-019-1123-8





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.