
- DAZ.online
- DAZ / AZ
- DAZ 10/2022
- Zwischen Chancen und ...
Versorgung
Zwischen Chancen und Risiken
Fünf Jahre Versorgung mit Cannabinoid-basierten Arzneimitteln
Cannabinoid-basierte Arzneimittel sind nicht neu. Historische Pharmakopöen weisen Monographien für ethanolische Hanfextrakte und -tinkturen auf, so beispielsweise der 6. Ergänzungsband zum Deutschen Arzneibuch aus dem Jahr 1941 bzw. dessen Nachdruck im Jahr 1948 [2]. In Folge des Beitritts zur UN Single-Convention über Suchtstoffe und nachfolgender Novelle des Betäubungsmittelrechts entfielen Cannabinoid-basierte Rezepturen mit Listung in der Anlage I des Betäubungsmittelgesetzes (BtMG) als nicht mehr verkehrs- und verschreibungsfähig [3]. Mitte der 1980er-Jahre wurden im Kontext der AIDS-Krise Fertigarzneimittel mit Tetrahydrocannabinol (THC, Dronabinol) seitens der US-amerikanischen Zulassungsbehörde Food and Drug Administration (FDA) unter dem Handelsnamen Marinol® zur symptomatischen Therapie der Anorexie bzw. Kachexie zugelassen [4]. Inzwischen liegen Generika zu Marinol® und die Dronabinol-Lösung Syndros® vor [5]. Weiterhin erfolgte im Dezember 1985 die Zulassung der FDA für das im Vergleich zu THC stärker wirksame, synthetische Cannabinoid Nabilon mit den Indikationen Übelkeit und Erbrechen im Rahmen einer Chemotherapie unter dem Handelsnamen Cesamet® [6]. Bereits im Jahr 1983 wurde dem pharmazeutischen Unternehmen Lilly in Deutschland eine Zulassung für Nabilon unter dem Handelsnamen Cesametic® erteilt, die jedoch im Jahr 1988 wieder erloschen ist [7]. Als Substanz wurde Dronabinol mit Änderung des BtMG 1998 in Anlage III als verkehrs- und verschreibungsfähig gelistet, die Aufnahme von Rezepturen ins NRF erfolgte im Jahr 2001, bspw. die öligen Dronabinol-Tropfen oder Kapseln [8]. Der ethanolische Cannabisextrakt mit ausgewogenem CBD (2,5mg/Hub) zu THC (2,7mg/Hub) Verhältnis (Sativex®) wurde im Mai 2011 zur Linderung der Spastik bei Multipler Sklerose zugelassen und hat das Verfahren der frühen Nutzenbewertung für Arzneimittel mit neuen Wirkstoffen beim Gemeinsamen Bundesausschuss (G-BA) zweimal durchlaufen. Im Ergebnis attestierte der G-BA einen „Hinweis auf einen geringen Zusatznutzen“ gegenüber zweckmäßiger Vergleichstherapie [9,10]. Seit Oktober 2019 steht ein Fertigarzneimittel mit Cannabidiol (Epidyolex®) zur Add-on-Therapie bei seltenen Formen der Epilepsie, das heißt dem Lennox-Gastaut- bzw. Dravet-Syndrom sowie mit Indikationserweiterung im Mai 2021 bei tuberöser Sklerose zur Verfügung. In fünf Beschlüssen attestierte der G-BA dreimal einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen, zweimal bei der Neubewertung aufgrund aktueller Daten Anhaltspunkte für beträchtlichen Zusatznutzen [11, 12, 13, 14, 15]. Im Frühjahr 2017 kam Nabilon unter dem Handelsnamen Canemes® basierend auf einer bibliographischen Zulassung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) im Jahr 2015 und ohne frühe Nutzenbewertung des G-BA erneut auf den Markt [16]. Der Versuch einer auf Marinol® bezugnehmenden generischen Zulassung für den Wirkstoff Dronabinol unter dem Handelsnamen Kachexol® seitens Bionorica Ethics scheiterte, sodass ausschließlich die drei Dronabinol-Rezepturzubereitungen des NRF zur Verfügung stehen [17].
Zusammenfassend ist somit festzustellen, dass Cannabinoid-basierte Arzneimittel Zulassungen als Fertigarzneimittel bei entsprechender Datenlage, das heißt bei Vorlage valider klinischer Studien, erhalten und auch die für alle Arzneimittel mit neuen Wirkstoffen verbindlichen G-BA-Verfahren der frühen Nutzenbewertung erfolgreich durchlaufen können. Die Nutzenbewertungen des G-BA nach § 35a SGB V prüfen in Ergänzung zur arzneimittelrechtlichen Zulassung den Mehrwert gegenüber bereits verfügbaren, etablierten Arzneimitteln.
Patienten versus Bundesopiumstelle
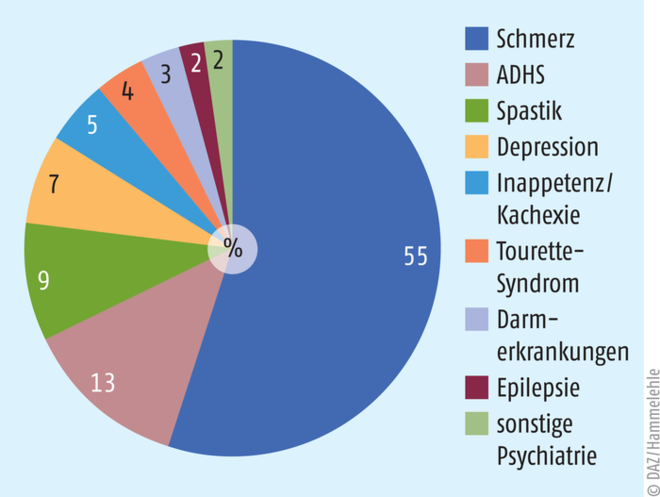
Patienten klagten bis zum Bundesverwaltungsgericht gegen die Bundesopiumstelle (BOPST) des BfArM zum Erlangen von Sondergenehmigungen nach § 3 Abs. (2) BtMG zur ärztlich begleiteten Selbsttherapie mit getrockneten Cannabisblüten aus dem staatlichen Programm der Niederlande (Bedrocan) bzw. aus eigenem Anbau [18, 19]. Die Bundesopiumstelle musste aufgrund dieser Urteile von 2006 bis 2017 rund 1100 Sondergenehmigungen erteilen (Abb. 1) [20].
Abb. 1: Anwendungsgebiete von Cannabinoid-basierten Arzneimitteln im Kontext der Sondergenehmigungen des BfArM nach § 3(2) BtMG, nach [20]
Um einen Eigenanbau durch schwerkranke Patienten eher unnötig zu machen und eine Kostenübernahme durch die gesetzliche Krankenversicherung zu ermöglichen, folgten im Rahmen des „Gesetzes zur Änderung betäubungsmittelrechtlicher und anderer Gesetze“ Novellierungen diver-ser Paragraphen im BtMG, in weiteren betäubungsmittelrechtlichen Verordnungen, im Grundstoffüberwachungsgesetz sowie die Ergänzung des § 31 im fünften Sozialgesetzbuch (SGB V) um den Absatz (6) mit Wirkung ab10.03.2017.
§ 31 Abs. (6) SGB V im Wortlaut (Auszug):
Versicherte mit einer schwerwiegenden Erkrankung haben Anspruch auf Versorgung mit Cannabis in Form von getrockneten Blüten oder Extrakten in standardisierter Qualität und auf Versorgung mit Arzneimitteln mit den Wirkstoffen Dronabinol oder Nabilon, wenn
1. eine allgemein anerkannte, dem medizinischen Standard entsprechende Leistung
a) nicht zur Verfügung steht oder
b) im Einzelfall nach der begründeten Einschätzung der behandelnden Vertragsärztin oder des behandelnden Vertragsarztes unter Abwägung der zu erwartenden Nebenwirkungen und unter Berücksichtigung des Krankheitszustandes der oder des Versicherten nicht zur Anwendung kommen kann,
2. eine nicht ganz entfernt liegende Aussicht auf eine spürbare positive Einwirkung auf den Krankheitsverlauf oder auf schwerwiegende Symptome besteht.
Seither dürfen auch getrocknete Cannabisblüten und Extrakte in pharmazeutischer Qualität im medizinischen Kontext verordnet werden. Neben den Fertigarzneimitteln Canemes® (Nabilon) und Sativex® (Oromukosalspray mit ethanolischem Cannabisextrakt – CBD:THC 2,5:2,7 mg/Hub) stehen die NRF-Rezepturen mit Dronabinol (NRF 22.7 – Kapseln; NRF 22.8 ölige Tropfen; NRF 22.16 ethanolische Inhalationslösung) sowie die Zubereitungen der Cannabisblüten (NRF 22.12/13 zur Inhalation nach Verdampfung; NRF 22.14/15 zur Teezubereitung) zur Verfügung [21]. Weiterhin können von der FDA zugelassene Fertigarzneimittel nach § 73 (3) Arzneimittelgesetz (AMG) einzeln importiert werden, die preislich zunächst unterhalb der NRF-Zubereitungen liegen, deren Einfuhr jedoch mehrere Wochen dauert und die im Ergebnis durch Gebühren und Zölle teurer als die NRF-Rezepturen werden. Die CBD-Lösung des NRF sowie Epidyolex® fallen nicht unter die Regelungen des § 31 (6) SGB V, CBD-reiche bzw. THC-arme Cannabisblüten hingegen schon, was eine Regelungslücke in der Gesetzgebung darstellt. Eine Begleitforschung der BOPST soll Erkenntnisse der nunmehr in großem Umfang möglichen Verordnung von Cannabinoid-basierten Arzneimitteln ohne Beschränkung von Indikationen oder arzneimittelrechtliche Zulassungen (No- bzw. Off-Label-Use) liefern. Der G-BA wird mit Hilfe dieser Daten über Art und Umfang der zukünftigen Kostenübernahme der GKV im Jahr 2022 eine Nutzenbewertung durchführen [22].
Off-Label-/No-Label-Use: Haftung und Risiken
Unter Off-Label-Use versteht man die Anwendung zugelassener Arzneimittel, im Fall von Cannabinoid-basierten Arzneimitteln also Canemes® und Sativex®, außerhalb der in klinischen Studien nachgewiesenen und behördlich genehmigten Anwendungsgebiete. Von No-Label-Use spricht man analog bei (noch) nicht zugelassenen Arzneimitteln [23]. In beiden Fällen tragen die verordnenden Ärztinnen und Ärzte eine große Verantwortung, weil im Schadensfall kein pharmazeutischer Unternehmer nach § 84 AMG für das Produkt haftet, sondern die Mediziner selbst mit ihrem Privatvermögen für eventuell auftretende schädliche Folgen der Therapie aufkommen müssten. Bei Cannabinoid-basierten Arzneimitteln und bei der Inhalation der Cannabisblüten zu medizinischen Zwecken bzw. dem Freizeitkonsum werden aktuell als mögliche gravierende Risiken Herzinfarkt, Vorhofflimmern sowie Schlaganfall von der amerikanischen Herzgesellschaft diskutiert und weitere Langzeitstudien als dringend notwendig gefordert [24]. Auf die mögliche Induktion einer Psychose bei Cannabisblüten mit hohem THC-Gehalt sowie synthetischen Cannabinoiden deutet eine aktuelle Längsschnittanalyse von Behandlungsfällen in der Psychiatrie der Jahre 2011 bis 2019 hin, deren Autoren auch einen Zusammenhang mit der „Verharmlosung der Risiken“ im Kontext der neuen Verordnungsmöglichkeiten sehen [25]. Auf die Gefahren systemischer Aspergillosen nach Inhalation von Cannabisblüten, insbesondere bei immunsupprimierten Patienten, wies der Apotheker Markus Hanl im Rahmen eines Industriesymposiums des Blütenproduzenten Tilray auf der Expopharm 2021 hin [26]. Auch finden sich in PubMed seit den 1970er-Jahren entsprechende Einzelfallberichte mit teils fatalem Ausgang [27, 28, 29, 30].
Abb. 2: Cannabinoid-basierte Arzneimittel im Kontext des § 31 (6) SGB V. Cannabidiol fällt zwar nicht darunter, wird der Vollständigkeit halber jedoch an dieser Stelle auch gelistet, nach [36]. CINV: Chemotherapie-induzierte Nausea und Emesis.
Die Apotheken sollten im Rahmen der Eingangsprüfung der Cannabisblüten unbedingt auf die ausschließliche Nutzung von nach der Verordnung über radioaktive oder mit ionisierenden Strahlen behandelte Arzneimittel (AMRadV) bestrahlten Sorten sowie die Einhaltung der mikrobiologischen Reinheit nach Ph. Eur. Monographie 5.1.4 achten. Cannabisblüten, die im Prüfzertifikat nach Ph. Eur. Monographie 5.1.8 A/B/C geprüft wurden, dürfen ausschließlich zur Teezubereitung bzw. Herstellung von Extrakten in Verkehr gebracht werden. Bei immunsupprimierten Patienten sollten besser orale Darreichungsformen Cannabinoid-basierter Arzneimittel zum Einsatz kommen [28].
Zurückhaltung der Ärzte und GKV
Diese möglichen Risiken und keineswegs ausreichend vorliegende Daten aus methodisch akzeptablen Therapiestudien erklären auch, weshalb nicht alle Ärzte Cannabinoid-basierte Arzneimittel verordnen und Kostenträger nicht alle Anträge bewilligen, was in Internetforen häufig bemängelt wird, allerdings ohne Angabe einer belastbaren Evidenz. Auffällig ist in diesem Zusammenhang, dass in verschiedenen Versorgungsanalysen bis zu zehnmal häufiger junge Männer als Frauen der gleichen Altersstufe 20 bis 30 Jahre Verordnungen von „medizinischem Cannabis“ erhalten (vielleicht, weil sie vor der Cannabis-Verordnungszeit eher an diesen Konsum gewöhnt waren?), in Einzelfällen bis zu 20 g Blüten als Tagesdosis [36, 38, 40].
Für eine Kostenübernahme der GKV im Off-Label-Use bestehen normalerweise stringente Vorgaben, die im § 35c SGB V sowie der Anlage VI der Arzneimittelrichtlinie des G-BA näher definiert werden. Expertengruppen beim BfArM unterstützen den G-BA und der Medizinische Dienst (MD) hat eine eigene Begutachtungsrichtlinie hierzu [31, 32, 33]. In diesem Kontext wundert es nicht, dass Patienten in Folge des medialen Hypes mit unausgewogener, einseitig positiver Berichterstattung über Cannabinoid-basierte Arzneimittel einerseits [34], MD und Kostenträger andererseits [35] ein unterschiedliches Verständnis des § 31 (6) SGB V haben, insbesondere was eine „schwerwiegende Erkrankung“ ist. Sozialgerichte mussten bisher in über hundert Fällen urteilen, ob Cannabinoid-basierte Arzneimittel im Einzelfall nun unter den Leistungsanspruch des SGB V fallen [36].
Um Patienten zu schützen und eine besser erforschte und länger etablierte Therapie nicht vorzuenthalten, wurde im § 31 (6) SGB V der Genehmigungsvorbehalt etabliert. Die Leistungen im Off- und No-Label-Bereich müssen vor Beginn der Therapie gesondert beantragt werden. Sehr häufig schalten die Kostenträger die Medizinischen Dienste, vormals MDK, zur Begutachtung im Einzelfall ein. Gerade Pharmakotherapien ohne arzneimittelrechtliche Zulassungen wohnt ein höheres Risiko inne. Weder liegen Fach- und Gebrauchsinformationen vor, noch erfolgt eine behördlich überwachte Erfassung von unerwünschten Arzneimittelwirkungen mittels systematischer Pharmakovigilanz, wie es bei Fertigarzneimitteln im In-Label-Use in Form der Periodic Safety Update Reports (PSURs) binnen der ersten Jahren nach Markteintritt der Fall wäre. Somit ist bei den Risiken derartiger Pharmakotherapien von einem Underreporting bzw. Dunkelfeld auszugehen. Die Erfassung dieser Risiken im Rahmen der Begleitforschung der BOPST beinhaltet nur die in dieser Studie eingeschlossenen Patientinnen und Patienten und nicht die Gesamtheit. Für Cannabis listet die Internetseite www.drugs.com 388 Interaktionen auf, hierunter 26 schwerwiegende und 362 moderate, die derzeit bei Interaktionsprüfungen beachtet werden müss(t)en [37]. Auch sollten die CYP(1A2, 2C9, 2C19, 2D6, 3A4)-bedingten möglichen Interaktionen von CBD und THC berücksichtigt werden [24].
Vorläufiges Fazit
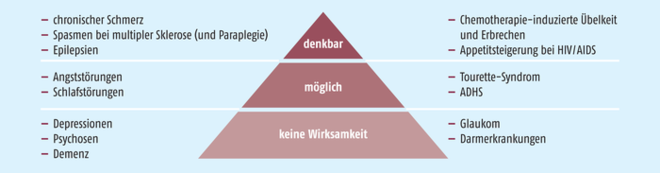
Es fällt auf, dass häufig nur von „medizinischem Cannabis“ die Rede ist, jedoch dezidierte Angaben zum tatsächlich in Studien genutzten Produkt, der Applikationsform, dessen Wirkstoffgehalt und Terpen-Profil oftmals fehlen, sodass sich in der Praxis die Frage stellt, wie die Ergebnisse im klinischen Alltag reproduziert werden könn(t)en? Im ersten Cannabis-Report wurde daher die Evidenz der beanspruchten Indikationen analysiert (s. Abb. 3) [38]. Auch liegt inzwischen die vom Bundesministerium für Bildung und Forschung geförderte Studie CaPRis vor [39].
Abb. 3: Bei der Anwendung von medizinischem Cannabis genannte Indikationen und deren Bewertung, nach [38]
Im Ergebnis wurden mit den neuen Regelungen nach § 31 (6) SGB V alle regulären Standards, das heißt Arzneimittelzulassung, eine zum Markteintritt zeitnahe frühe Nutzenbewertung des G-BA sowie strukturierte Pharmakovigilanz im Gesetzgebungsverfahren nicht ausreichend gewürdigt. Dennoch steigen die Ausgaben Cannabinoid-basierter Arzneimittel in der GKV von 26,7 Mio. Euro in 2017 um den Faktor 6,5 auf ca. 173,5 Mio. Euro im Jahr 2021 deutlich an, wobei der Anteil der Blüten in den Jahren 2019 bis 2021 immer über 40 Prozent lag [41, 42].
Zu wünschen bleibt daher ein verantwortungsvoller Umgang mit der Therapieoption Cannabinoid-basierter Arzneimittel und eine arzneimittelrechtliche Zulassung für alle Produkte in den jeweils beanspruchten Indikationen inklusive einer konsequenten Nutzenbewertung seitens des G-BA. In diesem Zusammenhang sei auch auf den im Jahr 2019 veröffentlichten Appell von Prof. Winfried Häuser mit Kolleginnen und Kollegen hingewiesen, der sich an Journalisten, Ärzte und Politiker richtet und fordert, verantwortungsvoll über den Einsatz von Medizinalcannabis zu berichten, Cannabis-Präparate umsichtig zu verschreiben und Daten nach den Standards der evidenzbasierten Medizin zu berücksichtigen [34]. Schließlich ist auch „medizinisches“ Cannabis kein Wundermittel. |
Erklärung
Die Autoren haben von der Mobil Krankenkasse (früher BKK Mobil Oil) eine finanzielle Forschungsunterstützung für die Erstellung des Cannabis-Reports 2020 erhalten. Weiterhin hat die Techniker Krankenkasse G. Glaeske eine finanzielle Forschungsunterstützung für die Erstellung des Cannabis-Reports im Jahr 2018 gewährt.
Literatur
[1] Bundesanzeiger. (2017). Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften. https://www.bgbl.de/xaver/bgbl/text.xav?SID=&tf=xaver.component.Text_0&tocf=&qmf=&hlf=xaver.component.Hitlist_0&bk=bgbl&start=%2F%2F*%5B%40node_id%3D%27943352%27%5D&skin=pdf&tlevel=-2&nohist=1&sinst=8AEAA2D5, letzter Zugriff: 25.02.2022.
[2] DAB EB. (1948). Ergänzungsbuch zum Deutschen Arzneibuch – Sechste Ausgabe (Erg.-B. 6): Neudruck 1948. https://publikationsserver.tu-braunschweig.de/receive/dbbs_mods_00036856, letzter Zugriff: 25.02.2022.
[3] Gesetz zur Neuordnung des Betäubungsmittelrechts Bundesgesetzblatt 681f, Bundesministerium für Jugend, Familie und Gesundheit; Bundesministerium für Justiz 28.07.1981, letzter Zugriff: 25.02.2022.
[4] FDA. (1985b). Marinol - Review: Approval - Priority Orphan. https://www.accessdata.fda.gov/drugsatfda_docs/nda/pre96/018651Orig1s000rev.pdf, letzter Zugriff: 25.02.2022.
[5] FDA. (2022). Drugs@FDA: FDA-Approved Drugs: Search Results for “dronabinol”. Dronabinol; Marinol; Syndros. https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process, letzter Zugriff: 25.02.2022.
[6] FDA. (1985a). Cesamet - Review: Approval - Standard. https://www.accessdata.fda.gov/drugsatfda_docs/nda/pre96/018677Orig1s000rev.pdf, letzter Zugriff: 25.02.2022.
[7] BfArM. (1988). Cesametic 1 mg: AMIce-ÖFF/Arzneimittel. https://portal.dimdi.de/amguifree/am/docoutput/jpadocdisplay.xhtml?globalDocId=2BB4A788C1074E3FBC59EB1A8A3367D0&directdisplay=true&docid=7, letzter Zugriff: 25.02.2022.
[8] DAC/NRF. (2021a). 22 – Psychopharmaka, Neurologika. https://dacnrf.pharmazeutische-zeitung.de/, letzter Zugriff: 25.02.2022.
[9] G-BA. (2017). Nutzenbewertungsverfahren zum Wirkstoff Extrakt aus Cannabis Sativa. https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/13/#beschluesse, letzter Zugriff: 25.02.2022.
[10] G-BA. (2018). Nutzenbewertungsverfahren zum Wirkstoff Extrakt aus Cannabis Sativa: (Neubewertung nach Fristablauf: Spastik bei Multiple Sklerose). https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/362/#beschluesse, letzter Zugriff: 25.02.2022.
[11] G-BA. (2020a). Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V Cannabidiol (Dravet-Syndrom, >/= 2 Jahre): D484. https://www.g-ba.de/downloads/39-261-4244/2020-04-02_AM-RL-XII_Cannabidiol_D-484_BAnz.pdf, letzter Zugriff: 25.02.2022.
[12] G-BA. (2020b). Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach §35a SGB V Cannabidiol (Lennox-Gastaut-Syndrom, >/= 2 Jahre): D-485. https://www.g-ba.de/downloads/39-261-4246/2020-04-02_AM-RL-XII_Cannabidiol-Lennox-Gastaut_D-485_BAnz.pdf, letzter Zugriff: 25.02.2022.
[13] G-BA. (2021a). Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach §35a SGB V – Cannabidiol (neues Anwendungsgebiet: Krampfanfälle im Zusammenhang mit Tuberöser Sklerose, >/= 2 Jahre, adjuvante Behandlung): D-683. https://www.g-ba.de/downloads/39-261-5109/2021-11-04_AM-RL-XII_Cannabidiol_D-683_BAnz.pdf, letzter Zugriff: 25.02.2022.
[14] G-BA. (2021b). Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V Cannabidiol – Neubewertung nach Fristablauf (Dravet-Syndrom, >/= 2 Jahre, Kombination mit Clobazam): D-595. https://www.g-ba.de/downloads/39-261-4789/2021-04-15_AM-RL-XII_Cannabidiol_D-595_BAnz.pdf, letzter Zugriff: 25.02.2022.
[15] G-BA. (2021c). Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V Cannabidiol – Neubewertung nach Fristablauf (Lennox-Gastaut-Syndrom, >/= 2 Jahre, Kombination mit Clobazam): D-596. https://www.g-ba.de/downloads/39-261-4790/2021-04-15_AM-RL-XII_Cannabidiol-LGS_D-596_BAnz.pdf, letzter Zugriff: 25.02.2022.
[16] BfArM. (2015). Canemes: AMIce-ÖFF/Arzneimittel. https://portal.dimdi.de/amguifree/am/docoutput/jpadocdisplay.xhtml, letzter Zugriff: 25.02.2022.
[17] apotheke adhoc. (2018). Bionorica scheitert mit Klage. https://www.apotheke-adhoc.de/nachrichten/detail/markt/bionorica-scheitert-mit-klage-cannabis-medikamente/, letzter Zugriff: 25.02.2022.
[18] BVerwG Urteil vom 19.05.2008; 3 C 17 – Erlaubnis zum Erwerb von Cannabis zu medizinischen Zwecken – Vorinstanz VG 7K 1979/01. https://www.bverwg.de/de/190505U3C17.04.0, letzter Zugriff: 25.02.2022.
[19] BVerwG Urteil vom 24.05.2013; 3 B 14.13 – Eigenanbau von Cannabis zu therapeutischen Zwecken gem. § 3 Abs. 2 BtmG. https://www.bverwg.de/de/240513B3B14.13.0, letzter Zugriff: 25.02.2022.
[20] Dr. Peter Cremer-Schaeffer (2016, Juni) . Cannabis als Arzneimittel: Fakten und Herausforderungen. ABDA, Berlin. https://www.abda.de/fileadmin/user_upload/assets/Pressetermine/2016/Symposium_Cannabis/Cannabis-Symposium_Praesentation_Cremer-Schaeffer.pdf, letzter Zugriff: 25.02.2022.
[21] DAC/NRF – 22-Psychopharmaka, Neurologika; Avoxa – Mediengruppe Deutscher Apotheker GmbH; https://dacnrf.pharmazeutische-zeitung.de, letzter Zugriff: 25.02.2022.
[22] Verordnung über die Begleiterhebung nach § 31 Absatz 6 des Fünften Buches Sozialgesetzbuch (Cannabis-Begleiterhebungs-Verordnung – CanBV), Bundesministerium für Gesundheit 23.03.2017, letzter Zugriff: 25.02.2022.
[23] KV BW. (2021). Arzneimittelverordnung im Off-Label-Use: Was ist zu beachten?: Prüfticker – Arzneimittel. Verordnungsforum, 17(56), 21–27. https://www.kvbw-admin.de/api/download.php?id=3861, letzter Zugriff: 25.02.2022.
[24] Page, R. L; Allen, L A; Kloner, R A; Carriker, C R; Martel, C; Morris, A A., Saucedo, J F. (2020). Medical Marijuana, Recreational Cannabis, and Cardiovascular Health: A Scientific Statement From the American Heart Association. Circulation, 142(10), e131-e152. https://doi.org/10.1161/CIR.0000000000000883
[25] Gahr, M, Ziller, J, Keller, F, & Schönfeldt-Lecuona, C. (2020). Increasing Proportion of Cannabinoid-Associated Psychotic Disorders: Results of a Single-Center Analysis of Treatment Data From 2011 to 2019. Journal of clinical psychopharmacology, 40(6), 642–645. https://doi.org/10.1097/JCP.0000000000001278
[26] Jäger-Becker, D. (2021). Qualitätsunterschiede bei Cannabisblüten. Schmerzmedizin, 37(6), 75. https://doi.org/10.1007/s00940-021-3236-9
[27] Remington, T L, Fuller, J, & Chiu, I. (2015). Chronic necrotizing pulmonary aspergillosis in a patient with diabetes and marijuana use. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne, 187(17), 1305–1308. https://doi.org/10.1503/cmaj.141412
[28] Ruchlemer, R, Amit-Kohn, M, Raveh, D, & Hanuš, L. (2015). Inhaled medicinal cannabis and the immunocompromised patient. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 23(3), 819–822. https://doi.org/10.1007/s00520-014-2429-3
[29] Vethanayagam, D, Saad, E, & Yehya, J. (2016). Aspergillosis spores and medical marijuana. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne, 188(3), 217. https://doi.org/10.1503/cmaj.1150081
[30] Waisglass, B R. (2015). Aspergillosis spores and medical marijuana. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne, 187(14), 1077. https://doi.org/10.1503/cmaj.1150062
[31] BfArM. (2021). Expertengruppe Off-Label: Anwendung von Arzneimitteln außerhalb des zugelassenen Indikationsbereiches. https://www.bfarm.de/DE/Arzneimittel/Zulassung/Zulassungsrelevante-Themen/Expertengruppen-Off-Label/_artikel.html, letzter Zugriff: 25.02.2022.
[32] G-BA. (2022). Arzneimittelrichtlinie -Anlage VI: Off-Label-Use. https://www.g-ba.de/richtlinien/anlage/15/, letzter Zugriff: 25.02.2022.
[33] MD. (2008). Off-Label-Use: Hinweise zur Begutachtung zur internen Verwendung durch die MDK-Gutachter. https://md-bund.de/fileadmin/dokumente/Publikationen/GKV/Begutachtungsgrundlagen_GKV/02_SEG6_Hinweise_off-label_2008.pdf, letzter Zugriff: 25.02.2022.
[34] Häuser, W, Hoch, E, Petzke, F, Thomasius, R, Radbruch, L, Batra, A., Havemann-Reinecke, U. (2019). Medizinalcannabis und cannabisbasierte Arzneimittel: Ein Appell an Ärzte, Journalisten, Krankenkassen und Politiker für einen verantwortungsvollen Umgang [Medicinal cannabis and cannabis-based medication: an appeal to physicians, journalists, health insurances, and politicians for their responsible handling]. Schmerz (Berlin, Germany), 33(5), 466–470. https://doi.org/10.1007/s00482-019-00409-0
[35] MD Bund. (2020). Sozialmedizinische Begutachtung von Cannabinoiden nach § 31 Absatz 6 SGB V: Begutachtungsanleitung Richtlinie des GKV-Spitzenverbandes nach § 282 SGB V. https://md-bund.de/fileadmin/dokumente/Publikationen/GKV/Begutachtungsgrundlagen_GKV/BGA_Cannabis_10_02_2020.PDF, letzter Zugriff: 25.02.2022.
[36] Glaeske, G., & Muth, L. (2021). Cannabis-Report 2020. https://www.socium.uni-bremen.de/uploads/Mitarbeiter/GerdGlaeske/Cannabis_Report_2020/Cannabis-Report_2020_Deckblatt.pdf, letzter Zugriff: 25.02.2022.
[37] Drugs.com. (2022). Cannabis Interactions: Medications known to interact with cannabis. https://www.drugs.com/drug-interactions/cannabis-index.html, letzter Zugriff: 25.02.2022.
[38] Glaeske, G., Maier, C., & Sauer, K. (2018). Cannabis-Report. https://www.socium.uni-bremen.de/uploads/News/2018/180523_Cannabis-Report.pdf, letzter Zugriff: 25.02.2022.
[39] Hoch, E.; Friemel, C.; Schneider, M.; Cannabis: Potenzial und Risiko – eine wissenschaftliche Bestandsaufnahme; 2019; Springer; Berlin, Heidelberg; https://doi.org/10.1007/978-3-662-57291-7; letzter Zugiff: 25.02.2022
[40] Marschall, U., L‘hoest, H., & Hennig, B. (2018). Heilsbringer Cannabis – wirklich ein Segen für die Schmerzmedizin?: Gesundheitswesen aktuell 2018 - Beiträge und Analysen. https://www.barmer.de/blob/165626/8ca56b2d83992b891bdff6f3eec01c93/data/barmer-gw-aktuell-2018-12-heilsbringer-cannabis---wirklich-ein-segen-fuer-die-schmerzmedizin-.pdf, letzter Zugriff: 25.02.2022.
[41] GKV-GAMSI (2019). Bruttoumsätze und Verordnungen von Cannabinoidhaltigen Fertigarzneimitteln und Zubereitungen von Januar bis Dezember 2018. 2019. https://www.gkv-gamsi.de/media/dokumente/quartalsberichte/2018/q4_19/Bundesbericht_GAmSi_201812_konsolidiert_Sonderbeilage_Cannabis.pdf, letzter Zugriff: 25.02.2022.
[42] GKV-GAMSI (2022). Bruttoumsätze und Verordnungen von Cannabinoidhaltigen Fertigarzneimittel und Zubereitungen von Januar bis September 2021. 2022. https://www.gkv-gamsi.de/media/dokumente/quartalsberichte/2021/q3_25/Bundesbericht_GAmSi_202109_konsolidiert_Sonderbeilage_Cannabis.pdf, letzter Zugriff: 25.02.2022.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.