
- DAZ.online
- DAZ / AZ
- DAZ 52/2021
- Neue Arzneimittel 2021
Neue Arzneimittel
Neue Arzneimittel 2021
Informationen zu neuen Wirkstoffen
In der monatlich erscheinenden Beilage „Neue Arzneimittel“ stellt Apothekerin Monika Neubeck alle neuen Wirkstoffe ausführlich vor und ordnet sie in die bestehenden Therapieoptionen ein. Ein Archiv mit den seit 2000 eingeführten Wirkstoffen finden Sie auf DAZ.online unter www.deutsche-apotheker-zeitung.de im Bereich „Pharmazie“. Oder Sie geben in die Suchfunktion auf DAZ.online den Webcode P7YV8 ein und gelangen direkt zur Übersichtsseite der „Neuen Arzneimittel“. Dort können Abonnenten nach Wirkstoffnamen, Handelsbezeichnung, Einführungsjahr oder ATC-Code suchen.
Antianämika
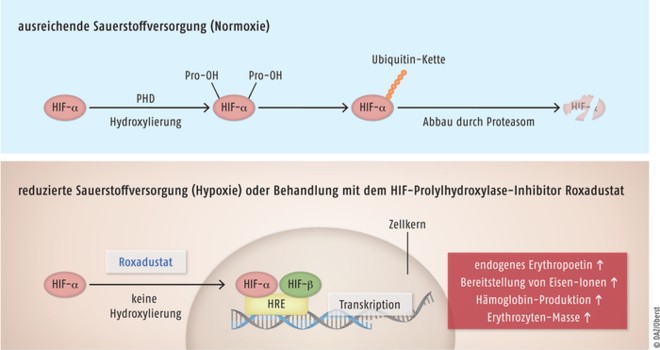
Roxadustat
Für die Behandlung einer symptomatischen Anämie bei Patienten mit chronischer Nierenerkrankung steht der Hypoxie-induzierbarer-Faktor-Prolylhydroxylase-Inhibitor (HIF-PHI) Roxadustat (Evrenzo®) zur Verfügung. Unter physiologischen Bedingungen – bei guter Versorgung des Gewebes mit Sauerstoff – wird der Hypoxie-induzierbare Faktor (HIF) mit Hilfe des Enzyms HIF-Prolylhydroxylase markiert, sodass es durch das Proteasom zerstört werden kann. So werden Signale verhindert, die zu einer verstärkten Bildung von Erythrozyten führen. Bei einer Hypoxie wird die Prolylhydroxylase dagegen gehemmt, da das Co-Substrat Sauerstoff nicht zur Verfügung steht. Als Folge steigen dadurch der HIF-Spiegel und die Erythropoese nimmt zu. So reagiert der Körper auf eine Unterversorgung der Zellen mit Sauerstoff. Diese adaptive Hypoxie-Antwort kann durch den Hypoxie-induzierbarer-Faktor-Prolylhydroxylase-Inhibitor Roxadustat imitiert bzw. verstärkt werden. Bei Anämie-Patienten wird damit eine Aktivierung des HIF-Signalwegs erreicht und somit die Produktion von endogenem Erythropoetin gesteigert. Folgen sind eine erhöhte Bereitstellung von Eisen-Ionen, eine verstärkte Hämoglobin-Produktion und die Zunahme der Erythrozyten-Masse. Dieser Mechanismus von Roxadustat ist zwar innovativ, aber in klinischen Studien hat sich die Substanz gegenüber Erythropoese-stimulierenden Substanzen wie Darbepoetin lediglich als ebenbürtig, nicht jedoch überlegen gezeigt. Daher wird es insgesamt als mäßiger therapeutischer Fortschritt eingeordnet. Ein gewisser Vorteil des HIF-Prolylhydroxylase-Inhibitors ist, dass er peroral verfügbar ist und nicht wie die direkten Erythropoetin-Abkömmlinge subkutan oder intravenös appliziert werden muss.
Roxadustat Bei ausreichender Sauerstoffversorgung wird die α-Untereinheit des Hypoxie-induzierbaren Faktors (HIF-α) durch das Enzym HIF-Prolylhydroxylase (PHD) an zwei Prolin-Aminosäuren hydroxyliert. Das entstehende Produkt wird mit einer Ubiquitin-Kette markiert und nachfolgend vom Proteasom abgebaut (oben). Bei Hypoxie oder dem Einsatz des Hypoxie-induzierbarer-Faktor-Prolylhydroxylase-Inhibitors Roxadustat findet keine Hydroxylierung von HIF-α statt. Das unveränderte HIF-α gelangt in den Zellkern und bildet mit HIF-β ein Heterodimer. Der Transkriptionsfaktor löst über die Bindung an sogenannte Hypoxia Response Elements (HRE) die Expression von an der Erythropoese beteiligten Genen aus (unten).
Antibiotika
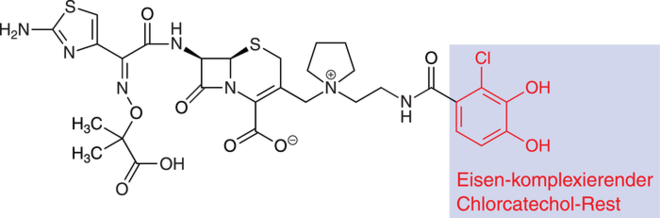
Cefiderocol
Cefiderocol Der rot markierte Siderophor-Anteil kann freie Eisen-Ionen binden und bietet zusätzliche Stabilität gegen β-Lactamasen.
Zur Behandlung von Infektionen durch aerobe gramnegative Erreger, für die nur (noch) begrenzte Therapiemöglichkeiten zur Verfügung stehen, wurde Cefiderocol (Fetcroja®) eingeführt. Das Cephalosporin-Antibiotikum wird ausschließlich intravenös appliziert und ist z. B. für die Behandlung von schweren Harnwegsinfektionen oder nosokomialen Pneumonien erprobt. Die bakterizide Wirkung beruht wie bei allen Cephalosporin- bzw. β-Lactam-Antibiotika auf einer Bindung an Penicillin-bindende Proteine: Die Peptidoglycan-Synthese in der bakteriellen Zellwand wird gehemmt und die Zelle stirbt. Anders als herkömmliche Substanzen ist Cefiderocol jedoch ein sogenanntes Siderophor-Cephalosporin. Siderophore sind Eisen-bindende Verbindungen, die von Bakterien, Pilzen und Pflanzen gebildet und in das umgebende Medium ausgeschieden werden. Hier werden mit extrazellulär vorliegenden, dreiwertigen Eisen-Ionen Komplexe gebildet, die nun mittels spezifischer Transportsysteme zusammen mit den Siderophoren wieder in die Zellen der Produzenten aufgenommen werden. Diesen Mechanismus nutzt auch Cefiderocol. Es gelangt nicht nur durch passive Diffusion durch Porin-Kanäle der äußeren Bakterien-Membran zum Wirkort, sondern bindet auch über seinen Chlorcatechol-Substituenten an extrazelluläres freies Eisen. Der aktive Transport über das Eisen-Siderophor-Aufnahmesystem in den periplasmatischen Raum soll zu einer verstärkten Wirkung gegen gramnegative Bakterien führen. Gegen grampositive oder anaerobe Bakterien wirkt Cefiderocol nur gering bis gar nicht. Zwar kann dieser Wirkmechanismus des Siderophor-Cephalosporins durchaus als innovativ eingeschätzt werden, aber es stellt nach derzeitigem Kenntnisstand allenfalls einen mäßigen therapeutischen Fortschritt dar. In klinischen Studien konnte bislang keine Überlegenheit gegenüber etablierten Behandlungsansätzen gezeigt werden. Im Gegenteil kam es bei Patienten mit Carbapenem-Resistenz zu einer deutlich erhöhten Inzidenz von Todesfällen.
Relebactam
Für im Krankenhaus erworbene Pneumonien sowie für schwer zu behandelnde Infektionen mit aeroben gramnegativen Erregern steht mit Recarbrio® ein antibiotisches Kombinationspräparat zur Verfügung, das in fixer Kombination den β-Lactamase-Hemmer Relebactam, das Carbapenem Imipenem und den Dipeptidase-Inhibitor Cilastatin enthält. Imipenem gehört zu den Carbapenemen. Es wird in den proximalen Tubuluszellen der Nieren durch eine renale Dipeptidase rasch abgebaut. Daher verabreicht man die Substanz ausschließlich in Kombination mit dem Dipeptidase-Inhibitor Cilastatin. Dennoch wird bei schweren Infektionen häufig keine ausreichend antibiotisch wirksame Imipenem-Konzentration im Plasma und im Urin erreicht. Relebactam, ein kompetitiver, reversibler Inhibitor der Inaktivierungsenzyme, wirkt selbst nicht antimikrobiell. Jedoch verstärkt das Diazabicyclooctan die Wirkung von kombiniert eingesetztem Imipenem, indem es dessen Abbau verhindert. Obwohl eine Erweiterung der antibiotischen Therapieoptionen generell begrüßenswert ist, gilt Recarbrio® allenfalls als ein geringer therapeutischer Fortschritt. Immerhin ist die Kombination auch gegen β-Lactamasen wie die Klebsiella-pneumoniae-Carbapenemasen, Breitspektrum-β-Lactamasen und die Pseudomonas-induzierte Cephalosporinase wirksam. Dies mag als ein Vorteil gegenüber anderen Therapieansätzen mit β-Lactamase-Inhibitoren zur Behandlung schwerer bakterieller Infektionen erscheinen. Doch konnte in klinischen Studien bislang keine relevante Überlegenheit zu weiteren antibiotischen Behandlungsoptionen gezeigt werden.
Antiepileptika
Cenobamat
Erwachsene Epilepsie-Patienten, die unter fokalen Anfällen mit oder ohne sekundäre Generalisierung leiden, können mit Cenobamat (Ontozry®) behandelt werden. Die Wirkung beruht auf einem dualen Mechanismus. Das kleine Molekül ist offenbar einerseits ein positiver allosterischer Modulator von Subtypen des γ-Aminobuttersäure(GABAA)-Ionenkanals, der jedoch nicht an die Benzodiazepin-Bindungsstelle bindet. Zum anderen verstärkt Cenobamat die Inaktivierung von Natrium-Kanälen und hemmt damit die persistente Komponente des Natrium-Stroms, wodurch das wiederholte neuronale Feuern bei fokalen Anfällen reduziert wird. Für Patienten mit fokalen Anfällen mit oder ohne sekundäre Generalisierung ist Cenobamat mit seinem komplementären Wirkmechanismus als relevanter therapeutischer Fortschritt anzusehen. In klinischen Studien wurde bei mehr als der Hälfte der Teilnehmer die Zahl der Krampfanfälle halbiert. Das Nebenwirkungs- und Interaktionsspektrum entspricht etwa dem anderer Antikonvulsiva. Der Einsatz bei Kindern und Jugendlichen wird zur Zeit geprüft.
Fenfluramin
Das Dravet-Syndrom ist eine sehr selten auftretende frühkindliche Epilepsieform, die oft auf herkömmliche Therapieregime nicht anspricht. Mit Fenfluramin (Fintepla®) steht für Patienten ab zwei Jahren ein neues Add-on-Therapeutikum zu weiteren Antikonvulsiva wie Stiripentol oder Valproat zur Verfügung. Fenfluramin ist ein Prodrug, das im Körper in die Wirkform Norfenfluramin umgewandelt wird. Dieses führt zu einer Freisetzung des Neurotransmitters Serotonin und zu erhöhten Serotonin-Spiegeln im präsynaptischen Bereich. Der genaue Wirkmechanismus konnte bislang nicht geklärt werden. In den zulassungsrelevanten Studien konnte mit Fenfluramin gegenüber Placebo eine etwa 55- bis 70%ige Reduktion der monatlichen Krampfanfälle erreicht werden. Auch wenn der Wirkstoff nicht neu ist, wird er als bedeutender therapeutischer Gewinn eingeordnet. Die Substanz wurde in den 60er bis 90er Jahren des 20. Jahrhunderts in höherer Dosis mit täglich 60 mg bis 120 mg als Appetitzügler eingesetzt. 1997 wurde es aufgrund schwerwiegender kardiovaskulärer Nebenwirkungen vom Markt genommen. Beim Dravet-Syndrom werden deutlich geringere Dosen eingesetzt, sodass dieses Risiko in Kauf genommen werden kann. Dennoch sind die Patienten auf entsprechende Symptome zu überwachen.
Antivirale Mittel
Baloxavir marboxil
Baloxavir marboxil (Xofluza®) wird zur Behandlung einer unkomplizierten Influenza sowie zur Postexpositions-Prophylaxe der Erkrankung angewendet. Der Endonuklease-Inhibitor kann ab zwölf Jahren eingesetzt werden und die Dauer von Influenza-Symptomen um etwa einen Tag reduzieren. Die antivirale Wirkung von Baloxavir marboxil oder vielmehr seines pharmakologisch aktiven Metaboliten Baloxavir beruht auf einer Hemmung des Enzyms CAP-Endonuklease. Als Folge werden die Transkription der viralen RNA zu mRNA und deren Ausschleusung aus dem Zellkern inhibiert, sodass die virale Proteinbiosynthese unterbleibt. Zumindest in vitro ist Baloxavir gegen Influenza-Viren aktiv, die als resistent gegen Neuraminidase-Hemmer (Oseltamivir, Zanamivir) gelten. Baloxavir marboxil gilt als moderater therapeutischer Fortschritt, denn es greift in einem früheren Schritt der Vermehrung von Influenza-Viren als Neuraminidase-Hemmer ein und wirkt gegen Influenza-A- und -B-Viren. In klinischen Studien war es ebenso gut wirksam wie Oseltamivir. Ein Vorteil ist in der nur einmaligen Applikation zu sehen, während Neuraminidase-Inhibitoren zweimal täglich über fünf Tage appliziert werden.
Cabotegravir
Der Integrase-Strangtransfer-Inhibitor Cabotegravir (Vocabria®) wird zur Behandlung von Infektionen mit dem humanen Immundefizienz-Virus 1 (HIV-1) eingesetzt. Cabotegravir bindet an das aktive Zentrum der HIV-1-Integrase und hemmt den Strangtransfer und den Einbau des retroviralen Erbguts in die DNA der Wirtszelle. So wird der Replikationszyklus des HI-Virus unterbunden. Cabotegravir gibt es als Filmtabletten und als Depot-Injektionssuspension. Begonnen wird mit einer täglichen peroralen Therapie, nach etwa einem Monat wird auf eine intramuskuläre Applikation umgestellt. Aufgrund der langsamen Elimination des intramuskulären Depots ist im Gegensatz zu anderen viralen Wirkstoffen eine tägliche Applikation nicht nötig, was sich positiv auf Lebensqualität und Adhärenz auswirkt. Die Substanz wird stets in Kombination mit dem nichtnukleosidischen Reverse-Transkriptase-Inhibitor Rilpivirin (Rekambys®) nur alle ein oder zwei Monate von Fachpersonal intramuskulär injiziert und gilt als erste parenterale HIV-Depottherapie. Daher ist Cabotegravir als relevanter therapeutischer Fortschritt anzusehen.
Fostemsavir
Multiresistente HIV-1-Infektionen bei Erwachsenen können mit Fostemsavir (Rukobia®) behandelt werden. Sein aktiver Metabolit Temsavir bindet als Attachment-Inhibitor an die virale gp120-Untereinheit und verhindert so das Andocken des HI-Virus an CD4-Zellen und andere Immunzellen. Zur effektiven Behandlung von HIV-Infektionen werden Kombinationen aus mehreren antiviralen Wirkstoffen eingesetzt. Derzeit gilt ein Integrase-Strangtransfer-Inhibitor in Kombination mit zwei nukleosidischen bzw. nukleotidischen Reverse-Transkriptase-Inhibitoren als Therapieregime der ersten Wahl. Dennoch treten immer wieder Fälle auf, die trotz eines Präparatewechsels nicht mehr ausreichend ansprechen. In den USA sind etwa 10.000 von 1,2 Millionen HIV-Infizierten betroffen, in Deutschland nur etwa 100 Personen. Die Prognose dieser resistenten Patienten ist sehr schlecht. Der erste Attachment-Inhibitor Fostemsavir bietet für einen Teil der Menschen mit resistenter HIV-1-Infektion neue Hoffnung.
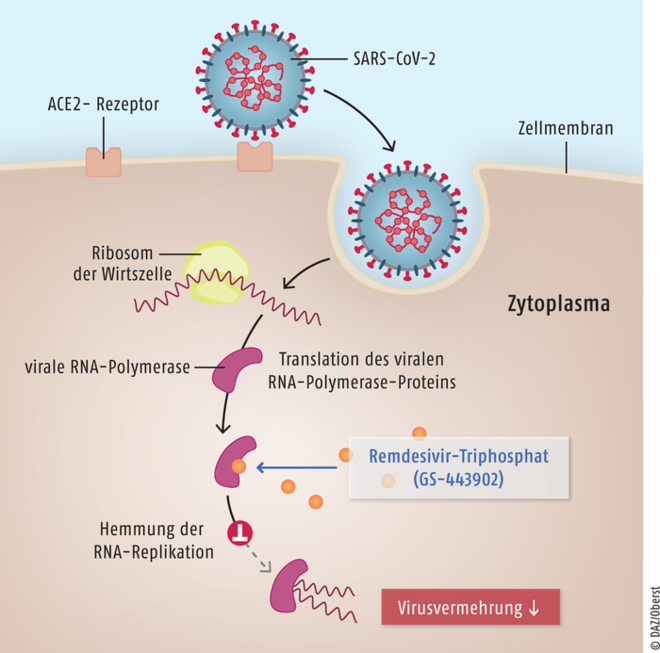
Remdesivir
Das Adenosin-Nukleotid-Prodrug Remdesivir (Veklury®) ist für die Behandlung von COVID-19-Patienten mit einer Pneumonie vorgesehen, die bei Therapiebeginn eine nichtinvasive Sauerstoffzufuhr erfordert. Remdesivir ist ein Monophosphoramidat, das in den Wirtszellen in die pharmakologisch aktive Form des Nukleosid-Triphosphat-Metaboliten GS-443902 umgewandelt wird. Als Analogon von Adenosin-Triphosphat (ATP) konkurriert Remdesivir-Triphosphat mit dem natürlichen Substrat ATP um die Integration in die entstehenden RNA-Ketten. Dies führt bei der viralen RNA-Replikation zu einer verzögerten Kettenterminierung und zum Kettenabbruch, die weitere Vermehrung des Virus in den infizierten Zellen wird unterbunden. In der Behandlung von SARS-CoV-2-Infektionen stellt Remdesivir allenfalls einen mäßigen therapeutischen Fortschritt dar. Die Substanz wurde bereits vor Jahren für die Hepatitis-C- und Ebola-Therapie entwickelt. Bei COVID-19-Infektionen war Remdesivir in der zulassungsrelevanten Studie ausschließlich für Patienten mit schwerer Erkrankung, jedoch ohne Bedarf einer invasiven Beatmung, geeignet. Für alle anderen Patienten konnte kein relevanter Unterschied zur Placebo-Behandlung festgestellt werden.
Remdesivir Das SARS-CoV-2-Virus dringt nach Andocken über den ACE2-Rezeptor in die Zelle ein. Das pharmakologisch aktive Remdesivir-Triphosphat (GS-443902) hemmt die virale RNA-Polymerase. Als Folge wird die Replikation viraler RNA unterbunden und somit die Virusvermehrung inhibiert.
Antihämorrhagika
Avatrombopag
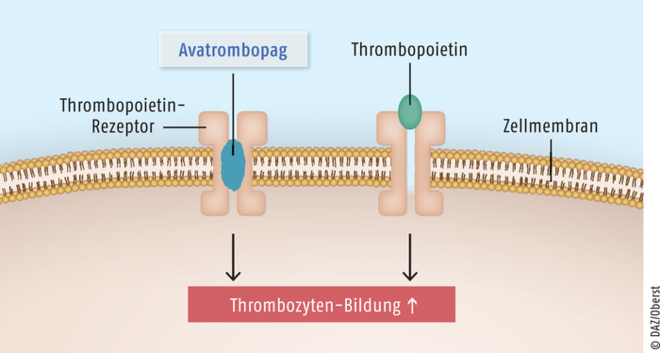
Für die Behandlung von Patienten mit schwerer Thrombozytopenie aufgrund einer chronischen Lebererkrankung und für Erwachsene mit primärer chronischer Immunthrombozytopenie ist Avatrombopag (Doptelet®) vorgesehen. Eine Immunthrombozytopenie beruht auf einer gegen Oberflächenproteine von Thrombozyten und Megakaryozyten gerichteten Autoimmunreaktion. Bei den Betroffenen fällt die Thrombozytenzahl immer wieder unter einen Grenzwert von 100.000 pro µl Blut und es kommt zu einer erhöhten Blutungsneigung. Avatrombopag ist ein oral wirksamer, kleinmolekularer Thrombopoietin-Rezeptor-Agonist. Er bewirkt eine Stimulation der Proliferation und Differenzierung von Megakaryozyten aus Knochenmarkvorläuferzellen und als Folge eine verstärkte Bildung von Thrombozyten. Das neue Avatrombopag gilt als ein gewisser therapeutischer Fortschritt. Seine Wirksamkeit wurde bislang in – allerdings relativ kurzen – placebokontrollierten Studien bestätigt. In ersten direkt vergleichenden Untersuchungen mit dem ebenfalls peroral verfügbaren Eltrombopag an Patienten mit Immunthrombozytopenien war Avatrombopag effektiver. Zudem ist die neue Substanz im Gegensatz zu Eltrombopag nicht mit Nahrungsrestriktionen assoziiert.
Avatrombopag ist ein Thrombopoetin-Rezeptor-Agonist, der die biologische Wirkung des körpereigenen Zytokins Thrombopoetin imitiert. Hierdurch kommt es zu einer verstärkten Bildung von Thrombozyten. Wirkort von Avatrombopag ist die Transmembrandomäne des Thrombopoetin-Rezeptors, sodass keine Konkurrenz mit körpereigenem Thrombopoetin stattfindet und ein additiver Effekt ermöglicht wird.
Antineoplastische Mittel
Acalabrutinib
Acalabrutinib (Calquence®) ist ein selektiver Bruton-Tyrosinkinase-Inhibitor zur Behandlung der chronisch lymphatischen Leukämie. Ein wesentlicher Stimulator bei dieser Leukämie ist der über B-Zell-Antigen- und Zytokinrezeptoren vermittelte B-Zell-Rezeptor-Signalweg, in dem die Bruton-Tyrosinkinase (BTK) eine zentrale Position einnimmt. Auch die Pathogenese anderer B-Zell-Malignome wie das Mantelzell-Lymphom, das diffus-großzellige B-Zell-Lymphom und das follikuläre Lymphom werden durch eine überaktive BTK begünstigt. Als Folge werden intrazellulär Signalwege aktiviert, die für Überleben, Proliferation, Migration, Chemotaxis und Adhäsion von B-Zellen notwendig sind. Acalabrutinib und auch sein aktiver Metabolit ACP-5862 bilden eine kovalente Bindung mit einem Cystein-Rest im aktiven Zentrum der Kinase. Diese irreversible Inaktivierung der Kaskade löst bei maligne entarteten B-Zellen verstärkt Apoptose aus. Bereits seit 2014 steht mit Ibrutinib (Imbruvica®) ein Bruton-Tyrosinkinase-Inhibitor zur Behandlung von B-Zell-Malignomen zur Verfügung. Acalabrutinib ist daher kein völlig neues Wirkprinzip. Noch liegen aber keine Resultate aus direkt vergleichenden Studien mit Ibrutinib vor, um einem der beiden Bruton-Tyrosinkinase-Inhibitoren einen Vorteil einräumen zu können.
Avapritinib
Avapritinib (Ayvakyt®) ist ein Typ-1-Kinase-Inhibitor zur Behandlung von Erwachsenen mit inoperablen oder metastasierten gastrointestinalen Stromatumoren (GIST). Die Substanz ist für Patienten geeignet, die eine Thrombozyten-Wachstumsfaktor-Rezeptor-α(PDGFRA)-D842V-Mutation aufweisen. Bei den meisten der fortgeschrittenen gastrointestinalen Stromatumoren, die resistent gegen die Standardtherapeutika Imatinib, Sunitinib und Regorafenib sind, sind diese Mutationen feststellbar. Sie führen zu einer kontinuierlichen Liganden-unabhängigen Aktivität der entsprechenden Tyrosinkinase. Durch den Typ-1-Kinase-Inhibitor Avapritinib werden die PDGFRA nachgeschalteten Signalwege inaktiviert und eine gezielte Zerstörung von gegen Standardmedikationen resistenten GIST-Zellen ermöglicht. Avapritinib erwies sich in vitro bei Zelllinien mit PDGFRA-D842V- und der verwandten KIT-D816V-Mutation als effektiv. Für genau diese Patienten stellt Avapritinib einen großen Fortschritt dar. Es wird als Monotherapeutikum eingesetzt und verlängert relevant die progressionsfreie Überlebenszeit.
Brexucabtagen Autoleucel
Für die Behandlung des rezidivierten oder refraktären Mantelzelllymphoms steht das CAR-T-Zell-Präparat Brexucabtagen Autoleucel (Tecartus®) zur Verfügung, eine für jeden Patienten individuell hergestellte „lebende“ Immunzell-Therapie auf Basis autologer T-Zellen. Das Mantelzelllymphom ist eine sehr aggressive maligne Erkrankung des lymphatischen Systems. Die Erkrankung beruht auf einer Mutation reifer B-Zellen in der inneren Mantelzone von Lymphknoten, wodurch die Zellfunktion verloren geht und eine ungebremste Vermehrung einsetzt. Trotz neuer Therapieoptionen ist derzeit keine Heilung möglich. Bei rezidiviertem oder refraktärem Mantelzelllymphom, das nicht (mehr) auf die Behandlung von Substanzen wie Fludarabin, den CD-20-Antikörper Rituximab oder Bruton-Tyrosinkinase-Inhibitoren anspricht, liegt die durchschnittliche Lebenserwartung bei sechs bis zehn Monaten. Für diese austherapierten Patienten stellt die neue CAR-T-Zelltherapie mit Brexucabtagen Autoleucel eine gewisse Hoffnung dar. Das aus T-Zellen hergestellte Präparat unterstützt das körpereigene Immunsystem bei der Bekämpfung des Lymphoms und bewirkt die Abtötung von CD19-positiven Tumorzellen. Der Wirkmechanismus ist praktisch identisch mit den seit 2018 zugelassenen weiteren CAR-T-Zell-Präparaten Tisagenlecleucel (Kymriah®) und Axicabtagen-Ciloleucel (Yescarta®). Alle CAR-T-Zell-Präparate weisen ein ähnliches Sicherheitsprofil auf und sind mit teilweise lebensbedrohlichen Nebenwirkungen assoziiert. Wie lange eine Remission durch die umprogrammierten T-Zellen anhält, ist in längerfristigen Studien zu klären. Immerhin waren in der Zulassungsstudie nach 24 Monaten noch 66,5% der Teilnehmer am Leben.
Dostarlimab
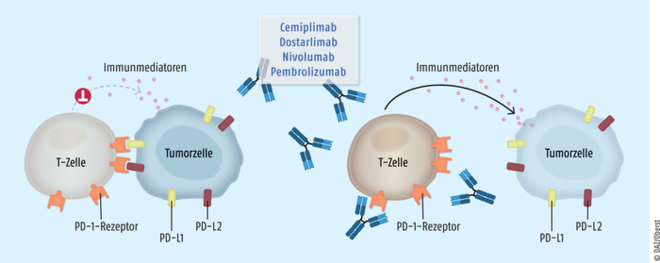
Dostarlimab (Jemperli®) ist ein gegen den Checkpoint-Rezeptor Programmed-Death-1 (PD-1) gerichteter Antikörper, der als Monotherapeutikum bei Frauen mit rezidivierendem oder fortgeschrittenem Endometriumkarzinom eingesetzt wird. Hier ist die Prognose besonders schlecht, wenn es sich, wie in etwa einem Drittel aller Fälle, um Karzinome in Zusammenhang mit einer genetisch bedingten Mismatch-Reparatur-Defizienz handelt. Hier erkennen Reparaturproteine wegen eines angeborenen Gendefekts den Einbau falscher Basen im Rahmen der DNA-Replikation nicht und führen daher keine Fehlerbehebung durch. Es entwickeln sich verstärkt höhergradige Karzinome mit häufigerer Invasivität. Der PD-1-Antikörper Dostarlimab ist die erste spezifisch für Endometriumkarzinome mit diesem Gendefekt zugelassene Therapieoption und gilt durchaus als therapeutischer Fortschritt. Der humanisierte monoklonale IgG4-Antikörper bindet hochselektiv an PD-1-Rezeptoren und verhindert deren Interaktion mit den Liganden PD-L1 und PD-L2. Als Folge wird die Hemmung der T-Zell-Funktion aufgehoben und die gegen den Tumor gerichtete Immunantwort wiederhergestellt. So können körpereigene T-Zellen die fremden Proteine in den Tumorzellen aufspüren und eliminieren. Dostarlimab hat kein vollständig neues Wirkprinzip: Mit Cemiplimab, Pembrolizumab und Nivolumab sind bereits drei weitere PD-1-Antikörper auf dem deutschen Markt verfügbar, allerdings sind sie zur Behandlung anderer Tumore zugelassen.
Dostarlimab Manche Zellen aus dem Tumor-Mikromilieu exprimieren Programmed-Death-1- und -2-Liganden (PD-L1 und PD-L2), die über eine Bindung an Programmed-Death-1-Rezeptoren (PD-1-Rezeptoren) zu einer Unterdrückung der Immunantwort von T-Zellen führen (links). Auf diese Weise schützen sich die Tumorzellen vor einer Zerstörung durch das körpereigene Immunsystem. Der Antikörper Dostarlimab bindet hochselektiv an den PD-1-Rezeptor (rechts) und unterbindet so dessen Interaktion mit den Liganden PD-L1 und -L2. Somit wird die Suppression von zytotoxischen T-Zellen aufgehoben.
Fedratinib
Patienten mit primärer Myelofibrose, Post-Polycythaemia-vera Myelofibrose oder post-essenzieller Thrombozythämie-Myelofibrose und krankheitsbedingter Splenomegalie oder anderen Erkrankungssymptomen können nun mit Fedratinib (Inrebic®) behandelt werden. Die antiproliferative Wirkung des Tyrosinkinase-Inhibitors beruht auf einer Hemmung der Januskinase 2 (JAK2). Die Januskinase 2 ist für die Myelo- und Erythropoese von Bedeutung. Mehr als die Hälfte der Myelofibrose-Erkrankungen beruht auf einer Mutation im für JAK2 codierenden Gen auf der Ebene der hämatopoetischen Stammzellen. Fedratinib ist ein Inhibitor von Wildtyp-JAK2 und mutationsaktivierter JAK2. Die inhibitorische Aktivität gegenüber den anderen Januskinasen ist geringer. Seit etwa zehn Jahren ist bei Myelofibrose-Patienten nur der duale JAK1-/JAK2-Inhibitor Ruxolitinib zugelassen. Der neue JAK2-Hemmer Fedratinib mit identischer Indikation wird als moderater therapeutischer Fortschritt eingeschätzt, eine lebensverlängernde Wirkung konnte noch nicht gezeigt werden.
Isatuximab
Der CD38-Antikörper Isatuximab (Sarclisa®) ist für die Behandlung von Erwachsenen mit rezidiviertem und refraktärem multiplem Myelom vorgesehen. Das transmembranäre Glycoprotein CD38 spielt bei der rezeptorvermittelten Zelladhäsion und der Signalübertragung eine Rolle, hat enzymatische Funktionen und auf der Oberfläche maligner hämatopoetischer Zellen, wie z. B. Multiplem-Myelom-Zellen, wird es überexprimiert. Der rekombinant hergestellte, humanisierte, monoklonale IgG1-Antikörper Isatuximab ist selektiv gegen das Glycoprotein CD38 gerichtet. Er induziert durch Aktivierung der körpereigenen komplement- und antikörperabhängigen zellvermittelten Zytotoxizität sowie der antikörperabhängigen zellulären Phagozytose eine Tumorzelllyse. Bei Patienten mit multiplem Myelom wurde weiterhin eine klonale Expansion des T-Zell-Rezeptor-Repertoires beobachtet, was auf eine adaptive Immunantwort hindeutet. Der kombiniert mit Isatuximab eingesetzte Immunmodulator Pomalidomid wirkt synergistisch und führt zu einer weiter verstärkten Lyse von CD38-exprimierenden Myelom-Zellen. Bereits seit einigen Jahren steht der CD38-Antikörper Daratumumab zur Verfügung. Damit gilt Isatuximab als weiterer Vertreter dieser Wirkstoffklasse zwar nicht als innovativer Fortschritt, allerdings wurden in der zulassungsrelevanten Studie tendenziell bessere Ansprechraten und ein längeres progressionsfreies Überleben als unter Daratumumab-Therapie nachgewiesen.
Pemigatinib
Zur Behandlung von Erwachsenen mit lokal fortgeschrittenem oder metastasiertem Cholangiokarzinom und einer FGFR2-Fusion oder einem -Rearrangement wurde Pemigatinib (Pemazyre®) eingeführt. Die Wirkung beruht auf einer selektiven Hemmung der Fibroblasten-Wachstumsfaktor-Rezeptoren 1, 2 und 3 (Fibroblast Growth Factor Receptor, FGFR). Bei einem neu diagnostizierten Cholangiokarzinom liegt die Fünf-Jahres-Überlebensrate bei weniger als 20%. Daher gilt Pemigatinib als ein gewisser therapeutischer Fortschritt. Die weiteren FGFR-Inhibitoren Erdafitinib und Rogaratinib sind bislang in Europa nicht zugelassen. Allerdings ist die Datenlage zur Wirksamkeit von Pemigatinib aufgrund der Seltenheit der Erkrankung sehr begrenzt. In längerfristigen Studien sollte die Auswirkung auf die Überlebenszeit geprüft werden.
Selpercatinib
Selpercatinib (Retsevmo®) ist ein Inhibitor der RET-Rezeptor-Tyrosinkinase, indiziert zur Behandlung von Erwachsenen mit fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom oder Schilddrüsen-Karzinom und bestimmten RET-Varianten. Die Abkürzung RET bedeutet Rearranged During Transfection, da bei bestimmten humanen Lymphomzellen während der Transfektion eine Neuanordnung der DNA-Sequenz dieses Gens beobachtet wurde. Die gezielte Ausschaltung dieser onkogenen Tyrosinkinase, die normalerweise für die embryonale Entwicklung mitverantwortlich ist, gilt als vielversprechender therapeutischer Ansatz zur Behandlung fortgeschrittener Krebserkrankungen, die nicht mehr auf Standardtherapeutika ansprechen. Bisher verfügbare Multikinase-Hemmer wie Cabozantinib, Vandetanib, Lenvatinib, Sorafenib, Alectinib und Sunitinib hemmen u. a. dieses Enzym und haben sich bei verschiedenen therapierefraktären Tumoren als wirksam erwiesen. Das neue Selpercatinib ist ein selektiver Inhibitor der RET-Rezeptor-Tyrosinkinase und der erste Wirkstoff, der gezielt bei Patienten mit Variation des RET-Gens eingesetzt wird.
Selumetinib
Kinder und Jugendliche ab drei Jahren mit symptomatischen, inoperablen plexiformen (netzartig wachsenden) Neurofibromen bei Neurofibromatose Typ 1 können mit Selumetinib (Koselugo®) behandelt werden. Der selektive Inhibitor der Mitogen-aktivierten Protein-Kinasen 1 und 2 (MEK1/2) führt zu einer Unterbrechung des Signalwegs und zu einer Rückbildung der Tumore. Die autosomal-dominant vererbte Erkrankung Neurofibromatose Typ 1 (NF-1) tritt mit einer Inzidenz von 1:3000 Geburten auf. Die bereits embryonal angelegten plexiformen Neurofibrome sind mit einer besonders schlechten Prognose assoziiert. Zwar gelten sie zunächst als gutartig, wachsen jedoch netzartig und verdrängend. In etwa 10% der Fälle kommt es durch eine maligne Entartung zu peripheren Nervenscheidentumoren, die früh metastasieren. Mit Selumetinib steht für Patienten mit inoperablen plexiformen Neurofibromen erstmals eine kausale Therapie zur Verfügung, sodass von einem relevanten therapeutischen Fortschritt ausgegangen werden kann. Durch die Hemmung des Schlüsselenzyms MEK1/2 des RAS-BRAF-MEK-ERK-Signalwegs kann der Tumor-aktivierenden Mutation unmittelbar entgegengewirkt werden.
Tucatinib
Tucatinib (Tukysa®
) ist zur Behandlung von Erwachsenen mit lokal fortgeschrittenem oder metastasiertem Brustkrebs als Drittlinien-Therapie indiziert, deren Tumor den humanen epidermalen Wachstumsfaktor-Rezeptor 2 (Human Epidermal Growth Factor Receptor 2, HER2) überexprimiert. Der reversible HER2-Tyrosinkinase-Inhibitor wird derzeit stets in Kombination mit Trastuzumab und Capecitabin eingesetzt. Bei etwa 20 bis 30% der Patienten mit Mammakarzinom ist eine vermehrte Bildung von HER2 feststellbar. Die Betroffenen haben im Vergleich zu HER2-negativen Personen einen aggressiveren Krankheitsverlauf mit erhöhter Rezidivrate, sodass eine zielgerichtete Therapie besonders wichtig ist. Mit Trastuzumab gibt es seit einigen Jahren ein gegen HER2 gerichteten Antikörper. Nach dieser sehr spezifischen Behandlung kommt es lediglich noch bei etwa 10% der Patientinnen innerhalb der ersten Jahre zu einer Rezidivbildung. Der neue Wirkstoff Tucatinib wurde entwickelt für Patienten, die ein Rezidiv erleiden bzw. für den Einsatz nach vorangegangener Behandlung mit mindestens zwei gegen HER2 gerichteten Behandlungsschemata. Die Hemmung der HER2-Tyrosinkinase ist allerdings kein innovativer therapeutischer Ansatz. Auch die Wirkung der bereits seit einiger Zeit für die gleiche Indikation im Einsatz befindlichen Tyrosinkinase-Hemmer Neratinib und Lapatinib beruhen auf diesem Mechanismus, wobei diese Wirkstoffe anders als Tucatinib nicht nur HER2, sondern auch weitere epidermale Wachstumsfaktor-Rezeptoren wie HER1 bzw. EGFR inhibieren.
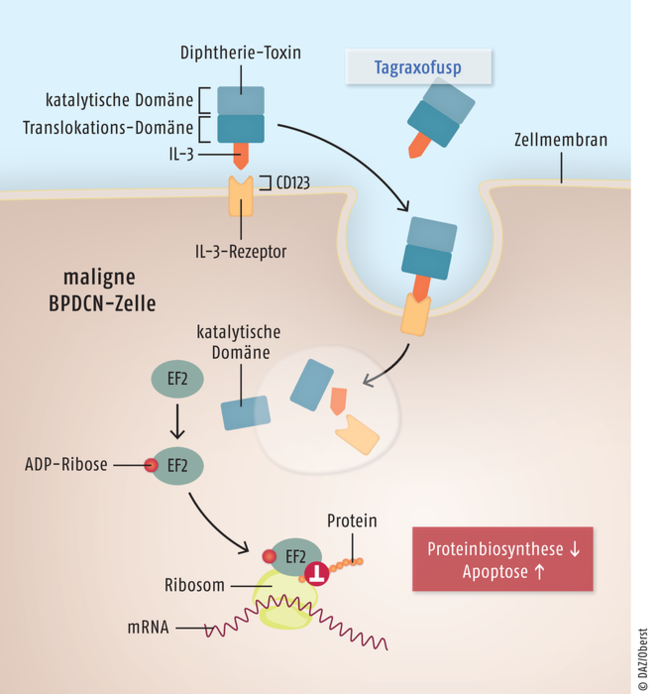
Tagraxofusp
Zur Behandlung von blastischen plasmazytoiden dendritischen Zellneoplasien wurde Tagraxofusp (Elzonris®) eingeführt. Das Fusionsprotein aus Interleukin 3 und einem Diphtherie-Toxin ist als Erstlinien-Therapeutikum für Erwachsene indiziert. Die seltene Erkrankung geht mit einer klonalen Proliferation von unreifen Vorläufern plasmozytoider dendritischer Zellen einher, die den Interleukin-3-Rezeptor (CD123) überexprimieren. Hier setzt das rekombinant hergestellte Tagraxofusp an: Das Fusionsprotein bindet mit dem IL-3-Anteil hochspezifisch an CD123 und wird zusammen mit diesem Rezeptorprotein in die maligne entarteten Zellen internalisiert. Hier wird die katalytische Domäne des Diphtherie-Toxins ins Zytoplasma freigesetzt, die eine irreversible Hemmung des ribosomalen Elongationsfaktors 2 bewirkt. Die Proteinbiosynthese unterbleibt, wird bei den CD123-positiven Zellen die Apoptose ausgelöst. Durch die Kopplung der zytotoxisch wirkenden Einheit an Interleukin ist eine gezielte Zerstörung der Tumorzellen möglich, während Körperzellen ohne den IL-3-Rezeptor weitgehend verschont bleiben. Bislang ist für das sehr aggressive hämatologische Malignom keine standardisierte Therapie etabliert. Tagraxofusp ist die erste für die Erstlinien-Therapie zugelassene Behandlung und damit als großer Fortschritt anzusehen.
Tagraxofusp ist ein Fusionsprotein aus Interleukin 3 (IL-3) und einem verkürzten Diphtherie-Toxin, bestehend aus einer katalytischen und einer Translokations-Domäne. Nach spezifischer Bindung an den Interleukin-3-Rezeptor (IL-3-R) auf CD123-positiven blastischen plasmazytoiden dendritischen Zellneoplasien (BPDCN) wird der Komplex in die Zelle aufgenommen. Die katalytische Domäne wird durch proteolytische Spaltung freigesetzt und blockiert durch Ribosylierung den Elongationsfaktor 2 (EF2), sodass in der Zelle keine Proteinbiosynthese mehr stattfindet und Apoptose ausgelöst wird.
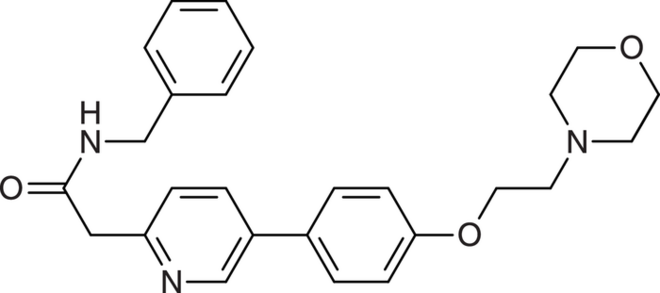
Tafasitamab
Patienten mit rezidiviertem oder refraktärem diffusem großzelligem B-Zell-Lymphom können mit dem CD19-Antikörper Tafasitamab (Minjuvi®) therapiert werden. Prä-B- und reife B-Lymphozyten exprimieren auf ihrer Oberfläche das Antigen CD19. Dieses verstärkt die Signalgebung des B-Zell-Rezeptors und beeinflusst so Aktivität und Überleben dieser wichtigen Zellen des körpereigenen Immunsystems. Bei maligne entarteten B-Zellen, wie beim diffus großzelligen B-Zell-Lymphom (DLBCL), ist das CD19-Oberflächenprotein meist überexprimiert. Die sehr aggressiv verlaufende Erkrankung, die mit einer massiven Schwächung des Immunsystems einhergeht, führt unbehandelt meist innerhalb von Wochen bis Monaten zum Tod. Der im Bereich der Fc-Region verstärkte monoklonale Antikörper Tafasitamab ist gegen das CD19-Antigen gerichtet und führt zur Lyse von B-Zellen. Ebenso kommt es zur direkten Induktion von Apoptose. Die Modifikation der Fc-Antikörper-Domäne führt zu einer verstärkten antikörperabhängigen zellulären Zytotoxizität und einer antikörperabhängigen zellulären Phagozytose. Als Folge wird eine Abnahme der maligne entarteten B-Zellen erreicht (B-Zell-Depletion). Allerdings sind auch gesunde B-Zellen von der durch Tafasitamab ausgelösten Lyse betroffen. Der Immunmodulator Lenalidomid wirkt mit dem Antikörper synergistisch und wird daher in Kombination eingesetzt. Tafasitamab gilt für bereits stark vorbehandelte Patienten mit diffus großzelligem B-Zell-Lymphom als relevanter therapeutischer Fortschritt.
Chemotherapeutikum
Tirbanibulin
Der Src-Inhibitor Tirbanibulin (Klisyri®) wird zur Feldtherapie von Erwachsenen mit nicht hyperkeratotischer, nicht hypertropher aktinischer Keratose verwendet. Die Tyrosinkinase Src aktiviert zahlreiche Proteine wie Adhäsionsproteine, Adaptorproteine und Transkriptionsfaktoren und spielt eine zentrale Rolle in der intrazellulären Signaltransduktion. Aus diesem Grund eignen sich Src-Inhibitoren wie Tirbanibulin zur Therapie von malignen Tumoren. Zusätzlich wirkt Tirbanibulin während des Zellzyklus durch direkte Bindung an das Tubulin der Mikrotubuli als Polymerisationshemmer. Die Ausbildung des Spindelapparats wird verhindert, sodass die Vermehrung proliferierender Zellen unterbrochen und Apoptose ausgelöst wird. Aufgrund dieser kombinierten antiproliferativen Wirkmechanismen führt über einmalig fünf Tage topisch appliziertes Tirbanibulin bei Patienten mit aktinischen Keratosen zum teilweisen oder vollständigen Verschwinden der Hautläsionen. Ob die topische Zubereitung auf Basis von Tirbanibulin einen therapeutischen Fortschritt darstellt, kann noch nicht endgültig beurteilt werden. Der Wirkmechanismus ist nicht innovativ, auch die Wirkung von Substanzen wie Dasatinib, Ponatinib oder Bosutinib beruht zumindest teilweise auf einer Hemmung der Tyrosinkinase Src.
Dermatika
Deoxycholsäure
Deoxycholsäure (Kybella®) wird bei Erwachsenen zur Behandlung von mittlerer bis schwerer Wölbung oder Fülle aufgrund von submentalem Fett (sogenanntes Doppelkinn) angewendet, wenn dieses eine erhebliche psychologische Belastung darstellt. Deoxycholsäure spielt im Organismus bei der Fettverdauung eine wichtige Rolle. Seine zytolytischen Eigenschaften macht man sich auch bei der Behandlung von submentalem Fett zunutze. Deoxycholsäure wird subkutan in die betroffene Region unterhalb des Kinns injiziert und zerstört im dort lokalisierten Subkutanfett die Zellmembran von Adipozyten. Nach zwei bis vier Anwendungen von Deoxycholsäure sehen die Konturen des Kinns in vielen Fällen definierter und schlanker aus.
Tralokinumab
Der IgG4-Antikörper Tralokinumab (Adtralza®) ist zur Behandlung der mittelschweren bis schweren atopischen Dermatitis bei Erwachsenen indiziert und wird in zwei- oder vierwöchigen Abständen subkutan appliziert. Als hochspezifischer Hemmstoff des Interleukin-13-Signalwegs führte er in klinischen Studien zu einer relevanten Besserung des Hautbilds und der Lebensqualität sowie von unerwünschten Symptomen wie Juckreiz und Hautinfektionen. Seit 2017 steht für Erwachsene mit mittelschwerer bis schwerer atopischer Dermatitis der spezifisch gegen die IL-4Rα-Untereinheit an Typ-I- und -II-Rezeptoren gerichtete Antikörper Dupilumab zur Verfügung, der die über IL-4 und IL-13 ausgelösten Reaktionskaskaden hemmt. Inwiefern der neue, ausschließlich gegen IL-13 gerichtete Antikörper Tralokinumab einen weiteren therapeutischen Fortschritt darstellt, ist derzeit nicht eindeutig zu beurteilen, da direkt vergleichende klinische Studien fehlen.
Herztherapie
Angiotensin II
Für die Behandlung der refraktären Hypotonie bei Erwachsenen mit einem septischen oder anderen distributiven Schock, die nicht auf eine Wiederherstellung des Volumens und die Gabe von Catecholaminen oder anderen Vasopressoren ansprechen, wurde Giapreza® eingeführt. Das intravenös verabreichte synthetische humane Angiotensin II wirkt wie körpereigenes Angiotensin II als sehr starker Vasokonstriktor.
Vericiguat
Eine symptomatische, chronische Herzinsuffizienmit reduzierter Ejektionsfraktion kann nun mit Vericiguat (Verquvo®) therapiert werden. Der Stimulator der löslichen Guanylatcyclase wird bei einem kürzlich aufgetretenen Dekompensationsereignis angewendet. Vericiguat bewirkt eine direkte Stimulation der löslichen Guanylatcyclase, sensibilisiert dieses Enzym für endogenes NO und kann zudem inaktive lösliche Guanylatcyclase reaktivieren. Als Folge wird der relative Mangel im NO-sGC-cGMP-Signalweg aufgehoben. Es kommt zu einer verstärkten Synthese von cGMP und damit zur Besserung der myokardialen und vaskulären Funktionen. Vericiguat wird in Kombination mit anderen Herzinsuffizienz-Therapeutika angewendet. Es soll zu einer Muskelrelaxation und Vasodilatation im Herz-Kreislauf-System führen und somit die Abwärtsspirale der schweren Herzinsuffizienz aufhalten. Inwiefern die Substanz einen therapeutischen Fortschritt darstellt, ist fraglich.
Hämatologika
Berotralstat
Der peroral verfügbare Plasma-Kallikrein-Inhibitor Berotralstat (Orladeyo®) wird bei hereditärem Angioödem eingesetzt. Durch die Blockade der Serinprotease wird weniger Bradykinin freigesetzt und das Entstehen der Ödemattacken verhindert. So ist eine routinemäßige Prävention wiederkehrender Erkrankungsattacken möglich, die durch mitunter lebensbedrohlichen Schwellungen und starken gastrointestinalen Beschwerden gekennzeichnet sind. 2019 wurde mit Lanadelumab ein Antikörper eingeführt, der bei hereditärem Angioödem bereits einen bedeutenden therapeutischen Fortschritt darstellte. Gut verträglich reduziert er signifikant die Anfallshäufigkeit um nahezu 90% und wird nur alle zwei bis vier Wochen prophylaktisch durch den Patienten selbst subkutan appliziert. Das neue Berotralstat ist allenfalls als geringer therapeutischer Fortschritt anzusehen. Er ist ebenfalls gegen Plasma-Kallikrein gerichtet, konnte aber in der zulassungsrelevanten Studie gegenüber Placebo lediglich eine 44%ige Reduktion der Anfallshäufigkeit erreichen. Ein gewisser Vorteil gegenüber Lanadelumab besteht in der peroralen Verfügbarkeit mit allerdings täglicher Einnahme.
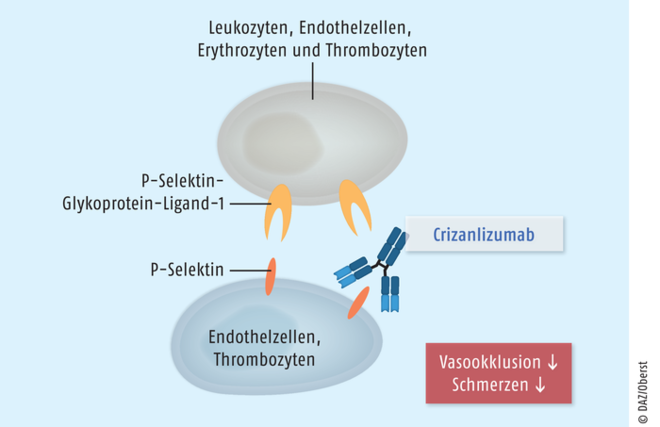
Crizanlizumab
Zur Prävention von wiederkehrenden vasookklusiven Krisen bei Patienten mit Sichelzellanämie kann der P-Selektin-Antikörper Crizanlizumab (Adakveo®) angewendet werden. Die Substanz wird im Rahmen der Erhaltungstherapie alle vier Wochen intravenös appliziert. Crizanlizumab gilt für Patienten mit Sichelzellanämie als ein bedeutender Fortschritt. Der Antikörper verhindert das Zusammenhaften von Endothelzellen, Thrombozyten, Erythrozyten und Leukozyten über das Zell-Adhäsionsmolekül P-Selektin und ist die erste Therapieoption, die die Erkrankungs-assoziierte Vasookklusion unmittelbar unterbindet. Durch die neue Therapieoption kann die Zeit bis zur in den nächsten Jahren erwarteten Markteinführung einer kausalen Gentherapie überbrückt werden.
Crizanlizumab Bei Patienten mit Sichelzellanämie kommt es immer wieder zu vasookklusiven Krisen. Auslöser dieser Gefäßverschlüsse ist das auf der Oberfläche von Endothelzellen und Thrombozyten lokalisierte und bei Sichelzellanämie-Patienten überexprimierte Adhäsionsmolekül P-Selektin. Der Antikörper Crizanlizumab ist gegen P-Selektin gerichtet und verhindert dessen Interaktion mit den zugehörigen Liganden.
CD34-positive Stammzellen
Für die Behandlung der metachromatischen Leukodystrophie wurde mit dem für jeden Patienten individuell hergestellten Präparat Libmeldy® eine langfristige kausale Therapieoption eingeführt. Die Zubereitung enthält CD34+-Stammzellen, die funktionelle Kopien des Arylsulfatase-A-Gens enthalten. Sie ist derzeit für Patienten im Säuglings- oder frühen Kindesalter vorgesehen. Insgesamt sind die Fortschritte der Gentherapien sehr zu begrüßen. Bereits 2020 wurde das Präparat Zynteglo® zur Behandlung der transfusionsabhängigen β-Thalassämie auf dem Markt eingeführt. Auch dieses Präparat enthält CD34+-Stammzellen, die zuvor dem Patienten entnommen wurden und funktionelle Kopien des fehlenden Enzyms tragen.
Immunsuppressiva
Bimekizumab
Der humanisierte monoklonale IgG1/κ-Antikörper Bimekizumab (Bimzelx®) richtet sich gegen die körpereigenen Zytokine Interleukin 17A und F. Die Substanz ist für die Erstlinien-Therapie Erwachsener mit mittelschwerer bis schwerer Plaque-Psoriasis vorgesehen, die für eine systemische Therapie infrage kommen. Bimekizumab kann durchaus als wesentlicher therapeutischer Fortschritt angesehen werden. Anders als die reinen Interleukin-17A-Antikörper Secukinumab und Ixekizumab hemmt Bimekizumab als bislang einzige Substanz zusätzlich das ebenfalls proinflammatorisch wirkende Zytokin Interleukin 17F. In den zulassungsrelevanten Studien war es gegenüber den Standardtherapeutika Ustekinumab und Adalimumab signifikant überlegen. Mit etwa 60% erreichten unter dem gut verträglichen Bimekizumab nahezu dreimal so viele Patienten eine völlige Symptomfreiheit.
Filgotinib
Für Erwachsene mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis steht mit Filgotinib (Jyseleca®) eine neue Therapieoption zur Verfügung. Der Inhibitor der Januskinase 1 (JAK1) kann als Monotherapeutikum oder in Kombination mit Methotrexat angewendet werden. In den letzten Jahren hat sich für therapierefraktäre Patienten die Hemmung der Januskinasen als ein vielversprechender Therapieansatz herauskristallisiert. Bisher waren in Europa aus dieser Wirkstoffgruppe Baricitinib, Tofacitinib und Upadacitinib zugelassen. Während die älteren Substanzen zwei bzw. drei verschiedene Januskinasen hemmen, inhibieren Filgotinib und Upadacitinib überwiegend JAK1, was zu einem verbesserten Nebenwirkungsprofil führen soll. Filgotinib wird wie die anderen JAK-Inhibitoren auch für den Einsatz bei weiteren immunvermittelten entzündlichen Erkrankungen wie Psoriasis-Arthritis, Morbus Crohn, atopischer Dermatitis, Colitis ulcerosa und Uveitis in verschiedenen Studien geprüft.
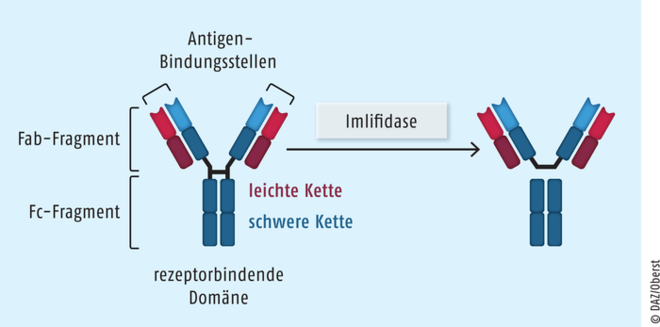
Imlifidase
Bei Nierentransplantations-Patienten mit Antikörpern, die eine positive Kreuzprobe gegen ein verfügbares Spenderorgan zeigen, ist die Chance auf eine erfolgreiche Transplantation sehr gering. Der neue Wirkstoff Imlifidase (Idefirix®) kann kurz vor dem Eingriff zur Desensibilisierung eingesetzt werden. Die Cysteinprotease bewirkt eine Abspaltung der schweren Ketten aller humanen Immunglobulin-G-Unterklassen. Dabei werden auch die gegen das Spendergewebe gerichteten Immunglobuline zerstört. Auf diese Weise gelingt eine effektive Desensibilisierung von Patienten, die bislang wegen eines positiven Kreuztests immer wieder abgelehnt wurden. In klinischen Studien konnte in den meisten Fällen eine erfolgreiche Nierentransplantation durchgeführt und die kritische Phase der ersten Monate überwunden werden. Damit gilt Imlifidase für diesen Personenkreis als ein erheblicher therapeutischer Fortschritt.
Imlifidase Die Cysteinprotease spaltet die schweren Ketten aller humanen Immunglobulin-G-Subklassen und eliminiert so die vom Fc-Anteil abhängigen Funktionen. Als Folge werden auch die gegen das Spenderorgan gerichteten spezifischen Antikörper zerstört, sodass die Transplantation der Niere mit sehr guten Erfolgsaussichten stattfinden kann.
Ofatumumab
Der monoklonale humane CD20-Antikörper Ofatumumab (Kesimpta®) ist zur Behandlung der aktiven schubförmigen multiplen Sklerose indiziert. Die Wirkung des Immunmodulators beruht auf einer Depletion von CD20-positiven B-Lymphozyten. Es kommt zu einer relevanten Reduktion der Erkrankungsprogression. Das Wirkprinzip von Ofatumumab ist allerdings nicht neu. Der bereits seit einigen Jahren verfügbare CD20-Antikörper Ocrelizumab ist ebenfalls für die Multiple-Sklerose-Behandlung zugelassen. Dieser Wirkstoff kann jedoch, anders als Ofatumumab, nicht nur bei schubförmiger Erkrankung, sondern auch bei früher primär progredienter multipler Sklerose eingesetzt werden.
Ponesimod
Zur Therapie von Erwachsenen mit schubförmig remittierender multipler Sklerose (RRMS) ist Ponesimod (Ponvory®) indiziert. Der Sphingosin-1-Phosphat(S1P)-Rezeptor-Modulator wirkt als funktioneller Antagonist am Subtyp S1P1 der insgesamt fünf S1P-assoziierten, G-Protein-gekoppelten Rezeptoren, der in erster Linie auf B- und T-Lymphozyten zu finden ist. Als Folge kommt es zu einer Internalisierung sowie zum Abbau des S1P1-Rezeptors, was zu einer Desensibilisierung der Lymphozyten gegen das Gewebshormon S1P führt. Somit verhindert Ponesimod, dass Immunzellen aus den Lymphknoten austreten und ins Zentralnervensystem gelangen. Bei den Betroffenen konnte eine signifikante Verringerung der Schubrate erreicht werden. Mit Fingolimod, Ozanimod und Siponimod sind schon S1P-Rezeptor-Modulatoren auf dem Markt, ob Ponesimod eine weitere therapeutische Verbesserung bedeutet, kann derzeit mangels direkt vergleichender klinischer Studien nicht endgültig beurteilt werden. Immerhin war es klinischen Studien gegenüber dem Standardtherapeutikum Teriflunomid überlegen.
Satralizumab
Für Patienten, die unter einer Neuromyelitis-optica-Spektrum-Erkrankung (NMOSD) leiden, steht eine neue Therapieoption zur Verfügung: Satralizumab (Enspryng®) ist Interleukin-6(IL-6)-Rezeptor-Antikörper, der bei Aquaporin-4-IgG-seropositiver schubförmiger NMOSD als Monotherapeutikum oder in Kombination mit einer immunsuppressiven Therapie eingesetzt wird. Neu ist dieser Wirkmechanismus nicht. Die bereits seit Jahren zur Behandlung der rheumatoiden Arthritis verfügbaren Substanzen Tocilizumab und Sarilumab sind ebenfalls gegen den Interleukin-6-Rezeptor gerichtet.
Mittel zur Behandlung von Suchterkrankungen
Cytisin
Das pflanzliche Chinolizidin-Alkaloid Cytisin kann zur schrittweisen Entwöhnung vom Zigarettenrauchen eingesetzt werden. Der Wirkstoff bewirkt bei entsprechend motivierten Rauchern eine Verminderung des Verlangens nach Nicotin. Die Cytisin-Wirkung beruht auf einem Agonismus an nicotinischen Acetylcholin-Rezeptoren, sie ist im Vergleich zu dem strukturell ähnlichen Alkaloid Nicotin jedoch schwächer. Mit Asmoken® ist eine dauerhafte Beendigung des Konsums Nicotin-haltiger Produkte innerhalb weniger Wochen möglich.
Mittel gegen Störungen des Muskel und Skelettsystems
Risdiplam
Risdiplam (Evrysdi®) wird bei Patienten ab einem Alter von zwei Monaten zur Behandlung der 5q-assoziierten spinalen Muskelatrophie (SMA) angewendet. Die seltene autosomal-rezessiv vererbbare Erkrankung ist durch einen fortschreitenden Untergang von Motoneuronen im Rückenmark und im unteren Hirnstamm mit fortschreitender Schwäche der Muskulatur gekennzeichnet. Risdiplam ist ein Spleiß-Modifikator auf Ebene der SMN2-Prä-mRNA. Durch die Beeinflussung des Spleißvorgangs kommt es zu einer vermehrten Bereitstellung von mRNA-Transkripten mit eingeschlossenem Exon 7. Als Folge wird in größerer Menge vollständiges und damit funktionsfähiges Survival-Motoneuron-Protein gebildet. Der Stellenwert von Risdiplam ist noch nicht eindeutig geklärt.
Mittel, die den Lipidstoffwechsel beeinflussen
Bempedoinsäure
Für die Behandlung von primären Hypercholesterolämien oder gemischten Dyslipidämien steht als neues Wirkprinzip Bempedoinsäure (Nilemdo®) zur Verfügung. Ihre Wirkung beruht auf einer Hemmung der Adenosintriphosphat-Citrat-Lyase: Folge ist eine Hemmung der körpereigenen Cholesterol-Synthese und eine Hochregulierung der LDL-Rezeptordichte, ein völlig neuer Wirkmechanismus. Aufgrund des leberspezifischen Aktivierungsmechanismus durch das Enzym Acyl-CoA-Synthetase treten unter Bempedoinsäure seltener muskuläre Nebenwirkungen als unter Statinen auf. Die Substanz kann zusammen mit einem Statin oder als Monotherapeutikum bzw. in Kombination mit anderen lipidsenkenden Therapeutika bei Statin-Intoleranz oder -Kontraindikation eingesetzt werden.
Icosapent-Ethyl
Die chemisch modifizierte Omega-3-Fettsäure Icosapent-Ethyl (Vazkepa®) ist zur Reduktion des Risikos für kardiovaskuläre Ereignisse bei Erwachsenen vorgesehen, die mit Statinen behandelt werden und ein hohes kardiovaskuläres Risiko sowie erhöhte Triglycerid-Werte ab 150 mg/dl aufweisen. Icosapent-Ethyl ist ein stabiler Ethylester und Prodrug der Omega-3-Fettsäure Eicosapentaensäure. Er soll über die Reduktion Triglycerid-reicher Lipoproteine, entzündungshemmende und antioxidative Effekte, die Reduktion der Makrophagen-Akkumulation, die Verbesserung der endothelialen Funktion und eine Thrombozytenaggregationshemmung zur Reduktion von kardiovaskulären Ereignissen beitragen. Der Wirkmechanismus ist nicht vollständig bekannt.
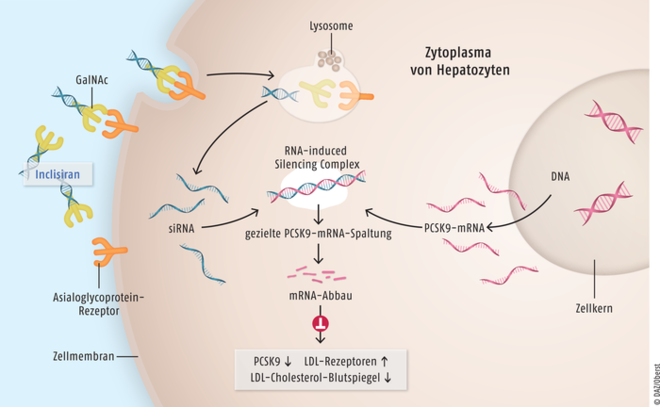
Inclisiran
Erwachsene mit primärer (heterozygoter) Hypercholesterolämie oder gemischter Dyslipidämie, bei denen mit anderen lipidsenkenden Therapeutika (Statine) kein ausreichender Effekt erzielbar ist, können mit dem Ribonukleinsäure-Fragment Inclisiran (Leqvio®) behandelt werden. Bei Patienten mit erhöhten LDL-Cholesterol-Spiegeln, die nicht ausreichend auf Statine ansprechen oder diese nicht vertragen, kommen bereits seit Jahren Proproteinkonvertase-Subtilisin/Kexin-Typ-9(PCSK9)-Antikörper wie Evolocumab oder Alirocumab zum Einsatz. Auch Inclisiran ist gegen PCSK9 gerichtet. Jedoch handelt es sich nicht um einen Antikörper, sondern um einen Vertreter der immer größer werdenden Gruppe der RNA-Silencer, wobei Inclisiran der erste auf dem Markt verfügbare PCSK9-Silencer ist. In den zulassungsrelevanten klinischen Studien war eine Reduktion der LDL-Cholesterol-Spiegel im Bereich von etwa 50% möglich. Obwohl der Effekt etwas geringer ausfiel als bei den PCSK9-Antikörpern, stellt Inclisiran dennoch eine Bereicherung des therapeutischen Spektrums dar.
Inclisiran ist ein doppelsträngiges Ribonukleinsäure-Fragment, an das drei Zuckerreste (triantennäres N-Acetylgalactosamin, GalNAc) gebunden sind (links). Nach Bindung an den Asialoglycoprotein-Rezeptor auf Hepatozyten erfolgt eine gezielte Aufnahme in das Zytoplasma der Leberzellen und eine lysosomale Spaltung des Wirkstoffmoleküls. Die nun einsträngige kleine interferierende Ribonukleinsäure (small interfering RNA, siRNA) bildet zusammen mit der für das Enzym Proproteinkonvertase Subtilisin/Kexin Typ 9 (PCSK9) kodierenden mRNA den RNA-induced Silencing Complex (RISC, Mitte). Als Folge wird die PCSK9-mRNA weitgehend zerstört, sodass das entsprechende Protein nicht mehr in größerem Ausmaß translatiert werden kann. Bei Patienten mit primärer Hypercholesterolämie werden so das Recycling und die Expression des LDL-Rezeptors auf der Oberfläche von Hepatozyten erhöht und es kommt zu einer vermehrten Aufnahme von LDL-Cholesterol in die Zellen.
Sexualhormone
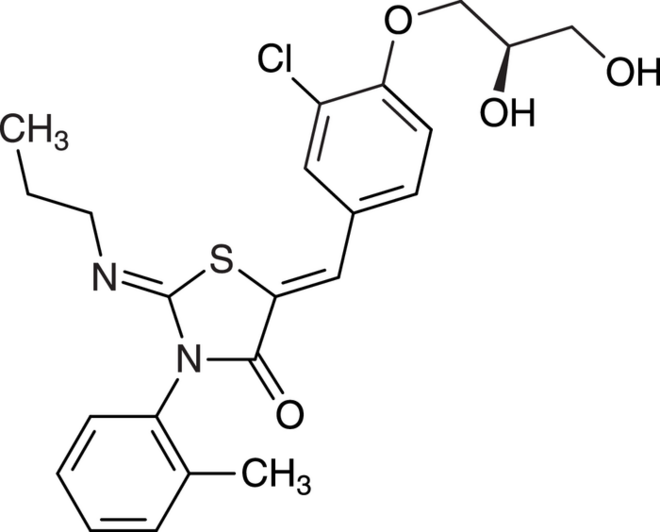
Estetrol
Das neue Kombinationspräparat mit dem Estrogen Estetrol und dem Gestagen Drospirenon (Drovelis®) ist zur oralen Kontrazeption indiziert. Aufgrund bislang fehlender epidemiologischer Studien sind vor dem Einsatz der Zubereitung bei den behandelten Frauen die individuellen Risikofaktoren im Hinblick auf arterielle und venöse Thromboembolien zu berücksichtigen, zumal bereits eine ganze Reihe von oralen Verhütungspräparaten zur Verfügung stehen. Ein therapeutischer Fortschritt könnte daher nur durch ein besonders gut wirksames oder verträgliches Präparat erreicht werden. Da die zulassungsrelevanten klinischen Studien widersprüchliche Resultate liefern, kann die Kombination aus Estetrol und Drospirenon noch nicht diesbezüglich beurteilt werden.
Mittel zur Gallentherapie
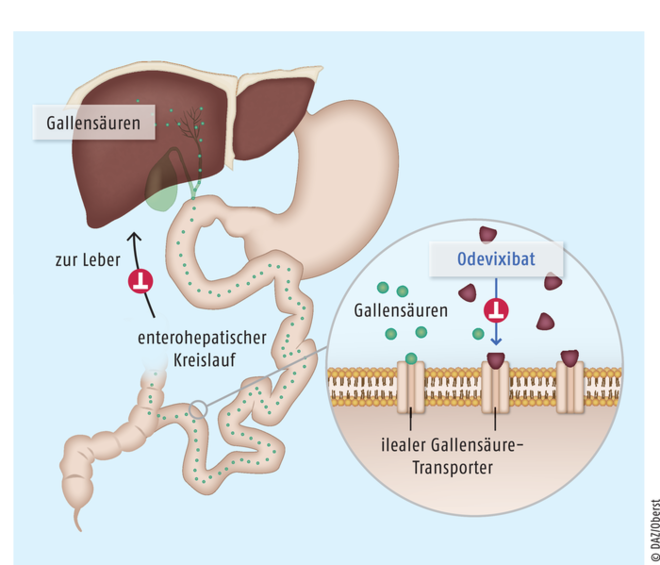
Odevixibat
Der selektive reversible Inhibitor des ilealen Gallensäure-Transporters Odevixibat (Bylvay®) steht für Patienten mit progressiver familiärer intrahepatischer Cholestase zur Verfügung, einer autosomal-rezessiv vererbten, schwer verlaufenden cholestatischen Lebererkrankung. Der Wirkstoff ist für den Einsatz bei Erwachsenen und Kindern ab dem siebten Lebensmonat vorgesehen. Odevixibat hemmt lokal im distalen Ileum den ilealen Gallensäure-Transporter, verringert die Wiederaufnahme der Gallensäuren und erhöht so deren Ausscheidung über den Dickdarm. Als Folge wird die Gallensäure-Konzentration im Serum und damit auch in der Leber reduziert. Damit steht erstmals ein spezifisch für die progressive familiäre intrahepatische Cholestase entwickelter Wirkstoff zur Verfügung. Der nicht systemisch wirkende Inhibitor des Gallensäure-Transporters ist die erste nichtchirurgische Behandlungsoption bei der progressiven familiären intrahepatischen Cholestase und hat einen innovativen Wirkmechanismus.
Odevixibat ist ein selektiver Inhibitor des ilealen Gallensäure-Transporters, der nach peroraler Einnahme lokal im distalen Ileum aktiv ist und den enterohepatischen Kreislauf der Gallensäuren unterbricht. Als Folge wird deren Ausscheidung mit den Fäzes verstärkt und die Gallensäure-Konzentration in Serum und Leber reduziert.
Mittel für das alimentäre System und den Stoffwechsel
Lumasiran
Patienten mit primärer Hyperoxalurie Typ 1 können mit dem Ribonukleinsäure-Fragment Lumasiran (Oxlumo®) behandelt werden. Durch eine monatliche bzw. vierteljährliche subkutane Applikation wird die Produktion von körpereigenem Oxalat reduziert und Erkrankungsfolgen wie Urolithiasis oder Nierenversagen werden zumindest gemildert. Die zielgerichtete Abschaltung von Genen mittels RNA-Silencing bzw. RNA-Interferenz ist ein physiologischer Abwehrmechanismus in den Zellen von Eukaryoten, beispielsweise bei Virenbefall. Im Rahmen der Proteinbiosynthese interagieren kurze Ribonukleinsäure-Fragmente mit der mRNA der entsprechenden Zellen. Unter Beteiligung mehrerer Enzymkomplexe wird die mRNA nicht abgelesen, sondern in Bruchstücke gespalten. Auf diese Weise wird die zu übertragende Information zerstört und eine Translation in ein Protein verhindert. So wird durch die doppelsträngige small interfering RNA Lumasiran eine Reduktion der hepatischen Glyoxylat-Biosynthese und damit auch des krankheitsauslösenden Oxalats erreicht. Nach Patisiran bei hereditärer Transthyretin(TTR)-vermittelter Amyloidose und Givosiran zur Behandlung der akuten hepatischen Porphyrie steht mit Lumasiran schon der dritte RNA-Silencer zur Verfügung.
Psychoanaleptika, andere Antidepressiva
Esketamin
Erwachsene mit therapieresistenter Major Depression und einer aktuellen mittelgradigen bis schweren depressiven Episode können nun mit Esketamin (Spravato®) als Antidepressivum behandelt werden. Esketamin, das S-Enantiomer von Ketamin, ist ein nichtselektiver, nicht-kompetitiver Antagonist des ionotropen N-Methyl-D-Aspartat(NMDA)-Glutamatrezeptors. Das Nasenspray wird längerfristig in Kombination mit SSRI bzw. SNRI oder zur akuten Kurzzeittherapie von psychiatrischen Notfällen zusammen mit einer oralen antidepressiven Therapie angewendet. Esketamin beeinflusst die Übertragung von Signalen zwischen Hirnzellen, die an der Regulierung der Stimmung beteiligt sind. Der exakte Wirkmechanismus hinsichtlich des antidepressiven Effekts ist nicht vollständig verstanden. Aber mit dem Esketamin-Nasenspray steht zum ersten Mal ein schnell wirksames Antidepressivum als Add-on-Therapeutikum zur Verfügung. Sowohl der nasale Applikationsweg des S-Enantiomers von Ketamin als auch die Auslösung der antidepressiven Wirkung durch eine Glutamat-Modulation sind innovativ. |
Substanz | Handelsname | Gruppe | Hersteller/Vertrieb | Einführungsdatum | NA Nr.-Jahr |
|---|---|---|---|---|---|
Acalabrutinib | Calquence® | antineoplastische Mittel, Proteinkinase-Inhibitoren | AstraZeneca GmbH | 1. Dezember 2020 | 2-21 |
Angiotensin II | Giapreza® | Herztherapie, sonstige Herzstimulanzien | Paion Deutschland GmbH | 15. Juli 2021 | 10-21 |
Avapritinib | Ayvakyt® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Blueprint Medicines (NL) | 1. November 2020 | 1-21 |
Avatrombopag | Doptelet® | Antihämorrhagika, andere systemische Hämostatika | Swedish Orphan Biovitrium GmbH | 1. April 2021 | 6-21 |
Baloxavir marboxil | Xofluza® | antivirale Substanzen zur systemischen Anwendung, andere antivirale Substanzen | Roche Pharma AG | 15. Februar 2021 | 5-21 |
Bempedoinsäure | Nilemdo® | Mittel, die den Lipidstoffwechsel beeinflussen, andere Mittel, die den Lipidstoffwechsel beeinflussen | Daiichi Sankyo Deutschland GmbH | 1. November 2020 | 1-21 |
Berotralstat | Orladeyo® | andere Hämatologika, Mittel zur Behandlung des hereditären Angioödems | BioCryst Ireland Limited (IRL) | 1. Juni 2021 | 9-21 |
Bimekizumab | Bimzelx® | Immunsuppressiva, Interleukin-Inhibitoren | UCB Pharma GmbH | 15. September 2021 | 11-21 |
Brexucabtagen Autoleucel | Tecartus® | sonstige antineoplastische Mittel | Gilead Sciences GmbH | 15. März 2021 | 6-21 |
Cabotegravir | Vocabria® | antivirales Mittel zur systemischen Anwendung, Integrase-Inhibitor | ViiV Healthcare BV (NL) | 1. Mai 2021 | 7-21 |
CD34-positive Stammzellen | Libmeldy® | andere hämatologische Wirkstoffe | Orchard Therapeutics GmbH | 1. Mai 2021 | 7-21 |
Cefiderocol | Fetcroja® | Antibiotika zur systemischen Anwendung | Shionogi GmbH | 15. Januar 2021 | 4-21 |
Cenobamat | Ontozry® | Antiepileptika, andere Antiepileptika | Arvelle Therapeutics (NL) | 1. Juni 2021 | 8-21 |
Crizanlizumab | Adakveo® | andere Hämatologika | Novartis Pharma GmbH | 1. Dezember 2020 | 2-21 |
Cytisin | Asmoken® | andere Mittel für das Nervensystem, Mittel zur Behandlung von Suchterkrankungen | Aflofarm Farmacja Polska (PL) | 15. Dezember 2020 | 3-21 |
Desoxycholsäure | Kybella® | andere Dermatika | Allergan GmbH | 15. Oktober 2020 | 1-21 |
Dostarlimab | Jemperli® | Antineoplastika, monoklonale Antikörper | GlaxoSmithKline GmbH | 15. Juni 2021 | 9-21 |
Esketamin | Spravato® | Psychoanaleptika, andere Antidepressiva | Janssen-Cilag International NV (B) | 1. März 2021 | 5-21 |
Estetrol | Drovelis® | Sexualhormone und Modulatoren des Genitalsystems, Gestagene und Estrogene, fixe Kombinationen | Gedeon Richter Plc. (HUN) | 1. Juli 2021 | 10-21 |
Fedratinib | Inrebic® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Celgene GmbH | 15. März 2021 | 6-21 |
Fenfluramin | Fintepla | Antiepileptika, andere Antiepileptika | Zogenix GmbH | 1. Februar 2021 | 4-21 |
Filgotinib | Jyseleca® | Immunsuppressiva | Gilead Sciences GmbH | 15. Oktober 2020 | 2-21 |
Fostemsavir | Rukobia® | antivirale Mittel zur systemischen Anwendung, andere antivirale Mittel | ViiV Healthcare GmbH | 1. April 2021 | 8-21 |
Icosapent-Ethyl | Vazkepa® | Mittel, die den Lipidstoffwechsel beeinflussen; andere Mittel, die den Lipidstoffwechsel beeinflussen | Amarin Pharmaceuticals Limited (IRL) | 1. September 2021 | 12-21 |
Imlifidase | Idefirix® | Immunsuppressiva, selektive Immunsuppressiva | Hansa Biopharma AB (S) | 15. März 2021 | 7-21 |
Inclisiran | Leqvio® | Mittel, die den Lipidstoffwechsel beeinflussen, andere Mittel, die den Lipidstoffwechsel beeinflussen | Novartis Pharma GmbH | 1. Februar 2021 | 4-21 |
Isatuximab | Sarclisa® | antineoplastische Mittel, monoklonale Antikörper | Sanofi-Aventis Deutschland GmbH | 1. Februar 2021 | 4-21 |
Lumasiran | Oxlumo® | sonstige Mittel für das alimentäre System und den Stoffwechsel | Alnylam Netherlands B.V. (NL) | 1. Januar 2021 | 3-21 |
Natriumzirconiumcyclosilicat | Lokelma® | Mittel zur Behandlung der Hyperkaliämie und Hyperphosphatämie | AstraZeneca GmbH | 1. April 2021 | 7-21 |
Odevixibat | Bylvay® | Gallen- und Lebertherapie, andere Mittel zur Gallentherapie | Albireo AB (S) | 15. September 2021 | 12-21 |
Ofatumumab | Kesimpta® | selektive Immunsuppressiva | Novartis Pharma GmbH | 1. September 2021 | 11-21 |
Pemigatinib | Pemazyre® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Incyte Biosciences Distribution B.V. (NL) | 1. Mai 2021 | 8-21 |
Ponesimod | Ponvory® | Immunsuppressiva, selektive Immunsuppressiva | Janssen-Cilag GmbH | 15. Juni 2021 | 9-21 |
Relebactam | Recarbrio® | Antibiotika zur systemischen Anwendung, Carbapeneme | MSD Sharp & Dohme GmbH | 1. Juli 2021 | 9-21 |
Remdesivir | Veklury® | antivirale Mittel zur systemischen Anwendung, direkt wirkende antivirale Mittel, andere antivirale Mittel | Gilead Sciences GmbH | 1. Juni 2021 | 8-21 |
Risdiplam | Evrysdi® | andere Mittel gegen Störungen des Muskel- und Skelettsystems | Roche Pharma AG | 1. Mai 2021 | 8-21 |
Roxadustat | Evrenzo® | Antianämika, andere Antianämika | Astellas Pharma GmbH | 15. September 2021 | 12-21 |
Satralizumab | Enspryng® | Immunsuppressiva, Interleukin-Inhibitoren | Roche Pharma AG | 15. Juli 2021 | 10-21 |
Selpercatinib | Retsevmo® | antineoplastische und immunmodulierende Mittel, antineoplastische Mittel, Proteinkinase-Inhibitoren | Lilly Deutschland GmbH | 15. März 2021 | 6-21 |
Selumetinib | Koselugo® | antineoplastische Mittel, Proteinkinase-Inhibitoren | AstraZeneca GmbH | 15. August 2021 | 11-21 |
Tafasitamab | Minjuvi® | andere antineoplastische Mittel, monoklonale Antikörper | Incyte Biosciences Distribution B.V. (NL) | 15. September 2021 | 12-21 |
Tagraxofusp | Elzonris® | antineoplastische Mittel, andere antineoplastische Mittel | Stemline Therapeutics B.V. (NL) | 15. Juni 2021 | 9-21 |
Tirbanibulin | Klisyri® | Antibiotika und Chemotherapeutika für die dermatologische Anwendung | Almirall Hermal GmbH | 1. September 2021 | 11-21 |
Tozinameran | Comirnaty® | Impfstoffe | Biontech Manufacturing GmbH | 21. Dezember 2020 | 3-21 |
Tralokinumab | Adtralza® | Mittel zur Behandlung der Dermatitis, exkl. Corticosteroide | Leo Pharma GmbH | 15. Juli 2021 | 10-21 |
Tucatinib | Tukysa® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Seagen Germany GmbH | 15. März 2021 | 7-21 |
Vektor-Impfstoff gegen SARS-CoV-2 | Vaxzevria | Impfstoffe, andere virale Impfstoffe | AstraZeneca GmbH | 29. Januar 2021 (bedingte Zulassung durch die EMA) | 5-21 |
Vericiguat | Verquvo® | Herztherapie, andere bei Herzerkrankungen eingesetzte Vasodilatatoren | Bayer Vital GmbH | 15. September 2021 | 11-21 |

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.