
- DAZ.online
- DAZ / AZ
- DAZ 51/2021
- Auf Umwegen, getarnt und ...
Onkologie
Auf Umwegen, getarnt und durch die Hintertür
Technologische Aspekte, Einsatzgebiete und Perspektiven von zytotoxischen Immunkonjugaten
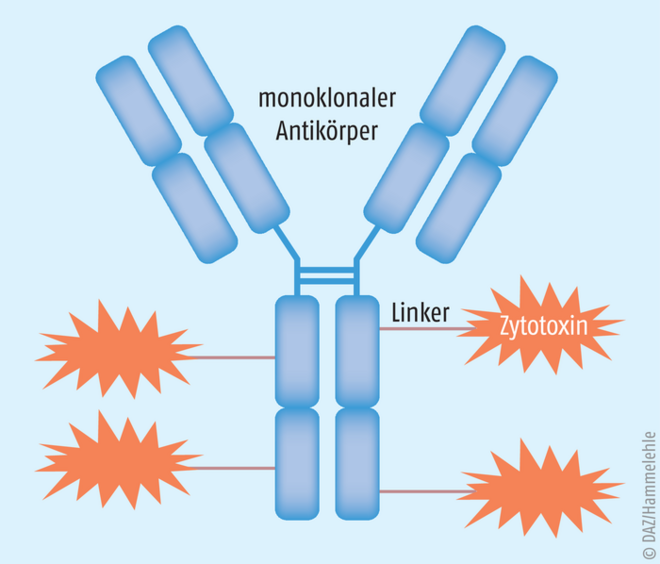
Alle derzeit verfügbaren zytotoxisch wirksamen Immunkonjugate (s. Abb., Tab. 1) haben eine Gemeinsamkeit: Zunächst bindet das Antikörper-Wirkstoff-Konjugat an ein überexprimiertes Epitop auf der Oberfläche von Tumorzellen. Mittels Endozytose gelangt es in das Innere der Tumorzelle. Im nächsten Schritt erfolgt eine lysomale Degradation sowohl des Epitops als auch des monoklonalen Antikörpers (MAB) unter Freisetzung des beladenen Zytostatikums (Payload). Je nach mitgeführtem Zytostatikum kann es zu einer DNS-Alkylierung (z. B. Calicheamicine), einer Mitosehemmung (z. B. Auristatine, Maytansinoide) oder einer Topoisomerase-I-Hemmung (z. B. Exactecan, SN38) kommen (s. Tab. 2). Bevorzugt werden in diesem Zusammenhang vor allem Zytostatika mit einer hohen zytotoxischen Potenz.
Abb.: Struktur eines Antikörper-Wirkstoff-Konjugats Die Auswahl des Linkers und des Zytostatikums sind für die pharmakologische Gesamtbeurteilung ebenso wichtig wie die Beladungsdichte pro Antikörper (nach [23]).
INN (Handelsname) | Zielstruktur und Konjugation, Hinweise zur Pharmakokinetik und Ausscheidung | Indikationen (Auswahl) | wesentliche Nebenwirkungen (Auswahl) |
|---|---|---|---|
Belantamab mafodotin (Blenrep) | humanisierter, afucosylierter Anti-BCMA-IgG1-MAB, gekoppelt an MMAF (nicht-spaltbarer Linker) HWZ: ca. 14 Tage (CYP3A) | fortgeschrittenes multiples Myelom (nach mindestens vier Vortherapien) | Keratopathien am Auge, Zytopenien, infusionsbedingte Reaktionen, Pneumonie, Pyrexie |
Brentuximab vedotin (Adcetris) | chimärer Anti-CD30-IgG1-MAB gekoppelt an MMAE (Cathepsin-Val-Citr-Linker) HWZ: 4 bis 6 Tage (CYP3A) | fortgeschrittener Morbus Hodgkin (Rezidiv) | Zytopenie, infusionsbedingte Reaktionen, Dyspnoe, Atemwegsinfektionen, gastrointestinale Beschwerden, Pruritus, periphere Neuropathien |
Enfortumab vedotin (Padcev) | Vollhumaner Anti-Nectin4-IgG1-MAB gekoppelt an MMAE (Val-Citr-Peptid-Linker) HWZ: 3,4 Tage (CYP3A) | fortgeschrittenes Urothelkarzinom | Fatigue, Zytopenie, Hautausschläge, Hyperglykämie, hepato-veno-okklusive Erkrankungen, periphere Neuropathie |
Gemtuzumab ozogamicin (Mylotarg) | humanisierter Anti-CD33-IgG4-MAB gekoppelt an Calicheamicin (säurelabiler Hydrazon-Linker) HWZ: ca. 72 Stunden (CYP3A) | fortgeschrittene akute myeloische Leukämie (AML) | Hepatotoxizität (incl. hepato-veno-okklusive Erkrankungen, sinusoidales Obstruktionssyndrom), Blutungen, Infektionen, Tumorlysesyndrom |
Inotuzumab ozogamicin (Besponsa) | humanisierter Anti-CD22-IgG4-MAB, gekoppelt an Calicheamicin (CM1) (säurelabiler Hydrazon-Linker) HWZ: ca. 12,3 Tage (CYP3A) | fortgeschrittene akute lymphatische Leukämie (ALL) | Fieber, Hypotension, Zytopenie, infusionsbedingte Reaktionen, Anstieg der Transaminasen, des Bilirubin, der Amylase, der Lipase; hepato-veno-okklusive Erkrankungen, ΔQT-Zeit |
Polatuzumab vedotin (Polivy) | Humanisierter Anti-CD79b-IgG1-MAB, gekoppelt an MMAE (Linker: Vc-PAB) HWZ: ca. 4 Tage (CYP3A) | fortgeschrittenes diffus großzelliges B-Zell-Lymphom (DLBCL) | Pneumonie, Herpes-Infektionen (incl. Zytomegalievirus), Zytopenie, Schwindel, periphere Neuropathie, Hypokaliämie, Hypocalciämie |
Sacituzumab govitecan (Trodelvy) | Anti-Trop2-IgG1-MAB, gekoppelt an SN38 (CL2A-Linker) HWZ: ca. 16 Stunden (UGT1A1) | vorbehandeltes, metastasiertes triple-negatives Mammakarzinom | gastrointestinale Beschwerden, Fatigue, Zytopenie, Hautausschläge, Hypophosphatämie |
Trastuzumab deruxtecan (Inhertu) | Anti-HER2-IgG1-MAB, gekoppelt an Exatecan (spaltbarer Tetrapeptid-basierter Linker) HWZ: ca. 7 Tage (CYP3A) | fortgeschrittenes, inoperables HER2-überexprimierendes vorbehandeltes Mammakarzinom | Zytopenie, gastrointestinale Beschwerden, LVEF-Reduktion, interstitielle Lungenerkrankungen |
Trastuzumab emtansin (Kadcyla) | Anti-HER2-IgG1-MAB gekoppelt an DM4 (Thioether-Linker) HWZ: 3 bis 4 Tage (ABCB1) | fortgeschrittenes HER2-überexprimierendes, vorbehandeltes Mammakarzinom; adjuvante Therapie des HER2-positiven Mammakarzinom | Zytopenie, gastrointestinale Beschwerden, Fatigue, erhöhte AST/ALT-Werte, Hypokaliämie, LVEF-Reduktion |
Wirkstoff | Wirkmechanismus | Kurzbezeichnung |
|---|---|---|
Auristatin | Mitosehemmstoff (Inhibition der Tubulin-Polymerisation) | MMAF: Monomethylauristatin F MMAE: Monomethylauristatin E, -vedotin, -mafodotin |
Calicheamicin | Alkylanz an der kleinen Furche der DNA | -ozogamicin |
Maytansin | Mitosehemmstoff (Inhibition der Tubulinpolymerisation) | DM1: -mertansin DM4: -emtansin, -ravtansin, -soravtansin |
Exatecan, SN38 (aktiver Metabolit von Irinotecan) | Topoisomerase-I-Hemmstoff | -govitecan -deruxtecan |
Auch wenn die Internalisierung des Antikörper-Wirkstoff-Konjugats pharmakodynamisch im Vordergrund steht, kann nach der Bindung des Antikörpers an das entsprechende Epitop auch eine Komplement-abhängige Zytotoxizität, eine Antikörper-abhängige zellvermittelte Zytotoxizität (ADCC) und eine Antikörper-abhängige zellvermittelte Phagozytose eingeleitet werden, wobei die jeweilige Ausprägung unter anderem durch die Wahl des Immunglobulin-G(IgG)-Subtyps gesteuert werden kann [19]. Der IgG-Subtyp IgG1 wird bisher am häufigsten verwendet. IgG1 ist wie IgG2 und IgG4 im Plasma relativ stabil (HWZ: ca. 21 Tage), weist aber eine höhere Affinität gegenüber Komplement und Rezeptoren für die Fc-Region von IgG auf, so dass sowohl die Komplement-abhängige und die Antikörper-abhängige zellvermittelte Zytotoxizität als auch die Antikörper-abhängige zellvermittelte Phagozytose unterstützt werden. IgG2 und IgG4 haben eine deutlich geringere Fähigkeit, Komplement zu binden und zu aktivieren. Auch die Aktivierung von Rezeptoren für die Fc-Region von IgG (FcyR) fällt geringer aus als bei IgG1-basierten Antikörper-Wirkstoff-Konjugaten. IgG2 und IgG4 sind vor allem dann von Interesse, wenn das Miteinbeziehen weiterer Immunzellen pharmakodynamisch nicht im Vordergrund stehen soll. Da IgG2 insgesamt vier Disulfidbrücken besitzt, IgG1 und IgG4 nur zwei, ist eine höhere Beladung mit Zytostatika pro IgG-Molekül möglich (Drug-Antibody-Ratio [DAR], Wirkstoff-zu-Antikörper-Verhältnis). IgG4 wiederum ist mit der Fähigkeit verbunden, die F(ab)-Arme austauschen zu können, so dass mit anderen IgG4 bispezifisch wirksame Antikörper gebildet werden können [3, 4, 10]. bb
Neben der Wahl des IgG-Subtyps kann auch mit speziellen Modifikationen am Fc-Teil des Immunglobulins die Bindung an FcyRIII-Rezeptoren deutlich erhöht werden. Möglich ist eine gezielte Reduktion des Fucose-Anteils am Fc-Teil (Afucosylierung) bzw. ein gezielter Austausch von Aminosäuren am Fc-Teil. So ist Belantamab mafodotin ein afucosyliertes Antikörper-Wirkstoff-Konjugat, das sich durch eine ausgeprägtere ADCC auszeichnet, hingegen weniger Komplement-abhängige Zytotoxizität induziert. Darüber hinaus kann eine Caspase-unabhängige Apoptose von Tumorzellen eingeleitet werden. Das Konjugat „mafodotin“ vermittelt die mitosehemmende Wirkung innerhalb der Tumorzelle [20].
Die Bedeutung des Linkers
Da nur ein Teil der intravenös verabreichten Menge an Antikörper-Wirkstoff-Konjugat tatsächlich effektiv in die Zielzellen eingebracht werden kann, wird angestrebt:
- eine möglichst hohe zytotoxische Potenz des Zytostatikums,
- ein möglichst hohes Wirkstoff-zu-Antikörper-Verhältnis im Konjugat und
- eine möglichst hohe Stabilität des Antikörper-Wirkstoff-Konjugats im systemischen Kreislauf, damit das Zytostatikum nicht bereits während der systemischen Zirkulation sukzessive freigesetzt wird [16].
Daher ist die Entwicklung geeigneter Linker wichtig, die das Zytostatikum mit dem monoklonalen Antikörper verknüpfen. Einerseits soll der Linker nicht bereits im systemischen Kreislauf den zytostatischen Anteil freisetzen, andererseits soll er aber nach entsprechender Internalisierung in die Tumorzelle schnell und effektiv gespalten werden können, um die freie Verfügbarkeit der zytotoxischen Ladung sicherzustellen. Eine Übersicht über die Vor- und Nachteile, die sich durch verschiedene Verknüpfungen in der Technologie zytotoxischer Immunkonjugate ergeben können, zeigt Tabelle 3, die wir Ihnen unter www.deutsche-apotheker-zeitung.de online an dieser Stelle des Artikels zur Verfügung stellen.
Mittels chemischer Konjugation ist es inzwischen möglich, z. B. relativ stabile Lysinamide als Linker zu nutzen. Aber damit lässt sich eine gewisse Variabilität beim Wirkstoff-zu-Antikörper-Verhältnis (Drug-Antibody-Ratio, DAR) zwischen 0 und 7 nicht vermeiden.
Art der Konjugation | Strategie | Vorteile bzw. Nachteile |
|---|---|---|
chemische Konjugation | Kopplung an Lysin | DAR: 0 bis 7; relativ einfacher Prozess, jedoch deutliche heterogene Streuung der DAR |
Kopplung an Cystein | DAR: 0 bis 8; relativ einfacher Prozess, allerdings DAR mit heterogener Streuung | |
Sortase | DAR: 3 bis 4; relativ kontrollierte DAR; Einbau des LPETG-Motivs in der schweren Kette erforderlich | |
(chemo)-enzymatische Konjugation | mikrobielle Transglutaminase | DAR: 2 (homogen); Entfernung des N-Glykan an Position N297 erforderlich |
Hydrazon | pH-Wert-abhängige Spaltung, säurelabil, kann bereits in der systemischen Zirkulation gespalten werden | |
Val-Ala- oder Val-Cit-PABC | Spaltung über Proteasen; spurenfreie Freisetzung des Zytostatikums | |
spaltbare Linker | Disulfid | intrazelluläre Freisetzung des Zytostatikums; teilweise aber auch schon systemisch |
nicht-spaltbare Linker | SMCC, MC | keine Mechanismen der Spaltung vorgesehen, stabil während der systemischen Zirkulation |
Eine weitere Option ist das Koppeln an Cystein-Einheiten im monoklonalen Antikörper. Mit der Cystein-basierten Technologie (Thiomab®) ist es inzwischen möglich, relativ homogene Antikörper-Wirkstoff-Konjugate mit einem Wirkstoff-zu-Antikörper-Verhältnis von 2 herstellen zu können. Eine alternative Strategie besteht im Einsatz von Aryl-Palladium-Komplexen zur Herstellung selektiver Cystein-Konjugate [16, 19].
Enzymatische Konjugationsprozesse arbeiten mit dem Enzym Sortase, das erstmals aus Staphylococcus-aureus-Stämmen isoliert wurde. Es spaltet Threonin-Glycin-Bindungen und katalysiert daraufhin eine Verknüpfung mit einem Oligo-Glycin-enthaltenden Molekül, mit dem weitere Fusionierungen erfolgen können. Dieses Prinzip der Transpeptidylierung mittels Sortase oder bakterieller Transglutaminasen spielt inzwischen eine wichtige Rolle in der Forschung, da eine relativ homogene Bildung von Antikörper-Wirkstoff-Konjugaten mit einer DAR von 2 möglich ist [16, 19].
Der Linker selbst soll intrazellulär durch die in der Zelle vorherrschenden pH-Wert-Verhältnisse oder durch spezifische lysosomale Enzyme wieder gespalten werden. So sind Hydrazone säurelabil und können als Linker im sauren Milieu der Endosomen (pH-Wert: 5 bis 6) und Lysosomen (pH-Wert: ca. 4,8) das Zytostatikum freisetzen, während unter physiologischem pH-Wert (7,4) nur eine sehr langsame Freisetzung zu beobachten ist. Cathepsin-B-empfindliche Linker werden vorzugsweise durch Cathepsin B gespalten. Durch die relativ hohe Expression von Cathepsin B in Lysosomen bzw. verschiedenen Tumoren ist eine selektive Freisetzung des Zytostatikums im Tumorgewebe möglich. Andere Strategien beruhen auf Glutathion-sensitiven Linkern, die die künstlich gebildeten Disulfide spalten. Auch der Einsatz von Pyrophosphatdiester-basierten Linkern ist vorstellbar. Darüber hinaus werden auch nicht-spaltbare Linker eingesetzt, so dass zunächst von einer kompletten lysosomalen Degradation der Antikörperkomponente ausgegangen wird und am Ende nur noch die Oligopeptide bzw. Aminosäuren des Antikörpers übrig bleiben, während das Zytostatikum unbeschadet seine Effekte entfalten kann [16, 19].
Pharmakokinetik
Bei der Elimination des zytotoxischen Immunkonjugats (s. Tab. 1) ist für die Antikörperkomponente zu erwarten, dass sie über katabole Vorgänge auf die gleiche Weise abgebaut wird, wie endogen vorkommende Immunglobuline. Von der zytotoxischen Komponente werden die im systemischen Kreislauf befindlichen Mengen über das hepatische CYP3A4-System verstoffwechselt, soweit es sich um entsprechende Substrate handelt (z.B. -deruxtecan, -vedotin,- MMAE, -ozogamicin). Werden in der Komedikation potente CYP3A-Induktoren bzw. -Inhibitoren eingesetzt, kann dieser Abbau beschleunigt oder verlangsamt werden, was in letzterem Fall zu einem verstärkten Maß an Nebenwirkungen führen kann. Beim aktivem Metabolit von Irinotecan (SN38)könnte eine Einschränkung der Glucuronidierungsleistung über UGT1A1 zu einer gesteigerten Toxizität beitragen, während beim DM1 (-emtansin) eine nicht-enzymatische Ausscheidung über P-Glykoprotein(P-gp)-basierte Effluxpumpen zu erwarten ist, so dass sich starke P-gp(ABCB1)-Inhibitoren (z. B. Dronedaron) ungünstig auf die Elimination auswirken könnten [16].
Anwendungsgebiete der Antikörper-Wirkstoff-Konjugate
Mittlerweile erstreckt sich das Spektrum an Indikationen, in denen Antikörper-Wirkstoff-Konjugate eingesetzt werden können, von hämatologischen Neoplasien, über Lymphome bis hin zu soliden Tumoren. Es werden weitere Antikörper-Wirkstoff-Konjugate erwartet, die z. B. zur Behandlung fortgeschrittener Stadien des Ovarialkarzinoms, des kleinzelliges Lungenkarzinoms, Glioblastoms, Urothelkarzinoms, Mesothelioms bis hin zur Behandlung des kolorektalen Karzinoms eingesetzt werden können. Dabei werden nicht nur bereits etablierte überexprimierte Epitope auf Tumorzellen als Zielstrukturen genutzt, sondern auch weitergehende Oberflächenstrukturen anvisiert. Einen Ausblick auf verschiedene zytotoxische Immunkonjugate, die sich derzeit in unterschiedlichen Phasen der klinischen Prüfung befinden, zeigt die Tabelle 4, die wir Ihnen online unter www.deutsche-apotheker-zeitung.de in dem Artikel an dieser Stelle zur Verfügung stellen [19].
INN | Gegenstand klinischer Prüfungen | Zielstruktur | Struktur des Antikörpers | Linker | zytotoxisches Konjugat |
|---|---|---|---|---|---|
Anetumab ravtansin | Mesothelin-exprimierende Tumoren | Mesothelin | vollhumaner IgG1-MAB | Disulfid SPDB | DM4 |
Coltuximab ravtansin | diffus großzelliges B-Zell-Lymphom (DLBCL) | CD19 | humanisierter IgG1-MAB | Disulfid SPDB | DM4 |
Denintuzumab mafadotin | diffus großzelliges B-Zell-Lymphom (DLBCL), follikuläres Lymphom (FL) | CD19 | humanisierter IgG1-MAB | MC | MMAF |
Depatuximab mafodotin | Glioblastom mit EGFR-Amplifikation | EGFRvIII | humanisierter IgG1-MAB | MC | MMAF |
Glembatumumab vedotin | dreifach negativer Brustkrebs (TNBC), fortgeschrittene Plattenepithelkarzinome der Lunge und anderer solider Tumoren | Glykoprotein NMB | humanisierter IgG2-MAB | VC-PAB | MMAE |
Indusatumab vedotin | gastrointestinale Tumoren u. a. | Guanylatcyclase C | humanisierter IgG1-MAB | VC-PAB | MMAE |
Indatuximab ravtansin | multiples Myelom | CD138 | chimärer IgG4mAB | Disulfid SPDB | DM4 |
Labetuzumab govitecan | metastasiertes Kolonkarzinom (mCRC) | CEACAMS | humanisierter IgG1-MAB | CL2A | SN38 |
Lifastuzumab vedotin | Ovarial-Karzinom, NSCLC | NaPi2b | humanisierter IgG1-MAB | VC-PAB | MMAE |
Loncastuximab tesirin | refraktäre großzellige B-ZellLymphome | CD19 | chimärer IgG1-MAB | PEG-Val-Ala-Dipipetid | SG3199 |
Lorvotuzumab maytansin | Leukämie, solide Tumoren (z. B. kleinzelliges Lungenkarzinom, SCLC) | CD56 | humanisierter IgG1-MAB | Disulfid-SPP | DM1 |
Milatuzumab doxorubicin | chronisch lymphatische Leukämie (CLL), multiples Myelom, Non-Hodgkin-Lymphom (NHL) | CD74 | humanisierter IgG1-MAB | Hydrazon | Doxorubicin |
Mirvetuximab soravtansin | FRα-positives, epitheliales Ovarial-Karzinom | Folat-Rezeptor-α | humanisierter IgG1-MAB, DM4, sulfo SPDB | Sulfo-SPDB | DM4 |
Naratuximab emtansin | Non-Hodgkin-Lymphom (NHL) | CD37 | humanisierter IgG1-MAB | VC-PAB | MMAE |
Pinatuzumab vedotin | Follikuläres B-Zell-Non-Hodgkin-Lymphom | CD22 | humanisierter IgG1-MAB | VC-PAB | MMAE |
Rovalpituzumab tesirin | DLL3-exprimierendes r/r kleinzelliges Lungenkarzinom | DLL3 | humanisierter IgG1-MAB | PEG8-Val-Ala | D6.5-PBD |
Tisotumab vedotin | multiple solide Tumoren | CD142 (Tissue Factor) | humanisierter IgG1-MAB | VC-PAB | MMAE |
Vadastuximab talirin | akute myeloische Leukämie (AML) | CD33 | humanisierter IgG1-MAB | Cystein-Brücke (MC-Val-Ala) | PBD |
Einsatz in der Hämatologie
Mit Gemtuzumab ozogamicin (Mylotarg®) wurde bereits vor mehr als 20 Jahren das erste zytotoxische Immunkonjugat in den USA zugelassen. Der humanisierte Antikörper Gemtuzumab ist gegen CD33-positive Zellen gerichtet, wie sie bei akuter myeloischer Leukämie (AML) nachgewiesen werden können. Das Zytostatikum „-ozogamicin“ ist ein Calicheamicin-Derivat, das ähnlich wie Trabectedin an die kleine Furche der DNA bindet und dort mittels Alkylierung zu irreversiblen DNA-Veränderungen führt. Das Konjugat konnte anfangs nicht durchgängig klinisch überzeugen. Hinzu kam eine Häufung von hepato-veno-okklusiven Verschlüssen, so dass der Einsatz von Gemtuzumab ozogamicin sehr stark eingeschränkt wurde. In Studien konnte dann gezeigt werden, dass eine Reduzierung der Dosierung und ein anderes Dosierschema klinisch deutlich vorteilhafter war. Auch wurde durch die Wahl eines geeigneteren Linkers die Stabilität des Moleküls erhöht und die Hepatotoxizität reduziert, da die vorzeitige Freisetzung von Calicheamicin im systemischen Kreislauf herabgesetzt wurde. Darauf basierend wurde im April 2018 Mylotarg® von der EMA zugelassen zur Induktions- und Konsolidierungstherapie bei AML-Patienten mit CD33-positiven Tumoren in Kombination mit Cytarabin und Daunorubicin [8, 10, 12, 19, 21].
Inotuzumab ozogamicin (Besponsa®) wird bei rezidivierender CD22-positiver B-Zell-ALL eingesetzt, wenn zuvor ein Tyrosinkinase-Inhibitor angewendet wurde. Zulassungsrelevant war die INO-VATE-ALL-Phase-III-Studie, in der das mittlere progressionsfreie Überleben unter Inotuzumab ozogamicin bei fünf Monaten, unter einer Chemotherapie nur bei 1,7 Monaten lag. Das Gesamtüberleben betrug 7,7 Monate vs. 6,2 Monate [11].
Mit Belantamab mafodotin (Blenrep®) steht nun auch in der Behandlung des stark vorbehandelten, rezidivierenden und therapierefraktären multiplen Myeloms (RRMM) das erste Antikörper-Wirkstoff-Konjugat zur Verfügung. Da es mit einer Dosierung von 3,4 mg/kg i. v. nebenwirkungsbedingt zu häufigen Dosisreduktionen gekommen war, wurden die Folgestudien mit niedrigen Dosierungen (2,5 mg/kg i. v. alle drei Wochen) fortgeführt (z. B. DREAMM-2). Mit diesem Studiendesign ließen sich ein Gesamtansprechen von 31% und eine mediane Ansprechdauer von ca. elf Monaten erreichen. Weitergehende Studien beschäftigen sich mit Kombinationstherapien, die z. B. einen Checkpoint-Inhibitor berücksichtigen [2].
Einsatz bei Lymphomen
In Deutschland wurde 2012 Brentuximab vedotin (Adcetris®) eingeführt, das gegen das rezidivierte, CD30-positive Hodgkin-Lymphom gerichtet ist und zunächst für fortgeschrittene Stadien zugelassen wurde. Die zulassungsrelevante Phase-III-Studie hatte gezeigt, dass sich die progressionsfreie Überlebenszeit von 42,9 Monaten gegenüber 24,1 Monaten (Placebo) verlängern ließ [21].
Zur Behandlung des großzelligen B-Zelllymphoms steht seit etwa zwei Jahren Polatuzumab vedotin (Polivy®) zur Verfügung. Dieses Non-Hodgkin-Lymphom ist mit einem hohen Rezidivrisiko verbunden: ca. 40% der Patienten entwickeln ein Rezidiv oder reagieren zunehmend refraktär auf das Standard-Therapieregime. Das zytotoxische Immunkonjugat, das gegen CD79b-Epitope auf B-Zellen gerichtet und mit einem Mitosehemmstoff verknüpft ist, führte zu einer kompletten Remissionsrate von 40% gegenüber 18% unter einer alleinigen Kombination aus Bendamustin/Rituximab [6].
Einsatz bei soliden Tumoren
Das erste Antikörper-Wirkstoff-Konjugat, das zur Behandlung solider Tumoren zugelassen wurde, war Trastuzumab emtansin (Kadcyla®). In der EMILIA-Phase-III-Studie wurde gezeigt, dass sich mit Trastuzumab emtansin beim HER2-positiven, inoperablen, metastasierten und vorbehandelten Mammakarzinom eine progressionsfreie Überlebenszeit von 9,6 Monaten erreichen ließ, während sie im Vergleichsarm (Lapatinib/Capecitabin) bei 6,4 Monaten lag. Die Gesamtüberlebensdauer betrug 30,9 Monate, im Vergleichsarm 25,1 Monate.
Mit Trastuzumab deruxtecan (Enhertu®) ist inzwischen ein weiterentwickeltes Antikörper-Wirkstoff-Konjugat von der EMA zugelassen worden, das selbst nach Vorbehandlung mit den Anti-HER2-Antikörpern Trastuzumab und Pertuzumab, aber auch mit Trastuzumab emtansin bei Patientinnen mit metastasiertem progredienten HER2-positivem Mammakarzinom noch wirksam ist. Es konnte ein Gesamtansprechen von 61,4% und eine mediane Ansprechdauer von 20,8 Monaten erreicht werden. Mehr als 80% der mit Trastuzumab deruxtecan behandelten Patientinnen sprachen mindestens sechs Monaten an. Diese Ergebnisse dürften sehr wahrscheinlich nicht nur mit der veränderten Zytostatika-Komponente (-deruxtecan vs. -emtansin), sondern auch mit dem ausgeprägteren Bystander-Effekt des weiterentwickelten Antikörper-Wirkstoff-Konjugats zusammenhängen: das intrazellulär freigesetzte Zytostatikum diffundiert in benachbarte Zellen und wirkt auch dort. Inzwischen liegen auch die ersten Ergebnisse einer Vergleichsstudie vor, in der sich Trastuzumab deruxtecan als überlegen zu Trastuzumab emtansin erwies [5].
Sacituzumab govitecan (Trodelvy®) ist beim Triple-negativen Mammakarzinom (TNBC) indiziert. Das zytotoxische Immunkonjugat ist gegen das transmembranäre Glycoprotein TROP2 (trophoblast cell-surface antigen 2) gerichtet, das häufig bei dreifach negativem Mammakarzinom auf der Tumoroberfläche überexprimiert wird. In der Phase-III-Studie ASCENT, die inoperable Patientinnen mit fortgeschrittenen Tumoren einschloss, ließ sich gegenüber einer Chemotherapie eine signifikante Verlängerung der progressionsfreien Überlebenszeit bzw. des Gesamtüberlebens erreichen: 5,6 vs. 1,7 Monate, bzw. 12,1 vs. 6,7 Monate [18].
Große Erwartungen werden bei der Behandlung solider Tumoren in Enfortumab vedotin (Padcev®) gesetzt, da es neue Perspektiven beim fortgeschrittenen Urothelkarzinom bietet. Dieser Tumor zeichnet sich durch eine Nectin-4-Überexpression auf seiner Oberfläche aus, so dass es naheliegend war, einen zielgerichtet wirksamen Antikörper gegen Nectin-4 zu entwickeln und ihn mit einem potenten Mitosehemmstoff zu verknüpfen. In der zulassungsrelevanten Phase-II-Studie wurde ein Gesamtansprechen von ca. 44%, eine mediane Ansprechdauer von ca. 7,5 Monaten und eine Verlängerung der Gesamtüberlebenszeit von ca. einem Jahr beobachtet, obwohl die eingeschlossenen Patienten bereits ausgiebig vorbehandelt waren und die Prognose für den weiteren Krankheitsverlauf ungünstig war [9].
Immuntoxine
Immuntoxine unterscheiden sich von Antikörper-Wirkstoff-Konjugaten deutlich: Zum zielgerichteten Angriff auf Tumorzellen werden nicht komplette Strukturen eines monoklonalen Antikörpers, sondern in der Regel nur Teile der antigen-bindenden (variablen) Region des Antikörpers verwendet. Alternativ kommen Strukturelemente eines Zytokins (z. B. IL-2 oder IL-3) zum Einsatz. Durch die geringere Molekülgröße wird eine Aufnahme in die Tumorzelle begünstigt.
Im Gegensatz zu den Antikörper-Wirkstoff-Konjugaten werden bei den Immuntoxinen die zielgerichtet wirksamen Strukturen nicht mit einem Zytostatikum, sondern mit einem fragmentierten Bakterien-Exotoxin – allen voran Pseudomonas- oder Diphtherietoxin – verknüpft. Eine Übersicht und kurze Beschreibung der aktuell verfügbaren Immuntoxine zeigt die Tabelle 5, die wir Ihnen online unter www.deutsche-apotheker-zeitung.de im Artikel an dieser Stelle zur Verfügung stellen. Nach entsprechender Bindung an das extrazelluläre Epitop und nachfolgender Internalisierung, wird das mitgeführte Toxin freigesetzt, das anschließend über die Hemmung der Proteinbiosynthese zu einer irreversiblen Schädigung des intrazellulären Stoffwechsels führt. Die rekombinante Modifikation und Verkleinerung des natürlich vorkommenden Bakterientoxins erleichtert seine Aufnahme in die Tumorzelle, reduziert seine Toxizität auf normale Körperzellen und senkt seine Immunogenität und HATA-Bildung (HATA: human antitoxin-antibodies) [1, 12].
Mit Denileukin diftitox (Ontak®) wurde vor mehr als 20 Jahren in den USA das erste Immuntoxin zugelassen. Zusammengesetzt ist der Wirkstoff aus einem Interleukin-2(IL-2)-Anteil und den Diphtherietoxin-Fragmenten A und B. Bindet der Wirkstoff hochaffin an IL-2-Rezeptoren, die aus den drei Proteinen CD25, CD122 und CD132 zusammengesetzt sind, so wird das Fusionsprotein in die Zelle mittels Endozytose eingeschleust. Wird in fortgeschrittenen Stadien des kutanen T-Zelllymphoms eine CD25-Überexpression nachgewiesen, so kann mit dem Immuntoxin eine Ansprechrate von ca. 30% in Aussicht gestellt werden [15].
INN (Handelsname) | Zusammensetzung | Indikation | Dosierung | HWZ |
|---|---|---|---|---|
Denileukin diftitox (Ontak®) | IL-2-Strukturelement, das mit dem Diphtherietoxin-Fragment A und B verknüpft ist | kutanes T-Zell-Lymphom (CTLC) | 9 bis 18 µg/kg/Tag i.v. (Tag 1 – 5); 21-Tage-Zyklus | k. A. |
Moxetumomab pasudatox(Lumoxiti®) | Fv-Fragment mit CD22-Affinität, das mit einem Pseudomonas-Exotoxin-Fragment verknüpft ist | vorbehandelte rezidivierende bzw. therapierefraktäre Haarzell-Leukämie | 0,04 mg/kg/Tag i.v. (30 Minuten Infusion) (Tag 1, 3 und 5) (28-Tage-Zyklus) | 1,4 Stunden |
Tagraxofusp(Elzonris®) | IL-3-Strukturelement, das an CD123 bindet, und mit einem fragmentierten Diphtherietoxin verknüpft ist | blastische plasmazystoide dendritische Zellneoplasie (BPDCN) | 12 µg/kg/Tag (15 Minuten Infusion) (Tag 1 – 5) 21-Tage-Zyklus | 0,7 Stunden |
Tagraxofusp (Elzonris®) wurde am 7. Januar 2021 von der EMA zugelassen. Das Immuntoxin besteht zum einen aus rekombinantem humanem Interleukin 3 (IL-3), mit dem der Wirkstoff an CD123-überexprimierende Tumorzellen binden kann, zum anderen aus einem fragmentierten Diphtherietoxin. Es ist zur Behandlung einer sehr selten auftretenden Erkrankung, der blastischen plasmazytoiden dendritischen Zellneoplasie (BPDCN) zugelassen. Wegweisend für die Zulassung waren die Ergebnisse der STML-401-0114-Studie, in der es bei 56,9% der zuvor unbehandelten Patienten zu einer vollständigen Rückbildung der Erkrankung ohne relevante Hautanomalien kam [17].
Moxetumomab pasudatox (Lumoxiti®) ist ebenfalls ein Fusionsprotein. Es enthält zum einen das Fragment der variablen IgG-Region (Fv-Fragment), das an CD22-Epitope bindet, zum anderen das 38 kDa-Fragment des Pseudomonas-Exotoxin A. Es ist in den USA zur Behandlung der rezidivierenden bzw. therapierefraktären Haarzell-Leukämie zugelassen. Da es sich um einen murinen Antikörper handelt (-momab), wird er relativ rasch im Körper abgebaut, die Eliminationshalbwertszeit liegt bei nur ca. 1,4 Stunden (Tabelle 5) [7].
Nebenwirkungsspektren
Antikörper-Wirkstoff-Konjugate werden relativ gut vertragen. Typisch sind gastrointestinale Beschwerden (z. B. Nausea, Diarrhoen, Appetitlosigkeit), Zytopenien (Neutropenie, Anämie und Thrombopenie) und infusions-assoziierte Reaktionen. Substanzspezifisch kann es zu ausgeprägten Keratopathien am Auge (z. B. Belantamab mafodotin), hepato-veno-okklusiven Erkrankungen (z. B. Gemtuzumab- oder Inotuzumab ozogamicin), peripheren Neuropathien (Brentuximab- oder Polatuzumab vedotin) oder möglichen Einschränkungen der linksventrikulären Auswurffraktion (Trastuzumab emtansin bzw. -deruxtecan) kommen.
Mit sehr ausgeprägten Nebenwirkungen ist vor allem beim Einsatz der Immuntoxine zu rechnen. So ist 60 Minuten vor der Anwendung von Elzonris® eine Prämedikation mit einem H1- und H2-Antihistaminikum, einem Corticoid und einem Antipyretikum erforderlich, um das Risiko schwerer infusions-assoziierter Reaktionen so gering wie möglich zu halten. Es kommt unter dem Fusionsprotein relativ häufig zu einem Capillary-Leak-Syndrom, zu Atembeschwerden, Ergüssen, Thrombopenien, Anämien, Verwirrtheitszuständen, Synkopen, Sehstörungen, Hyperbilirubinämien, Hautausschlägen, Myalgien, akuten Nierenschäden und zahlreichen Laborveränderungen. Auch beim Moxetumomab pasudatox muss häufig mit behandlungsbedürftigen Nebenwirkungen wie peripheren Ödemen, Nausea, Fatigue, Kopfschmerzen und Fieber gerechnet werden. Teilweise kam es zu einem Capillary-Leak-Syndrom.
Perspektiven
Neben den vielfältigen technologischen Möglichkeiten wie die Entwicklung stabiler gebundener Zytostatika, höherer DAR-Quotienten und weiterer Zytostatika, die mit dem zielgerichteten Antikörper verknüpft werden können, stehen in der klinischen Entwicklung vor allem zwei Schwerpunkte im Vordergrund:
- Sukzessive Erweiterung von Indikationsgebieten, wobei es nicht nur um weitere Tumorentitäten in fortgeschrittenen Stadien, sondern auch um Anwendungen in früheren Stadien der malignen Erkrankung geht.
- Erfassen von neuen Tumor-assoziierten Epitopen, für die dringend der Bedarf für eine Behandlungsoption (unerfüllter medizinischer Bedarf, unmet need) besteht, d. h. neue Antikörper-Wirkstoff-Konjugate.
So könnte z. B. Depatuxizumab mafodotin für Patienten mit neu diagnostiziertem oder rezidivierendem EGFR-amplifizierenden Glioblastom eine wichtige Perspektive sein. Die ersten Phase-II-Studienergebnisse sind ermutigend.
Inwieweit man mit geeigneten prädiktiven Markern die individualisierte Therapie noch verbessern kann, bleibt abzuwarten. Darüber hinaus werden derzeit auch verschiedene Kombinationstherapien mit Antikörper-Wirkstoff-Konjugaten und Checkpoint-Inhibitoren untersucht [13]. Bisher werden alle Antikörper-Wirkstoff-Konjugate nach dem Körpergewicht bzw. der Körperoberfläche des Patienten dosiert. Da sie meist deutlich weniger physikalisch-chemisch stabil sind als die korrespondierenden, unbeladenen monoklonalen Antikörper, fallen in einem zentralisierten Onkologie-Service einer Apotheke, die für die Herstellung patientenindividueller Zubereitungen verantwortlich ist, unvermeidlich Restmengen an, die verworfen werden müssen. Dass einige Kostenträger nur die verabreichten Ist-Mengen – mg-genau – erstatten wollen, nicht aber die entstandenen Verwürfe, ist nicht hinnehmbar. Zu beachten ist, dass während der Lagerung des rekonstituierten Lyophilysats mit einer allmählichen Freisetzung des Zytostatikums aus dem Immunkonjugat gerechnet werden muss, so dass eine Verlängerung der vorgegebenen Haltbarkeiten nur auf der Basis weitergehender Spezifikationsanalysen der pharmazeutischen Hersteller erfolgen kann. Es sei in diesem Zusammenhang an Gemtuzumab ozogamicin erinnert, bei dem sich durch eine vorzeitige Freisetzung des Calicheamicins die Hepatotoxizität erhöht [8]! Die Therapieschemata sind teilweise recht komplex, so dass der Onkologie-Service in darauf spezialisierten Apotheken ein sehr großes Augenmerk bei der Plausibilitätskontrolle von Verordnungen, der Herstellung der patientenindividuellen Zubereitung, der Einhaltung von Spezifikationsgrenzen und der Beratung in der Supportivtherapie bei speziellen Nebenwirkungen (z. B. Keratitis) richten muss. |
Literatur
[1] Allahyari H, Heidari S, Ghamgosha M, et al. Immuntoxin A:a new tool for cancer therapy Tumor Biol 2017;39:epub
[2] Barila G, Rizzi R, Zambello R, Musto P. Drug conjugated and bispecific antibodies for Multiple Myeloma:Improving Immunotherapies off the Shelf. Pharmaceuticals 2021;14epub
[3] Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer. Lancet 2019;394:793-804
[4] Chin P, Chan AC. Ocrelizumab:A New Therapeutic Paradigm for Multiple Sclerosis Biochemistry 2018;57:474-476
[5] Cortés J, Kim S, Chung W et al. Trastuzumab deruxtecan (T-DXd) vs. Trastuzumab emtansine (T-DM1) in patients with HER2+ metastatic breast cancer (mBC):Results of the randomized phase III Destiny Breast 03 study. Ann Oncol 2021;32(Suppl5) LBA1
[6] Deeks ED. Polatuzumab vedotin: First Global Approval. Drugs 2019;79:1467-1475
[7] Dhillon S. Moxetumomab pasudatox: First Global Approval. Drugs 2018;78:1763-1767
[8] Duerr C, Friess W. Antibody-drug conjugates: stability and formulation. Eur J Pharmaceutics and Biopharmaceutics 2019;139:168-176
[9] Halford Z, Anderson MK, Clark MD. Enfortumab vedotin: A First-Class Anti-Nectin-4 Antibody-Drug Conjugate for the Management of Urothelial Carcinoma. Ann Pharmacother 2021;55:772-782
[10] Hoffmann RM, Coumbe BGT, Josephs DH et al. Antibody structure and engineering considerations for the design and function of Antibody Drug Conjugates (ADCs). Oncoimmunology 2018;7:epub
[11] Kantarjian HM et al. Inotuzumab ozogamicin versus standard therapy for acute lymphoblastic leukemia. NEJM 2016;375:740-753
[12] Kaplon H, Muralidharan M, Schneider Z, Reichert JM. Antibodies to watch in 2020. MABS 2020;12:epub
[13] Lassman AB, van den Bent MJ, Gan HK, et al. Safety and efficacy of depatuximab mafodotin + temozolomide in patients with EGFR-amplified recurrent glioblastoma:results from an internationale phase I multicenter trial. Neuro Oncol 2019;21:106-114
[14] Ogitani Y, Hagihara K, Oitate M, et al. Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human EGFR 2 heterogeneity. Cancer Sci 2016;107:1039-46
[15] Olsen E, Duvic M, Frankel A, et al. Pivotal Phase III Trials of Two Dose Levels of Denileukin Diftitox for the Treatment of Cutaneous T-Cell Lymphoma. J Clin Oncol 2001;19:376-388
[16] Paci A, Desnoyer A, Delahousse J, et al. Pharmacokinetic/pharmacodynamic relationship of therapeutic monoclonal antibodies used in oncology:Part 1, monoclonal antibodies, antibody-drug conjugates and bispecific T-cell engagers. Eur J Cancer 2020;128:107-118
[17] Pemmaraju N, Lane AA, Sweet KL, et al. Tagraxofusp in Blastic Plasacytoid Dendritic-Cell Neoplasm. N EJM 2019;380:1628-1637
[18] Seligson JM, Patron AM, Berger MJ et al. Sacituzumab govitecan:an antibody-drug conjugate for the treatment for refractory metastatic triple-negative breast cancer. Ann Pharmacother 2021;55:921-931
[19] Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell 2018;9:33-46
[20] Van der Horst HJ, Nijhof IS, Mutis T, Chamuleau MED. Fc-Engineered Antibodies with Enhanced Fc-Effector Function for the Treatment of B-Cell Malignancies. Cancers 2020;12epub
[21] Yu B, Liu D. Antibody-drug conjugates in clinical trials for lymphoid malignancies and multiple myeloma. J Hematol Oncol 2019;12:94 epub
[22] Hübner B. Antikörper-Wirkstoff-Konjugate in der Tumortherapie: Therapeutisches Potenzial. AMT 2019;37:2-4























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.