
- DAZ.online
- DAZ / AZ
- DAZ 46/2021
- Gut versorgt
Sondenernährung
Gut versorgt
Was Apotheker über enterale Ernährung wissen sollten
Wenn ein Patient sich auf normalem Wege nicht mehr bedarfsdeckend ernähren kann, stellt sich die Frage, ob ihm eine Ernährungssonde gelegt werden soll. In die Antwort darauf fließen nicht nur medizinische, sondern oft auch ethische Aspekte ein, und nicht zuletzt auch die Frage der Kostenübernahme durch die Krankenkasse. Noch vor wenigen Jahren war dies ein komplizierter, mit Fallen gespickter Prozess, und niedergelassene Ärzte trugen ein erhebliches Risiko, von den Kassen unter Bezugnahme auf § 12 und § 31 des SGB V in Regress genommen zu werden. Auch wenn sich diese Situation heute etwas entspannt hat, ist eine wasserdicht dokumentierte Indikationsstellung nach wie vor wichtig, bevor eine Sonde gelegt und die enterale Ernährung begonnen wird. Meist geschieht dies in der Klinik und wird im ambulanten Sektor fortgesetzt.
Erstmals wurde 2007 mit den Leitlinien Enterale und Parenterale Ernährung der Deutschen Gesellschaft für Ernährungsmedizin (DGEM) definiert, dass in Kliniken Ernährungsteams alle Entscheidungen über die klinische Ernährung treffen [1]. Diesen Teams gehören neben dem behandelnden Arzt auch Pflegekräfte, Ernährungsfachkräfte (meist Diätassistenten, seltener Ökotrophologen) sowie Apotheker an. Die 2007 noch zusammengefasste Leitlinie wurde bis heute zu einer Vielzahl von nach Fachbereichen (Chirurgie, Intensivmedizin, Pädiatrie, Geriatrie, mehrere Bereiche der Gastroenterologie) aufgeteilten Leitlinien weiterentwickelt [2 - 9].
Die Indikationsstellung
Es reicht nicht aus festzustellen, dass sich der Patient aktuell nicht auf normalem Wege ernähren kann. Im Auftrag des Gesetzgebers im SGB V hat der gemeinsame Bundesausschuss festgelegt: „Enterale Ernährung ist bei fehlender oder eingeschränkter Fähigkeit zur ausreichenden normalen Ernährung verordnungsfähig, wenn eine Modifizierung der normalen Ernährung und/oder sonstige ärztliche, pflegerische oder ernährungstherapeutische Maßnahmen zur Verbesserung der Ernährungssituation nicht ausreichen.“ Zu dokumentieren ist daher auch, dass diätetische (kalorische Anreicherung), pflegerische (z. B. Füttern), logopädische (Konsistenzerhöhung bei Schluckstörungen) oder ergotherapeutische (Esstraining bei motorischen Problemen) Maßnahmen nicht möglich sind oder erfolglos waren. Eine pharmazeutische Aufgabe im Rahmen eines Medikationsmanagements kann hier die Überprüfung des Medikationsplans auf appetitvermindernde Arzneimittel sein – und gegebenenfalls das Finden von Alternativen dazu. Eine bereits bestehende Mangelernährung muss dokumentiert werden. Dies geschieht meist in der Klinik, da die Diagnose Mangelernährung im System der Fallpauschalen ein zusätzliches Entgelt bringt. Die Evaluation des Ernährungszustands umfasst die Diätanamnese (ungewollter Gewichtsverlust?), den Body Mass Index, das Subjective Global Assessment (Gewicht, Nahrungszufuhr, gastrointestinale Symptome, Leistung, metabolischer Stress und körperliche Zeichen wie z. B. Ödeme) [10] und anthropometrische Messungen (z. B. die Bestimmung des Körperfettanteils durch bioelektrische Impedanzmessung). Diese Parameter werden ergänzt durch die Bestimmung von Laborwerten wie Albumin oder Gesamteiweiß im Blut. Daraus ergibt sich ein Bild über das Ausmaß und die Art der Mangelernährung. Es werden vier Arten der Mangelernährung (Malnutrition) unterschieden:
- Marasmus ist ein Kalorienmangel mit kachektischem Erscheinungsbild. Die klassische Anorexia nervosa meist junger Frauen ist typischerweise ein Marasmus.
- Kwashiorkor ist ein Proteinmangel bei meist extrem kohlenhydratlastiger Ernährung, der durch Ödeme wie Aszites (z. B. der typische angeschwollene Bauch der „Biafra-Kinder“) gekennzeichnet ist. Infolge der extrem eiweißarmen Ernährung reduziert die Leber die Synthese von Albumin, das unter anderem Wasser im intravasalen Lumen bindet. Dieses tritt dann verstärkt in die Gewebe aus und bildet Ödeme.
- PEM (Protein-Energie-Mangelsyndrom) ist ein Protein- und Energiemangel, also die Mischform von Kwashiorkor und Marasmus, und findet sich gehäuft bei geriatrischen Patienten. Die Ödeme an Bauch und Extremitäten können auf den ersten Blick den Eindruck der Mangelernährung kaschieren.
- Hidden Hunger ist ein Mangel an Mikronährstoffen (Vitaminen und Spurenelementen) bei ansonsten oft adipösem Erscheinungsbild. Er stellt keine Indikation zur künstlichen Ernährung dar, sondern zur gezielten Substitution der entsprechenden Mikronährstoffe. Rechnet man den Hidden Hunger zu den Arten der Malnutrition, muss ein Großteil der geriatrischen Patienten als mangelernährt gelten.
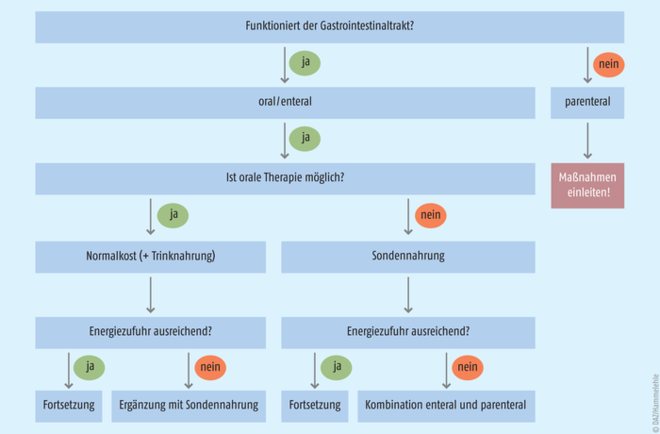
Zur Indikationsstellung gehört es jedoch auch, die Kontraindikationen zu beachten (s. Abb.). In der Klinik zählen dazu ein „akutes Abdomen“ (eher eine OP-Indikation) und eine ausgeprägte Minderdurchblutung des Bauchraums. Innerhalb von 24 Stunden nach einer Operation oder einem Trauma (sogenannte Ebb-Phase) empfehlen die Leitlinien keine Ernährung, obwohl die Studienlage hierzu eher dünn ist [3]. Eine metabolische Intoleranz, unter anderem gekennzeichnet durch Blutzucker- und Lactat-Anstieg sowie Abfall der Phosphat-Spiegel, ist zumeist nur ein Anlass, die Ernährung zu reduzieren. Ethische Gründe, die Ernährung auszusetzen, liegen im Patientenwillen, der zunehmend in Form einer Patientenverfügung dokumentiert ist (s. Kasten „Woran man bei einer Patientenverfügung zur enteralen Ernährung denken sollte“). Das Beenden der Ernährung im Spätstadium einer Alzheimer-Erkrankung, wenn der Patient bereits das Schlucken „verlernt“ hat, ist dagegen nicht ethisch, sondern medizinisch begründet. Die Studienlage zeigt eindeutig, dass die Anlage einer perkutan endoskopischen Gastrostomie (PEG) das Leben dieser Patienten nicht verlängert, sondern oftmals eher verkürzt [11].
Abb.: Entscheidungsbaum zur klinischen Ernährung schwer erkrankter Patienten. Es wird deutlich, dass die Ernährung individuell an die Möglichkeiten angepasst wird und dass sich verschiedene Ernährungsformen ergänzen können. Ebenso deutlich wird, dass eine alleinige parenterale Ernährung auf Dauer kein akzeptabler Zustand ist. Bei bestimmten Stoffwechselstörungen (Verdauungsstörungen, Niereninsuffizienz, Leberversagen) schließt sich ein zweiter Entscheidungsbaum an, bei dem es um die Auswahl der richtigen Sondennahrung geht.
Die Ermittlung des Kalorien- und Proteinbedarfs
Die Bestimmung des Kalorienbedarfs ist seit langer Zeit Gegenstand kontroverser Diskussionen. Auf Intensivstationen wird empfohlen, den Bedarf durch indirekte Kalorimetrie, basierend auf der Messung des Sauerstoffverbrauchs, zu ermitteln. Die Geräte dafür stehen jedoch oft gar nicht zur Verfügung. Alternativ kann bei Patienten mit einem BMI unter 30 kg/m2 von einem Bedarf von 24 kcal pro kg Körpergewicht (KG) ausgegangen werden. Adipöse Patienten sollen hypokalorisch ernährt werden.
Es gibt einen Konsens, dass komplizierte Rechenwege wie die Formel nach Harris und Benedict zur Ermittlung des Kalorienbedarfs nicht mehr eingesetzt werden sollen. Bei mangelernährten Patienten soll eine zu aggressive hyperkalorische Ernährung vermieden werden, da diese zu einem Anstieg vor allem infektiologischer Komplikationen führt.
Neben dem Kalorienziel spielt auch das Proteinziel eine große Rolle für die Genesung des Patienten. Dabei wird in der Akutphase einer Erkrankung ein Wert von 1,0 g/kg Körpergewicht angestrebt. Bestimmte Umstände wie Dialyse (mit Verlusten von Aminosäuren ins Dialysat) oder stark sezernierende Wunden erhöhen den Bedarf auf 1,2 g Protein/kg Körpergewicht. Dann sind eiweißreichere Sondennahrungen zu wählen. Im Setting der Intensivstationen kommen auch Proteinziele bis 1,5 g/kg Körpergewicht vor, weil im Stressstoffwechsel, angeregt durch Cortisol und Katecholamine, die Leber aus Aminosäuren große Mengen Glucose bildet (Gluconeogenese). Meist wird dieser Bedarf durch eine Kombination von enteraler und parenteraler Ernährung gedeckt. Spezielle Sondennahrungen für dieses Setting, die neben dem sehr hohen Proteingehalt auch Fischöl und spezielle Aminosäuren (Arginin oder Glutamin) enthalten, haben sich auf dem Markt nicht durchgesetzt und werden in den Leitlinien nicht empfohlen.
Die Zusammensetzung von Sondennahrungen
Grundsätzlich unterscheiden sich Sondennahrungen nur geringfügig von den in Apotheken vielfach angebotenen Trinknahrungen. Nennenswerte Unterschiede sind das Fehlen von Inhaltsstoffen, die Geschmacksrichtungen definieren (bei Trinknahrungen oft Schokolade oder Vanille), sowie die Kaloriendichte, die bei Sondennahrungen meist 1,0 kcal/ml (normokalorisch) oder 1,5 kcal/ml (hochkalorisch) beträgt. Bei Trinknahrungen, die ja zusätzlich zu einer (reduzierten) Nahrungs- und (in der Regel normalen) Flüssigkeitsaufnahme angeboten werden, beträgt die Kaloriendichte dagegen oft 2,0 kcal/ml. Eine zu hohe Kaloriendichte ist bei Sondennahrungen unerwünscht, da sie mit einer Zunahme von Komplikationen einhergehen kann (s. u.).
Als Protein ist bei den meisten Sondennahrungen Milcheiweiß enthalten. Als Alternativen bei Unverträglichkeiten stehen Sojaeiweiß und – deutlich teurer – Protein aus Fleisch (z. B. Hipp Pute Mais Karotte) zur Verfügung.
Der Fettanteil besteht in der Regel aus Pflanzenölen, wodurch auch der Bedarf an essenziellen mehrfach ungesättigten langkettigen (LCT) Fettsäuren abgedeckt ist.
Die Kohlenhydrate sind Oligo- und Polysaccharide wie z. B. hydrolysierte Stärke, oft auch mit einem geringen Anteil an Di- und Monosacchariden. Mineralstoffe, Vitamine und Spurenelemente werden entsprechend der Diätverordnung zugesetzt.
Woran man bei einer Patientenverfügung zur enteralen Ernährung denken sollte
In Vorträgen zur Patientenverfügung wird meist dazu geraten, den ersten Text – als gesunder Mensch – möglichst allgemein zu formulieren und ihn dann, wenn im Alter Erkrankungen diagnostiziert werden, nach eingehender Beratung spezifischer zu formulieren. So kann z. B. ein Dreißigjähriger festlegen, dass er im Falle eines Wachkomas aufgrund einer akuten Erkrankung oder eines Unfalls nur für eine gewisse, in der Verfügung definierte Zeit, enteral ernährt werden will. Gibt es dann keine Änderung seines Zustands, ist die Ernährung einzustellen.
Wird bei diesem Menschen im Alter von 65 Jahren nun ein Morbus Parkinson diagnostiziert, kann er in der Honeymoon-Phase genannten Zeit, in der ihm seine medikamentöse Einstellung noch ein weitgehend normales Leben ermöglicht, darüber entscheiden, wie es bei Fortschreiten der Erkrankung weitergehen soll. Bei vielen Parkinson-Patienten schließt die Symptomatik der neurodegenerativen Erkrankung eine Beeinträchtigung des Schluckreflexes ein – und das häufig früher als gedacht. Levodopa verliert oft dadurch seine Wirkung, dass es gar nicht mehr zur Zeit der Einnahme in den Magen gelangt. In der Arzneimitteltherapie kann man darauf reagieren, indem man verstärkt Dopamin-Agonisten einsetzt, z. B. Rotigotin-Pflaster. Was die Ernährung betrifft, steht die Entscheidung an, ob eine PEG gelegt werden soll.
Unterlässt man die Anlage einer Sonde ist der Weg vorgezeichnet: Aus Angst vor Aspiration wird die Nahrung zunehmend weniger und damit hypokalorisch. Dennoch kommt es irgendwann zur ersten Aspirationspneumonie mit Krankenhauseinweisung, zur parenteralen Antibiotikatherapie (da man bei oralen Antibiotika ja nicht sicher sein kann, dass sie dort ankommen, wo sie wirken sollen). Begleitet wird die akute Erkrankung von Stressstoffwechsel, der zum weiteren Abbau der ohnehin geschwächten Muskulatur führt – ein Teufelskreis. Dieser Vorgang wiederholt sich bis zum Eintritt des Todes einige Male.
Ist das ein gnädiger Tod? Unter Umständen ja, wenn die Alternative ein langes Siechtum in dementer Umnachtung ist. Bei einem großen Teil der Patienten wird einige Jahre nach der Parkinson-Diagnose auch eine Demenz festgestellt. Oft handelt es sich dabei um eine Lewy-Körper-Demenz mit relativ rascher Progredienz. In einem solchen Fall könnte die Patientenverfügung (frühzeitig, solange der Patient noch entscheiden kann) lauten, dass auf das Legen einer perkutanen endoskopischen Gastrostomie verzichtet werden und eine Aspirationspneumonie nur bis zu einem bestimmten Stadium antibiotisch behandelt werden soll. Palliativmediziner bezeichnen die Pneumonie als „Freund des alten Mannes“, weil der Tod nicht durch Ersticken (Anstieg des CO2-Partialdrucks im Blut), sondern durch Sauerstoffmangel eintritt.
Ist der Patient dagegen geistig fit, kann er dank einer PEG trotz körperlicher Einschränkungen Jahre gewinnen, in denen er am Leben teilnehmen kann. Dabei ist anzumerken, dass die PEG selbst – im Gegensatz zu einer nasalen Sonde – den Schluckreflex nicht stört. Mit entsprechender Vorsicht ist es damit sogar noch möglich, Essen zu genießen. Schließt der Patient mit seiner Patientenverfügung jegliche künstliche Ernährung aus, beraubt er sich dieser Chance.
Ballaststoffhaltige Sondennahrung enthält nach dem Vorbild einer gesunden Ernährung Cellulose, Hemicellulose, Pektin, Inulin, Guar oder Fructooligosaccharide. Da diese nicht von jedem Patienten vertragen werden, gibt es von den meisten Präparaten auch eine ballaststofffreie Version. Aus all diesen Komponenten wird eine Emulsion hergestellt und steril in eine licht- und luftdichte Verpackung abgefüllt. Die dafür früher verwendeten Braunglasflaschen werden dabei mehr und mehr durch Folienbeutel verdrängt. Moderne Sondennahrungen sind frei von relevanten Mengen an Purinen, Cholesterol und Lactose. Für bestimmte Erkrankungen werden Sondennahrungen mit veränderter Zusammensetzung angeboten [12].
Bei Verdauungsstörungen (Pankreasinsuffizienz oder kurzes für die Resorption zur Verfügung stehendes Darmsegment) gibt es Oligopeptid-Diäten (OPD) mit vorverdautem Protein. Sie werden oft kombiniert mit mittelkettigen Triglyceriden (MCT). MCT-Fette haben den Vorteil, dass sie intakt, also ohne die Spaltung in Fettsäuren und Glycerin durch Pankreaslipasen, resorbiert werden können. So können heute die meisten Patienten mit schwerer Pankreatitis auch bei Unverträglichkeit hochmolekularer Sondennahrungen enteral ernährt werden, während man früher oft die parenterale Ernährung wählte.
Sondennahrungen für niereninsuffiziente Patienten werden unterteilt in Prädialyse- und Dialyse-Nahrungen. Beiden gemeinsam ist der reduzierte Anteil an Phosphat-, Kalium- und Natrium-Ionen. Prädialyse-Nahrungen sind nach dem heutigen Stand der Wissenschaft für ein Proteinziel von 0,8 g/kg Körpergewicht ausgelegt, während der Dialyse steigt der Proteingehalt dagegen auf 1,2 g/kg Körpergewicht.
Hepa-Sondennahrungen sind für Patienten in späten Stadien einer Leberzirrhose konzipiert. Sie enthalten einen hohen Anteil an verzweigtkettigen Aminosäuren (Leucin, Isoleucin und Valin), was die steigenden Ammoniak-Spiegel günstig beeinflusst. Entsprechend ist ihr leitliniengerechter Einsatz auf die Fälle beschränkt, in denen bereits erhöhte Ammoniak-Spiegel im Blut gemessen oder Symptome einer hepatischen Enzephalopathie beobachtet werden.
Die oben genannten Typen von Sondennahrungen sind im ambulanten Sektor bei entsprechend dokumentierter Indikationsstellung erstattungsfähig. Bei vielen anderen Präparaten, z. B. Diabetiker-Trink- und Sondennahrungen, verweigern die Kostenträger häufig die Erstattung unter Hinweis auf den nicht belegten Nutzen im Vergleich zu den Standardpräparaten.
Komplikationen und Monitoring
Wie häufig Komplikationen auftreten, ist stark von der Applikationsform abhängig. Die kontinuierliche Dauertropfapplikation ist insbesondere in Kliniken üblich, da es dabei seltener zu Komplikationen kommt. Die intermittierende Bolusapplikation, bei der z. B. mehrmals täglich 250 ml innerhalb weniger Minuten appliziert werden, erfordert speziell programmierbare Pumpen und ist gelegentlich in Pflegeheimen und bei mobilen Patienten zu finden. Der Vorteil besteht darin, dass der Patient in den Pausen nicht mit Beutel oder Flasche und Pumpe verbunden sein muss. Diese Applikationsform ist zwingend an eine gastrale Sondenlage gebunden. Der Dünndarm ist nicht in der Lage, größere Volumina in kurzer Zeit aufzunehmen, und reagiert mit starken Bauchschmerzen, Krämpfen, zum Teil auch Kreislauf- und Hautreaktionen (Flush). Diesen Zustand, der immer ein Hinweis auf eine duodenale Fehllage ist, nennt man Dumping-Syndrom.
Ein weiteres „Syndrom“ in Zusammenhang mit enteraler Ernährung ist das tube feeding syndrome. Dabei handelt es sich schlicht um eine Exsikkose, die entsteht, wenn schlecht ausgebildetes Pflegepersonal oder pflegende Angehörige irrtümlich glauben, mit drei Beuteln à 500 ml würden dem Patienten bereits 1,5 Liter Flüssigkeit zugeführt. Die Folge ist im Labor typischerweise messbar als Hypernatriämie. Vor allem bei geriatrischen Patienten wird es begleitet von deliranten Zuständen. Ein frühes Warnsignal ist eine Obstipation, ein schneller Test ist das Kneifen in den Handrücken der Patienten. Bleibt danach eine Hautfalte stehen, ist der Patient dehydriert. Je höher die Kaloriendichte der Sondennahrung, desto geringer ist naturgemäß ihr Flüssigkeitsanteil. Deshalb sollten außerhalb von Kliniken hyperkalorische Präparate nur eingesetzt werden, wenn aus medizinischen Gründen eine Flüssigkeitsrestriktion indiziert ist. In jedem Fall muss die Sondennahrung durch Wasser oder Tee ergänzt werden. Schwarztee ist günstig bei Durchfallneigung, durch Komplexbildung sind aber Interaktionen möglich unter anderem mit Psychopharmaka und Eisen-Präparaten.
Reflux, Völlegefühl, Übelkeit und Erbrechen kommen häufig vor und sollten immer zu der Frage nach der korrekten Sondenlage führen. Gegebenenfalls muss auch die Zufuhrrate reduziert werden, eine Bolusgabe durch kontinuierliche Applikation ersetzt oder die Substratauswahl überdacht werden. Das reflexartige Verordnen von Protonenpumpenhemmern ist nicht immer zielführend und kann die Situation eventuell auch verschlimmern. Gerade wenn aus pathophysiologischen (z. B. diabetische Gastroparese) oder pharmakologischen (Opioide, Anticholinergika) Gründen die Peristaltik gestört ist, können Darmkeime einen durch Protonenpumpenhemmer neutralisierten Magen schnell besiedeln. Werden dann hochkalorische Substrate gegeben, können diese als Nährboden dienen und zur Bildung von Gasen führen, die den Mageninhalt in den Ösophagus drücken können.
Diarrhöen sind bei Sondenpatienten, auch wenn einige Hersteller dem Pflegepersonal mit ihrem Marketing etwas anderes suggerieren, eher selten auf den hohen osmotischen Druck der Nahrung zurückzuführen, häufig jedoch auf eine fehlende Einschleichphase oder eine zu schnelle Applikation. Zu empfehlen ist immer eine Untersuchung des Stuhls. Enthält er Fett, liegt eine Verdauungsstörung vor, was durch Umstellung auf ein MCT-haltiges Präparat meist behoben werden kann. Pathogene Keime – schlimmstenfalls Clostridioides difficile – sind in der Regel nicht durch die Sondennahrung, sondern durch eine vorangegangene Antibiotikatherapie selektiert worden. Gerade für uns Pharmazeuten lohnt sich ein Blick in den Medikationsplan. Viele Patienten, die unter Diarrhö leiden, hatten vorher auch schon andere Komplikationen, darunter Übelkeit mit oder ohne Erbrechen. Wurden dafür prokinetische Antiemetika wie Metoclopramid oder Domperidon verordnet und danach nicht wieder abgesetzt, ist eine Arzneimittelnebenwirkung als Ursache der Diarrhö schnell identifiziert. Um Komplikationen zu vermeiden, sollte bei Sondenpatienten ein intensiveres Monitoring angesetzt werden als bei normal ernährten Menschen. Puls, Blutdruck, Hautturgor (der Hautfalten-Test am Handrücken) und – sofern möglich – einfache kognitive Tests im Rahmen einer normalen Konversation (einschließlich der Frage nach dem Durstgefühl!) sollten täglich erfolgen, abhängig von Vorerkrankungen auch eine Blutzuckermessung. Auch Stuhlfrequenz und -konsistenz sollten dokumentiert werden. Ein Blutbild mit Bestimmung von Serumelektrolyten, Hämoglobin, Hämatokrit, Albumin oder Gesamteiweiß, Serumkreatinin und -harnstoff sollte auch in Pflegeheimen häufiger erfolgen als bei anderen Patienten.
Erfolgsrate höher als angenommen
Enterale Ernährung hat zu Unrecht ein schlechtes Image. Das Bild vom Patienten, der in Abhängigkeit von Nahrung, die keinen Genussfaktor mehr hat, dem Tode entgegendämmert, trifft bei Weitem nicht in allen Fällen zu. Oft gelingt es durch Sondennahrung, Patienten aus der Mangelernährung heraus in einen Zustand zu bringen, in dem sie wieder aktiv am Leben teilnehmen können. Wer gerade seine Patientenverfügung ausfüllt, sollte daher einen differenzierteren Blick auf die Thematik werfen, bevor er jegliche künstliche Ernährung ablehnt. |
Literatur
[1] Enterale und Parenterale Ernährung. Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), Thieme Verlag 2007
[2] Klinische Ernährung in der Chirurgie. S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/005, in Überarbeitung, www.awmf.org
[3] Klinische Ernährung in der Intensivmedizin. S2k-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/004, www.awmf.org
[4] Parenterale Ernährung in der Kinder- und Jugendmedizin. S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/023, in Überarbeitung, www.awmf.org
[5] Klinische Ernährung in der Geriatrie. Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/019, www.awmf.org
[6] Klinische Ernährung in der Gastroenterologie. Teil 1 – Leber. Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/024, www.awmf.org
[7] Klinische Ernährung in der Gastroenterologie. Teil 2 – Pankreas. S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/025, www.awmf.org
[8] Klinische Ernährung in der Gastroenterologie. Teil 3 – Chronisches Darmversagen. S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/025, www.awmf.org
[9] Klinische Ernährung in der Gastroenterologie. Teil 4 – Chronisch entzündliche Darmerkrankungen. S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin (DGEM), AWMF-Register-Nr.: 073/027, www.awmf.org
[10] Detsky AS et al. What is subjective global assessment of nutritional status? JPEN J Parenter Enteral Nutr 1987;11(1):8 – 13
[11] Goldberg LS, Altman W. The role of gastrostomy tube placement in advanced dementia with dysphagia: a critical review. Clin Interv Aging 2014;14(9):1733 – 739
[12] Adolph M, Pirlich M. Klinische enterale und parenterale Ernährung. In: Biesalski HK et al. (Hrsg.): Ernährungsmedizin. 5. Auflage, Thieme Verlag 2018




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.