
- DAZ.online
- DAZ / AZ
- DAZ 36/2021
- Wenn Medikamente Diabetes...
Nebenwirkungen
Wenn Medikamente Diabetes auslösen
Wissenswertes rund um den Steroid-Diabetes
Glucocorticoide kommen aufgrund ihrer antiinflammatorischen Wirkung häufig bei der Behandlung von Entzündungskrankheiten, z. B. Morbus Crohn und Asthma bronchiale, zum Einsatz. Virale Infekte wie COVID-19 oder Hepatitis werden ebenfalls damit behandelt. Und auch zur Therapie von Autoimmunerkrankungen, wie rheumatoider Arthritis oder multipler Sklerose, sowie bei Tumorerkrankungen werden Glucocorticoide angewendet [1]. In der westlichen Welt erhalten rund 1% aller Menschen langfristig systemische Glucocorticoide; in Deutschland werden knapp eine Million Patienten damit behandelt [2, 3]. Davon entwickelt etwa jeder Zehnte infolge seiner Therapie einen Diabetes mellitus [2]. Diese Form der Zuckerkrankheit wird auch Steroid-Diabetes genannt und gehört zu einer Untergruppe des Diabetes vom Typ 3, die durch Chemikalien oder Medikamente verursacht wird [4, 5]. Neben Glucocorticoiden können unter anderem auch Schilddrüsenhormone, Thiazid-Diuretika, Beta-Sympathomimetika, das Antiprotozoikum Pentamidin, das Antiepileptikum Phenytoin, das Hypoglykämikum Diazoxid, Interferon γ sowie das B-Vitamin Nicotinsäure und das Nagetiergift Pyrinuron zu einem Diabetes Typ 3e führen [5, 6]. Die ätiologische Klassifikation des Diabetes mellitus nach den Kriterien der American Diabetes Association (ADA) ist in vereinfachter Form in Tabelle 1 dargestellt [4, 5].
Klasse | Beschreibung | |
|---|---|---|
I. | Diabetes mellitus Typ 1 (Beta-Zell-Zerstörung, die zum absoluten Insulin-Mangel führt) | |
A. immunologisch bedingt (Sonderform: LADA) | ||
B. idiopathisch (in Europa selten) | ||
II | Diabetes mellitus Typ 2 (Insulin-Resistenz und/oder Insulin-Mangel) | |
III | andere spezifische Diabetestypen (Diabetes mellitus Typ 3) | |
A. genetische Defekte der Beta-Zellfunktion | z. B. MODY3 (Chromosom 12, HNF-1α), MODY2 (Chromosom 7, Glucokinase), MODY1 (Chromosom 20, HNF-4α), mitochondriale DNA | |
B. genetische Defekte der Insulin-Wirkung | z. B. Insulinresistenz Typ A, Leprechaunismus, lipatrophischer Diabetes | |
C. Erkrankungen des exokrinen Pankreas | z. B. Pankreatitis, Trauma/Pankreatektomie, zystische Fibrose, Hämochromatose, fibrosierend verkalkende Pankreatitis | |
D. Endokrinopathien | z. B. Akromegalie, Cushing-Syndrom, Hyperthyreose, Aldosteronom (primärer Hyperaldosteronismus) | |
E.Arzneimittel- oder Chemikalien-induziert | z. B. Pyrinuron, Pentamidin, Nicotinsäure, Glucocorticoide, Schilddrüsenhormone, Diazoxid, β-adrenerge Agonisten, Thiazid-Diuretika, Dilantin, Interferon α | |
F. Infektionen | z. B. kongenitale Röteln, Zytomegalievirus | |
G. seltene, immunologisch bedingte Formen | z. B. Stiff-man-Syndrom, Anti-Insulin-Rezeptor-Antikörper | |
H. andere, manchmal mit Diabetes assoziierte Syndrome | z. B. Down-Syndrom, Klinefelter-Syndrom, Turner-Syndrom, Friedreichsche Ataxie, Chorea Huntington, Porphyrie | |
IV. | Gestationsdiabetes (Schwangerschaftsdiabetes) | |
Wie verursachen Glucocorticoide einen Diabetes und welche Risikofaktoren gibt es?
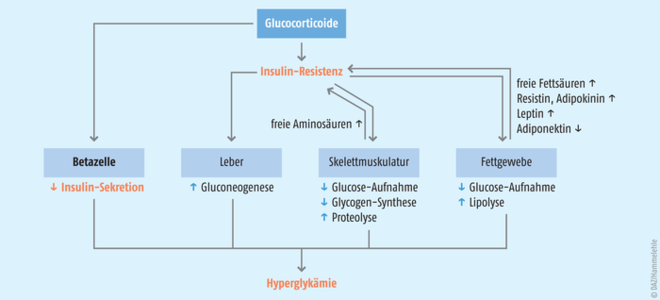
Glucocorticoide können über verschiedene Mechanismen zu einer Erhöhung des Blutzucker-Spiegels beitragen (Abb. 1) [7 – 10]:
- Glucocorticoide induzieren in den Zellen von Leber, Skelettmuskulatur und Fettgewebe eine vermehrte Insulin-Resistenz.
- In der Leber fördern Glucocorticoide über eine erhöhte Expression der Phosphoenolpyruvat-Carboxykinase (PEPCK) und Glucose-6-Phosphatase die hepatische Glucose-Produktion und -Freisetzung.
- Im Skelettmuskel stören Glucocorticoide die Insulin-Signalkaskade und hemmen so die Aufnahme der Insulin-abhängigen Glucose sowie die Glykogen-Synthese. Zudem induzieren Glucocorticoide eine vermehrte Proteolyse, so dass zusätzlich Aminosäuren im Serum freigesetzt werden, die wiederum den Insulin-Signalweg in der Muskelzelle beeinträchtigen.
- Im Fettgewebe haben Glucocorticoide direkte Effekte auf verschiedene Fettgewebshormone (Adipokine). So wird die Expression von Resistin und Adipokinin, die die Glucose-Toleranz beeinflussen, gefördert. Demgegenüber wird die Expression von Adiponektin ‒ ein Hormon, das die Wirkung des Insulins an den Fettzellen verstärkt ‒ gehemmt. Zudem steigt der Leptinspiegel im Blut an. Diese Effekte führen letztlich zur Fettmobilisierung aus Adipozyten (Lipolyse) und zur Freisetzung von Fettsäuren, die in den Muskelzellen akkumulieren und die Glucose-Aufnahme durch Beeinflussung des Insulin-Signalwegs reduzieren.
- Darüber hinaus beeinträchtigen Glucocorticoide die Insulin produzierenden Betazellen in den Langerhans-Inseln des Pankreas und hemmen so die Insulin-Sekretion.
Auf molekularbiologischer Ebene binden die Glucocorticoide an spezifische Rezeptoren, die vom Zytoplasma in den Zellkern verlagert werden und dort durch Wechselwirkung mit DNA-Sequenzen die Expression verschiedener Gene fördern oder hemmen können. In den letzten Jahren wurde eine Reihe von Transkriptionsfaktoren identifiziert, die in diese Genregulationsprozesse involviert sind. Dazu zählt der in vielen Geweben nachweisbare Faktor E47 [11]. Im Rahmen einer Studie konnte gezeigt werden, dass Mäuse, die diesen Transkriptionsfaktor nicht bilden (homozygote E47-Knockout-Mäuse), vor den Nebenwirkungen der Glucocorticoide wie Hyperglykämie, Hyperlipidämie und hepatischer Steatose geschützt waren, während die Steroidgabe bei Mäusen mit intaktem E47 zu den unerwünschten Stoffwechselveränderungen führte. Die Autoren der Studie hoffen nun, dass diese Erkenntnisse ein Ansatzpunkt für neuartige Glucocorticoid-Therapien mit reduzierten Nebenwirkungen sein könnten [11].
Als Risikofaktoren für die Entstehung eines Glucocorticoid-induzierten Diabetes mellitus gelten eine höher dosierte Glucocorticoid-Behandlung (Prednisolon > 20 mg/Tag, Hydrocortison > 50 mg/Tag, Dexamethason > 4 mg/Tag), eine längere Dauer der Glucocorticoid-Therapie sowie fortgeschrittenes Alter und ein hoher Body-Mass-Index [12]. Auch eine vorherige Glucose-Intoleranz oder gestörte Glucose-Toleranz, ein Schwangerschaftsdiabetes oder eine frühere Glucocorticoid-induzierte Hyperglykämie in der Anamnese prädestinieren die Betroffenen für die Entwicklung eines Steroid-Diabetes, ebenso wie ein Diabetes mellitus in der Familienanamnese sowie ein HbA1c-Wert ≥ 6% [12]. Im Rahmen eines Morbus Cushing kann der daran erkrankte Patient infolge des damit verbundenen Überschusses an Cortisol ebenfalls einen Glucocorticoid-induzierten Diabetes entwickeln (siehe Kasten „Morbus Cushing“).
Morbus Cushing
Morbus Cushing (auch zentrales Cushing-Syndrom) ist eine Erkrankung, bei der im Körper des Patienten zu viel Kortisol vorhanden ist [22]. Ursache hierfür ist meist ein in der Hypophyse lokalisiertes Adenom [22]. Dieser Tumor setzt ungehemmt adrenocorticotropes Hormon (ACTH) frei, das wiederum die übermäßige Produktion von Kortisol in der Nebennierenrinde anregt [22]. Charakteristische Symptome eines Morbus Cushing sind unter anderem Vollmondgesicht, Stammfettsucht, Stiernacken, Muskelschwäche und -atrophie sowie eine diabetische Stoffwechsellage infolge der gesteigerten Synthese des Glucocorticoids Cortisol [22]. Durch eine operative Entfernung des Adenoms oder – falls dies nicht möglich ist - durch Bestrahlung des Tumors sowie durch die Gabe des Somatostatin-Analogons Pasireotid, das die ACTH-Sekretion hemmt, lässt sich ein Morbus Cushing und damit auch der Steroid-Diabetes behandeln [22]. Sollten diese Therapieoptionen nicht greifen, dann ist als letzte Alternative auch eine chirurgische Entfernung beider Nebennieren möglich, wobei der Patient dann lebenslang eine Glucocorticoid- und Mineralcorticoid-Substitution erhalten muss [22].
Wie wird ein Steroid-Diabetes diagnostiziert?
Definiert ist ein steroidinduzierter Diabetes als abnorm erhöhter Blutzucker-Spiegel in Verbindung mit der Verwendung von Glucocorticoiden. Dabei unterscheiden sich die diagnostischen Kriterien prinzipiell nicht von denen anderer Diabetestypen [13]. Demnach liegt ein Diabetes mellitus dann vor, wenn eines der folgenden Kriterien erfüllt ist [14]:
- Nüchtern-Blutzucker-Spiegel ≥ 7 mmol/l (≥ 126 mg/dl)
- Blutzucker-Spiegel von ≥ 11,1 mmol/l (≥ 200 mg/dl) zwei Stunden nach Einnahme von 75 g Glucose in einem oralen Glucose-Toleranztest
- HbA1c-Wert ≥ 6,5% (≥ 48 mmol/mol)
- Gelegenheits-Blutzucker-Spiegel ≥11,1 mmol/l (≥ 200 mg/dl) bei Patienten mit klassischen Symptomen einer Hyperglykämie oder einer hyperglykämischen Krise.
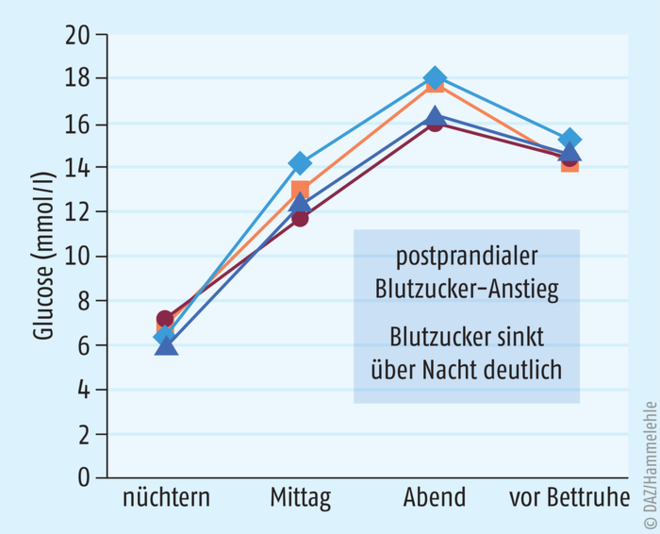
Um eine Glucocorticoid-induzierte Hyperglykämie möglichst frühzeitig erkennen und nötigenfalls rasch behandeln zu können, sollten zumindest stichprobenartig Blutzucker-Messungen zu Beginn und im weiteren Verlauf einer Steroidtherapie durchgeführt werden. Dabei ist es wichtig, die Pharmakokinetik bzw. -dynamik des eingesetzten Glucocorticoids bei der Wahl des Messzeitpunkts zu berücksichtigen. Ansonsten besteht das Risiko, den Zeitpunkt zu verpassen, zu dem der Blutzucker-Wert tatsächlich erhöht ist [15]. So ist bei morgendlicher Gabe von Prednison der Nüchtern-Blutzucker-Wert oftmals im Normbereich, kann dann aber im Verlauf des Tages ansteigen, um über Nacht wiederum deutlich abzusinken (Abb. 2). Damit ist der Nüchtern-Blutzucker-Wert nicht für ein Screening auf Steroid-Diabetes geeignet. Dies bestätigen auch die Daten einer Studie, in der bei Patienten, die wegen einer entzündlichen rheumatischen Erkrankung mit Prednisolon behandelt wurden, die Diagnose eines Diabetes anhand des Nüchtern-Blutzucker-Wertes nur mit einer Sensitivität von 33% gelang [16]. Auch die Bestimmung des HbA1c-Wertes ist für die Diagnostik eines Steroid-Diabetes nicht geeignet, da die Stoffwechsellage vor Beginn der Glucocorticoid-Therapie möglicherweise noch normal war und der Langzeitzucker-Wert im Blut dann den aktuellen Status nicht korrekt erfasst [15]. Zudem spiegelt der HbA1c-Wert die vorwiegend postprandiale Blutzucker-Erhöhung nur ungenau wider [15].
Abb. 2: Typisches Tagesprofil des Blutzucker-Spiegels bei morgendlicher Gabe von Prednison (nach [23]).
Ob ein Patient unter einer Glucocorticoid-Therapie einen Diabetes mellitus entwickelt hat, sollte daher durch postprandiale Blutzucker-Messungen überprüft werden [15]. Optimal geeignet ist hier der postprandiale, zwei Stunden nach dem Mittagessen gemessene Plasma-Glucose-Spiegel [8]. Dabei liegt der Grenzwert, ab dem ein Steroid-Diabetes beim Vorliegen von entsprechenden Symptomen diagnostiziert wird, bei ≥ 200 mg/dl (≥ 11,1 mmol/l) [15]. Die Messung erfolgt im venösen Plasma und sollte durch eine zweite Messung bestätigt werden. Ein Tagesprofil der Blutzucker-Werte ist ebenfalls geeignet, um einen Steroid-Diabetes zu erkennen. Dabei sollten Messungen vor dem Mittagessen und Abendessen durchgeführt werden. Zusätzliche Messungen ein bis zwei Stunden nach den Mahlzeiten können die Sensitivität der Diagnostik weiter erhöhen [15].
Management des Steroid-Diabetes
Die Therapie beim Glucocorticoid-induzierten Diabetes sollte individuell an die Bedürfnisse des Patienten angepasst und dementsprechend flexibel gestaltet werden. Dabei müssen das Ausmaß der Hyperglykämie, die Wirkstärke und -dauer des jeweils gegebenen Glucocorticoids (Tab. 2) sowie die angestrebte Dauer und Dosierung der Glucocorticoid-Therapie und eventuelle Risikofaktoren bzw. Vorerkrankungen des Patienten berücksichtigt werden [8, 15]. Zur Behandlung eines Steroid-Diabetes kommen ‒ wie bei anderen Formen von Diabetes mellitus auch ‒ nichtmedikamentöse Maßnahmen, orale Antidiabetika und verschiedene Arten von Insulin zum Einsatz.
Glucocorticoide | Wirkdauer | relative glucocorticoide Potenz |
|---|---|---|
Cortison (Hydrocortison) | kurz (8 - 12 Stunden) | 1 |
Prednison, Prednisolon | mittellang (12 - 36 Stunden) | 4 |
Triamcinolon | lang (36 – 72 Stunden) | 5 |
Dexamethason | lang (< 48 Stunden) | 30 – 40 |
Betamethason | lang (48 Stunden) | 25 |
Indikation für eine antidiabetische Therapie abklären
Bevor eine antidiabetische Therapie eingeleitet wird, sollte zunächst geklärt werden, ob eine Hyperglykämie bei dem jeweiligen Patienten überhaupt behandelt werden muss. So ist nach einer kurzfristigen Gabe von Glucocorticoiden eine Therapie der Hyperglykämie nicht immer notwendig, insbesondere wenn die postprandialen Werte zur Mittagszeit nur leicht erhöht sind [15]. Denn in vielen Fällen normalisieren sich die Blutzucker-Werte nach Absetzen der Corticosteroide wieder. Wenn ein Patient aber über mehrere Wochen oder sogar dauerhaft mit Glucocorticoiden behandelt werden muss, dann ist in der Regel eine Therapie der Hyperglykämie erforderlich [15]. Dabei erfordern postprandiale Blutzucker-Werte zwischen 7,8 und 11,1 mmol/l (140 und 200 mg/dl) zunächst keine Behandlung, wobei jedoch das Risiko einer zunehmenden Überlastung der Betazellen und somit einer Stoffwechselentgleisung besteht [10]. Daher sollte bei diesen Patienten der Blutzucker-Spiegel regelmäßig kontrolliert werden [10]. Liegen die postprandialen Blutzucker-Werte über 11,1 mmol/l (200 mg/dl), dann ist eine antidiabetische Therapie indiziert [10].
Nichtmedikamentöse Maßnahmen
Wie beim Diabetes mellitus vom Typ 1 oder 2 können auch bei der Glucocorticoid-induzierten Hyperglykämie durch entsprechende Ernährung (Einschränkung vor allem von verarbeiteten Kohlenhydraten, Vermeidung von Zwischenmahlzeiten, erhöhter Ballaststoffanteil), durch vermehrte körperliche Aktivität und gegebenenfalls durch Gewichtsabnahme die Blutzucker-Werte wirksam verbessert werden [15]. Die jeweilige Grunderkrankung des Patienten, die zur Steroidtherapie führt, kann jedoch die Umsetzung solcher Maßnahmen einschränken [15]. So ist beispielsweise bei Asthmapatienten eine vermehrte sportliche Betätigung oftmals problematisch.
Orale Antidiabetika
Bei Patienten ohne vorbestehenden Diabetes mellitus, die niedrig dosierte Glucocorticoide erhalten und postprandiale Blutzucker-Werte unter 13,9 mmol/l (250 mg/dl) aufweisen, kann ein Therapieversuch mit oralen Antidiabetika unternommen werden [10]. Allerdings wurde deren Effekt bei der Behandlung des Steroid-Diabetes bisher nur in wenigen Studien untersucht [15]. Prinzipiell stehen jedoch verschiedene Wirkstoffe zur Verfügung [15, 17 – 20]:
- Metformin: Die Substanz hemmt die hepatische Gluconeogenese und mindert in der Folge die Freisetzung von Zucker aus der Leber. Außerdem erhöht Metformin die Insulin-Sensitivität und damit die periphere Verwertung von Glucose. Es gibt Hinweise darauf, dass Metformin die Langzeitnebenwirkungen der Steroidanwendung reduzieren kann. Es fehlt jedoch der Nachweis eines Nutzens bei akuter steroidinduzierter Hyperglykämie. Eine Kombination aus Metformin und einem Gliptin kann besonders geeignet für die Behandlung eines Steroid-Diabetes sein, da das zusätzliche Gliptin spezifisch den postprandialen Blutzucker-Anstieg bekämpft, wobei am besten eine einmalige Dosis am Morgen verabreicht wird.
- Glitazone (z. B. Pioglitazon): Diese Substanzen erhöhen die Empfindlichkeit der Zellen von Leber, Muskulatur und Fettgewebe für Insulin, senken also die Insulin-Resistenz. Fettsäuren und Glucose werden dadurch vermehrt in die Zellen aufgenommen und im Stoffwechsel umgesetzt. Glitazone werden daher auch Insulin-Sensitizer und ‒ nach ihrem chemischen Grundgerüst ‒ Thiazolidindione genannt. Glitazone haben jedoch einen verzögerten Wirkeintritt sowie einen ungünstigen Effekt auf Gewicht und Knochen (Osteoporose).
- Sulfonylharnstoffe (z. B. Glibenclamid, Glimepirid, Gliclazid und Gliquidon): Diese Wirkstoffe fördern die Insulin-Freisetzung aus der Betazelle des Pankreas. Ein kurzwirksamer, einmal täglich eingenommener Sulfonylharnstoff, wie z. B. Gliclazid, kann den Blutzucker-Spiegel gut kontrollieren. Erhalten Patienten mit Steroid-Diabetes langwirksame Sulfonylharnstoffe, dann besteht die Gefahr von nächtlichen Hypoglykämien, wenn das Glucocorticoid nur einmal täglich verabreicht wird und der Blutzucker-Spiegel daher nachts sowieso absinkt.
- Glinide (Repaglinid und Nateglinid): Ähnlich wie Sulfonylharnstoffe steigern Glinide ‒ unabhängig vom aktuellen Blutzucker ‒ die körpereigene Produktion und Freisetzung von Insulin. Im Gegensatz zu den Sulfonylharnstoffen setzt die Wirkung aber rasch ein und hält nur kurz an. Das Risiko einer Hypoglykämie ist bei einer Therapie mit Gliniden damit deutlich geringer.
- DPP-4-Hemmer bzw. Gliptine (z. B. Sitagliptin, Saxagliptin, Vildagliptin und Linagliptin): Diese Wirkstoffe hemmen das Enzym DPP-4 (Dipeptidylpeptidase 4) im Darm. Dadurch werden bestimmte Darmhormone verlangsamt abgebaut, was wiederum die Insulin-Freisetzung fördert. In der Folge wird der postprandiale Blutzucker-Spiegel gesenkt. Zudem hemmen Gliptine die hepatische Gluconeogenese und sind gewichtsneutral bis -reduzierend. Es gibt derzeit jedoch keine validen Daten, die den Einsatz von Gliptinen zur Therapie von Steroid-Diabetes stützen würden.
- GLP-1-Agonisten (z. B. Albiglutid, Dulaglutid, Semaglutid und Liraglutid): Diese Substanzen ahmen die Wirkung des Darmhormons GLP-1 (Glucagon-like Peptide-1) nach, das die Abgabe von Insulin aus der Bauchspeicheldrüse fördert und gleichzeitig den „Gegenspieler“ von Insulin, das Hormon Glucagon, hemmt. Der Einsatz von GLP-1-Agonisten bei Steroid-Diabetes ist bislang aber ebenfalls nicht durch Studiendaten gestützt.
- SGLT-2-Inhibitoren (z. B. Dapagliflozin und Empagliflozin): Diese Substanzen blockieren das Enzym SGLT-2 (Sodium-Glucose Linked Transporter 2) in der Niere. Dies wiederum führt zu einer verstärkten Ausscheidung der Glucose über den Harn. Die Wirkung von SGLT-2-Inhibitoren ist im Unterschied zu anderen Antidiabetika also von Insulin unabhängig. Die Substanzen senken das Gewicht und den Blutdruck. Zudem sind sie nicht mit einem erhöhten Hypoglykämierisiko verbunden. Allerdings gibt es auch hier keine valide Evidenz für den Einsatz bei Steroid-Diabetes.
In Tabelle 3 sind die Vor- und Nachteile der verschiedenen oralen Antidiabetika bei der Behandlung des Glucocorticoid-induzierten Diabetes einander gegenübergestellt [18].
Vorteile | Nachteile | |
|---|---|---|
Metformin | gewichtsneutral, kein Hypoglykämie-Risiko, senkt Insulinresistenz, senkt Gluconeogenese | Gefahr der Laktatazidose bei Niereninsuffizienz, mäßige postprandiale Blutzucker-Senkung |
Glitazon | reduziert Insulin-Resistenz, kein Hypoglykämie-Risiko, Alternative zu Metformin bei Niereninsuffizienz | Gewichtszunahme, Ödembildung (CAVE Herzinsuffizienz), Frakturrisiko, langsamer Wirkeintritt |
Insulin-Sekretagoga (SFH, Glinide) | postprandiale Glucose-Senkung (vor allem Glinide), Alternative bei fehlender Möglichkeit zur Insulinisierung | Gewichtszunahme,Hypoglykämie-Risiko, Wirkverlust bei Langzeittherapie häufig |
Inkretin-basierte Substanzen (DPP-4-Hemmer, GLP-1-Agonisten) | senkt Gluconeogenese, gewichtsneutral bis -reduzierend (GLP-1), Senkung des postprandialen Blutzuckerspiegels (kurzwirksame GLP-1) | wenige Studien zur Glucose-Therapie, dabei unter DPP-4-Hemmern mäßige, postprandiale Senkung des Blutzuckerspiegels |
SGLT-2-Inhibitoren | senkt Gewicht/Blutdruck, kein Hypoglykämie-Risiko, verringert Volumenstatus, kardio- und renoprotektiv | bisher keinerlei Daten, Gefahr der euglykämischen Ketoazidose in Sondersituationen |
Insulin
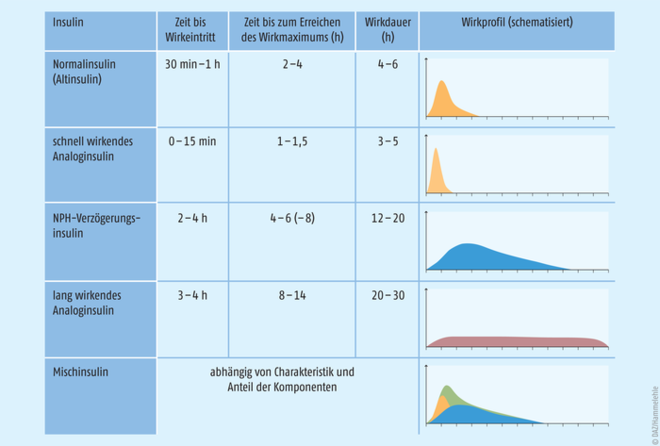
Sind postprandiale Blutzucker-Werte über 13,9 mmol/l (250 mg/dl) nachweisbar, dann ist eine Insulin-Therapie meist unumgänglich, um eine ausreichende Kontrolle des Blutzuckers zu erreichen [10]. Hierfür stehen prinzipiell verschiedene Arten von Insulin mit unterschiedlichen Wirkprofilen zur Verfügung, die jedoch zur Behandlung der Glucocorticoid-induzierten Hyperglykämie nicht gleichermaßen geeignet sind (Abb. 3) [21]. Bei der Insulin-Therapie des Steroid-Diabetes werden die beiden folgenden Strategien bevorzugt [9, 15]:
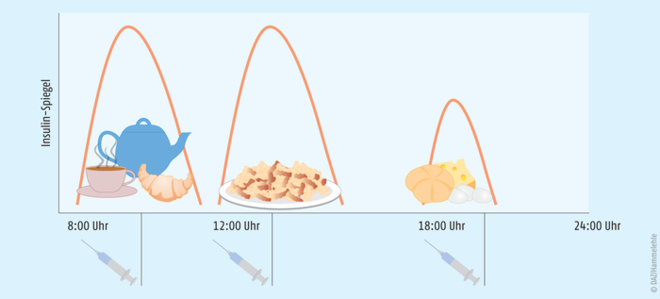
- Prandiale bzw. supplementäre Insulin-Therapie: Bei einmal täglicher Gabe eines Steroids wie Prednisolon werden kurzwirksame Insulin-Präparate (Normalinsuline) zu den einzelnen Hauptmahlzeiten appliziert (Abb. 4). Der Stoffwechsel kann auf diese Weise vor allem dann gut kontrolliert werden, wenn der Patient keine Zwischenmahlzeiten einnimmt.
- Therapie mit Misch- oder Verzögerungsinsulin: Hier wird einmalig am Morgen ein Mischinsulin, z. B. Normalinsulin plus NPH-Insulin (Neutral-Protamin-Hagedorn-Insulin) im Verhältnis 30/70 oder 50/50 appliziert. Auch ein langwirksames NPH-Insulin ist eine mögliche Option. Die Wirkung von lang wirksamen Analoginsulinen hält hingegen potenziell zu lange an, so dass über Nacht der Blutzucker-Spiegel zu stark absinken würde.
Abb. 3: Einteilung der therapeutischen Insulin-Präparate nach Wirkeintritt, Wirkdauer und Wirkprofil (nach [21]).
Abb. 4: Prandiale Insulin-Therapie beim Steroid-Diabetes Die Applikation der kurzwirksamen Insulin-Präparate erfolgt zu den Mahlzeiten (nach [23]).
Die beim Diabetes mellitus Typ 2 übliche Vorgehensweise, abends ein NPH-Insulin zu geben (Bedtime-Insulin), ist bei einem Diabetes z. B. infolge einer Prednison-Therapie nicht sinnvoll, da hier die Blutzucker-Werte über Nacht entsprechend der Pharmakodynamik des Glucocorticoids ohnehin absinken [15]. Was die Dosierung des Insulins in der Praxis betrifft, kann die Therapie mit einer Startdosis eingeleitet werden, die dem höchsten Blutzucker-Wert im Tagesprofil entspricht [15]. Wenn also beispielsweise unter einer Therapie mit Prednison der Blutzucker des Patienten bis auf 18 mol/l (324 mg/dl) ansteigt, beträgt die initiale Dosis 18 Einheiten Insulin [15]. Die Startdosis kann auch gewichtsabhängig berechnet werden, wobei je nach Dosierung des Steroids täglich insgesamt 0,1 bis 0,25 Einheiten Insulin pro kg Körpergewicht angesetzt werden können [10]. Die gewählte Insulin-Dosis wird dann ‒ je nach Therapiestrategie ‒ entweder auf drei Injektionen (zu den jeweiligen Hauptmahlzeiten) verteilt appliziert oder einmal am Morgen gegeben. Dabei ist zu beachten, dass nach dem Frühstück ‒ trotz der meist niedrigen Blutzucker-Werte am Morgen ‒ ein ähnlich hoher Insulin-Bedarf wie beim Mittagessen besteht, da nach Einnahme des Steroids der Blutzucker stark ansteigt. Demgegenüber wird abends weniger Insulin benötigt, wobei zunächst davon ausgegangen wird, dass der Insulin-Bedarf am Abend etwa 50% geringer ist als am Morgen oder Mittag [15]. Dementsprechend wird das Insulin-Schema bei der prandialen Insulin-Therapie gewählt.
Auf einen Blick
- Glucocorticoide können bei Menschen ohne bisher bekannten Diabetes mellitus einen Steroid-Diabetes verursachen. Bei Patienten mit bereits bestehendem Diabetes kann die Hyperglykämie durch die Gabe von Steroiden erheblich verschärft werden.
- Pathophysiologisch greifen Glucocorticoide an verschiedenen Stellen des Glucose-Stoffwechsels ein und können so zu einer Erhöhung des Blutzuckers führen.
- Die Diagnose eines Steroid-Diabetes erfolgt über postprandiale Messungen des Blutzuckers bzw. über die Erstellung eines Tagesprofils. Die Nüchternblutzucker-Werte und der HbA1c-Wert liegen bei einer Glucocorticoid-Therapie häufig im Normbereich und sind daher weniger geeignet, um einen Steroid-Diabetes festzustellen.
- Patienten mit erhöhten Blutzucker-Werten unter 13,9 mmol/l (250 mg/dl) können versuchsweise mit oralen Antidiabetika behandelt werden. Liegen die Blutzucker-Werte darüber, ist meist eine Insulintherapie erforderlich.
- Die Insulin-Therapie muss der Dosierung und der Pharmakodynamik des eingesetzten Glucocorticoids bzw. dem Verlauf des Blutzucker-Spiegels angepasst werden. Hier sind verschiedene Strategien möglich.
Im weiteren Verlauf der Therapie kann es ‒ je nach gemessenen Blutzucker-Werten ‒ notwendig werden, die Insulin-Dosis anzupassen. Dabei sollte der Zielblutzucker-Wert nicht zu niedrig angesetzt werden, da dann oft sehr hohe Insulin-Dosen notwendig sind, die wiederum das Risiko für eine nächtliche Hypoglykämie erhöhen [15]. Daher ist ein Blutzucker-Wert unter 8 bis 10 mmol/l (144 bis 180 mg/dl) vor dem Abendessen in der Regel akzeptabel [15]. Wichtig ist auch, die Insulin-Dosis bei Bedarf an eine geänderte Steroiddosis anzupassen: Wenn also die Dosierung des Glucocorticoids im Verlauf der Behandlung erhöht oder reduziert wird, dann muss die Insulin-Dosis entsprechend gesteigert oder verringert werden [15]. Neben einer Anpassung der Insulin-Dosis, kann unter Umständen auch eine geänderte Zusammensetzung des Mischinsulins sinnvoll sein. So sollte der Patient z. B. bei Blutzucker-Werten, die mittags deutlich höher liegen als abends, auf ein Mischinsulin mit einem höheren Anteil an kurzwirksamem Insulin umgestellt werden [15].
Wenn schon ein Diabetes besteht
Bei Patienten, die bereits an einem Diabetes Typ 1 oder 2 erkrankt sind, kann eine Therapie mit Glucocorticoiden zu einer hyperglykämischen Entgleisung führen [2]. Ein Typ-2-Diabetiker, der mit einem oralen Antidiabetikum behandelt wird, muss dann ‒ nach einer Patientenschulung ‒ gegebenenfalls auf eine zusätzliche oder alleinige Insulin-Therapie umgestellt werden [2]. Bei Diabetikern, die bereits Insulin erhalten, muss die Insulin-Therapie intensiviert werden, wobei eine erhebliche Steigerung der Dosis um insgesamt 30% bis 100% notwendig werden kann [2]. Hier muss bei Patienten, die ausschließlich Basalinsulin erhalten, darauf geachtet werden, dass eine solche intensive Dosissteigerung zu nächtlichen Hypoglykämien führen kann. Empfehlenswert ist daher ‒ ebenso wie bei den Patienten, die vor der Steroidtherapie keinen Diabetes hatten ‒ eine prandiale Humaninsulin-Gabe zu den Mahlzeiten [2]. |
Literatur
[1] Gelbe Liste. Glucocorticoide (Corticosteroide). www.gelbe-liste.de/wirkstoffgruppen/glucocorticoide, Abruf am 17. Juni 2021
[2] Jungmann E. Steroidinduzierter Diabetes mellitus: Wie erkennen – wie behandeln? Diabetes aktuell 2019;17:189–196.
[3] Fardet L, Fève B. Systemic glucocorticoid therapy: a review of its metabolic and cardiovascular adverse events. Drugs 2014;74:1731-1745.
[4] Pschyrembel online. Diabetes mellitus (DM). www.pschyrembel.de/Diabetes%20mellitus/K05U4 , Abruf am 17. Juni 2021
[5] Association AD. Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 2014;37:81-90
[6] Feichter M. Diabetes Typ 3. www.netdoktor.de/krankheiten/diabetes-mellitus/diabetes-typ-3/, Abruf am 17. Juni 2021
[7] Grigoryan K. Characteristics of the management of hyperglycemia in critically ill patients with inpatient COVID-19 and diabetes mellitus to whom glucocorticoids were administered 2021
[8] Willms A, Schumm-Draeger PM, Siegmund T. Glucocorticoide und Diabetes. Diabetologe 2016;12:127-138
[9] Tamez-Pérez HE, Quintanilla-Flores DL, Rodríguez-Gutiérrez R, González-González JG, Tamez-Peña AL. Steroid hyperglycemia: Prevalence, early detection and therapeutic recommendations: A narrative review. World J Diabetes 2015;6:1073-1081
[10] Siegmund T. Müssen die Glucocorticoide jetzt abgesetzt werden? MMW - Fortschritte der Medizin 2014;156:90-93
[11] Hemmer MC, Wierer M, Schachtrup K, Downes M, Hübner N, Evans RM, Uhlenhaut NH. E47 modulates hepatic glucocorticoid action. Nat Commun 2019;10:306
[12] Suh S, Park MK. Glucocorticoid-Induced Diabetes Mellitus: An Important but Overlooked Problem. Endocrinol Metab (Seoul) 2017;32:180-189
[13] Bonaventura A, Montecucco F. Steroid-induced hyperglycemia: An underdiagnosed problem or clinical inertia? A narrative review. Diabetes Research and Clinical Practice 2018;139:204-219
[14] Association AD. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes—2019. Diabetes Care 2019;42:13-28
[15] Capraro J. Steroid-induzierter Diabetes. Swiss Medical Forum 2012;2012:562-565
[16] Burt MG, Willenberg VM, Petersons CJ, Smith MD, Ahern MJ, Stranks SN. Screening for diabetes in patients with inflammatory rheumatological disease administered long-term prednisolone: a cross-sectional study. Rheumatology (Oxford) 2012;51:1112-1119
[17] Joint British Diabetes Societies für Inpatient Care (JBDS-IP). Management of Hyperglycaemia and Steroid (Glucocorticoid) Therapy (Revised May 2021 abcd.care/sites/abcd.care/files/site_uploads/JBDS_08_Steroids_DM_Guideline_FINAL_28052021.pdf , Abruf am 23. Juni 2021
[18] MedMedia Verlag und Mediaservice GmbH. Diabetes als Komplikation einer Glucocorticoidtherapie. www.medmedia.at/faktenrheumatologie/wie-hoch-ist-das-risiko-einen-diabetes-zu-entwickeln-welche-antidiabetika-sind-bei-gc-induziertem-diabetes-einsetzbar/, Abruf am 23. Juni 2021
[19] DocCheck Flexikon. Orales Antidiabetikum. flexikon.doccheck.com/de/Orales_Antidiabetikum, Abruf am 6. Juli 2021
[20] Diabetesinformationsportal diabinfo.de. Diabetes Typ 2: Medikamente. www.diabinfo.de/leben/typ-2-diabetes/behandlung/medikamente.html, Abruf am 06. Juli 2021
[21] Überblick: Insuline und ihre Wirkungen. MedMedia Verlag und Mediaservice GmbH, www.medmedia.at/univ-innere-medizin/insuline-und-ihre-wirkungen/, Abruf am 25. Juni 2021
[22] Morbus Cushing. DocCheck Flexikon, flexikon.doccheck.com/de/Morbus_Cushing, Abruf am 25. Juni 2021
[23] Wiesli P. Vortrag: Steroide bei Patienten mit Diabetes. slideplayer.org/slide/1330661/, Abruf am 18. Juni 2021






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.