
- DAZ.online
- DAZ / AZ
- DAZ 32/2021
- Macht Milch krank
Ernährung
Macht Milch krank?
Ein kritischer Blick auf das „Signalsystem“ Milch
Milchkonsum ist Bestandteil unserer Zivilisation, in die wir hineingeboren wurden. Mit einem Pro-Kopf-Verbrauch in 2019 von 49,5 l Kuhmilch in Deutschland und 98,2 l in 2018 in Schweden gehört Milch zu den Hauptkomponenten westlicher Ernährung [1, 2]. Ihre Verwendung vom Kindesalter an erscheint uns dabei so selbstverständlich, dass ein kritisches Hinterfragen des „Systems Milch“ häufig auf Kritik und Skepsis stößt. Ein tieferer Einblick in die biochemischen und physiologischen Prozesse rund um die Milch könnte zu einem besseren Verständnis der Pathogenese unserer Zivilisationskrankheiten führen. Ziel dieses Artikels ist es, dafür zu sensibilisieren, dass Milch kein übliches Lebensmittel ist, sondern ein endokrines und epigenetisch wirksames Signalsystem [3], dessen Verständnis die Pathogenese Milch-induzierter Zivilisationskrankheiten nahelegt [4].
Milch spielt nach der Geburt bei der extra-uterinen Weiterversorgung und der metabolisch/immunologischen Programmierung des Neugeborenen eine wichtige Rolle [5]. So wird durch verschiedene Inhaltsstoffe der Milch beim Säugling die Nahrungs- und Wachstumsfaktor-abhängige Kinase mTORC1 (mechanistic target of rapamycin complex 1) aktiviert [6], die für Wachstum und Anabolismus der Körperzellen verantwortlich ist. mTORC1 benötigt im Wesentlichen die Präsenz von vier Signalen:
- essenzielle verzweigtkettige Aminosäuren (branched-chain amino acids, BCAA) vom Prototyp Leucin [7, 8],
- Wachstums-stimulierende Hormone wie Insulin, Wachstumshormon (growth hormone, GH) und Insulin-artiger Wachstumsfaktor 1 (insulin-like growth factor 1, IGF-1) [9, 10],
- gesättigte Fettsäuren vom Prototyp Palmitinsäure (C16:0) [11] und
- Glucose zur Sicherstellung einer ausreichenden Versorgung mit zellulären Energieträgern zur erforderlichen Bereitstellung von ATP sowie die Aktivierung der BCAA-mTORC1-Interaktion [12, 13].
Über Jahrmillionen scheint über das mütterliche Laktationsgenom das Sekret Milch sich optimal auf die Bedürfnisse eines Säuglings eingestellt zu haben, da die Muttermilch allein ausreicht, damit der Säugling wächst und gedeiht.
So fördern die insulinotropen Aminosäuren der Milch wie Leucin die postprandiale Ausschüttung des anabolen Wachstumshormons Insulin [14]. Auch beim Konsumenten von Kuhmilch und Milchprotein steigen die Serumspiegel des mitogenen Schwesterhormons IGF-1 deutlich [15, 16]. Milchkonsum erhöht basale Spiegel an Wachstumshormon, das nach Bindung an den GH-Rezeptor in der Leber die systemische Bildung von IGF-1 induziert [17 – 19]. Milch scheint induktiv auf die hepatische Synthese und Ausschüttung von IGF-1 zu wirken. Höchste Serum-IGF-1-Spiegel finden sich während der Pubertät, einer Lebensphase beschleunigten Wachstums. Gesteigertes Wachstum im Säuglingsalter und während der Pubertät werden also in analoger Weise durch IGF-1 angetrieben, wobei die Milch als Induktor der IGF-1-Bildung physiologischerweise nur während der Stillzeit zum Einsatz kommen soll. Durch persistenten Kuhmilchkonsum während der Pubertät kann die systemische IGF-1-Signaltransduktion überhöht werden, was nicht nur als Störung der Talgdrüsenhomöostase (Akne) äußerlich sichtbar wird [20, 21], sondern auch intern die Ausdifferenzierung des Gewebes der Brustdrüsen (Brustkrebsrisiko im weiteren Leben) [22, 23] und der Prostata (Prostatakrebsrisiko im weiteren Leben) [24 – 26] nachteilig beeinflussen kann.
Hitzestabile „Hardware“ der Milch
Wesentlicher Bestandteil der mitogenen „Hardware“ der Milch ist das Milchprotein mit seinem hohen Anteil an essenziellen Aminosäuren (verzweigtkettige Aminosäuren, branched-chain amino acids, BCAA), die im Darm aus Molkeproteinen schnell freigesetzt und resorbiert werden. Diese überstehen das Kochen, Ultrahocherhitzen (UHT-Milch) und auch die bakterielle Fermentierung (Joghurt). Eine Studie der Universität Oxford hat kürzlich an einer großen Zahl an Probanden (n = 11.815) gezeigt, dass der Konsum von Milch- und Joghurtprotein mit einer signifikanten Erhöhung der Serum-IGF-1-Konzentrationen assoziiert ist [16]. Aus endokriner Sicht scheint es einen Unterschied zu machen, ob man Fisch-, Fleisch- oder Milchprotein konsumiert. Insbesondere die Kombination von Kohlenhydraten mit verzweigtkettigen Aminosäuren – was beim Zusetzen von zuckerhaltigem Kinderkakaopulver zur Milch routinemäßig passiert – führt zu einer weiteren Erhöhung der IGF-1-Serumkonzentrationen [27].
Hitzelabile „Software“ der Milch
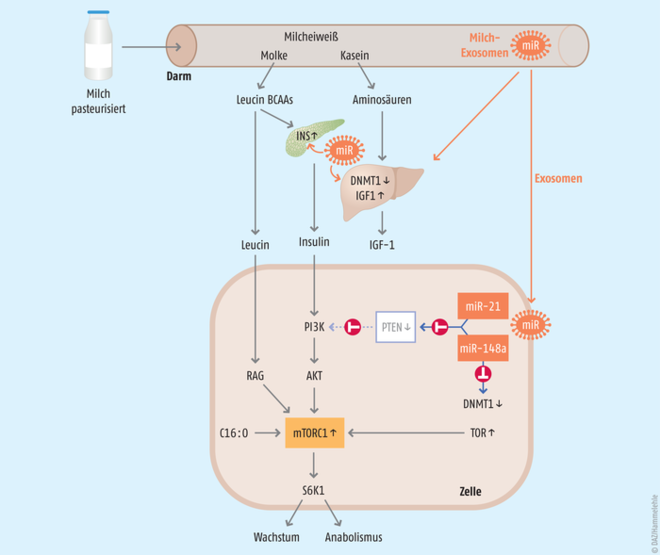
In den letzten Jahren wird über eine weitere Kommunikationsebene der Milchbestandteile diskutiert, die als Gen-regulierende Software der Milch betrachtet werden kann. Hierbei handelt es sich um ein großes Spektrum hitzelabiler extrazellulärer Vesikel (EV) (50 nm bis 1 μm), die von der Brustdrüse aller Säuger in die Milch sezerniert werden [28]. Von diesen extrazellulären Vesikeln sind die Milch-Exosomen (50 bis 130 nm) von besonderer funktioneller Bedeutung, die bei 100.000 × g in der Ultrazentrifuge sedimentieren [29, 30]. In Tierversuchen und in In-vitro-Modellen konnte gezeigt werden, dass sie die Magen-Darm-Passage überstehen [31], in die Blutbahn gelangen und ein breites Spektrum von RNA transportieren können [32 – 34], insbesondere microRNA, die für die epigenetische Regulation zahlreicher Gene eine kritische Rolle spielen [35] (s. Abb.). So hemmt die in allen Tiermilchen und in der Muttermilch dominante microRNA-148a die Expression der DNA-Methyltransferase 1 (DNMT1) und hat damit einen Einfluss auf den Methylierungsgrad multipler Gene [35, 36].
„Unabhängig von den unmittelbaren Effekten des Milchkonsums auf das Individuum sind die ökologischen Belastungen durch die Milcherzeugung wie die Bodenbelastung mit Nitraten (Gülle), die Luft- und Klimabelastung durch Methan- und CO2-Emissionen der Kühe und die Rodung der Regenwälder zum Kraftfutteranbau weitere gesundheitskritische Aspekte des Milchkonsums. Pharmazeuten sind herzlich eingeladen, in die kontroverse Debatte zur Milch und ihren gesundheitlichen Risiken einzutreten.“
Eine Hemmung der DNA-Methyltransferase 1 führt auch zur Aktivierung der Expression von FoxP3 [37], einem Master-Transkriptionsfaktor regulatorischer T-Zellen [38]. Da ein Mangel an FoxP3 das Risiko für allergische Erkrankungen erhöhen kann [39, 40], könnte die Zufuhr von Milchexosomen und deren microRNA durch Verzehr ungekochter Kuhmilch, die in künstlicher Säuglingsnahrung fehlen [5, 41], den Allergie-präventiven Effekt des Rohmilchkonsums (farm milk effect) erklären [42, 43].
Nach oraler Gabe boviner Milchexosomen an Mäuse konnten diese in zahlreichen Organen – sogar im Gehirn – nachgewiesen werden [33]. Die Exosomen der Milch können also die systemische Zirkulation erreichen und die Bluthirnschranke überwinden. Diesen exosomalen Transfereffekt – verbunden mit der hohen Bioverfügbarkeit und geringen Allergenität der Kuhmilch-Exosomen – könnte man nutzen, um Pharmaka oder antisense-microRNA in Tumorgewebe einzuschleusen [44, 45]. Für diesen Zweck hat die Firma Roche eine große Plattform mit einem 36 Millionen-Dollar-Budget eingerichtet [46]. Im Gegensatz zu diesen Bestrebungen schätzt das Bundesinstitut für Risikobewertung (BfR) die Auswirkungen von mit der Milch aufgenommenen microRNA auf die menschliche Gesundheit als sehr unwahrscheinlich ein [47].
Jüngste Forschungsergebnisse aus den Niederlanden zeigen, dass durch Pasteurisieren der Milch die Gesamtzahl der extrazellulären Vesikel und 20 bis 40% ihrer RNA erhalten bleiben, wohingegen die Vesikel und ihre RNA durch Ultrahocherhitzen vollständig zerstört werden [48].Auch durch bakterielle Fermentierung werden die Milchexosomen angegriffen und die Zahl ihrer microRNA deutlich vermindert [49].
Abb.: Endokrine und epigenetische Signaltransduktion durch Bestandteile der Milch. Die Aminosäuren aktivieren nach schneller intestinaler Hydrolyse die Bildung und Ausschüttung von Insulin und den Insulin-artigen Wachstumsfaktor 1 (IGF-1). Diese Wachstumshormone aktivieren den PI3K-AKT-Signalweg zur Aktivierung von mTORC1. Essenzielle Aminosäuren (Prototyp Leucin, zu 10% in Molkeprotein enthalten) aktivieren den RAG-GTPase-abhängigen Signalweg zur mTORC1-Aktivierung an der Membran von Lysosomen. Gesättigte Fettsäuren wie Palmitinsäure (C16:0), dominante Fettsäure des Milchfetts, aktivieren ebenfalls mTORC1. Pasteurisierte Milch überträgt mittels extrazellulärer Vesikel hitzelabile microRNA-haltige Exosomen, die in die systemische epigenetische Regulation eingreifen. Die als Signatur-microRNA identifizierten microRNA-148a und microRNA-21 hemmen die DNA-Methyltransferase 1 (DNMT1), wodurch zahlreiche Entwicklungs-Gene (INS, IGF-1, TOR u. a.) verstärkt exprimiert werden. Die mTORC1-Aktivierung induziert anaboles Wachstum, das für das Wachstum des Neugeborenen gewünscht ist, nicht aber für die Induktion mTORC1-getriebener Zivilisationskrankheiten. AKT: Serin/Threonin-Kinase, BCAA: verzweigtkettige Aminosäuren, INS: Insulin, mTOR: mechanistic target of rapamycin, PI3K: Phosphoinositid-3-Kinase, PTEN: Phosphatase, die als Tumorsuppressor agiert, RAG: recombination-activating gene, S6K1: ribosomale Protein-S6-Kinase Beta-1
Deutlich wird, dass der moderne Verbraucher durch die Einführung pasteurisierter Milch im großen Maßstab erstmals dem genregulatorischen Potenzial der Milch in großem Umfang exponiert wurde [50].
Durch Aufnahme pasteurisierter Milch und besonders durch unbehandelte Vorzugsmilch vom Bauernhof ist der Konsument dem genregulatorischen Einfluss der Bestandteile der Kuhmilch ungeschützt ausgesetzt. Eine ständige Exposition des Verbrauchers durch mitogene und onkogene exosomale microRNA als Folge des weitverbreiteten Milchkonsums sollte unterbunden werden [30, 35]. Dieser Verantwortung sollten sich zuständige Bundesinstitute wie das Bundesforschungsinstitut für Ernährung und Lebensmittel (Max Rubner-Institut, MRI), das Bundesinstitut für Risikobewertung (BfR) und die Deutsche Gesellschaft für Ernährung (DGE) stellen. So scheinen die microRNA-148a und die microRNA-21 als dominante Signatur-microRNA der Kuhmilch [53] eine Rolle in der Pathogenese des Prostata- und Mammakarzinoms [54 – 58] zu spielen.
Der Mensch konsumiert seit 7000 bis 10.000 Jahren Tiermilch und hat früher in Ermangelung von Kühltechnologie und Pasteurisierung die Milch meist in Form natürlich fermentierter Produkte (Käse, Joghurt, Kefir) verzehrt. Durch Fermentierung, Kochen und Ultrahocherhitzen wird ein Großteil der exosomalen microRNA der Milch eliminiert [35, 38, 39]. Durch Einführung von Pasteurisierung in Kombination mit flächendeckender Kühltechnologie wird heutzutage der Verbraucher permanent mit dem biologisch und epigenetisch aktiven Original und dessen onkogener microRNA konfrontiert [35, 50]. Hierbei handelt es sich um eine von vielen unbemerkte Verhaltensänderung des neolithischen Menschen. Etwa zeitgleich trat eine Mutation des Lactase-Gens auf, die eine dauerhafte intestinale Expression der Lactase und damit eine permanente Lactose-Toleranz ermöglichte. So wurde der heutige Europäer geformt, und durch die gute Verträglichkeit microRNA-haltiger pasteurisierter Milch besteht die Gefahr einer von der Natur unbeabsichtigten exogenen „Genmanipulation“.
Zwar nehmen als Folge des Milchkonsums die Körpergröße [59, 60], der BMI [61] und die Fruchtbarkeit [62] zu, wodurch im Vergleich zu unseren Vorfahren unsere Lebenserwartung größer ist, aber unter heutigen Bedingungen einer ständigen Gefahr der Überernährung mit Überangebot hyperglykämischer Kohlenhydrate scheint eine Dauerexposition mit dem Wachstumskatalysator Milch die gesundheitsschädigenden Effekte des westlichen Ernährungsstils zu potenzieren.
Studien aus Schweden berichten über einen Zusammenhang zwischen Milchkonsum und gesteigertem Mortalitätsrisiko [99 – 102], wohingegen fermentierte Milchprodukte das Mortalitätsrisiko nicht erhöhten [101, 103]. Es scheint ein großer biologischer Unterschied zwischen dem Konsum nicht-fermentierter und fermentierter Milch zu bestehen, der bevorzugten Konsumform von Milch seit der neolithischen bis hin zur industriellen Revolution. Theoretische Überlegungen legen nahe, dass mikrobielle Fermentierung der Milch deren mTORC1-Aktivität vermindert [50]. Insbesondere die pasteurisierte microRNA-übertragende Milch wird aus ärztlicher Perspektive als kritischer Promotor westlicher Zivilisationskrankheiten betrachtet [109]. Aus der biologischen Forschung ist bekannt, dass Überhöhung von IGF-1 und mTORC1 die Lebenserwartung in zahlreichen Tiermodellen vermindert [110 – 112].
Schutzfunktion der Lactose-Intoleranz
Die ursprüngliche genetische Ausstattung des Homo sapiens sieht eine Lactose-Intoleranz spätestens im reproduktiven Alter durch Unterdrückung der intestinalen Lactase-Expression vor [63]. Welchen Grund mag es haben, dass alle Säugetiermilchen das Disaccharid Lactose (Glucose-Galactose) und nicht viel einfacher Blutzucker in die Milch sezernieren? Diesem könnte eine einfache Erklärung zugrunde liegen, die das Überleben der Säugetiere garantiert. Physiologische Lactose-Intoleranz im reproduktiven Alter mit gastrointestinalen Symptomen nach Milchaufnahme könnte die männlichen Erzeuger davon abgehalten haben, ihrem Nachwuchs die überlebenswichtige Milch wegzutrinken. Von diesem physiologischen Verhaltensmuster ist der Lactose-tolerante neolithische Mensch massiv abgewichen und kann sich mutationsbedingt ohne Warnzeichen ständig dem Signaltransduktionssystem Milch aussetzen [50]. Bedauerlicherweise induziert die Milch durch Aktivierung der IGF-1/PI3K/AKT/mTORC1-Signalkaskade zum postnatalen Wachstum die gleichen Signalwege, die Tumorzellen für ihr malignes Wachstum aktivieren [64 – 68].
In zahlreichen gut kontrollierten Kohorten-Studien mit homogenen Patientenkollektiven konnte eine Korrelation von Milchkonsum und den häufigsten Krebserkrankungen westlicher Zivilisation wie Prostatakarzinom und Brustkrebs gezeigt werden. Diese Erkrankungen stehen aber nicht im Verantwortungsbereich der Ökotrophologie, sondern unter der Obhut der Medizin und Pharmazie. Um die Auswirkung des Milchkonsums auf den Menschen zu erfassen, sind Kurzzeitanalysen über wenige Jahre nicht zielführend, sondern es muss die Milch-Exposition über die gesamte Lebenszeit ganzheitlich betrachtet werden (s. Tab. 1) [69, 70]. So zeigte kürzlich die Rotterdam-Studie, dass hoher Milchkonsum von Müttern im ersten Trimester der Schwangerschaft mit einem erhöhten BMI und vermehrtem Viszeralfett ihrer Kinder im Alter von zehn Jahren korreliert [71].
Milchkonsum | Auswirkungen | Literatur |
|---|---|---|
in der Schwangerschaft | fetales Wachstum↑ | [69, 70] |
Geburtsgewicht↑ | [69, 70] | |
BMI im Alter von zehn Jahren↑ | [71] | |
Viszeralfett im Alter von 10 Jahren↑ | [71] | |
im Kindesalter | BMI↑ | [61] |
in der Pubertät | frühzeitige Menarche↑ | [62] |
Talgdrüsenaktivität und Akne↑ | [72, 73] | |
Brustdrüsendichte↑ | [74] | |
Längenwachstum↑ | [59, 60] | |
Risiko für Prostatakrebs im Alter↑ | [75] | |
im Erwachsenenalter | Diabetesrisiko↑ | [76 – 78] |
Brustkrebsrisiko↑ | [79 – 81] | |
Prostatakrebsrisiko↑ | [82 – 86] | |
Leberkrebsrisiko↑ | [87 – 90] | |
Risiko für diffuses B-Zell-Lymphom↑ | [91] | |
Darmkrebsrisiko↓ | [92 – 94] | |
Risiko für Parkinson-Krankheit↑ | [95 – 98] | |
Gesamtmortalität↑ | [99 – 103] |
Die gesundheitlichen Aspekte des Milchkonsums stehen zunehmend im Fokus einer kontroversen Debatte zwischen Ökotrophologie und Medizin. Qualitativ hochwertige Kohortenstudien zeigen ein erhöhtes Risiko für Brust- und Prostatakrebs auf [80, 81], das durch Metaanalysen wieder relativiert wird, die eine deutlich höhere Inhomogenität in Bezug auf die unterschiedlichen ethnischen Gruppen und Studienmethodiken aufweisen [105, 106] (Tab. 2).
Metaanalysen | Literatur | Kohortenstudien | Literatur |
|---|---|---|---|
kein erhöhtes Brustkrebsrisiko | [105 – 107] | erhöhtes Brustkrebsrisiko | [80 – 81] |
kein erhöhtes Prostatakrebsrisiko | [108] | erhöhtes Prostatakrebsrisiko | [82, 85] |
keine Steigerung der Gesamtmortalität | [105] | Steigerung der Gesamtmortalität | [99 – 102] |
Zu dieser kontroversen Betrachtungsweise ist ein neuer Aspekt hinzugekommen: das zunehmende biochemische Verständnis der Milch als System der Signaltransduktion, das genau die Signalwege (IGF-1/PI3K/AKT/mTORC1) antreibt und die onkogene microRNA überträgt, die beim Prostata- und Brustkrebs eine kritische Rolle spielen [3, 4, 6, 30, 56].
Bei der Bewertung der gesundheitlichen Risiken des Konsums von Milch sollten prospektive, lokal kontrollierte Kohortenstudien nicht einfach durch Metaanalysen mit weltweitem Dateneinfluss und erhöhter Heterogenität nivelliert werden. Bei allem Pro und Kontra zu epidemiologischen Studien und ihren vermeintlichen Qualitäten sollte der biologische und medizinische Sachverstand zum endokrinen System Milch in die Überlegungen mit einbezogen werden.
Das Defizit der Erfassung der thermischen Bearbeitung der Milch in allen bisherigen epidemiologischen Studien zeigt, dass die wissenschaftliche Erkenntnis der Grundlagenforschung die Basis für weiterführende epidemiologische Untersuchungen sein muss und nicht umgekehrt. |
Literatur
[1] Deutschland: Pro-Kopfverbrauch von Milchprodukten. Informationen des Milchindustrie-Verband e.V., Stand April 2020, https://milchindustrie.de/wp-content/uploads/2020/04/ProkopfDeutschland_Mopro_2013-2019x_Homepage.pdf
[2] Ridder M. Statista: Per capita consumption of milk in Sweden 2008-2018, www.statista.com/statistics/557618/per-capita-consumption-of-milk-in-sweden
[3] Melnik BC et al. Milk is not just food but most likely a genetic transfection system activating mTORC1 signaling for postnatal growth. Nutr J 2013;12:103
[4] Melnik BC. Lifetime impact of cow‘s milk on overactivation of mTORC1: From fetal to childhood overgrowth, acne, diabetes, cancers, and neurodegeneration. Biomolecules 2021;11:404
[5] Melnik BC et al. Exosome-derived microRNAs of human milk and their effects on infant health and development. Biomolecules 2021;11:851
[6] Melnik BC. Milk - a nutrient system of mammalian evolution promoting mTORC1-dependent translation. Int J Mol Sci 2015;16:17048-17087
[7] Condon KJ et al. Nutrient regulation of mTORC1 at a glance. J Cell Sci 2019;132:jcs222570
[8] Takahara T et al. Amino acid-dependent control of mTORC1 signaling: a variety of regulatory modes. J Biomed Sci 2020;27:87
[9] Foster KG et al. Mammalian target of rapamycin (mTOR): conducting the cellular signaling symphony. J Biol Chem 2010;285:14071-14077.
[10] Dibble CC et al. Regulation of mTORC1 by PI3K signaling. Trends Cell Biol 2015;25:545-555
[11] Denhez B et al. Saturated fatty acids induce insulin resistance in podocytes through inhibition of IRS1 via activation of both IKKβ and mTORC1. Sci Rep 2020;10:21628
[12] Lin SC et al. AMPK: sensing glucose as well as cellular energy status. Cell Metab 2018;27:299-313
[13] Yoon I et al. Glucose-dependent control of leucine metabolism by leucyl-tRNA synthetase 1. Science 2020;367:205-210
[14] Yang J et al. Leucine metabolism in regulation of insulin secretion from pancreatic beta cells. Nutr Rev 2010;68:270-279
[15] Qin LQ et al. Milk consumption and circulating insulin-like growth factor-I level: a systematic literature review. Int J Food Sci Nutr 2009;60 Suppl 7:330-340
[16] Watling CZ et al. Associations of circulating insulin-like growth factor-I with intake of dietary proteins and other macronutrients. Clin Nutr 2021;40(7):4685-4693, https://doi.org/10.1016/j.clnu.2021.04.021
[17] Rich-Edwards et al. Milk consumption and the prepubertal somatotropic axis. Nutr J 2007;6:28
[18] Barrea L et al. Influence of nutrition on somatotropic axis: Milk consumption in adult individuals with moderate-severe obesity. Clin Nutr 2017;36:293-301
[19] Takahashi Y. The role of growth hormone and insulin-like growth factor-I in the liver. Int J Mol Sci 2017;18:1447
[20] Smith TM et al. IGF-1 induces SREBP-1 expression and lipogenesis in SEB-1 sebocytes via activation of the phosphoinositide 3-kinase/Akt pathway. J Invest Dermatol 2008;128:1286-1293
[21] Melnik BC et al. Role of insulin, insulin-like growth factor-1, hyperglycaemic food and milk consumption in the pathogenesis of acne vulgaris. Exp Dermatol 2009;18:833-841
[22] Lønning PE et al. IGF-1 and breast cancer. Novartis Found Symp 2004;262:205-212
[23] Christopoulos PF et al. The role of the insulin-like growth factor-1 system in breast cancer. Mol Cancer 2015;14:43
[24] Roberts CT Jr. IGF-1 and prostate cancer. Novartis Found Symp 2004;262:193-199
[25] Ahearn TU et al. Expression of IGF/insulin receptor in prostate cancer tissue and progression to lethal disease. Carcinogenesis 2018;39:1431-1437
[26] Harrison S et al. Does milk intake promote prostate cancer initiation or progression via effects on insulin-like growth factors (IGFs)? A systematic review and meta-analysis. Cancer Causes Control 2017;28:497-528
[27] Li R et al. Co-ingestion of carbohydrate with branched-chain amino acids or L-leucine does not preferentially increase serum IGF-1 and expression of myogenic-related genes in response to a single bout of resistance exercise. Amino Acids 2015;47:1203-1213
[28] Sanwlani R et al. Milk-derived extracellular vesicles in inter-organism, cross-species communication and drug delivery. Proteomes 2020;8:11
[29] Zempleni J et al. Milk-derived exosomes and metabolic regulation. Annu Rev Anim Biosci 2019;7:245-262
[30] Melnik BC et al. Exosomes of pasteurized milk: potential pathogens of Western diseases. J Transl Med 2019 ;17:3
[31] Benmoussa A et al. Commercial dairy cow milk microRNAs resist digestion under simulated gastrointestinal tract conditions. J Nutr 2016;146:2206-2215
[32] Baier SR et al. MicroRNAs are absorbed in biologically meaningful amounts from nutritionally relevant doses of cow milk and affect gene expression in peripheral blood mononuclear cells, HEK-293 kidney cell cultures, and mouse livers. J Nutr 2014;144:1495-1500
[33] Manca S et al. Milk exosomes are bioavailable and distinct microRNA cargos have unique tissue distribution patterns. Sci Rep 2018;8:11321
[34] Sadri M et al. Milk exosomes and miRNA cross the placenta and promote embryo survival in mice. Reproduction 2020;160:501-509
[35] Melnik BC et al. MicroRNAs: Milk‘s epigenetic regulators. Best Pract Res Clin Endocrinol Metab 2017;31:427-442
[36] Reif S et al. Milk-derived exosomes (MDEs) have a different biological effect on normal fetal colon epithelial cells compared to colon tumor cells in a miRNA-dependent manner. J Transl Med 2019;17:325
[37] Lal G et al. Epigenetic mechanisms of regulation of Foxp3 expression. Blood 2009;114:3727-3735
[38] Passerini L et al. Forkhead box P3: the peacekeeper of the immune system. Int Rev Immunol 2014;33:129-145
[39] Admyre C et al. Exosomes with immune modulatory features are present in human breast milk. J Immunol 2007;179:1969-1978.
[40] Melnik BC et al. Milk: an exosomal microRNA transmitter promoting thymic regulatory T cell maturation preventing the development of atopy? J Transl Med 2014;12:43
[41] Leiferman A et al. Storage of extracellular vesicles in human milk, and microRNA profiles in human milk exosomes and infant formulas. J Pediatr Gastroenterol Nutr 2019;69:235-238
[42] Loss G et al. The protective effect of farm milk consumption on childhood asthma and atopy: the GABRIELA study. J Allergy Clin Immunol 2011;128:766-773.e4
[43] Sozańska B et al. Consumption of unpasteurized milk and its effects on atopy and asthma in children and adult inhabitants in rural Poland. Allergy 2013;68:644-650
[44] Munagala R et al. Bovine milk-derived exosomes for drug delivery. Cancer Lett 2016;371:48-61
[45] Betker JL et al. The potential of exosomes from cow milk for oral delivery. J Pharm Sci 2019;108:1496-1505
[46] Got Milk? Roche to Apply PureTech Exosomes Platform in $1B+ Collaboration. Genetic Engineering & Biotechnology News, Stand 20. Juli 2018, www.genengnews.com/topics/omics/got-milk-roche-to-apply-puretech-exosomes-platform-in-1b-collaboration/
[47] Mikro-Ribonukleinsäure in Milch: Gesundheitliches Risiko sehr unwahrscheinlich. Stellungnahme Nr. 020/2019 des Bundesinstituts für Risikobewertung (BfR), https://mobil.bfr.bund.de/cm/343/mikro-ribonukleinsaeure-in-milch-gesundheitliches-risiko-sehr-unwahrscheinlich.pdf
[48] Kleinjan M et al. Regular industrial processing of bovine milk impacts the integrity and molecular composition of extracellular vesicles. J Nutr 2021;151:1416-1425
[49] Yu S et al. Fermentation results in quantitative changes in milk-derived exosomes and different effects on cell growth and survival. J Agric Food Chem 2017;65:1220-1228
[50] Melnik BC et al. Pasteurized non-fermented cow‘s milk but not fermented milk is a promoter of mTORC1-driven aging and increased mortality. Ageing Res Rev 2021;67:101270
[51] van Herwijnen MJC et al. Abundantly present miRNAs in milk-derived extracellular vesicles are conserved between mammals. Front Nutr 2018;5:81
[52] Golan-Gerstl R et al. Characterization and biological function of milk-derived miRNAs. Mol Nutr Food Res 2017;61(10)
[53] Chen X et al. Identification and characterization of microRNAs in raw milk during different periods of lactation, commercial fluid, and powdered milk products. Cell Res 2010;20:1128-1137
[54] Dybos SA et al. Increased levels of serum miR-148a-3p are associated with prostate cancer. APMIS 2018;126:722–731
[55] Xu Y et al. miRNA-148a regulates the expression of the estrogen receptor through DNMT1-mediated DNA methylation in breast cancer cells. Oncol Lett 2017;14:4736-4740
[56] Melnik BC. Milk disrupts p53 and DNMT1, the guardians of the genome: implications for acne vulgaris and prostate cancer. Nutr Metab (Lond) 2017;14:55
[57] Zhou H et al. MicroRNA-21 and microRNA-30c as diagnostic biomarkers for prostate cancer: a metaanalysis. Cancer Manag Res 2019;11:2039-2050
[58] Savari B et al. Overexpression of microRNA-21 in the serum of breast cancer patients. Microrna 2020;9:58-63
[59] Hoppe C et al. Cow‘s milk and linear growth in industrialized and developing countries. Annu Rev Nutr 2006;26:131-173
[60] Wiley AS. Consumption of milk, but not other dairy products, is associated with height among US preschool children in NHANES 1999-2002. Ann Hum Biol 2009;36:125-138
[61] Wiley AS. Dairy and milk consumption and child growth: Is BMI involved? An analysis of NHANES 1999-2004. Am J Hum Biol 2010;22:517-525
[62] Wiley AS. Milk intake and total dairy consumption: associations with early menarche in NHANES 1999-2004. PLoS One 2011;6:e14685
[63] Ségurel L et al. On the evolution of lactase persistence in humans. Annu Rev Genomics Hum Genet 2017;18:297-319
[64] Hare SH et al. mTOR function and therapeutic targeting in breast cancer. Am J Cancer Res 2017;7:383-404
[65] Sridharan S et al. Distinct roles of mTOR targets S6K1 and S6K2 in breast cancer. Int J Mol Sci 2020;21:1199
[66] Melnik BC et al. The impact of cow‘s milk-mediated mTORC1-signaling in the initiation and progression of prostate cancer. Nutr Metab (Lond) 2012;9:74
[67] Zabala-Letona A, et al. mTORC1-dependent AMD1 regulation sustains polyamine metabolism in prostate cancer. Nature 2017;547:109-113
[68] Shorning BY et al. The PI3K-AKT-mTOR pathway and prostate cancer: At the crossroads of AR, MAPK and WNT signaling. Int J Mol Sci 2020;21:4507
[69] Olsen SF et al. Milk consumption during pregnancy is associated with increased infant size at birth: prospective cohort study. Am J Clin Nutr 2007;86:1104-1110
[70] Melnik BC et al. Milk consumption during pregnancy increases birth weight, a risk factor for the development of diseases of civilization. J Transl Med 2015;13:13
[71] Voerman E et al. Maternal first-trimester cow-milk intake Is positively associated with childhood general and abdominal visceral fat mass and lean mass but not with other cardiometabolic risk factors at the age of 10 years. J Nutr 2021, doi: 10.1093/jn/nxab047, Epub ahead of print
[72] Melnik BC. Acne vulgaris: The metabolic syndrome of the pilosebaceous follicle. Clin Dermatol 2018;36:29-40
[73] Juhl CR et al. Dairy Intake and Acne Vulgaris: A Systematic Review and Metaanalysis of 78.529 Children, Adolescents, and Young Adults. Nutrients 2018;10(8):1049
[74] Gaskins AJ et al. Dairy intake in relation to breast and pubertal development in Chilean girls. Am J Clin Nutr 2017;105:1166-1175
[75] Torfadottir JE et al. Milk intake in early life and risk of advanced prostate cancer. Am J Epidemiol 2012;175:144-153
[76] Sluijs I et al. The amount and type of dairy product intake and incident type 2 diabetes: results from the EPIC-InterAct Study. Am J Clin Nutr 2012;96:382-390
[77] Melnik BC. The pathogenic role of persistent milk signaling in mTORC1- and milk-microRNA-driven type 2 diabetes mellitus. Curr Diabetes Rev 2015;11:46-62
[78] Brouwer-Brolsma EM et al. Dairy product consumption is associated with pre-diabetes and newly diagnosed type 2 diabetes in the Lifelines Cohort Study. Br J Nutr 2018;119:442-455
[79] Gaard M et al. Dietary fat and the risk of breast cancer: a prospective study of 25,892 Norwegian women. Int J Cancer 1995;63:13-17
[80] Fraser GE et al. Dairy, soy, and risk of breast cancer: those confounded milks. Int J Epidemiol 2020;49:1526-1537
[81] Kaluza J et al. Long-term consumption of non-fermented and fermented dairy products and risk of breast cancer by estrogen receptor status - population-based prospective cohort study. Clin Nutr. 2021;40:1966-1973
[82] Song Y et al. Whole milk intake is associated with prostate cancer-specific mortality among U.S. male physicians. J Nutr 2013;143:189-196
[83] Lu W et al. Dairy products intake and cancer mortality risk: a metaanalysis of 11 population-based cohort studies. Nutr J 2016;15:91
[84] Downer MK et al. Dairy intake in relation to prostate cancer survival. Int J Cancer 2017;140:2060-2069
[85] Tat D et al. Milk and other dairy foods in relation to prostate cancer recurrence: Data from the cancer of the prostate strategic urologic research endeavor (CaPSURE™). Prostate 2018;78:32-39.
[86] Sargsyan A et al. Milk consumption and prostate cancer: A systematic review. World J Mens Health 2020;. doi: 10.5534/wjmh.200051. Epub ahead of print.
[87] Duarte-Salles T et al. Dairy products and risk of hepatocellular carcinoma: the European Prospective Investigation into Cancer and Nutrition. Int J Cancer 2014;135:1662-1672
[88] Yang W et al. A prospective study of dairy product intake and the risk of hepatocellular carcinoma in U.S. men and women. Int J Cancer 2020;146:1241-1249
[89] Wang XJ et al. Milk consumption and risk of mortality from all-cause, cardiovascular disease and cancer in older people. Clin Nutr 2020;39:3442-345
[90] Melnik BC. Dairy consumption and hepatocellular carcinoma risk. Ann Transl Med 2021;9:736
[91] Wang J et al. Dairy product consumption and risk of non-Hodgkin lymphoma: a meta-analysis. Nutrients 2016;8:120
[92] Aune D et al. Dairy products and colorectal cancer risk: a systematic review and metaanalysis of cohort studies. Ann Oncol 2012;23:37-45
[93] Ralston RA et al. Colorectal cancer and nonfermented milk, solid cheese, and fermented milk consumption: a systematic review and meta- analysis of prospective studies. Crit Rev Food Sci Nutr 2014;54:1167-1179
[94] Vieira AR et al. Foods and beverages and colorectal cancer risk: a systematic review and metaanalysis of cohort studies, an update of the evidence of the WCRF-AICR Continuous Update Project. Ann Oncol 2017;28:1788-802
[95] Kyrozis A et al. Dietary and lifestyle variables in relation to incidence of Parkinson‘s disease in Greece. Eur J Epidemiol 2013;28:67-77
[96] Jiang W et al. Dairy foods intake and risk of Parkinson‘s disease: a dose-response metaanalysis of prospective cohort studies. Eur J Epidemiol 2014;29:613-619
[97] Hughes KC et al. Intake of dairy foods and risk of Parkinson disease. Neurology 2017;89:46-52
[98] Olsson E et al. Milk and fermented milk intake and Parkinson‘s disease: Cohort study. Nutrients 2020;12:2763
[99] Michaëlsson K et al. Milk intake and risk of mortality and fractures in women and men: cohort studies. BMJ 2014;349:g6015
[100] Michaëlsson K et al. Milk, fruit and vegetable, and total antioxidant intakes in relation to mortality rates: Cohort studies in women and men. Am J Epidemiol 2017;185:345-361
[101] Michaëlsson K et al. Mixing of apples and oranges in milk research: A cohort analysis of non-fermented milk intake and all-cause mortality. Nutrients 2020;12:1393.
[102] Tognon G et al. Nonfermented milk and other dairy products: associations with all-cause mortality. Am J Clin Nutr 2017;105:1502-1511
[103] Melnik BC. Synergistic effects of milk-derived exosomes and galactose onα-synuclein pathology in Parkinson’s disease and type 2 diabetes mellitus. Int J Mol Sci 2021;22:1059
[104] Cavero-Redondo I et al. Milk and dairy product consumption and risk of mortality: An overview of systematic reviews and metaanalyses. Adv Nutr 2019;10(suppl 2):97-104
105] Ernährungsphysiologische Bewertung von Milch und Milchprodukten und deren Inhaltsstoffen. Bericht für das Kompetenzzentrum für Ernährung, Bayern November 2014, Max Rubner-Institut, www.mri.bund.de/fileadmin/MRI/News/Dateien/Ernährungsphysiolog-Bewertung-Milch-Milchprodukte.pdf
[106] Dong JY et al. Dairy consumption and risk of breast cancer: a metaanalysis of prospective cohort studies. Breast Cancer Res Treat 2011;127:23-31
[107] Chen L et al. Milk and yogurt intake and breast cancer risk: A metaanalysis. Medicine (Baltimore) 2019;98:e14900
[108] López-Plaza B et al. Milk and dairy product consumption and prostate cancer risk and mortality: An overview of systematic reviews and metaanalyses. Adv Nutr 2019;10(suppl 2):212-223
[109] Melnik BC et al. Gesundheitsrisiken durch Milchkonsum : Eine kritische Bewertung aus ärztlicher Sicht. MMW Fortschr Med 2021;163:3-9
[110] Anisimov VN et al. The key role of growth hormone-insulin-IGF-1 signaling in aging and cancer. Crit Rev Oncol Hematol 2013;87:201-223
[111] Johnson SC. Nutrient sensing, signaling and ageing: The role of IGF-1 and mTOR in ageing and age-related disease. Subcell Biochem 2018;90:49-97
[112] Weichhart T. mTOR as regulator of lifespan, aging, and cellular senescence: A mini-review. Gerontology 2018;64:127-134






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.