
- DAZ.online
- DAZ / AZ
- DAZ 24/2021
- Sicher ans Ziel
Pharmakotherapie
Sicher ans Ziel
Therapeutisches Drug Monitoring bei chronisch-entzündlichen Darmerkrankungen
Die chronisch-entzündlichen Darmerkrankungen Morbus Crohn und Colitis ulcerosa sind schwerwiegende Erkrankungen des Darmes mit weltweit steigender Inzidenz. In Europa sind ca. 800 Personen bezogen auf 100.000 Einwohner betroffen [1]. Oftmals wird die Diagnose mittlerweile schon vor dem 18. Lebensjahr gestellt. Hervorgerufen werden die folgenschweren Entzündungen durch ein komplexes Wechselspiel zwischen genetischen Faktoren und Umwelteinflüssen wie z. B. der Ernährung, das eine Überreaktion des Immunsystems auf die Darmflora auslöst. Während die Colitis ulcerosa nur den Dickdarm befällt, kann Morbus Crohn den gesamten Gastrointestinaltrakt, vom Mund bis zum Anus, betreffen [1]. Die gastrointestinalen Entzündungsherde führen je nach Ausbreitung und Lage zu unterschiedlichen Symptomen und können eine Unterscheidung zwischen einem Morbus Crohn und einer Colitis ulcerosa schwierig gestalten. Gemein ist beiden Krankheitsbildern ein schubweiser Krankheitsverlauf, der gekennzeichnet ist von krampfartigen Schmerzen im Abdomen, Durchfällen und blutigen Stühlen. Letztere treten allerdings eher bei der Colitis ulcerosa auf. Morbus-Crohn-Patienten leiden häufig unter Abszessen und Fisteln im Magen-Darm-Trakt. Neben den gastrointestinalen Symptomen zeigen die Betroffenen auch systemische Krankheitszeichen: Sie verlieren oft an Gewicht, leiden an einem allgemeinen Krankheitsgefühl mit Fieber und können eine ausgeprägte Fatigue-Symptomatik aufweisen. Extraintestinale, arthritische Symptome sind bei beiden Krankheitsformen möglich, aber typischer für Morbus Crohn.
Die Therapie ist darauf fokussiert, die schweren Entzündungen einzudämmen, um eine klinische und endoskopische Remission zu erzielen. Dabei werden Aminosalicylate wie Mesalazin und Sulfasalazin, Glucocorticoide und Immunmodulatoren eingesetzt. Zu Letzteren zählen klassische Immunsuppressiva wie Methotrexat und Azathioprin sowie die neueren Biologika, die spezifisch in die Entzündungskaskade eingreifen, z. B. die Tumornekrose-Faktor-alpha(TNF-alpha)-Blocker Infliximab, Adalimumab und Certolizumab.
Um diese Wirkstoffe langanhaltend und sicher einzusetzen, auch im Hinblick auf die vielen jugendlichen Betroffenen, hat sich das therapeutische Drug-Monitoring bei der Behandlung der chronisch-entzündlichen Darmerkrankungen immer stärker etabliert. Mithilfe der bestimmten Arzneistoff-Blutspiegel kann die Therapie zielgerichtet kontrolliert und toxische Nebenwirkungen können in Schach gehalten werden.
Azathioprin machte den Anfang
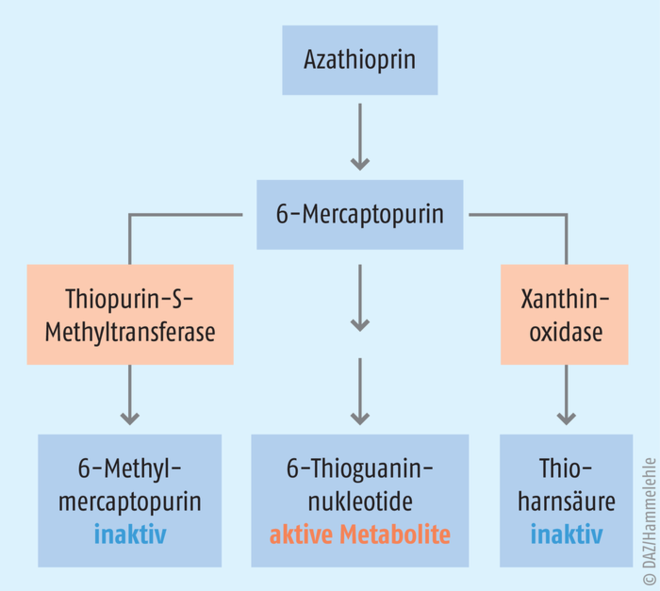
Einzug hielt das Drug Monitoring in die Therapie der chronisch-entzündlichen Darmerkrankungen Mitte der 1990er-Jahre mit der Bestimmung der Metabolite der Thiopurine Azathioprin und Mercaptopurin [2]. Die Wirkstoffe aus der Klasse der Purin-Analoga waren und sind immer noch ein wichtiger Bestandteil im Management der chronisch-entzündlichen Erkrankungen. Allerdings birgt deren Anwendung ein erhebliches toxisches Potenzial. Eine durch den Wirkstoff hervorgerufene Knochenmarksdepression oder geschädigte Leber können zum Therapieabbruch führen und die adäquate Kontrolle der Erkrankung gefährden. Die Aufklärung des Stoffwechselweges von Azathioprin stellte daher einen wichtigen Meilenstein in der Optimierung der Wirksamkeit und Sicherheit der Behandlung dar. Azathioprin ist ein Prodrug und wird im Organismus über verschiedene Wege metabolisiert (Abb. 1) [2]. Auf nicht enzymatischem Weg wird das Molekül zunächst durch biogene Thiole in 6-Mercaptopurin umgewandelt und in mehreren Schritten in die aktiven Metabolite, die Thioguanin-Nukleotide, überführt. Zusätzlich existieren zwei dazu konkurrierende Stoffwechselwege, über die 6-Mercaptopurin inaktiviert wird: Das Molekül kann durch die Xanthinoxidase zur Thioharnsäure oxidiert oder durch die Thiopurin-S-Methyltransferase zum 6-Methylmercaptopurin methyliert werden. Beide Stoffwechselprodukte sind nicht wirksam. Allerdings ist die Aktivität der Methyltransferase aufgrund eines genetischen Polymorphismus variabel. 10% der Bevölkerung weisen eine verringerte Aktivität auf, wohingegen bei 0,3% das Enzym komplett inaktiv ist [3]. Dies hat zur Folge, dass sich das Stoffwechselgleichgewicht stärker zu den aktiven Metaboliten verlagert und somit die Gefahr für eine Knochenmarksdepression steigt. Zudem zählen 10 bis 15% der Bevölkerung zu den sogenannten Hypermethylierern [4]. Bei diesen Patienten wird verstärkt das inaktive 6-Methylmercaptopurin gebildet und dafür weniger aktive Metabolite generiert. Die Wirksamkeit der Therapie sinkt somit, und das Risiko für eine Leberschädigung durch das methylierte Stoffwechselprodukt erhöht sich. Trotzdem lässt sich nur ein Teil der beobachteten toxischen Wirkungen des Purin-Analogons auf den Enzym-Polymorphismus zurückführen. Neben einer Genotypisierung der Methylase steht deshalb vor allem das therapeutische Drug Monitoring der Thioguanidin-Nukleotide und des 6-Methylmercaptopurins in den Erythrozyten zur Verfügung, um mögliche Ungleichgewichte frühzeitig zu erkennen. Als therapeutisches Fenster für die aktiven Metabolite werden Spiegel zwischen 235 pmol/8 × 108 Erythrozyten und 450 pmol/8 × 108 Erythrozyten empfohlen [5, 6]. Die Konzentration an 6-Methylmercaptopurin sollte einen Wert von 5700 pmol/8 × 108 Erythrozyten nicht überschreiten, um das Risiko für eine Schädigung der Leber gering zu halten [6]. Insgesamt werden Azathioprin und Mercaptopurin aufgrund ihrer inhärenten Malignität heutzutage allerdings weniger häufig und meist zeitlich limitiert verwendet.
Abb. 1: Verstoffwechselung des Purin-Analogons Azathioprin, vereinfacht nach [2]. Azathioprin wird zunächst auf nicht-enzymatischem Wege in den zentralen Metabolit 6-Mercaptopurin umgewandelt. Dieses Molekül kann in mehreren Schritten in die aktiven Metabolite, die 6-Thioguaninnukleotide, überführt werden. Konkurrierend dazu existieren zwei Stoffwechselwege, die das Molekül inaktivieren: Methylierung durch die Thiopurin-S-Methyltransferase sowie Oxidation durch die Xanthinoxidase.
Biologicals: Revolution mit Hindernissen
Die Therapie der chronisch-entzündlichen Darmerkrankungen wurde mit der Einführung der Biologicals revolutioniert. Erstmals war es nicht nur möglich, Patienten symptomatisch zu behandeln, sondern eine komplette Remission des Krankheitsgeschehens durch eine Heilung der Darmmukosa zu erreichen. Der erste Vertreter dieser neuen Therapeutika war Infliximab (z. B. Remicade®), ein monoklonaler Antikörper gegen TNF-alpha. Später folgten in dieser Klasse Adalimumab (z. B. Humira®), Certolizumab (z. B. Cimzia) und Golimumab (z. B. Simponi®). Jedoch bergen diese Biopharmazeutika auch neue Herausforderungen. Bei einem Drittel der Patienten schlagen diese Wirkstoffe gar nicht an, in anderen bildet der Organismus Antikörper gegen die Moleküle, die Injektionsreaktionen hervorrufen, aber auch das Therapeutikum aus dem Blutkreislauf eliminieren können und die Behandlung so im Laufe der Zeit wirkungslos machen [7]. Ein solcher sekundärer Wirksamkeitsverlust tritt bei ca. 20 bis 40% aller Patienten auf, die mit TNF-alpha-Blockern behandelt werden [7]. Ein primäres Nicht-Ansprechen und auch ein Wirkungsverlust sind vor allem assoziiert mit einem erhöhten Body-Mass-Index, dem weiblichen Geschlecht, dem Lebensalter und einer starken Krankheitsaktivität, die eine hohe inflammatorische Belastung für den Körper bedeutet [8]. Das therapeutische Drug Monitoring stellt in diesem Zusammenhang ein nützliches Instrument dar, das helfen kann, den Wirkungsverlust zu überwinden.
Infliximab-Patienten profitieren vom Monitoring
Belegt ist der Nutzen eines therapeutischen Drug Monitorings in der Erhaltungstherapie z. B. für Infliximab [14]. Die Patienten profitieren bei unnötiger Überexposition von der Möglichkeit der Verlängerung des Dosisintervalls und insgesamt von einer stabileren Remission mit weniger Exazerbationen im Vergleich zur konventionellen Therapie. Weniger Daten gibt es zum potenziellen Nutzen eines Drug Monitorings in der Induktionsphase. Nachdem es für Infliximab aus retrospektiven Untersuchungen Hinweise auf einen Nutzen eines therapeutischen Drug Monitorings gegeben hat, wurde ein proaktives Monitoring kürzlich in einer randomisierten Studie aus Norwegen prospektiv untersucht [18]. Hier waren das therapeutische Drug Monitoring und die klinisch gesteuerte Standarddosierung gleichwertig. Die Autoren führen jedoch an, dass die Standardtherapie in Norwegen bereits stark individualisiert werden kann, was den Vergleichsarm in der Studie aufgewertet haben könnte. Auch das Auftreten von Antikörpern war möglicherweise in dem untersuchten Kollektiv nicht so stark ausgeprägt, sodass ein Vorteil eines therapeutischen Drug Monitorings detektiert hätte werden können. Hinzu kommt, dass die Zielwerte in der Induktionsphase möglicherweise noch optimiert werden müssen und die Konzentrationen der Biologika stark durch Krankheitsgeschehen selbst beeinflusst werden, z. B. durch eine Ausscheidung der Biologika über Blutungen im Darm. Die niedrigen Konzentrationen sind in so einem Fall nicht Ursache für, sondern Folge des Krankheitsgeschehens. Auch schwanken die Konzentrationen innerhalb der Patienten in der Induktionsphase stärker, was eine Dosisanpassung erschwert. In diesem Kollektiv wäre insbesondere eine Identifikation von prognostischen Risikofaktoren für die Entwicklung von Antikörpern gegen die Biologika wegweisend in der Therapie.
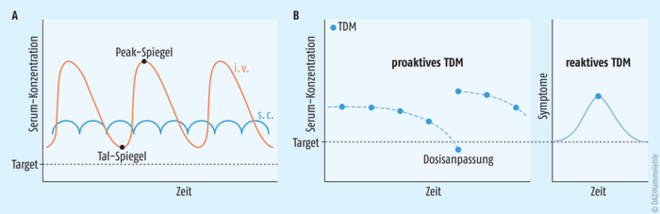
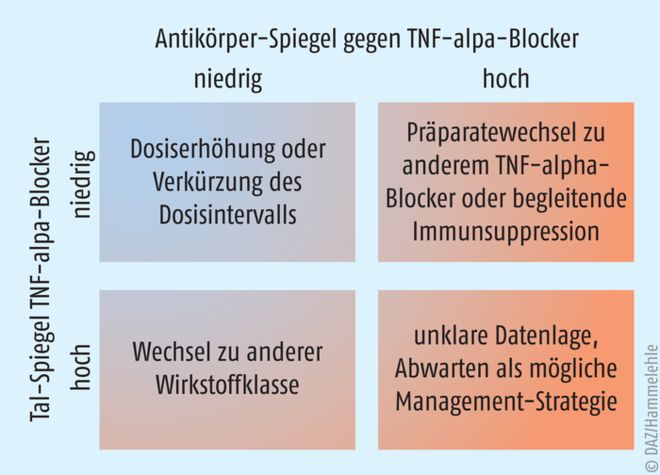
Die zentralen Messgrößen bei den Biologika sind die Tal-Spiegel, also die Konzentration vor der Applikation der nächsten Dosis und die Titer der Antikörper gegen die Wirkstoffe zum Zeitpunkt der Bestimmung der Tal-Spiegel (Abb. 2). Entwickelt ein Patient keine ausreichende Wirkung, kann anhand dieser Parameter die passende Entscheidung getroffen werden, wie die Behandlung fortgesetzt werden soll (Abb. 3). Ist die Tal-Konzentration zu niedrig und sind wenige Antikörper gegen die Therapeutika vorhanden, kann die verabreichte Dosis erhöht oder das Applikationsintervall verkürzt werden, um den Spiegel und damit die Wirkung zu erhöhen. Sind die Konzentrationen aber zu gering, weil der Patient hohe Antikörper-Titer im Blut hat, sollte über einen Wechsel zu einem anderen TNF-alpha-Blocker nachgedacht werden oder aber ein Immunsuppressivum wie Methotrexat oder Azathioprin zum Behandlungsschema hinzugefügt werden. Zahlreiche Untersuchungen belegen, dass eine begleitende immunsupprimierende Therapie die Konzentration der gegen die Biologicals gerichteten Antikörper verringern kann [8]. Bei hohen Wirkstoffspiegeln und gleichzeitig geringen Antikörperspiegeln sollte bei einem Ausbleiben der Wirkung die Präparateklasse gewechselt werden. Bleibt die Wirkung aber bei gleichzeitig hohen Talspiegeln und hohen Antikörperspiegeln aus, ist womöglich Abwarten die beste Option, da die Antikörper häufig nur transient auftreten und im Laufe der Zeit wieder verschwinden können [9]. Welche Tal-Spiegel nun genau angestrebt werden sollen, darüber gibt es noch keinen festen Konsens in der Fachwelt. Studien zufolge korreliert die Höhe der Talspiegel aber mit der Kontrolle des Krankheitsgeschehens [7]. Die American Gastroenterological Association beispielsweise empfiehlt Konzentrationen von ≥ 5 µg/ml für Infliximab, ≥ 7,5 mg/ml für Adalimumab und ≥ 20 µg/ml für Certolizumab pegol [10]. Für Infliximab ist die Datenlage am solidesten und Talspiegel zwischen 3 und 7 ng/ml haben sich in der Erhaltungstherapie der chronisch-entzündlichen Darmerkrankungen bewährt [17].
Abb. 2: Prinzip des therapeutischen Drug Monitorings der Biologika bei chronisch-entzündlichen Darmerkrankungen, modifiziert nach [7] A Die Talspiegel werden vor der Applikation der nächsten Dosis bestimmt. B Beim proaktiven Drug Monitoring werden die Wirkstoffspiegel regelmäßig bestimmt und die Dosis bei Abweichungen angepasst. Beim reaktiven Drug Monitoring werden die Spiegel nur bei nicht ausreichender Symptomkontrolle oder unerwünschten Wirkungen bestimmt, um ggf. entsprechende Maßnahmen ergreifen zu können.
Neuere Biologika wie der monoklonale Antikörper gegen Interleukine 12 und 23 Ustekinumab (Stelara®) und der monoklonale Integrin-Antikörper Vedolizumab (Entyvio®) zeichnen sich durch eine geringere Immunogenität im Vergleich zu den TNF-alpha-Blockern aus und induzieren damit weniger häufig gegen die Wirkstoffe gerichtete Antikörper. Für beide Therapeutika konnte außerdem gezeigt werden, dass mit höheren Talspiegeln eine bessere Kontrolle der chronisch-entzündlichen Darmerkrankungen erreicht werden konnte [11, 12]. Es scheint naheliegend, dass Patienten von einem therapeutischen Drug Monitoring profitieren könnten. Jedoch mangelt es an umfassenden und belastbaren Daten, die klare Empfehlungen für ein Drug Monitoring geben können.
Abb. 3: Strategien beim Nicht-Ansprechen oder Wirkungsverlust unter Berücksichtigung der beim therapeutischen Drug Monitoring bestimmten Talkonzentration der TNF-alpha-Blocker sowie der Spiegel der gegen die Therapeutika gerichteten Antikörper (modifiziert nach [8]).
Actio oder Reactio?
Meist wird das therapeutische Drug Monitoring bei chronisch-entzündlichen Darmerkrankungen wie in den beschriebenen Fällen reaktiv durchgeführt. Man schaut also nur genauer auf die Arzneistoffspiegel, sobald die Therapie nicht nach Plan läuft. Entweder, weil sich die Symptome des Patienten verschlechtern, da die Arzneimittel nicht anschlagen bzw. die Wirkung nachlässt oder weil unerwünschte Wirkungen die Behandlung gefährden. Die meisten Leitlinien weltweit sprechen in diesen Fällen eine Empfehlung für das reaktive therapeutische Drug Monitoring von Azathioprin-Metaboliten bzw. Biologika aus, um die Entscheidung zu unterstützen, wie die Therapie angepasst werden sollte. Demgegenüber steht das proaktive Monitoring, bei dem von Anfang an die Serumspiegel der Therapeutika bestimmt werden, unabhängig davon, wie der Patient sich fühlt (Abb. 2). So sollen eventuelle Wirksamkeitsverluste und Nebenwirkungen von vornherein vermieden werden. Die Datenlage für den proaktiven Ansatz ist allerdings nach wie vor dünn. Für die Überlegenheit des proaktiven Azathioprin-Metaboliten-Monitoring hat noch keine prospektive Studie einen Beleg gefunden [8]. Bei den Biologika ist das Bild differenzierter. Den deutlichsten Nachweis für den Nutzen eines proaktiven Monitoring lieferten Assa et al. In ihrer Studie wurden 78 Kinder und Jugendliche mit Morbus Crohn, die auf eine Induktionstherapie mit Adalimumab ansprachen, randomisiert entweder mit einem proaktiven Monitoring-Ansatz betreut oder reaktiv überwacht [13]. In beiden Gruppen wurden Talspiegel von 5 µg/ml Adalimumab angestrebt. Die proaktiven Messungen fanden in einem Abstand von acht Wochen statt. Im Rahmen der Studie wurde untersucht, wie viele Probanden eine anhaltende, steroidfreie Remission der Krankheit erreichten. Mit einem proaktiven Monitoring-Ansatz schafften dies 82% aller Teilnehmer, in der reaktiven Monitoring-Gruppe nur 42%, ein signifikanter Unterschied. In zwei weiteren Studien (TAXIT und TAILORIX) konnte hingegen gezeigt werden, dass ein proaktives Infliximab-Monitoring langfristig keine Vorteile bietet [14, 15]. Die TAXIT-Studie unterstreicht aber, dass ein Drug Monitoring in der Frühphase der Therapie wesentlich ist für den Erfolg der Behandlung [14]. Weitere Publikationen zu diesem Thema sind oft retrospektiver Natur oder methodisch unzureichend und daher nur bedingt aussagefähig. Es besteht noch dringender Forschungsbedarf, um die Relevanz eines proaktiven therapeutischen Drug Monitorings zu klären. Werden allerdings die Calcineurin-Inhibitoren Ciclosporin A und Tacrolimus bei schweren oder therapierefraktären Formen der Colitis ulcerosa eingesetzt, ist ein regelmäßiges Monitoring der Wirkstoffspiegel bereits heute Standard. Die Talspiegel dieser Immunsuppressiva können individuell sehr unterschiedlich ausfallen, sodass regelmäßige Blutspiegelmessungen und eventuelle Dosisanpassungen unerlässlich sind [9]. Eine optimale Zielkonzentration ist aber auch bei den Calcineurin-Inhibitoren nicht bekannt, es wird daher für die Ciclosporin-A-Talspiegel ein Bereich zwischen 250 und 400 ng/ml als therapeutisches Fenster empfohlen [9]. Für Tacrolimus finden sich je nach Quelle verschiedene Empfehlungen im Konzentrationsbereich von 4 bis 15 ng/ml [9]. Hinsichtlich der Häufigkeit der Messungen bestehen keine spezifischen Richtlinien. Als Faustregel gibt die deutsche S3-Leitlinie „Colitis ulcerosa“ mit auf den Weg, dass die Spiegel in der Initialphase der Therapie häufiger bestimmt werden sollten, beispielsweise einmal wöchentlich, während bei stabil eingestellten Patienten die Zeiträume vergrößert werden können. Aufgrund der erheblichen Nebenwirkungen der Calcineurin-Inhibitoren sollte spätestens nach sechs Monaten auf ein anderes Präparat gewechselt werden, um die Remission der Erkrankung zu erhalten [9].
Chance und Herausforderung
Bei der Implementierung des Drug Monitorings lauern jedoch auch einige Hindernisse. Nach wie vor existieren wenige verbindliche Angaben zu empfohlenen Talspiegeln und Cut-offs für Antikörper gegen Biologicals. Auch die Spiegelbestimmung und Interpretation der Ergebnisse selbst ist nicht immer trivial (siehe Interview mit Prof. Dr. Sebastian Wicha). Nachteilig ist außerdem, dass die Talspiegelbestimmung direkt vor der Applikation der nächsten Dosis stattfindet und festgestellte Unregelmäßigkeiten meist erst zur nächsten Dosierung korrigiert werden können. Bei Infliximab z. B. beträgt dieses Intervall immerhin acht Wochen. Ein weiteres Argument, was häufig gegen ein therapeutisches Drug Monitoring ins Feld geführt wird, ist die Kostenfrage. Ob sich das Monitoring auch langfristig finanziell rechnet, ist unklar. Dass eine 2018 veröffentlichte Metaanalyse einen Kostenvorteil des reaktiven Monitorings einer Infliximab-Therapie feststellte, ist in diesem Zusammenhang ermutigend [16]. Das therapeutische Drug Monitoring ist ganz klar ein wichtiges Instrument, das die Behandlung der chronisch-entzündlichen Darmerkrankungen deutlich verbessern kann. Die ermittelten Talspiegel sollen aber nicht zu starr betrachtet werden. Manch ein Patient ist bei der empfohlenen Talkonzentration z. B. noch nicht in Remission und könnte von höheren Spiegeln profitieren. Ein ganzheitliches Therapiekonzept umfasst daher die Arzneimittelspiegel, die Symptomatik und verschiedene klinische Parameter wie das C-reaktive-Protein oder MRT- bzw. Endoskopie-Resultate [7]. Jeder Patient ist individuell und in der Zusammenschau dieser Elemente kann der Behandlungsplan für jeden personalisiert werden. |
Literatur
[1] Wehkamp J et al. Chronisch-entzündliche Darmerkrankungen. Dtsch Arztebl Int 2016;113:72-82
[2] Warner B et al. A practical guide to thiopurine prescribing and monitoring in IBD. Frontline Gastroenterol 2018;9:10-15
[3] Weinshilboum RM, Sladek SL. Mercaptopurine pharmacogenetics: monogenic inheritance of erythrocyte thiopurine methyltransferase activity. Am J Hum Genet 1980;32:651-662
[4] Ansari A et al. Prospective evaluation of the pharmacogenetics of azathioprine in the treatment of inflammatory bowel disease. Aliment Pharmacol Ther 2008;28:973-983
[5] Moreau AC et al. Association between 6-thioguanine nucleotides levels and clinical remission in inflammatory disease: a meta-analysis. Inflamm Bowel Dis 2014;20:464-471
[6] Dubinsky MC et al. Pharmacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterology 2000;118:705-713
[7] Argollo M et al. Optimizing biologic therapy in IBD: how essential is therapeutic drug monitoring? Nat Rev Gastroenterol Hepatol 2020;17:702-771
[8] Lee S et al. Therapeutic Drug Monitoring for Current and Investigational Inflammatory Bowel Disease Treatments. J Clin Gastroenterol 2021;55:195-206
[9] Kucharzik T et al. Aktualisierte S3-Leitlinie Colitis ulcerosa – Living Guideline. Gastroenterol 2020;58:241-326
[10] Feuerstein JP et al. American Gastroenterological Association Institute Guideline on Therapeutic Drug Monitoring in Inflammatory Bowel Disease. Gastroenterology 2017;153:827-834
[11] Williet N et al. Association between low trough levels of vedolizumab during induction therapy for inflammatory bowel diseases and need for additional doses within 6 months. Clin Gastroenterol Hepatol 2017;15:1750-1757
[12] Battat R et al. Association between ustekinumab trough concentrations and clinical, biomarker, and endoscopic outcomes in patients with Crohn’s disease. Clin Gastroenterol Hepatol 2017;15:1427-1434
[13] Assa A et al. Proactive Monitoring of Adalimumab Trough Concentration Associated With Increased Clinical Remission in Children With Crohn‘s Disease Compared With Reactive Monitoring. Gastroenterology 2019;157(4):985-996
[14] Casteele NV et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology 2015;148:1320-1329
[15] D’Haens G et al. Increasing Infliximab Dose Based on Symptoms, Biomarkers, and Serum Drug Concentrations Does Not Increase Clinical, Endoscopic, and Corticosteroid-Free Remission in Patients With Active Luminal Crohn‘s Disease. Gastroenterology 2018;154:1343-1351
[16] Ricciuto A et al. Clinical Outcomes With Therapeutic Drug Monitoring in Inflammatory Bowel Disease: A Systematic Review With Meta-Analysis. J Crohns Colitis 2018;12:1302-1315
[17] Papamichael K et al. Therapeutic Drug Monitoring During Induction of Anti–Tumor Necrosis Factor Therapy in Inflammatory Bowel Disease: Defining a Therapeutic Drug Window. Inflamm Bowel Dis 2017;23:1510-1515
[18] Syversen SW et al. Effect of Therapeutic Drug Monitoring vs Standard Therapy During Infliximab Induction on Disease Remission in Patients With Chronic Immune-Mediated Inflammatory Diseases. JAMA 2021;325:1744-1754
Ein Baustein zur Therapiesteuerung
Ein Interview mit Prof. Dr. Sebastian Wicha
DAZ: Welche Vorteile bietet ein therapeutisches Drug Monitoring bei chronisch-entzündlichen Darmerkrankungen?
Prof. Dr. Sebastian Wicha: Bei chronisch-entzündlichen Darmerkrankungen möchte man mit einem therapeutischen Drug Monitoring einen Wirkungsverlust durch zu niedrige Konzentrationen der Biologika verhindern. Auch kann man Antikörper detektieren, die zu einem Wirkungsverlust führen können, so dass ein Wechsel des Präparats nötig wird. Auch finanziell kann es attraktiv sein: Unnötige Überdosierungen werden erkannt, das Dosisintervall kann verlängert werden, dadurch können bei einem Teil der Patienten die Dosis und damit die Therapiekosten gesenkt werden. Das ist auch für den Patienten vorteilhaft, wenn das Dosisintervall in der Remissionsphase verlängert werden kann und damit weniger Arztbesuche für die Infusionen erforderlich sind.
DAZ: Wird das therapeutische Drug Monitoring bereits ausreichend im klinischen Alltag eingesetzt? Wo sehen Sie Verbesserungsbedarf?
Wicha: Reaktives therapeutisches Drug Monitoring, also ein Monitoring bei einem Nicht-Ansprechen der Therapie, wird bei chronisch-entzündlichen Darmerkrankungen bereits vielfach durchgeführt. In der Praxis werden die Vorzüge des therapeutisches Drug Monitoring bisher nicht vollumfänglich genutzt. Eine Dosisreduktion und das damit verbundene Einsparpotenzial bei erhöhten Konzentrationen bleibt meist ungenutzt. Auch eine Unterdosierung, die sich erst im Verlauf in einer Exazerbation äußert, könnte frühzeitig erkannt und vermieden werden. Um diese Patienten zu identifizieren, erfordert es ein proaktives Monitoring, das viel seltener eingesetzt wird.
DAZ: Welche Herausforderungen bringt das therapeutische Drug Monitoring für das medizinische Personal und die Patienten mit sich?
Wicha: Für die Patienten sind die Herausforderungen aus meiner Sicht eher gering. Die zusätzliche Blutentnahme fällt bei einer ohnehin intravenösen Applikation sicherlich kaum ins Gewicht, und die potenziellen Vorteile (stabilere Remission, potenziell seltenere Arztbesuche durch verlängerte Dosisintervalle) überwiegen. Für das medizinische Personal ist es durchaus mit zusätzlichen Herausforderungen verbunden, denn neben der Analytik der Biologika ist die Interpretation der Messungen essenziell. Hier hat sich jedoch in den letzten Jahren einiges getan, und spezielle Softwareprogramme zur Dosisanpassung von Biologika (z. B. Baysient® oder InsightRX®) stehen zur Verfügung. Insbesondere die Interpretation von Antikörpern gegen die Biologika ist jedoch weiterhin herausfordernd: Die bloße Messung ist allein leider oft nicht zielführend, da die Antikörper je nach Art und Ausprägung entweder nur die Elimination beschleunigen und die Therapie aber wirksam bleibt bzw. mit einer Dosiserhöhung kompensiert werden kann, oder aber neutralisierend wirken und die Wirkung damit stark abschwächen können. Das therapeutische Drug Monitoring kann da neben dem Beobachten des klinischen Ansprechens nur ein Baustein zur Therapiesteuerung sein.
DAZ: Meist werden die Wirkstoffspiegel bestimmt, sobald Probleme bei der Therapie auftreten. Befürworten Sie ein proaktives Drug Monitoring, um diese Probleme möglichst erst gar nicht auftreten zu lassen?
Wicha: Ein proaktives therapeutisches Drug Monitoring in der Erhaltungstherapie für alle Patienten mit entzündlichen Darmerkrankungen wäre aus meiner Sicht für Infliximab sinnvoll, um die Remission stabil zu halten und nicht notwendige Überdosierungen zu vermeiden. Auch wenn prinzipiell ein proaktives therapeutisches Drug-Monitoring attraktiv erscheint, sollte dessen Nutzen jedoch erst in prospektiv angelegten, randomisierten Studien gegen die Standardtherapie evaluiert werden, bevor es Therapiestandard werden könnte.
DAZ: Vielen Dank für das Gespräch!
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.