
- DAZ.online
- DAZ / AZ
- DAZ 24/2021
- Neue Vorschriften für ...
Praxis
Neue Vorschriften für gefährliche Gemische
Herstellung und Abgabe von Kleinstmengen in Apotheken oft unmöglich
Werden in der Apotheke gefährliche Gemische oder gefährliche Biozid-Produkte selbst hergestellt, abgefüllt oder umgefüllt, müssen diese seit 1. Januar 2021 europaweit einheitlich mit einem sogenannten UFI-Code gekennzeichnet werden. UFI steht dabei für Unique Formula Identifier und ist ein 16-stelliger Code aus Zahlen und Buchstaben, der auf dem Etikett des Gemischs anzubringen ist. Unter dieser Code-Nummer, die die Apotheke auf dem dafür eingerichteten Zentralserver (UFI-Code-Creator) generieren muss, sind dann noch die detaillierten Produktdaten des Gemischs im sogenannten PCN-Format (PCN = Poison Centres Notification) auf den Zentralserver der ECHA (Europäische Chemikalienagentur) zu laden.
Das Bundesamt für Risikobewertung (BfR) lädt diese Produktmitteilungen zurzeit einmal pro Arbeitstag von dem ECHA-Portal herunter und stellt diese Informationen den deutschen Giftinformationszentren zur Verfügung. Auf der Basis des UFI-Codes können diese dann schnell und digital auf die Zusammensetzung und das mögliche Gefährdungspotenzial von Gemischen zugreifen, um im Bedarfsfall schnell und zielgenau beraten zu können.
Dies gilt sowohl für die Abgabe an private als auch an gewerbliche Verwender. Die gesetzliche Grundlage hierfür ist der § 16e Chemikaliengesetz, in Verbindung mit der Giftinformationsverordnung und Anhang VIII der Verordnung (EG) Nr. 1272/2008 (CLP-Verordnung).
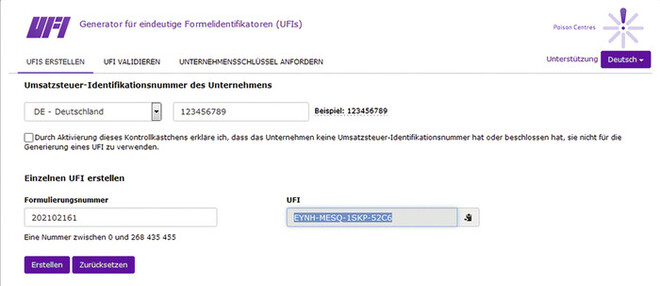
Wird also jetzt in einer Apotheke ein bisher noch nicht gemeldetes gefährliches chemisches Gemisch oder ein Biozid-Produkt zum ersten Mal für die Abgabe hergestellt, muss für das Produkt ein UFI-Code erstellt und bei der Mitteilung an die ECHA angegeben werden (Abb.). Der einfachste Weg ist der UFI-Code-Creator unter https://ufi.echa.europa.eu/#/create.
Hier wird die Umsatzsteueridentifikationsnummer der Apotheke sowie eine für das Gemisch selbst angelegte Formulierungsnummer (z. B. die eigene Chargennummer) benötigt. Der UFI-Code ordnet die eingereichten Informationen einem Gemisch eindeutig zu. Die Zuteilung des UFI-Codes ist unentgeltlich.
Folgende Angaben zum gefährlichen Gemisch oder Biozid müssen vor dem erstmaligen Inverkehrbringen oder bei Änderungen der Zusammensetzung mitgeteilt werden:
- Produktkennung (Produktname, UFI-Code)
- Kontaktdaten der Apotheke
- Einsatzbereich des Gemischs
- chemische Zusammensetzung
- toxikologische Informationen
- Einstufung und Kennzeichnung
- Produktkategorie
- Zusatzinformationen, z. B. zu Farbe, pH-Wert, Art und Größe der Verpackung
Die Meldung muss im sogenannten PCN-Format erfolgen. Dazu bietet die ECHA über https://poisoncentres.echa.europa.eu/de/echa-submission-portal eine kostenfreie cloudbasierte Softwarelösung (IUCLID6-Cloud) an, in der die oben geforderten Produktinformationen eingegeben und dann in das geforderte PCN-Format transferiert werden können. Allerdings ist dies relativ aufwendig und aufgrund der Programmstruktur nicht selbsterklärend. Die Abgabe solcher Meldungen wird damit in der Apothekenpraxis nur zu leisten sein, wenn Gemische in größerem Umfang hergestellt und abgegeben werden sollen. Nur dann stellt sich eine Routine ein, die den Aufwand rechtfertigt.
Die Mitteilungspflicht gilt nicht für:
- Reinstoffe,
- ausschließlich als explosiv eingestufte Gemische,
- ausschließlich als Gase unter Druck eingestufte Gemische,
- ausschließlich als umweltgefährlich eingestufte Gemische,
- Gemische für die innerbetriebliche Anwendung, z. B. als Prüfreagenz,
- die Abgabe von unveränderten Produkten im Originalgefäß,
- Medizinprodukte, auch In-vitro-Diagnostika,
- Arzneimittel,
- Lebensmittel.
Was heißt das für den Apothekenalltag?
Das Gesetz versteht unter Gemischen Lösungen aus mindestens zwei Stoffen, wobei auch das Verdünnungsmittel Wasser als Stoff gilt.
Wässrige Lösungen von Stoffen gelten dann als Reinstoffe, wenn das Lösungsmittel Wasser nicht abgetrennt werden kann, ohne das Gemisch zu zerstören. So gelten z. B. Natriumhypochlorit-Lösung und Wasserstoffperoxid-Lösung als Reinstoff, Salzsäure- und Natriumhydroxid-Lösungen dagegen als Gemische.
Die Tabelle zeigt an Beispielen, in welchen Fällen die neuen Vorschriften gelten bzw. wo sie nicht greifen.
Abgabe in der Apotheke | Beispiele aus dem Apothekenalltag | Mitteilungspflicht |
|---|---|---|
selbst hergestellte Gemische/Verdünnungen | Ammoniak- Lösung | ja |
Essigsäure ab 10% | ja | |
Ethanol-Wasser-Mischungen | ja | |
Isopropanol-Wasser-Mischungen | ja | |
Natriumhypochlorit-Lösung | nein | |
Salzsäure-Lösungen | ja | |
Wasserstoffperoxid-Lösung (bis 12%) | nein | |
Gemische/Verdünnungen, unverändert abgefüllt in kleinere Gebinde | „150 ml“ Salzsäure 36%, abgefüllt aus <1 Liter> Salzsäure 36% Fa. Hedinger <Originalgebinde> | ja Die UFI des Herstellers darf übernommen werden (Vermerk auf dem Etikett). |
Gemische/Verdünnungen im Originalgefäß | <1 Liter> Salzsäure 36% Fa. Hedinger <Originalgebinde> | nein |
Reinstoffe im Originalgefäß | 250 g Citronensäure-Monohydrat | nein |
Reinstoffe, unverändert abgefüllt in kleinere Gebinde | Aceton, Benzin, Citronensäure, Isopropanol | nein |
Herstellung/Verdünnung von Gemischen zur rein innerbetrieblichen Anwendung, z. B. als Prüfreagenz oder Fließmittel | Natronlauge verdünnt, Salpetersäure verdünnt, Silbernitrat-Lösung, Zinksulfat-Lösung | nein |
in der Apotheke hergestellte Arzneimittel (Rezeptur, Defektur, Standardzulassungen) | nein | |
Medizinprodukte, In-vitro-Diagnostika | nein |
Bei den selbst hergestellten Gemischen gilt die Meldepflicht nur, wenn sie für technische Zwecke als Gefahrstoffe abgegeben werden sollen. Werden die Produkte als Arzneimittel (z. B. Ethanol 70% V/V als Standardzulassung) oder als Lebensmittel (z. B. Essigsäure-Lösung > 10%) in einer für den Endverbraucher bestimmten und konfektionierten Packung in den Verkehr gebracht, gelten die Vorschriften des Gefahrstoffrechts nicht.
Fazit
Die Herstellung von Gemischen als Einzelanforderungen von Kunden ist damit für die Apotheke faktisch unmöglich geworden, da es auf europäischer Ebene keine Ausnahmen für Kleinstmengen unter der Verantwortung der Approbation eines Apothekers bzw. einer Apothekerin gibt. Der einzig praktikable Weg für die Apotheke besteht somit derzeit nur darin, endverbrauchertauglich verpackte und gekennzeichnete Gemische zu beziehen und unverändert abzugeben. Sollen selbst hergestellte Gemische in größerem Umfang in den Verkehr gebracht werden, so wird eine effiziente Meldung an die ECHA nur über eine spezifische Softwarelösung zu realisieren sein, die die Zusammenstellung der erforderlichen Daten wirksam unterstützt und diese über die schon auf dem Portal vorgesehene Schnittstelle in die ECHA-Datenbank einspeist. |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.