
- DAZ.online
- DAZ / AZ
- DAZ 19/2021
- Regulatorisches Dickicht ...
Interpharm online 2021
Regulatorisches Dickicht um Cannabis und CBD
Was muss bei der Abgabe von Blüten und Zubereitungen beachtet werden?
Schon seit Jahren ranken sich jede Menge Rechtsfragen um die Einordnung von Cannabis-haltigen Produkten und die Konsequenzen, die sich daraus für den Handel, das heißt auch für die Apotheken ergeben. Bei vielen Erzeugnissen, vor allem solchen mit dem nicht suchterzeugenden Cannabidiol (CBD) sind erhebliche Zweifel an der Verkehrsfähigkeit anzumelden. Das rechtliche „Damoklesschwert“, das über allen „sonstigen Cannabisprodukten“ ohne Arzneimittelcharakter schwebt, ist das Betäubungsmittelgesetz.
Erste Frage: Handelt es sich um ein BtM?
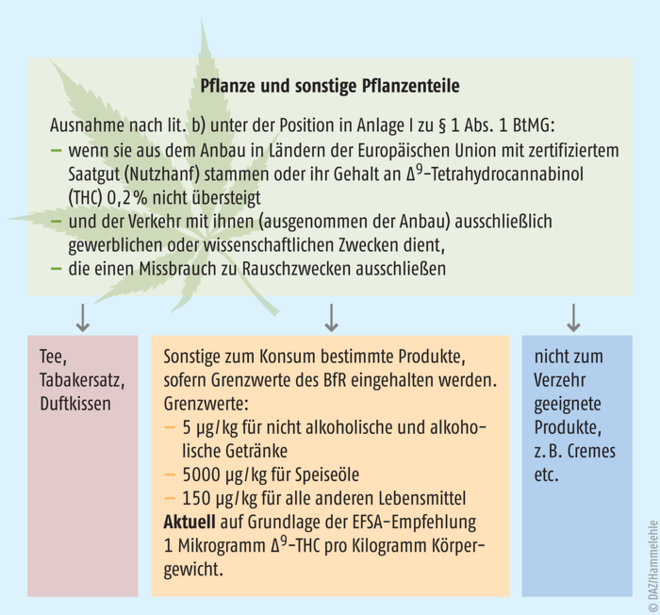
Nach Anlage I zum Betäubungsmittelgesetz (BtMG) sind sowohl „Pflanzen und Pflanzenteile der zur Gattung Cannabis gehörenden Arten“ als auch das suchterzeugende Tetrahydrocannabinol (THC) nicht verkehrsfähige Betäubungsmittel. Hierzu gibt es allerdings einige Ausnahmen. Eine davon betrifft die Anwendung von Cannabis zu medizinischen Zwecken als „Medizinalcannabis“, eine weitere Hanfsamen (außer für den unerlaubten Hanfanbau) sowie sämtliche Produkte aus Hanfsamen, wie Hanfsamenöl oder Hanfsamenmehle. Die dritte Ausnahme betrifft Cannabis-Pflanzen und Pflanzenteile, die als Nutzhanf verwendet werden. Diese müssen allerdings aus dem Anbau in der EU mit eigens hierfür zertifiziertem Saatgut stammen. Alternativ darf der THC-Gehalt maximal 0,2% betragen, was dem zertifizierten Saatgut entspricht. Außerdem muss der Verkehr damit ausschließlich zu gewerblichen oder wissenschaftlichen Zwecken dienen, die einen Missbrauch zu Rauschzwecken ausschließen (Abb. 1).
EuGH: Cannabidiol ist kein BtM
An diesen Vorgaben müssen sich alle Cannabisprodukte, die als Lebensmittel, Medizinprodukte oder Kosmetika vermarktet werden, messen lassen, hob Köbler hervor. Als Optionen für solche Produkte führte die Referentin Tees, Tabakersatz, Duftkissen oder sonstige zum Konsum bestimmte Produkte an. Dabei ist der mögliche Gehalt an dem psychoaktiven Tetrahydrocannabinol (THC) ein wesentliches Kriterium. Das Bundesamt für Risikobewertung (BfR) hat deshalb für die Produkte bestimmte THC-Obergrenzen festgelegt.
Cannabidiol (CBD ist in den Anlagen zum BtMG nicht gesondert erwähnt. Nach einem Urteil des Europäischen Gerichtshofs von November 2020 (Rs. C-663/18) soll CBD kein Suchtstoff im Sinne des Einheitsübereinkommens über Suchtstoffe sein. Das soll sowohl für synthetisch hergestelltes als auch für „natürliches“ CBD als Isolat aus Pflanzenteilen gelten.
Unterscheidung vom Arzneimittel
Viele Cannabis- oder Cannabidiol-haltige sonstige Cannabisprodukte suchen in ihrer Auslobung die Nähe zum Arzneimittel, weil diese sich dann aus Sicht der Hersteller besser vermarkten lassen. Das heißt aber noch lange nicht, dass sie de facto keine Arzneimittel sind. Für die Abgrenzung sind laut Köbler die Kriterien für ein Funktionsarzneimittel oder Präsentationsarzneimittel maßgeblich. So ist beispielsweise bei einem Produkt mit 200 mg CBD täglich wegen der zweifelsohne vorhandenen pharmakologischen Wirkung von einem Funktionsarzneimittel auszugehen. Angaben zu Wirkstoffmengen oder das Anpreisen von gesundheitsfördernden, heilenden oder lindernden Wirkungen machen ein Produkt aller Wahrscheinlichkeit nach zu einem Präsentationsarzneimittel, wobei die überwiegende objektive Zweckbestimmung entscheidend ist. Hier könnten schon Nuancen in Formulierungen und Beschreibungen ausschlaggebend sein, betonte die Rechtsanwältin.
Zulassung als Novel Food gefordert
Die größte Bedeutung unter den sonstigen Cannabis-Produkten haben diejenigen, die als Lebensmittel beziehungsweise Nahrungsergänzungsmittel in den Verkehr gebracht werden. Neben der Abgrenzung zum Arzneimittel kommt hier noch ein anderer Aspekt zum Tragen, und zwar die Einordnung als neuartiges Lebensmittel (Novel Food). Die Europäische Kommission hat Hanfprodukte mit folgender Maßgabe in den Novel-Food-Katalog der EU aufgenommen: Während die Hanfpflanze selbst ebenso wie Hanfsamen, Hanfsamenöl oder Hanfsamenmehl oder fettfreies Hanfsamenprotein keine neuartigen Lebensmittel sein sollen, werden Cannabinoid-haltige Extrakte aus der Cannabispflanze und andere Produkte, denen solche Extrakte als Zutat zugesetzt werden (z. B. Hanfsamenöl mit CBD), als neuartig eingestuft, ebenso wie die Einzelsubstanz Cannabidiol (CBD), und zwar auch in synthetischer Form. Das heißt, dass die Produkte eigens zugelassen werden müssen.
Zahlreiche Anträge anhängig
Der Novel-Food-Katalog der EU hat zwar für die Mitgliedstaaten lediglich einen Hinweischarakter, aber die Gerichte und Überwachungsbehörden sind dieser Einstufung laut Köbler bislang weitgehend gefolgt. Für die Gerichte sei die „Sache durch“. Angesichts dessen, dass es bislang keine Zulassung für entsprechende Produkte als Novel Food gibt, hat das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) festgestellt, dass ihm bislang keine Fallgestaltung bekannt sei, wonach Cannabidiol (CDB) in Lebensmitteln, also auch in Nahrungsergänzungsmitteln verkehrsfähig wäre. Aktuell sind jedoch zahlreiche Anträge zur Zulassung von Cannabidiol als Novel Food anhängig. Köbler geht davon aus, dass „hier demnächst Bewegung reinkommt“, und rechnet deshalb in absehbarer Zeit mit einem weiteren Cannabidiol-Boom.
Dr. Christian Rotta, Geschäftsführer des Deutschen Apotheker Verlags, führte durch den ApothekenRechtTag 2021.
CBD als Inhaltsstoff in Kosmetika erlaubt
Die Versuche von Herstellern, Cannabidiol als Medizinprodukt auf den Markt zu bringen, sind bislang noch recht zaghaft. Cannabis-haltige Kosmetika sind demgegenüber zahlreich vorhanden, und auch für diese ist der Grat für das rechtmäßige Inverkehrbringen schmal. Kommt der Cannabidiol-Gehalt dem eines Fertigarzneimittels gleich (Sativex-Spray zur Anwendung in der Mundhöhle), so scheidet die Qualifikation als Kosmetikum aus Köblers Sicht regelmäßig aus. Das BfR empfiehlt, für kosmetische Mittel nur Hanföle einzusetzen, die den Richtwert von 5000 µg/kg THC für Speiseöle einhalten. Nach dem EuGH-Urteil hat die EU-Kommission natürliches CBD in die Datenbank kosmetischer Inhaltsstoffe (Cosing) aufgenommen. Daraufhin seien schon einige Hersteller auf diesen Zug aufgesprungen und hätten entsprechende Produkte auf den Markt gebracht, berichtete Köbler.
Hilfe bei der Produktqualifizierung
Wie kann man sich in dem Dickicht der Vorschriften für die Abgrenzung zurechtfinden, wenn es darum geht, ein Produkt mal „auf die Schnelle“ grob einzuordnen? Hierzu lieferte die Rechtsanwältin einen vereinfachten Kriterienkatalog (Tab. 1).
Kategorie | Merkmale |
|---|---|
Arzneimittel | Zulassungsnummer, Registrierungsnummer, Hinweise wie „verschreibungspflichtig/apothekenpflichtig“ |
Medizinprodukt | CE-Kennzeichnung, Angabe einer Benannten Stelle |
Kosmetikum | Angabe der Liste der Bestandteile mit „Ingredients“, Betonung „pflegend“ |
Lebensmittel | Zutatenverzeichnis, konkrete Bezeichnung |
Nahrungsergänzungsmittel | Zutatenverzeichnis, Hinweis „die angegebene und empfohlene tägliche Verzehrmenge darf nicht überschritten werden“, Hinweis „Nahrungsergänzungsmittel sollten nicht als Ersatz für eine ausgewogene und abwechslungsreiche Ernährung verwendet werden“ |
Haftungsrisiken eher unwahrscheinlich
Was kann passieren, wenn in der Apotheke ein nicht verkehrsfähiges Cannabis-Produkt abgegeben wird? Hierzu ist Köbler bislang kein Strafverfahren bekannt. Bei nicht verkehrsfähigen Produkten gerate eher der Hersteller oder der Inverkehrbringer in den rechtlichen Fokus. Gleichwohl könne eine Unterlassungsklage für das Inverkehrbringen dann am Ende auch die Apotheken für die Abgabe betreffen. Dass die Apotheken gesondert angegangen werden könnten, hält Köbler allerdings für eher unwahrscheinlich. |
Schon angemeldet, aber Vortrag verpasst? Sie können ihn bis zum 15. Juni 2021 unter www.interpharm.de im Video-Archiv jederzeit abrufen.
Sie haben die Teilnahme an der Interpharm-online-Premiere verpasst? Kein Problem. Melden Sie sich unter www.interpharm.de an und holen Sie die Interpharm online einfach nach. Wenn Sie dann auch noch 7 von 10 Fragen zu den jeweiligen Vorträgen richtig beantworten, können Sie noch eine Fortbildungspunkt im Rahmen unserer BAK-Zertifizierung erwerben.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.