
- DAZ.online
- DAZ / AZ
- DAZ 6/2020
- Grippeviren ausbremsen
Arzneimittel und Therapie
Grippeviren ausbremsen!
Medikamentös gegen Influenza
Bei den meisten Patienten, die an Grippe erkrankt sind, ist es ausreichend, diese symptomatisch zu behandeln [1 – 3]. Besteht jedoch der Verdacht bzw. ein erhöhtes Risiko, dass die Influenza einen schweren Verlauf nehmen könnte, dann sollte eine Therapie mit antiviral wirksamen Arzneimitteln in Betracht gezogen werden [3]. Dies ist beispielsweise der Fall bei [3 – 5]:
- Kindern unter zwei Jahren
- älteren Menschen ab 65 Jahren
- Patienten, die bereits bestimmte Vorerkrankungen aufweisen wie chronische Herz- oder Lungenerkrankungen, Diabetes mellitus, Immundefekte, neurologische bzw. neuromuskuläre Erkrankungen oder schwere Adipositas
- hospitalisierten Patienten
- schwangeren oder postpartalen (< zwei Wochen) Frauen
Eine antivirale Therapie zielt darauf ab, die Symptomatik zu lindern, die Krankheitsdauer zu verkürzen und Komplikationen zu reduzieren. Bei schweren Symptomen ist es sinnvoll, die Diagnose durch eine Laboruntersuchung zu sichern, was den Behandlungsbeginn aber nicht verzögern darf [3]. Die antivirale Therapie sollte nämlich so früh wie möglich, d. h. innerhalb von 48 Stunden nach Auftreten der ersten Grippesymptome begonnen werden, da sie dann den größten Nutzen aufweist [3, 4].
Die Vorbeugung gegen Influenza erfolgt zwar bevorzugt mittels Impfung, aber auch die zur Verfügung stehenden antiviral wirksamen Arzneimittel sind grundsätzlich für eine Prophylaxe geeignet. So lassen sich Personen vor einer Infektion schützen, wenn sie wegen einer Vorerkrankung nicht geimpft werden können [1 – 3]. Dasselbe gilt für Patienten mit einer Immunschwäche, bei denen eine eingeschränkte Schutzwirkung der Impfung zu befürchten ist [1 – 3]. Prophylaktisch können antivirale Arzneimittel auch zum Schutz potenziell exponierter Personen eingesetzt werden, wenn Häufungen von Grippefällen in einer geschlossenen Umgebung, z. B. im Pflegeheim oder Krankenhaus, auftreten [1 – 3].
Welche Arzneimittel gibt es?
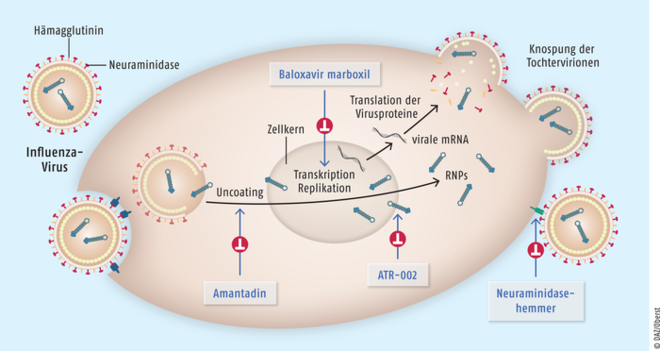
Die Tabelle gibt eine Übersicht über die aktuell verfügbaren antiviralen Arzneimittel gegen Influenza [6 – 17]. In der Regel werden Inhibitoren der viralen Neuraminidase eingesetzt. Das Oberflächenprotein der Influenza-Viren besitzt enzymatische Eigenschaften und spaltet terminale Sialinreste von Glykoproteinen und Glykolipiden auf der Oberfläche von Wirtszellen ab. Dadurch können sich die Viren nach ihrer Vermehrung wieder von ihrer Wirtszelle lösen und weitere Zellen befallen. Neuraminidasehemmer wirken somit virostatisch, verhindern also die Vermehrung der Viren im Körper (s. Abbildung). In Deutschland sind derzeit Oseltamivir und Zanamivir zur Behandlung der Influenza zugelassen; Peramivir besitzt eine Zulassung für die EU und USA, ist in Deutschland aber nicht im Handel.
Wirkstoff | Präparat | Wirkprinzip | Indikation |
|---|---|---|---|
Oseltamivir |
| Neuraminidasehemmer | Therapie und Prophylaxe der Influenza A und B bei Erwachsenen und Kindern |
Zanamivir |
| Neuraminidasehemmer | Relenza®: Therapie und Prophylaxe der Influenza A und B bei Erwachsenen und Kindern Dectova®: Therapie einer komplizierten und potenziell lebensbedrohlichen Influenza A und B bei Erwachsenen und Kindern |
Peramivir |
| Neuraminidasehemmer | Therapie der unkomplizierten Influenza A und B bei Erwachsenen und Kindern |
Amantadin |
| M-2-Kanal-Inhibitor | Therapie und Prophylaxe der Influenza A |
Baloxavir marboxil |
| Inhibitor der CAP-abhängigen Endonuklease | Therapie der akuten, unkomplizierten Influenza A und B, deren Symptome seit maximal 48 Stunden bestehen in den USA: Therapie der Influenza A und B bei Patienten mit hohem Risiko für grippebedingte Komplikationen |
Abb.: Angriffspunkte antiviraler Wirkstoffe (nach [25, 26]). Amantadin hemmt die Freisetzung der viralen Nukleinsäure aus dem Nukleokapsid. Baloxavir marboxil verhindert die Transkription und die virale Proteinbiosynthese. ATR-002 blockiert den Export viraler Ribonukleopeptide (RNPs) aus dem Zellkern. Neuraminidasehemmer verhindern, dass sich die Viruszelle von der Wirtszelle lösen kann, indem sie die terminale Sialinsäure abspalten, über die das Virus an die Wirtszelle gebunden ist.
Oseltamivir wird in Deutschland unter dem Namen Tamiflu® in Form von Hartkapseln oder als Pulver zur Herstellung einer oralen Suspension angeboten [6, 7]. Beide Darreichungsformen sind zur Therapie und Prophylaxe der Influenza A und B bei Erwachsenen und Kindern indiziert [6, 7]. Erst kürzlich wurde der Nutzen einer Behandlung mit Oseltamivir in einer offenen Studie an insgesamt 3059 Patienten mit grippeähnlicher Erkrankung bestätigt [18]. Dabei erholten sich diejenigen, die im Rahmen der Primärversorgung mit Oseltamivir behandelt wurden, im Durchschnitt etwa einen Tag früher als die Patienten, die nur die übliche Versorgung erhielten [18]. Ältere, kränkere Patienten mit Komorbiditäten und langfristigerer Symptomatik profitierten sogar durch eine um zwei bis drei Tage frühere Genesung [18].
Zanamivir ist in Deutschland unter dem Namen Relenza® als Pulver zur Inhalation mittels Diskhaler zugelassen [8]. Indikationen sind hier die Therapie und Prophylaxe der Influenza A und B bei Erwachsenen und Kindern ab fünf Jahren [8]. Seit dem Jahr 2019 wird der Neuraminidasehemmer unter dem Namen Dectova® auch als Infusionslösung angeboten, die für eine Behandlung von komplizierten, potenziell lebensbedrohlichen Formen der Influenza A oder B bei Erwachsenen, Jugendlichen und Kindern ab einem Alter von sechs Monaten indiziert ist [9]. Der Einsatz ist also schweren Fällen vorbehalten.
Peramivir ist in den USA unter dem Namen Rapivab™ und in der EU unter dem Namen Alpivab® zur Behandlung einer akuten, unkomplizierten Influenza zugelassen [10]. Im Gegensatz zu den beiden anderen Neuraminidasehemmern kann Peramivir aufgrund seiner schlechteren Bioverfügbarkeit nur intravenös in Form einer Infusion verabreicht werden, die als Einzeldosis gegeben wird [10].
In Deutschland wird auch noch der NMDA-Antagonist Amantadin in Form von Filmtabletten und als Infusionslösung zur Prophylaxe und Therapie der Virusgrippe angeboten. Die Substanz wirkt als M-2-Kanal-Inhibitor und blockiert dadurch die Freisetzung der viralen Nukleinsäure aus dem Nukleokapsid („Uncoating“) (s. Abbildung). Amantadin wird in der Praxis jedoch nicht mehr verwendet, da es prinzipiell nur bei Influenza A eingesetzt werden kann und ohnehin mittlerweile mehr als 99% der zirkulierenden Influenza-Viren gegen die Therapie resistent sind [1, 3]. Zudem ist Amantadin schlechter verträglich als die verfügbaren Neuraminidasehemmer [3].
Ein antiviral wirksames Arzneimittel mit neuartigem Wirkansatz ist der Polymerase-Inhibitor Baloxavir marboxil. Die Substanz hemmt die sogenannte CAP-abhängige Endonuklease und somit einen der ersten Schritte im Replikationszykus des Influenzavirus (s. Abbildung) [11]. Die Transkription des Influenza-Genoms in virale mRNA ist ohne die CAP-abhängige Endonuklease nicht möglich. Dadurch wird die virale Proteinbiosynthese blockiert und letztlich die Vermehrung des Virus verhindert [11]. In den USA und Japan ist Baloxavir marboxil unter dem Namen Xofluza™ zur Therapie der akuten, unkomplizierten Influenza zugelassen, deren Symptome seit maximal 48 Stunden bestehen [11]. Ende 2019 wurde die Zulassung in den USA auf Patienten mit hohem Risiko für grippebedingte Komplikationen erweitert. Dort ist Baloxavir marboxil nun auch bei Erwachsenen ab 65 Jahren oder Menschen, die an Grunderkrankungen wie Asthma, chronischer Lungenerkrankung, krankhafter Adipositas oder Herzerkrankungen leiden, indiziert [11].
Baloxavir marboxil hat den Vorteil, dass eine einmalige Einnahme ausreicht. So wurde in der Zulassungsstudie Capstone-1 durch eine einzelne orale Dosis des Arzneimittels eine ähnliche Wirkung erzielt wie durch eine fünftägige Behandlung mit Oseltamivir [19]. In beiden Behandlungsarmen klangen die Influenza-Symptome nach knapp 54 Stunden ab im Vergleich zur Placebogruppe, bei der dies erst nach gut 80 Stunden der Fall war [19]. Der Benefit betrug bei den beiden antiviralen Arzneimitteln somit mehr als einen Tag [19]. Es gibt allerdings bereits Anzeichen für eine Resistenzentwicklung gegenüber dieser antiviralen Therapie. So wurde in einer Studie an mit Influenza-A-Viren infizierten Japanern, die Baloxavir marboxil erhalten hatten, bei rund jedem vierten Patienten Viren mit der Punktmutation PA‑I38T gefunden [20]. Das entsprechende Gen codiert für einen Bestandteil des Polymerase-Komplexes [20]. Zwei Patienten ‒ Bruder und Schwester ‒ wiesen ebenfalls bereits eine Resistenz gegen Baloxavir marboxil auf, wobei das Virus wohl zunächst bei dem Jungen mutiert war und dann auf das Mädchen übertragen wurde [20]. Es könnte also das Risiko bestehen, dass Influenza-Viren schnell eine Resistenz gegen Baloxavir marboxil entwickeln, die dann von Mensch zu Mensch weitergegeben werden kann.
Therapien in der Entwicklung
Neben diesen bereits verfügbaren antiviralen Arzneimitteln gibt es zahlreiche weitere, vielversprechende Ansätze. Beispielsweise inhibiert Pimodivir, ähnlich wie Baloxavir marboxil, den Polymerase-Komplex, ist jedoch nur gegen Influenza-A-Viren effektiv. Wirksamkeit und Verträglichkeit werden derzeit in Phase-III-Studien untersucht [21]. Das oral verfügbare ATR-002 richtet sich hingegen ‒ anders als die bisherigen Therapien ‒ nicht gegen das Virus selbst, sondern zielt auf die Wirtszelle [12]. Die Substanz wirkt als MEK-Inhibitor, hemmt also eine Mitogen-aktivierte Proteinkinase, die im Körper eine Funktion bei der Proliferation und Differenzierung von Zellen hat. Durch die Hemmung der Proteinkinase kommt es zu einer Akkumulation der viralen Ribonukleoproteine im Zellkern, die virale Vermehrung wird so blockiert (s. Abbildung). Die Vorteile dieses Therapieansatzes liegen laut der Herstellerfirma Atriva in einem reduzierten Potenzial für die Entstehung viraler Resistenzen sowie einem verlängerten Behandlungsfenster im Vergleich zu den bisherigen Therapien [22]. In einer Dosis-Eskalationsstudie der Phase I an 70 gesunden Probanden konnte kürzlich die Sicherheit und Verträglichkeit von ATR-002 gezeigt werden [22]. Für das Jahr 2020 ist eine klinische Sicherheits- und Wirksamkeitsstudie der Phase II geplant [22].
Grippeimpfstoff aus Wimperntierchen
Zur Prophylaxe gegen Influenza stehen verschiedene Impfstoffe zur Verfügung, deren Zusammensetzung jährlich an die aktuelle epidemiologische Situation angepasst werden muss. Hergestellt werden die Vakzine mittels abgetöteter oder abgeschwächter Erreger, die eigens dafür in befruchteten, angebrüteten Eiern von steril gehaltenen Hühnern gezüchtet werden müssen. Dieses Verfahren ist sehr zeitintensiv und es besteht das Risiko einer allergischen Reaktion auf das Hühnereiweiß. Mit Flucelvax® Tetra steht in dieser Saison erstmals auch ein Impfstoff zur Verfügung, der in Zellkulturen und nicht in Hühnereiern produziert wird. Ganz ohne Hühnereier kommt auch die neu entwickelte Vakzine CiFlu® aus: Dieser Grippeimpfstoff wird durch Einzeller (Wimperntierchen) produziert, die biotechnologisch so verändert sind, dass sie das Oberflächenprotein Hämagglutinin des Grippevirus produzieren. Mit diesem Verfahren soll die Impfstoffproduktion innnerhalb von 14 bis 18 Wochen statt wie bisher in 28 Wochen möglich sein [24]. Zugelassen ist der neue Impfstoff bislang aber noch nicht.
Ein weiterer in der Entwicklung befindlicher Wirkstoff ist der orale RNA-Polymerasehemmer EIDD-2801. Die Substanz ähnelt in ihrer chemischen Struktur dem Nukleinsäurebaustein Cytidin ‒ einem Bestandteil der Virus-RNA [13]. Daher wird EIDD-2801 vom Enzym RNA-Polymerase anstelle von Cytidin in die Virus-RNA eingebaut [13]. Es kommt zu Mutationen im Genom des Grippevirus, das sich in der Folge nicht mehr vermehren kann [13]. Frettchen, die zur Prophylaxe EIDD-2801 erhalten hatten, wiesen nach Infektion mit verschiedenen Influenza-Virenstämmen keine Grippesymptome und auch keine Viren im Nasensekret auf [13, 23]. Bei infizierten Tieren, die erst nach Einsetzen des Fiebers behandelt wurden, verringerte sich die Virenvermehrung innerhalb eines Tages stark und auch die Dauer des Fiebers verkürzte sich im Vergleich zu unbehandelten oder mit Oseltamivir behandelten Tieren [13, 23]. Der Wirkstoff führte auch nicht zur Resistenzbildung, obwohl die Viren längere Zeit verschiedenen Konzentrationen des Wirkstoffs ausgesetzt wurden [13, 23]. Die Autoren der Studie betrachten EIDD-2801 daher als Kandidaten mit hohem Potenzial für die Monotherapie von saisonalen und pandemischen Influenza-Virusinfektionen [23]. |
Literatur
[1] Tesini BL. Influenza. MSD Manual. www.msdmanuals.com; letzter Zugriff am 20. Januar 2020
[2] Tesini BL. Influenza (Grippe). MSD Manual. www.msdmanuals.com; letzter Zugriff am 20. Januar 2020
[3] Robert Koch-Institut (RKI). Influenza (Teil 1): Erkrankungen durch saisonale Influenzaviren, RKI-Ratgeber. www.rki.de; letzter Zugriff am 20. Januar 2020
[4] Lehnert R et al. Antiviral Medications in Seasonal and Pandemic Influenza. Dtsch Arztebl Int 2016;113:799–807
[5] Weltgesundheitsorganisation (WHO). World Health Organization: WHO guidelines for pharmacological management of pandemic (H1N1) 2009 influenza and other influenza viruses (Stand 2010). www.who.int; letzter Zugriff am 20. Januar 2020
[6] Rote Liste. Fachinformation Tamiflu® 6 mg/ml Pulver (Stand: Januar 2019). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[7] Rote Liste. Fachinformation Tamiflu® 30 mg/45 mg/75 mg Hartkapseln (Stand: Februar 2019). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[8] Rote Liste. Fachinformation Relenza® 5 mg/Dosis (Stand: Januar 2019). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[9] Rote Liste. Fachinformation Dectova® 10 mg/ml Infusionslösung (Stand: Oktober 2019). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[10] Pharmawiki. Peramivir. www.pharmawiki.ch; letzter Zugriff am 21. Januar 2020
[11] DAZ-Online. Baloxavir: Erstes Grippemittel auch für Risikopatienten. www.deutsche-apotheker-zeitung.de; letzter Zugriff am 22. Januar 2020
[12] DAZ-Online. Phase-I-Studie für Influenza-Wirkstoff: Wirtszelle statt Virus als Ziel. www.deutsche-apotheker-zeitung.de; letzter Zugriff am 22. Januar 2020
[13] Wissenschaft aktuell. Neuer Wirkstoff hemmt Grippeviren. www.wissenschaft-aktuell.de; letzter Zugriff am 22. Januar 2020
[14] Fachinformation Amantadin neuraxpharm® (Stand: Dezember 2018). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[15] Fachinformation Amantadin-ratiopharm® 100 mg Filmtabletten (Stand: Januar 2019). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[16] Fachinformation Amantadin-ratiopharm® 200 mg Infusionslösung (Stand: November 2018). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[17] Fachinformation Amantadin® AbZ 100 mg Filmtabletten (Stand: Januar 2019). www.fachinfo.de; letzter Zugriff am 20. Januar 2020
[18] Butler CC et al. Oseltamivir plus usual care versus usual care for influenza-like illness in primary care: an open-label, pragmatic, randomised controlled trial. Lancet 2020;395:42–52.
[19] Hayden FG et al. Baloxavir Marboxil for Uncomplicated Influenza in Adults and Adolescents. N Engl J Med 2018;379:913–923
[20] Imai M et al. Influenza A variants with reduced susceptibility to baloxavir isolated from Japanese patients are fit and transmit through respiratory droplets. Nat Microbiol 2020;5:27–33
[21] Mifsud EJ. Antivirals targeting the polymerase complex of influenza viruses. Antiviral Res 2019;169:104545
[22] Atriva Therapeutics. Atriva Therapeutics Reports Results of ATR-002 Phase I Clinical Trial. www.atriva-therapeutics.com; letzter Zugriff am 22. Januar 2020
[23] Toots M et al. Characterization of orally efficacious influenza drug with high resistance barrier in ferrets and human airway epithelia. Sci Transl Med 2019;11(515):eaax5866
[24] Cilian AG. CiFlu®: Ein Untereinheiten-Impfstoff zur Behandlung von saisonaler und pandemischer Grippe. www.cilian.de; letzter Zugriff am 22. Januar 2020
[25] Pharmawiki. Neuraminidasehemmer. www.pharmawiki.ch; letzter Zugriff am 20. Januar 2020)
[26] Atriva Therapeutics. The Atriva Approach. www.atriva-therapeutics.com; letzter Zugriff am 22. Januar 2020




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.