
- DAZ.online
- DAZ / AZ
- DAZ 5/2020
- Schon wieder ein ...
Arzneimittel und Therapie
Schon wieder ein Coronavirus!
Warum gibt es bisher keinen Impfstoff?
Vor knapp 20 Jahren tauchte das schwere akute respiratorische Syndrom (severe acute respiratory syndrome, SARS) in der chinesischen Provinz Guangdong auf. Als Resultat wurden 916 Todesfälle bei mehr als 8098 Patienten in 29 Ländern beklagt. Das Coronavirus, das zehn Jahre später das Middle East respiratory syndrome (MERS) auslöste, führte nach Daten der Weltgesundheitsorganisation (WHO) zu 2254 im Labor bestätigten Infektionsfällen, die von 2012 bis September 2018 auftraten, mit mindestens 800 Todesfällen in 27 Ländern. Mit dem neuartigen Coronavirus (2019-nCoV) haben sich aktuell in China mehr als 4500 Menschen infiziert, mindestens 106 Menschen sind verstorben (Stand: 28. Januar 2020). In Thailand, Nepal, den USA, Kanada, Japan, Südkorea, Singapur, Vietnam, Australien, Malaysia und Frankreich kam es zu einzelnen importierten Fällen. Auch in Deutschland wurde ein erster Fall bestätigt. Wir steuern also tatsächlich auf eine neue Pandemie zu.
Von der WHO wurde am 23. Januar 2020 für 2019-nCoV eine Basisreproduktionszahl R0 von 1,4 bis 2,5 angegeben, d. h. eine infizierte Person kann im Mittel 1,4 bis 2,5 Personen anstecken. Der Anteil schwerer Krankheitsverläufe liegt laut WHO bei 25%. Ein Impfstoff wäre dringend nötig!
Coronaviren sind ubiquitär vorkommende Viren, die als sogenannte gewöhnliche CoV beim Menschen recht häufig für banale Erkältungskrankheiten verantwortlich sind. Andere Virusstämme kommen natürlicherweise in Tieren vor, allen voran in Fledermäusen, aber – wie im Fall von MERS-CoV – auch in Dromedaren. Bei engem Kontakt zwischen Mensch und Tier kann es zu einer eher zufälligen Infektion des Menschen mit einem zoonotischen Coronavirus kommen. Die beobachteten schweren Krankheitsbilder im Falle von SARS- bzw. MERS-CoV beruhen auf der bisher fehlenden Anpassung (Coevolution) des humanen Immunsystems an das jeweilige Virus. Sowohl MERS-CoV als auch SARS-CoV können nach der Infektion in Menschen eine schwere Pneumonie hervorrufen.
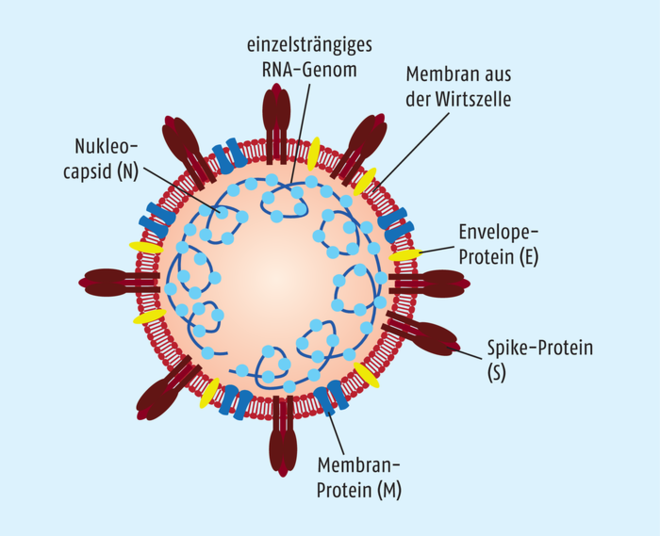
Struktur von SARS- und MERS-CoV
Coronaviren sind membranumhüllte Viruspartikel mit einem einzelsträngigen RNA-Genom in Positivstrangorientierung, d. h. die RNA kann in der Wirtszelle direkt als mRNA für die Proteinbiosynthese eingesetzt werden. Allerdings bedeutet das RNA-Genom auch, dass bei der Replikation der Virus-Nukleinsäure Fehler auftreten und dadurch eine erhöhte Variabilität in der Virus-Nachkommenschaft entsteht, was durchaus die Infektiosität und Übertragbarkeit der Viren verändern kann. Die Ausbreitung von Mensch zu Mensch wird durch den biologischen Selektionsdruck auf das Virus immer wahrscheinlicher.
Abb.: Schematische Darstellung eines Coronavirus mit den wichtigen Strukturproteinen in der Membran.
Das RNA-Genom des SARS- und des MERS-CoV codiert für vier wichtige virale Strukturproteine: Spike- (S), Envelope- (E), Membran- (M) und die Nukleokapsidproteine (N) 3 – 5 (s. Abbildung). In der Membran des Virus sind die S-, E- und M-Proteine lokalisiert, wobei die M- und E-Proteine bei der viralen Assemblierung relevant sind, während das S-Protein eine wichtige Funktion beim Eintritt in die Wirtszelle spielt und deshalb interessant ist als Ziel einer Therapie, aber auch als mögliches Impf-Antigen. Das S‑Protein wird durch verschiedene wirtseigene Proteasen in die zwei Untereinheiten S1 und S2 gespalten. S1 ist für die Rezeptorbindung verantwortlich, während S2 die Fusion der Virushülle mit der Membran der Wirtszelle vermittelt. SARS-CoV und wohl auch 2019-nCoV, das genetisch eng mit dem SARS-CoV verwandt ist, nutzen vor allem das auf Zellen im Respirationstrakt weit verbreitete membranständige angiotensin-converting enzyme 2 (ACE 2) als Adhäsionspartner. Der wichtigste Rezeptor für MERS-CoV ist die ubiquitär exprimierte Dipeptidylpeptidase 4 (DPP 4).
Impfstrategien
Betrachtet man die verschiedenen Strategien zur Entwicklung eines Impfstoffes zur aktiven Immunisierung, wurden schon viele verschiedenen Varianten ausgetestet (s. Tabellen 1 und 2). Bereits 2007 wurde eine klinische Studie der Phase I mit inaktivierten, adjuvantierten bzw. nichtadjuvantierten SARS-CoV gestartet, die allerdings abgebrochen wurde. Das gleiche Schicksal erlitt 2013 eine Phase-I-Studie mit einem rekombinanten S-Protein von SARS-CoV als Antigen, das mit und ohne Adjuvans getestet wurde. Etwas mehr Erfolg verspricht man sich von nichtreplikationsfähigen Viruspartikeln, die so verändert werden, dass sie das S-Protein von MERS- oder SARS-CoV auf ihrer Oberfläche präsentieren. Als Träger werden beispielsweise Pockenviren (Modifiziertes Vaccinia-Virus Ankara, MVA) oder Schimpansen-Adenoviren (Chimpanzee Adenovirus, Oxford University #1, ChAdOx1) verwendet. Auch DNA- oder RNA-Impfstoffe, die für das S-Protein codieren, werden entwickelt und zum Teil bereits klinisch getestet. Bei dieser Art von Vakzinen wird das Protein-Antigen nicht als fertiges Molekül verabreicht, vielmehr soll der Körper das Antigen selbst herstellen und dadurch die Immunantwort induzieren. Hierfür benötigen Körperzellen die genetische Information für das Antigen in Form von Nukleinsäuren, d. h. entweder DNA oder mRNA, die mittels geeigneter Transfektionsmethoden (z. B. physikalisch über Elektroporation) in die Zellen gebracht werden.
Impfstoff | Herstellung | Vorteil | Nachteil |
|---|---|---|---|
inaktivierte Viren | Virionen, durch Hitze, Chemikalien oder Strahlung inaktiviert | leicht herzustellen, Virusstruktur bleibt erhalten, neutralisierende Antikörper werden induziert | evtl. ungeeignet für Immunsupprimierte, möglicherweise fehlende zelluläre Immunantwort |
lebend-attenuierte Viren | Virulenz wird durch Mutagenese oder gezielte Deletion verringert | preiswert herzustellen, nachhaltige Aktivierung des Immunsystems | Reversion des Phänotyps oder Genotyps möglich, ausreichende Virusreplikation nötig |
vektor-basierter Impfstoff | S- und N-Protein in nicht-replizierendem Trägerviruspartikel | sicherer Impfstoff, starke Induktion der humoralen und zellulären Immunantwort | evtl. unwirksam bei älteren Personen, möglicherweise fehlende zelluläre Immunantwort, evtl. unvollständiger Schutz |
Subunit-Impfstoff | S- und N-Protein als Impf-Antigene ohne Trägervirus | sehr sicherer Impfstoff, Induktion der humoralen und zellulären Immunantwort, hoher Titer an neutralisierenden Antikörpern | relativ geringe Immunogenität, Adjuvans nötig, unklare Kosteneffektivität |
DNA- bzw. RNA-Impfstoff | genetische Information für das S- und ggf. N-Protein zur Antigenexpression in Zellen der geimpften Person | einfach zu entwickeln, sehr sicher, hohe Titer an neutralisierenden Antikörpern | schlechte Immunantwort, möglicherweise fehlende zelluläre Immunantwort, evtl. Überempfindlichkeitsreaktion |
Impfstoff | Beschreibung | Verabreichung | klinische Phase |
|---|---|---|---|
MERS-Coronavirus | |||
GLS-5300 | DNA-Plasmid mit Gen für S-Protein | Elektroporation | Phase I/IIa |
BVRS-GamVac bzw. BVRS-GamVac-Combi | keine Information verfügbar | intramuskulär | Phase I/IIa |
ChAdOx1 | replikationsdefizientes Affen-Adenovirus mit Gen für MERS-S-Protein | intramuskulär | Phase I |
MVA-MERS-S_DF1 | replikationsdefizientes, modifiziertes Vaccinia-Virus Ankara | intramuskulär | Phase I |
SARS-Coronavirus | |||
VRC-SRSDNA015-00-VP | DNA-Plasmid mit Gen für Spike-Protein | intramuskulär | Phase I |
Die vor wenigen Jahren ins Leben gerufene Coalition for Epidemic Preparedness Innovations (CEPI), eine weltweite Allianz aus privaten Förderern, Regierungen, der WHO, Forschungseinrichtungen und anderen Akteuren hat am 23. Januar 2020 angekündigt, drei Entwicklungsprogramme als Basis für Impfstoffe gegen 2019-nCoV besonders zu fördern und möglichst innerhalb von 16 Wochen in klinische Studien zu bringen: eine DNA- und eine mRNA-Vakzine gegen das S-Protein sowie eine Expressionsplattform für korrekt gefaltete S-Protein-Antigene.
Alternativ stehen aber auch Wirkstoffe zur passiven Immunisierung gegen MERS-Coronaviren zur Verfügung und werden in Phase I der klinischen Entwicklung getestet: SAB-301 ist ein humanes polyklonales Serum aus transgenen Rindern, während REGN3048 und REGN3051 monoklonale Antikörper gegen das S-Protein sind.
Fazit
Mit der baldigen Einführung eines Impfstoffes gegen Coronaviren ist leider nicht zu rechnen. Allerdings wird an einigen Strategien intensiv gearbeitet. In Deutschland forscht beispielsweise die Firma CureVac in Tübingen an der Entwicklung eines mRNA-Impfstoffs und am Universitätsklinikum Hamburg-Eppendorf läuft eine Studie mit MVA-MERS-S. Ob diese Impfstoffe jedoch auch gegen 2019-nCoV wirken könnten, ist völlig offen, sind doch die Coronaviren sehr mutationsfreudig. |
Literatur
Song Z et al. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses 2019; 11(1):E59; doi: 10.3390/v11010059
Neuartiges Coronavirus (2019-nCoV). Robert Koch-Institut (RKI). www.rki.de
Novel Coronavirus (2019-nCoV). World Health Organizazion (WHO). www.who.int
ClinicalTrials.gov. National Library of Medicine (NLM) at the National Institutes of Health (NIH). https://clinicaltrials.gov
CEPI to fund three programmes to develop vaccines against the novel coronavirus, nCoV-2019. Mitteilung der Coalition for Epidemic Preparedness Innovations (CEPI) vom 23. Januar 2020. https://cepi.net
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.