
- DAZ.online
- DAZ / AZ
- DAZ 38/2020
- Freispruch für Aluminium...
Toxikologie
Freispruch für Aluminium-Deos
Der lange Weg bis zur Entwarnung
Nach Sauerstoff und Silizium ist Aluminium das dritthäufigste Element in der Erdkruste und ein natürlicher Bestandteil in der Umwelt, in Nahrungsmitteln und im Trinkwasser. Eine Exposition des Menschen ist damit unvermeidlich [Tietz et al., 2019]. Vor einer Aluminium-Vergiftung ist der menschliche Organismus gut geschützt, denn Haut und Schleimhäute bilden eine effektive Barriere. Die Bioverfügbarkeit ist sehr gering, eine Aufnahme über den Magen-Darm-Trakt oder die Haut findet nur in geringsten Mengen statt. Nach oraler Zufuhr wird maximal 1% absorbiert – im Mittel sind es nur etwa 0,1%. Über die Haut gelangt noch weniger in den Organismus. Die aufgenommenen Mengen werden überwiegend rasch mit dem Urin ausgeschieden, ein Teil auch mit den Fäzes. Daraus resultieren sehr geringe Konzentrationen an Aluminium-Ionen – wenige Mikrogramm pro Liter –, die sich im Blut oder Urin der Allgemeinbevölkerung nachweisen lassen (s. Tab. 1).
Personengruppe | Konzentration |
|---|---|
Allgemeinbevölkerung | < 15 µg/l Urin (Referenzwert*) |
Allgemeinbevölkerung | < 5 µg/l Serum (Referenzwert*) |
Arbeiter | 10 bis 14 µg/l Plasma |
Arbeiter mit Frühzeichen von Neurotoxizität | ab ca. 13 µg/l Plasma |
Dialysepatienten (Toxizitätsschwelle) | ca. 50 µg/l Plasma |
Dialysepatienten mit Enzephalopathie | ca. 100 bis 500 µg/l Plasma |
* Der Referenzwert ist das 95. Perzentil der Messwerte einer Stoffkonzentration in der Referenzpopulation | |
Bei ungewöhnlich hoher Exposition – etwa am Arbeitsplatz – können höhere Konzentrationen erreicht werden. Bei Aluminium-Schweißern korreliert der Gehalt an Aluminium-Ionen im Schweißrauch mit den Aluminium-Konzentrationen im Blut und Urin. Die Konzentrationen betragen etwa 10 bis 14 µg/l Plasma. Diese Werte liegen allerdings noch unter der Grenze von 50 µg/l, der bei Dialysepatienten als Toxizitätsschwelle angenommen wird. Bei Patienten mit Nierenversagen traten zum Teil schwerwiegende neurotoxische Effekte auf, wenn für die Dialyse Leitungswasser mit zu hohem Aluminium-Gehalt verwendet wurde. Dies wurde zum Beispiel in den 1970er-Jahren in den Niederlanden beobachtet, nachdem das Wasser in einem Boiler mit Aluminium-haltigen Anoden erhitzt worden war. Bei Dialysepatienten sind Plasmakonzentrationen von mehreren Hundert Mikrogramm pro Liter gemessen worden, auch im Hirngewebe waren die Konzentrationen erhöht. Seit das Wasser für die Dialyse hinsichtlich des Aluminium-Gehaltes geprüft wird, kommen solche Fälle nicht mehr vor. Betroffene Patienten zeigten damals neurotoxische Effekte wie Verwirrtheit, Sprachstörungen, Gedächtnisstörungen und im fortgeschrittenen Stadium ein demenzielles Syndrom sowie fokale oder generalisierte Krampfanfälle [Klotz et al, 2017].
In den vergangenen Jahren gab es intensive Diskussionen über die möglichen Risiken bei Anwendung Aluminium-haltiger Antitranspirantien, viele Verbraucher waren zunehmend verunsichert. Bereits 2014 wurde in einem ausführlichen Beitrag für die DAZ das Risikopotenzial einer Aluminium-Exposition aus Kosmetika, Impfstoffen und Arzneimitteln diskutiert [Stahlmann, 2014]. Die schweißhemmende Wirkung von Aluminium-Salzen ist schon seit sehr langer Zeit bekannt. In der Dermatologie werden bei Hyperhydrosis Lösungen mit 10% bis 30% Aluminiumchlorohydrat therapeutisch verwendet. Die Aluminium-Mengen in kommerziellen Zubereitungen sind deutlich geringer, solche Körperpflegeprodukte werden seit mehr als Hundert Jahren kommerziell angeboten. Nach Berechnungen des Scientific Committee on Consumer Safety (SCCS) werden bei Verwendung eines Antitranspirants mit 6,25% Aluminium etwa 1,3 mg Aluminium/kg Körpergewicht aufgetragen. Die entscheidende Frage lautet: Wie viel davon penetriert durch die Haut? Das Thema war unter anderem auch deshalb so kontrovers, weil diese Frage nicht wissenschaftlich fundiert beantwortet werden konnte und es damit eine erhebliche Unsicherheit bei der Risikoabschätzung gab. Neuere Studien über die Aufnahme des Aluminiums nach dermaler Anwendung liegen inzwischen vor und gestatten eine deutlich bessere wissenschaftliche Beurteilung als noch vor einigen Jahren. Allerdings war der Weg dorthin schwieriger als gedacht und mit etlichen Rückschlägen und Enttäuschungen verbunden [BfR, 2014; SCCS, 2020; BfR, 2020].
Versuch mit Studenten der Universität Erlangen
Die Methoden zum chemischen Nachweis von Fremdstoffen sind in den vergangenen Jahrzehnten kontinuierlich weiterentwickelt worden. Wir haben uns daran gewöhnt, dass chemische Substanzen im Bereich von µg/l [ppb], ng/l [ppt] oder sogar noch niedriger nachgewiesen werden können. Ein Nachweis der Veränderung der Aluminium-Konzentration im Organismus durch Antitranspirantien gelingt jedoch auch mit sehr feinen Methoden nicht ohne Weiteres. Dies wird deutlich aus einem Versuch mit Studenten der Universität Erlangen. Mithilfe der Atomabsorptionsspektrometrie wurden die Aluminium-Konzentrationen im Blut und Urin von Probanden gemessen, die zwei Wochen lang ein handelsübliches Antitranspirant angewandt hatten. Mit diesem Analyseverfahren lassen sich Konzentrationen von weniger als 1 µg/l bestimmen. Die Plasmakonzentrationen lagen vor der Anwendung zwischen 0,6 und 2,1 µg/l, bei der zweiten Messung nach der Anwendung schwankten sie zwischen 1,4 und 2,1 µg/l. Die Mittelwerte ließen keinen signifikanten Unterschied erkennen, bei den Urinkonzentrationen wurde sogar ein Rückgang festgestellt [Letzel et al., 2019]. Bei dieser Gruppe von Freiwilligen konnte also vor dem Hintergrund der „normalen“ Aluminium-Konzentration die mögliche geringe Zunahme durch die Verwendung des Antitranspirants nicht nachgewiesen werden. Zudem bestand eine deutliche individuelle Variabilität, die sehr wahrscheinlich durch unterschiedliche Ernährungsgewohnheiten erklärt werden kann. Um genauere Daten über die Aufnahme von Aluminium über die Haut zu erhalten, müssen andere Methoden angewandt werden.
Humanversuch mit Aluminium-26
In drei Studien wurde das extrem seltene und sehr teure Radionuklid Aluminium-26 verwendet. Mit dem sehr empfindlichen Verfahren der Massenbeschleunigungsspektrometrie [AMS, accelerated mass spectrometry] gelingt es, das im Versuch verwendete 26Al von dem 27Al zu unterscheiden, das über die Nahrung oder aus anderen Quellen aufgenommen wird. Die Bestimmungsgrenze liegt dann bei 0,1 pg/l (= 0,1 fg/ml) oder weniger.
Vorläufige Daten wurden bereits 2001 von amerikanischen Wissenschaftlern mit diesem Verfahren erstellt und publiziert [Flarend et al., 2001]. Sie berechneten eine dermale Absorption von nur 0,012% der aufgetragenen Menge. Allerdings ist das Ergebnis schwierig zu übertragen auf die Allgemeinbevölkerung, denn die Studie hatte einige methodische Schwächen und Besonderheiten (Tab. 2). Es nahmen nur zwei Probanden teil, eine Lösung von Aluminiumchlorohydrat wurde nur einmal aufgetragen, und das exponierte Hautareal wurde nach dem Trocknen mit einem Pflasterverband abgedeckt. Die obersten Hautschichten wurden sechs Tage lang täglich zweimal mit Klebestreifenabriss entfernt. Mit anderen Worten: Diese Studie entsprach nicht den Bedingungen, unter denen die Anwendung von Aluminium-haltigen Antitranspirantien erfolgt. Vorteilhaft war jedoch die verwendete analytische Methode mit 26Al. Dieser Ansatz wurde daher auch in zwei neueren Studien aufgegriffen, in denen ein realistischerer Expositionsansatz gewählt wurde.
Flarend et al. 2001 | TNO 2016 | TNO 2019 | |
|---|---|---|---|
Probanden | 1 ♂ / 1 ♀ | 12 (11) ♀ | 6 ♀ |
Applikationsort | 1 Achsel | 2 Achseln | 2 Achseln |
Hautfläche | 77 cm2 | 2 × 100 cm2 | 2 × 100 cm2 |
Formulierung | 21% ACH# (5,21% 27Al) in Wasser | 25% ACH# (6,25% 27Al) in HEC* | 25% ACH# (6,25% 27Al) in HEC* |
Menge | 0,246 / 0,230 g | 2 × 0,75 g = 1,5 g | 2 × 0,75 g = 1,5 g |
Dosis 27Al | 13,3 bzw. 12,4 mg | 113 mg | 83 mg |
Dosis 26Al | 7,75 bzw. 8,31 ng | 138 ng | 3732 ng |
Radioaktivität (26Al) | 5,6 bzw. 6,0 Bq | 100 Bq | 2695 Bq |
Okklusivverband | ja | nein | „semi-okklusiv“ |
# = Aluminiumchlorohydrat; * HEC = Wasser mit 0,625% Hydroxyethylcellulose | |||
TNO-Studie mit Aluminium-26
Bereits 2016 wurde die erste von zwei Studien im Auftrag der Kosmetikindustrie bei der niederländischen Forschungsorganisation TNO durchgeführt. Trotz sorgfältiger Planung verlief einiges nicht wie erwartet [TNO, 2016; de Ligt et al., 2018]. Für den Versuch wurden insgesamt 7 µg 26Al synthetisiert und als Aluminiumhydrochlorid bereitgestellt, das entsprach 60% des Weltvorrats. Eine geringe Menge Aluminium-26 wurde in die Mixtur gegeben, um das Aluminium im Organismus später zu identifizieren. Das Verhältnis 26Al : 27Al betrug 1 : 820.000, trotzdem war die Menge 26Al deutlich höher als in der älteren Studie (Tab. 2). Die Lösung aus Aluminiumchlorohydrat wurde mit Hydroxyethylcellulose eingedickt, um den handelsüblichen Zubereitungen zu entsprechen.
Insgesamt zwölf Frauen im Alter zwischen 23 und 39 Jahren benutzten einmalig einen Rollstift mit der Lösung, und in den Tagen und Wochen danach wurden mehrfach Blut- und Urinproben gewonnen. Aluminium bildet mit den Proteinen der Haut chemisch inerte Komplexe, und die schweißhemmende Wirkung lässt sich durch einen Verschluss der Ausführungsgänge der Schweißdrüsen erklären. Daher wurden drei verschiedene Abschnitte in dieser klinischen Studie konzipiert: Bevor die radioaktiv markierte Zubereitung aufgetragen wurde, hatten die Frauen [a] bereits vier Wochen lang ein handelsübliches nichtmarkiertes Antitranspirant benutzt und / oder [b] täglich eine Nassrasur der Achselbehaarung durchgeführt, um zu überprüfen, ob [a] bei kontinuierlichem Gebrauch eventuell weniger resorbiert wird und ob [b] durch eine frisch rasierte Haut mehr Aluminium penetrieren kann.
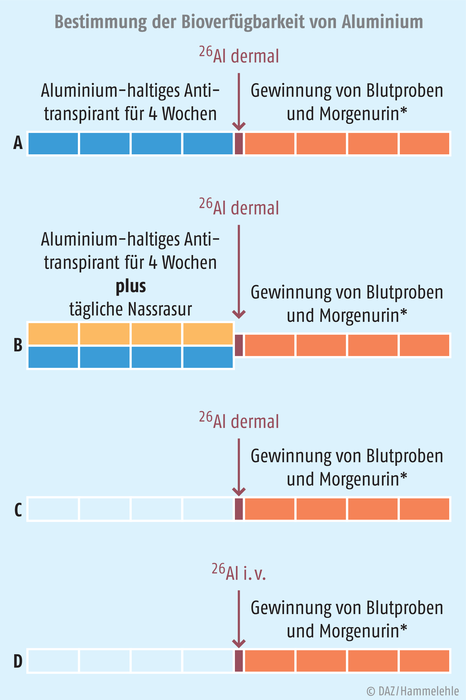
Es wurde ein Überkreuzdesign [cross over] angewandt, bei dem die zwölf Probandinnen in drei Gruppen zu je vier Personen aufgeteilt wurden. Jede Teilnehmerin durchlief innerhalb der gesamten Studiendauer von 24 Wochen jede Phase. Zusätzlich wurde das Radionuklid in einer Aluminiumcitrat-Lösung der gesamten Gruppe zum Abschluss einmalig intravenös verabreicht, um eine Basis für die Berechnung der Bioverfügbarkeit zu haben. Da eine Probandin schwanger wurde, konnten nur elf anstatt zwölf an diesem letzten Teil des Versuchs teilnehmen. Insgesamt ergaben sich vier Versuchsabschnitte (s. Abb.).
A: Anwendung eines 26Al-markierten Antitranspirants nach täglicher Anwendung eines Aluminium-haltigen Antitranspirants ohne Rasur der Achseln
B: Anwendung eines 26Al-markierten Antitranspirants nach täglicher Anwendung eines Aluminium-haltigen Antitranspirants und täglicher Rasur
C: Anwendung eines 26Al-markierten Antitranspirants ohne vorherige Anwendung eines Aluminium-haltigen Antitranspirants und ohne Rasur
D: intravenöse Injektion von 26Al-markiertem Aluminiumchlorid in einer Aluminiumcitrat-Lösung (ein Prozent der dermal applizierten Dosis) nach einer Auswaschphase von vier Wochen.
* Zehn Blutproben wurden in der ersten Woche gewonnen, dann einmal pro Woche, Morgenurin wurde in der ersten Woche an vier Tagen asserviert, dann einmal pro Woche.
Das intravenös injizierte 26Al war gut bestimmbar, es wurde rasch eliminiert. Direkt nach der Verabreichung wurden Konzentrationen von ca. 300 pg/l gemessen. Innerhalb von zwölf Stunden war das Radionuklid fast vollständig ausgeschieden, ein AUC-Wert konnte berechnet werden. Obwohl in diesem Versuch eine 16-fach höhere Menge von 26Al verwendet wurde als in der Pilotstudie von 2001, gelang ein zuverlässiger Nachweis des Radionuklids nach dermaler Exposition im Blut der meisten Teilnehmerinnen nicht. Die Gehalte lagen nur bei zwei von 504 Proben oberhalb der Bestimmungsgrenze von 0,12 pg/l. Das war unerwartet und enttäuschend. Zur Berechnung der resorbierten Menge musste daher auf Proben von Morgenurin zurückgegriffen werden, die als Reserve zurückgestellt worden waren. Doch auch im Urin konnte nur in den ersten Tagen nach der Exposition das 26Al nachgewiesen werden. Aus den vorhandenen Ergebnissen konnte eine Bioverfügbarkeit nach dermaler Gabe von etwa 0,01% abgeschätzt werden; ein Einfluss der täglichen Nassrasur oder einer vorhergehenden vierwöchigen Anwendung eines handelsüblichen Aluminium-haltigen Produktes war nicht zu erkennen [de Ligt et al., 2018].
Auf einen Blick
- Aluminium ist das dritthäufigste Element in der Erdkruste und natürlicher Bestandteil in Trinkwasser und Lebensmitteln.
- Haut und Schleimhäute bilden eine effektive Barriere, es werden nur geringste Mengen über den Gastrointestinaltrakt oder die Haut aufgenommen.
- Nach oraler Zufuhr werden im Mittel nur etwa 0,1% absorbiert.
- Wegen einer schweißhemmenden Wirkung werden Aluminium-Salze in Antitranspirantien eingesetzt.
- Mithilfe des radioaktiven Radionuklids 26Al konnte gezeigt werden, dass das Leichtmetall nur in Spuren durch die Haut penetriert.
- Überwiegend wird Aluminium über die Nahrung aufgenommen, die Menge im menschlichen Körper wird durch Kosmetika nicht signifikant erhöht.
- Verbraucher müssen bei der täglichen Anwendung von Antitranspirantien mit Aluminiumchlorohydrat keine gesundheitlichen Beeinträchtigungen befürchten.
Der zweite Anlauf
Wegen der aufgetretenen Schwierigkeiten wurde der Versuch unter ähnlichen Bedingungen, aber mit entscheidenden Modifikationen wiederholt [TNO, 2019; BfR, 2020; SCCS, 2020]. So wurde die aufgetragene Menge an radioaktivem Aluminium nochmals deutlich – bis zum ethisch vertretbaren Limit – erhöht, und neben Sammelurin wurden auch Stuhlproben gewonnen (Tab. 2). Sechs Frauen verwendeten zwei Wochen lang bei täglicher Rasur ein handelsübliches Antitranspirant, bevor die 26Al-haltige Lösung aufgetragen wurde. Damit entsprach das Schema etwa der Gruppe B in dem ersten Versuch. Nach Abtrocknung wurde der Achselbereich mit Verbandmull abgedeckt (semi-okklusiv). Der Anteil der quantifizierbaren Blutproben lag diesmal zwar höher, trotzdem ließen sich nur begrenzt aussagefähige Blutkonzentrations-Zeitprofile ableiten. Bis einschließlich Tag sechs der Studie lag der Anteil der quantifizierbaren Urinproben bei 90%. Auch der Verbandmull, die Waschlösung und die getragenen T-Shirts wurden analysiert. Zusätzlich wurde auch bei diesen Probandinnen die Kinetik nach intravenöser Injektion untersucht. Da nun auch Proben von 24-Stunden-Sammelurin und Stuhlproben verfügbar waren, wurden erstmals belastbare Daten zur Aluminium-Ausscheidung und damit zur Frage der Hautpenetration des Metalls generiert. Über den gesamten Versuchszeitraum wurden 70% des intravenös injizierten Aluminiums mit dem Urin ausgeschieden, nach der Auftragung auf die Haut wurden nur 0,00036% nachgewiesen. Unter Berücksichtigung dieser und anderer Daten lässt sich für das Aluminium in Antitranspirantien nach dermaler Applikation bei vorausgegangener Rasur eine systemische Bioverfügbarkeit von 0,0019% ableiten.
Fazit
Mit großem Aufwand ist es gelungen, belastbare Daten zur Frage der Bioverfügbarkeit von Aluminium aus Antitranspirantien zu erstellen. Das Leichtmetall penetriert nur in Spuren durch die Haut. Durch Verwendung des radioaktiven Radionuklids 26Al konnte die Bestimmungsgrenze in den Bereich von weniger als einem Femtogramm pro Milliliter gesenkt werden. In vorläufigen Studien war vor etwa 20 Jahren eine Bioverfügbarkeit von 0,012% ermittelt worden. Nun konnte gezeigt werden, dass bei täglicher Verwendung Aluminium-haltiger Antitranspirantien die Aufnahme offenbar nur etwa ein Sechstel des Wertes beträgt (0,0019%). Ganz überwiegend nehmen wir Aluminium mit der Nahrung auf, die Menge im menschlichen Körper wird durch Kosmetika nicht signifikant erhöht. Gesundheitliche Beeinträchtigungen für die Verbraucher sind bei der täglichen Anwendung von Antitranspirantien mit Aluminiumchlorohydrat nicht zu befürchten. |
Literatur
Aluminium-haltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. Stellungnahme des Bundesinstituts für Risikobewertung (BfR) Nr. 007/2014 vom 26. Februar 2014
Neue Studien zu Aluminium-haltigen Antitranspirantien: Gesundheitliche Beeinträchtigungen durch Aluminium-Aufnahme über die Haut sind unwahrscheinlich. Stellungnahme des Bundesinstituts für Risikobewertung (BfR) Nr. 030/2020 vom 20. Juli 2020
de Ligt R, van Duijn E, Grossouw D, Bosgra S, Burggraaf J, Windhorst A, Peeters PAM van der Luijt GA, Alexander-White C, Vaes WHJ. Assessment of Dermal Absorption of Aluminum from a Representative Antiperspirant Formulation Using a [26] Al Microtracer Approach. Clin Transl Sci 2018;11:573-581
Klotz K, Weistenhöfer W, Neff F, Hartwig A, van Thriel C, Drexler H. The Health Effects of Aluminum Exposure. Dtsch Arztebl Int 2017;114[39]:653-659
Letzel M, Drexler H, Göen T, Hiller J. Impact of Daily Antiperspirant Use on the Systemic Aluminum Exposure: An Experimental Intervention Study. Skin Pharmacol Physiol 2020;33[1]:1-8
Flarend R, Bin T, Elmore D, Hem SL. A preliminary study of the dermal absorption of aluminium from antiperspirants using aluminium-26. Food Chem Toxicol 2001;39:163-168
Stahlmann R. Gefährliche Deos? Zum Risikopotenzial von Aluminium in Kosmetika und Impfstoffen. DAZ 2014;39:40-46
Tietz T, Lenzner A, Kolbaum AE, Zellmer S, Riebeling C, Gürtler R, Jung C, Kappenstein O, Tentschert J, Giulbudagian M, Merkel S, Pirow R, Lindtner O, Tralau T, Schäfer B, Laux P, Greiner M, Lampen A, Luch A, Wittkowski R, Hensel A. Aggregated aluminium exposure: risk assessment for the general population. Arch Toxicol 2019;93:3503-3521
TNO. Assessment of bioavailability of aluminium, as aluminium chlorohydrate, in humans after topical application of a representative antiperspirant formulation using a [26Al] microtracer approach. Study commissioned by the Cosmetics Industry via Cosmetics Europe. 2016, Informationen der Niederländischen Organisation für Angewandte Naturwissenschaftliche Forschung (Nederlandse Organisatie voor toegepast-natuurwetenschappelijk onderzoek,TNO), www.tno.nl
TNO. Assessment of bioavailability of aluminium in humans after topical application of a representative antiperspirant formulation using a [26Al] microtracer approach. Study commissioned by the Cosmetics Industry via Cosmetics Europe. 2019, Informationen der Niederländischen Organisation für Angewandte Naturwissenschaftliche Forschung (Nederlandse Organisatie voor toegepast-natuurwetenschappelijk onderzoek,TNO), www.tno.nl























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.