
- DAZ.online
- DAZ / AZ
- DAZ 33/2020
- (K)ein Überraschungsfund...
Arzneistoffanalytik
(K)ein Überraschungsfund in Paracetamol
Synthesewege prädestinieren für Verunreinigungen wie Chloranilin
Kürzlich berichtete das „Nieuwe Rotterdamsche Courant Handelsblad“ von Paracetamol, hergestellt von der chinesischen Firma Anqiu Lu´an Pharmaceuticals, das 4-Chloranilin in sehr kleinen Mengen enthält. Von den gefundenen Mengen sollen keine Gefahr ausgehen, da selbst bei einer Einnahme von sechs Tabletten à 500 mg Paracetamol die toxische Dosis nicht erreicht wird. Die Richtlinie M7 der „International Conference of Harmonization“ (ICH) gibt derzeit für 4-Chloranilin, das in Mausversuchen teilweise kanzerogene Wirkung gezeigt hat, eine Dosis von 34 µg/Tag bezogen auf die Lebenszeit an, die ungefährlich ist [1].
Nach heutiger Kenntnis können auch deutlich kleinere Mengen unterhalb der akuten Grenzwerte bei chronischer Einnahme zu langfristigen Schäden führen und die Wahrscheinlichkeit einer Krebserkrankung erhöhen. Bei einer breiten Anwendung, wie sie beim Missbrauch von rezeptfreien Schmerzmitteln mit Überschreiten der Maximaldosis von 3 g/Tag Paracetamol häufig geschieht, wären auch so zahlreiche Individuen betroffen. Die Überschreitung der empfohlenen Tagesdosis ist besonders kritisch bei Personen mit schon vorhandenen Leberschädigungen. Insofern kann auch die toxische Dosis von 4-Chloranilin erreicht, wenn nicht ebenso überschritten werden.
Toxikokinetik
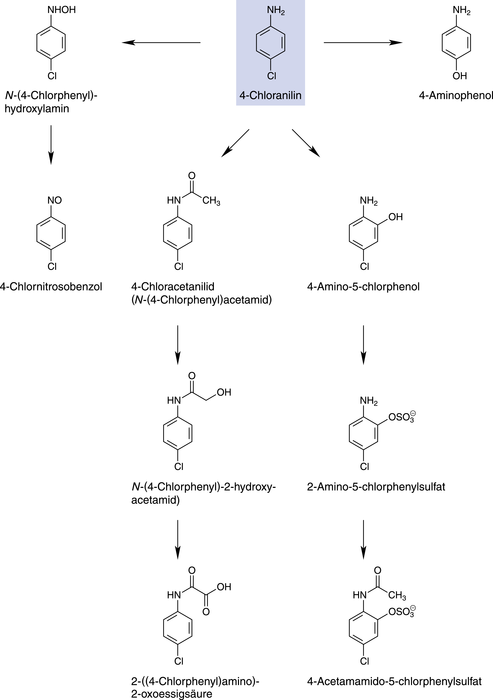
Die wissenschaftlichen Grundlagen zur Toxikokinetik von 4-Chloranilin entstammen hauptsächlich Tierversuchen, einigen wenigen Fallberichten beim Menschen und dem Biomonitoring von exponierten Arbeitern. 4-Chloranilin wird schnell aus dem Magen-Darm-Trakt resorbiert, auch über die Haut kann die Substanz in den Blutkreislauf kommen, wo sie sich in den Erythrozyten anreichert. Reaktive Zwischenprodukte reagieren irreversibel mit Hämoglobin (verursacht die Methämoglobin-Bildung) und Proteinen in Leber und Nieren. Im Blut kommen 4-Chloracetanilid und das Konjugat 2-Amino-5-chlorphenylsulfat als Hauptmetaboliten vor, weitere Metaboliten zeigt Abbildung 1. Langsam-Acetylierer zeigen eine höhere Hämoglobin-Adduktbildung als schnelle. Alkohol verstärkt die Methämoglobin-Bildung, Gegengifte bei einer Intoxikation sind Ascorbinsäure und Methylenblau. 4-Chloranilin verteilt sich schnell im Körper und hat ein hohes Verteilungsvolumen, innerhalb von 24 Stunden ist der größte Teil im Urin ausgeschieden. Bisher ist nur ein Todesfall nach akzidenteller Aufnahme beschrieben. Weitere Informationen zur Toxizität, Genotoxizität und Kanzerogenität finden sich DAZ 2020, Nr. 31, S. 38.
Die Synthesen und die Schwierigkeiten
Wie kommt 4-Chloranilin in den Wirkstoff? Die Synthese des Paracetamols ist aufgrund der kleinen Größe des Moleküls nicht sehr komplex. Trotz allem sind inzwischen in der Patentliteratur zahlreiche Synthesemöglichkeiten beschrieben. Aber im Wesentlichen lassen sich drei Syntheserouten beschreiben, die alle über aromatische Aminderivate (Aniline) verlaufen [3]. Schon an dieser Stelle sei angemerkt, dass die Synthese nur ein Aspekt ist, der wesentlichen Einfluss auf die Qualität des Wirkstoffs hat. So besitzt zwar Paracetamol chemisch eine einfache Struktur, da aber keine Synthese ohne Nebenprodukte verläuft, sind die Nebenprodukte auch dem Paracetamol sehr ähnliche aromatische Verbindungen, die aufgrund sehr ähnlicher physikochemischer Eigenschaften wie der Löslichkeit und der Polarität nur sehr aufwendig vom eigentlichen Wirkstoff abzutrennen sind. Dies erklärt die Fülle von verfahrenstechnischen Patenten, die sich mit aufwendigen Reinigungsmethoden des Paracetamols beschäftigen.
Das Warner-Lambert-Patent
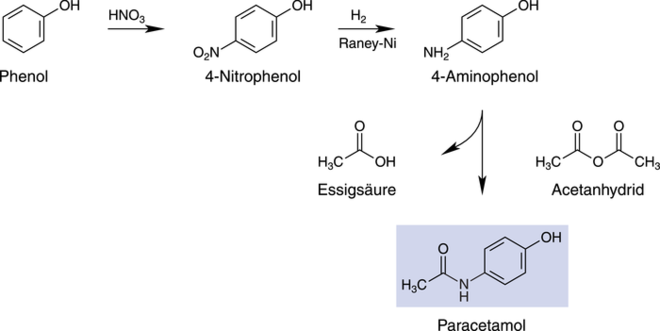
Wilbert und DeAngelis sind in einem Warner-Lambert-Patent von 1961 (US 2 998 450) von Phenol ausgegangen, haben dieses klassisch mit Salpetersäure nitriert, die Nitrogruppe mit Wasserstoff/Raney-Nickel (alternativ kann auch Natriumborhydrid verwendet werden) zum Aminophenol hydriert und mit Acetanhydrid die Aminogruppe acetyliert. Dies klingt so einfach, dass man dies auch im Organikpraktikum des Pharmaziestudiums durchführen könnte. Die Synthese nach Wilbert und DeAngelis ist in Abbildung 2 gezeigt:
Das Hoechst-Celanese-Verfahren
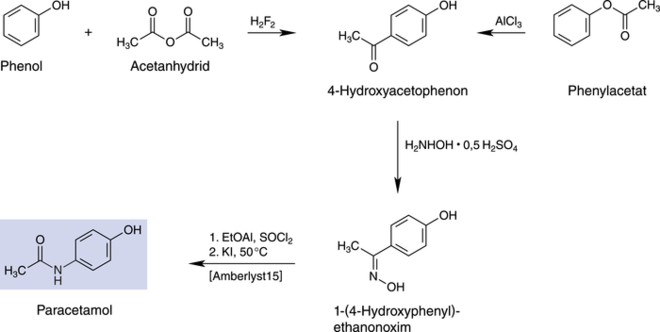
Der zweite und großindustriell angewandte Syntheseweg, der als Hoechst-Celanese-Verfahren bezeichnet wird, startet entweder beim Phenol, das mittels Acetanhydrid und H2F2 in 4-Position acetyliert wird, oder direkt beim Phenylacetat, das mit AlCl3 einer Friesumlagerung bei geringen Temperaturen unterzogen wird. Das erhaltene 4-Hydroxyacetophenon wird mit Hydroxylamin und Schwefelsäure zum Oxim umgesetzt, und die finale Beckmann-Umlagerung mittels SOCl2 in Ethylacetat und Kaliumiodid bei 50 oC führt zum gewünschten Produkt. Diese Synthesewege sind in Abbildung 3 zusammenfassend dargestellt.
Abb. 3: Die Paracetamol-Synthese gemäß dem Hoechst-Celanese-Verfahren über die Zwischenstufe 4-Hydroxyacetophenon.
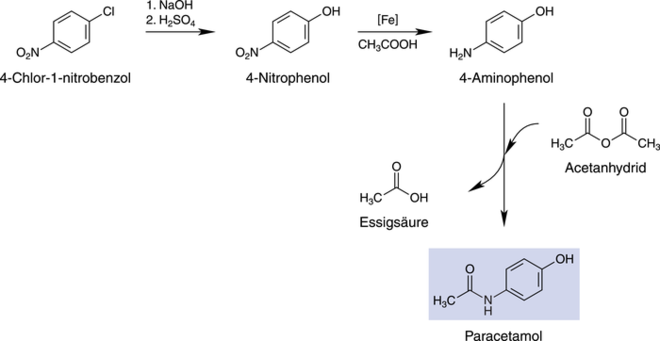
Es gibt zahlreiche weitere Synthesevarianten, die vom 4-Chlor-1-nitrobenzol ausgehen und über die klassische Aromatenchemie bis zum 4-Aminophenol umgesetzt werden, welches dann noch mit Acetanhydrid acetyliert werden muss [4, 5, 6, 7]. Die Syntheseoption ist schematisch in Abbildung 4 gezeigt.
Abb. 4: Schematische Paracetamol-Synthese ausgehend von 4-Chlor-1-nitrobenzol über das Schlüsselintermediat 4-Aminophenol.
Wegen der breiten Anwendung von Paracetamol zur Behandlung diverser Schmerzen als Monotherapie oder in Kombination mit anderen Analgetika, wie z. B. Opioiden, existiert ein breiter Markt für Paracetamol. Somit ist es nicht verwunderlich, dass das EDQM (European Directorate for the Quality of Drugs and HealthCare) zahlreiche Zertifikate (sogenannte CEPs = Certificates of Suitability to the Monograph of the European Pharmacopoeia) für Hersteller ausgestellt hat, die belegen, dass die Qualität des Wirkstoffs der Qualität des Europäischen Arzneibuches entspricht. Derzeit halten folgende Firmen ein CEP [8]: Liaoyuan City Baikang Pharmaceuticals (China), Novacyl (Frankreich), Sri Krishna Pharmaceuticals Ltd. (Indien), Atabay Kimya Sanayi Ve Ticaret A.S. (Türkei), Granules India Ltd. (Indien), Hebei Jiheng (group) Pharmaceutica (China), Anhui BBCA Likang Pharmaceuticals (China), Zhejiang Kangle Pharmaceuticals (China), Farmson Pharmaceutical Gujarat Ltd. (Indien), Meghmani LLP (Indien) und Specgx LLC (US).
Bekannte Verunreinigungen
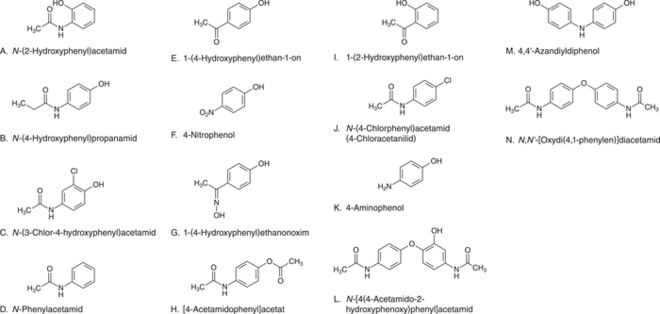
Es ist keine Überraschung, dass man im Europäischen Arzneibuch (Ph. Eur. 10.2 [9]) zahlreiche Verunreinigungen der beschriebenen Synthesewege, die zum Teil Synthesezwischenprodukte und zum Teil Nebenprodukte sind, findet, aber auch Zersetzungsprodukte des Paracetamols. Die im Arzneibuch mitgeteilten Verunreinigungen sind in Abbildung 5 zusammengestellt.
Basierend auf der wissenschaftlichen Literatur sind die folgenden Verunreinigungen unabhängig von der Syntheseroute für die Fertigarzneimittel besonders relevant:
- 4-Chloracetanilid,
- 4-Nitrophenol und
- 4-Aminophenol.
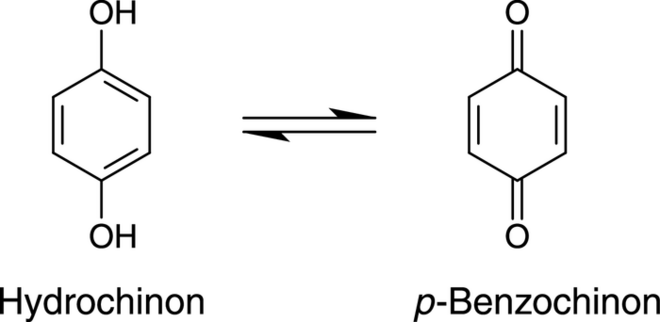
Zusätzlich werden hier die hoch-mutagenen Zersetzungsprodukte des Paracetamols wie Hydrochinon und p-Benzochinon genannt, die in Abbildung 6 gezeigt sind.
Abb. 6: Mutagene Zersetzungsprodukte des Paracetamols. p-Benzochinon ist die oxidierte Form vom Hydrochinon.
Das Arzneibuch begrenzt für den Arzneistoff alle unspezifizierten Verunreinigungen mit 0,05% aufgrund der hohen Maximaldosis bis zu 3 g pro Tag. Die Anilinderivate 4-Aminophenol und 4-Chloracetanilid dürfen Grenzwerte von 50 ppm bzw. 10 ppm aufgrund ihrer Toxizität nicht überschreiten. 4-Chloranilin ist hier allerdings nicht aufgeführt; vielleicht, weil es bisher in keinen Chargen gefunden worden ist. Auch wenn 4-Chloranilin nicht in der Monographie als Verunreinigung aufgeführt ist, bedeutet das aber nicht, dass diese Verunreinigung bei den zertifizierten Herstellverfahren nicht auftaucht. Diese Verunreinigung kann in spezifischen Prozessen durchaus beobachtet werden, sie wird dann nur als nicht „monographierte“ Verunreinigung kontrolliert, sondern über die M7-Richtlinie der ICH [1]. In Abhängigkeit des Herstellprozesses kann diese für die Freigabe-Spezifikation relevant sein oder auch nicht. Solche Informationen sind im sogenannten „Restricted Part“ des „Drug Master Files“ aufgeführt, der nur dem Paracetamol-Hersteller und der Zulassungsbehörde bekannt und in der Regel dem Hersteller des Fertigarzneimittels nicht zugänglich ist. Vielleicht liegt auch hier eine große Gefahr, dass immer wieder unerwartete Verunreinigungen auftauchen können, die man nur findet, wenn man danach sucht oder sie zufällig in Routineanalysen detektiert werden.
Ursachenforschung
Bei der Ursachenforschung stellt sich nun die Frage, wie das 4-Chloranilin in bedenklichen Konzentrationen ins Paracetamol kommen kann. Hier gibt es prinzipiell zahlreiche Ursachen in Abhängigkeit vom angewandten Syntheseverfahren. Zum einen kann es als Verunreinigung in dem regulatorisch definierten GMP-Startmaterial eingeschleppt worden sein, was in der Eingangskontrolle als nicht spezifizierte Verunreinigung damit auch nicht kontrolliert worden ist. Wechsel des Startmaterial-Herstellers oder auch eine Variation im Herstellverfahren des Startmaterials können eine Ursache dafür sein, aber auch eine sogenannte Abweichung in der sogenannten Batch-Qualität ohne Variation des Herstellverfahrens. Somit wird eine kleine Kontamination über die unterschiedlichen Herstellstufen in das finale Produkt verschleppt, ohne dass es zu Abreicherungen (Purging) bei den Aufreinigungsstufen gekommen ist mit der Folge, dass sich die Kontamination unbemerkt weiter in minimalen Mengen angereichert hat. Besonders die Herstellverfahren, die ausgehend vom 4-Nitrobenzol über das 4-Aminophenol verlaufen, sind hierfür sehr anfällig. Bei nicht optimierten Umsätzen kann z. B. bei der Umsetzung des Ausgangsmaterials 4-Nitrophenol verschleppt worden sein, das sich dann im nachfolgenden Reaktionsschritt zum 4-Chloranilin umsetzen kann.
Für das BfArM keine Überraschung?!
Zurzeit untersucht die EDQM die Chargen und die Ursache des 4-Chloranilin-Auftretens zusammen mit den betroffenen Herstellern [11]. Bemerkenswert in diesem Zusammenhang ist, dass das BfArM gegenüber der DAZ (DAZ 2020, Nr. 31, S. 38) mitgeteilt hat, dass 4-Chloranilin keine neue Verunreinigung in Paracetamol sei. Auch das ist somit keine Überraschung. Wenn aber schon nationale Behörden diese Kenntnis haben, wie kann es dann passieren, dass solche Qualitätsmängel immer wieder berichtet werden? Müssen wir das Kontrollverfahren durch erhöhte Transparenz zwischen den zentralen und nationalen Zulassungsbehörden innerhalb der Europäischen Union weiter optimieren?
Inzwischen gibt es eine umfassende Darstellung der EMA über die Nitrosamin-Problematik mit dem Thema [10]: Lessons learned? Haben wir wirklich was gelernt? Und wenn ja, warum kommen immer wieder diese Meldungen? Für uns stellen sich immer mehr Fragen. Antworten kommen – wenn überhaupt – viel zu spät.
Aber auch die weitere Umsetzung der monographierten Verunreinigungen können als potenzielle 4-Chloranilin-Quelle infrage kommen. Die Amidbindung des Paracetamols ist Hydrolyse-empfindlich und stellt den Hauptzersetzungsweg des Paracetamols dar. Somit kann die monographierte Verunreinigung J (N-(4-Chlorphenyl)acetamid (4-Chloracetanilid); siehe Abb. 5) direkt als sogenanntes sekundäres Zersetzungsprodukt zum 4-Chloranilin reagieren. Diese nachträgliche Bildung muss nicht notwendigerweise im Wirkstoff stattfinden, sondern kann auch im Fertigarzneimittel während der Lagerung auftreten. Somit sind Wirkstoffhersteller wie auch Fertigarzneimittelhersteller gleichermaßen gefragt. Auch ein unbemerkt mitgeschleppter Anteil von p-Aminophenol kann in Reaktion mit Chlorierungsreagenzien wie Thionylchlorid direkt zum 4-Chloranilin führen.
Auch geringe Abweichungen der Reaktionsführung bei der Umsetzung des 4-Hydroxyacetophenons über die Oxim-Zwischenstufe und der weiteren Umsetzung mit Thionylchlorid können die unkontrollierte Bildung von 4-Chloranilin wahrscheinlich machen.
Insgesamt kann festgestellt werden, dass aufgrund der vielfältigen Bildungsmöglichkeiten bei einer Gesamtbetrachtung aller möglichen Aspekte, die Synthese-relevant sind, und auch der nicht auszuschließenden nachträglichen Bildung in der Fertigarznei, Verunreinigungen wie 4-Chloranilin wissenschaftlich keine wirkliche Überraschung darstellen. Fehlt es den Kontrollbehörden möglicherweise an wissenschaftlicher Kompetenz und gefährden sie deshalb somit immer wieder die Qualität der Arzneimittel für den europäischen Markt?
Konsequenzen
Wie bereits erwähnt stellt sich die Frage, wie häufig wir Berichte über solche „unerwarteten“ Verunreinigungen, ob nun toxisch oder nicht, noch erwarten dürfen. Im Unterschied zu den Nitrosaminen in den Sartanen [12, 13] handelt es sich in diesem Fall nicht um eine im engeren Sinne unerwartete Verunreinigung, denn das Auftreten von 4-Chloranilin kann – wie erklärt – mehrere Ursachen haben. Grundsätzlich gilt, dass kleine Änderungen eines Syntheseweges, wie z. B. der Reaktionsbedingungen, der Aufreinigungen oder der Wechsel eines Startmaterial-Herstellers, schon zur Entstehung von bis dahin nicht beobachteten Verunreinigungen führen können. Dies gilt im Grunde für alle Arzneistoffe. Deshalb sollte bei der Planung einer Wirkstoffsynthese immer eine Risikoanalyse durchgeführt werden, auch dann, wenn es sich um einen bereits gut bekannten Herstellungsweg handelt. Dabei müssen alle Verunreinigungen der bei der Synthese verwendeten Ausgangsstoffe, Katalysatoren und Hilfsstoffe sowie der Lösungsmittel, deren Reaktionen untereinander sowie deren Verschleppung in die nächsten Reaktionsschritte, die Reaktivität der Zwischenprodukte und ggf. Zersetzungsprodukte beachtet werden. Außerdem müssen kleine Abweichungen der Reaktionsbedingungen und auch Qualitätsänderungen der verwendeten Chemikalien in die Analyse Eingang finden. Daraus erwächst schnell eine komplexe Matrix, die in die Qualitätsanalytik mit eingehen muss. Wir haben dies kürzlich am Beispiel Cetirizin-Dihydrochlorid aufgezeigt [14]. Es stellt sich an dieser Stelle die Frage, ob eine solche Risikoanalyse auch immer durchgeführt wird.
Außerdem sind in den letzten Jahren die Analysenverfahren, insbesondere die massenspektrometrischen Detektionsmöglichkeiten der HPLC/UPLC, immer empfindlicher geworden, so dass man auch kleinste Mengen finden und sie aufgrund der Genauigkeit der Massenbestimmung auch einer Summenformel zuordnen kann. An dieser Stelle seien nur die ESI-TOF-Detektoren genannt. Insofern findet man natürlich auch immer mehr Verunreinigungen. Laufende Untersuchungen an Bisoprolol geben ein beredtes Beispiel dafür [15]. Nichtsdestoweniger sollten Nitrosamine nicht in Sartanen und 4-Chloranilin nicht in Paracetamol gefunden werden. |
Literatur
[1] https://database.ich.org/sites/default/files/M7_R1_Guideline.pdf, Assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk. Abgerufen am 30.8.2020
[2] MAK (1992) p-Chloroaniline. In: Occupational toxicants: critical data evaluation for MAK values and classification of carcinogens. Volume 3. Deutsche Forschungsgemeinschaft, Commission for the Investigation of Health Hazards of Chemical Compounds in the Work Area. Weinheim, VCH Publishers, 45-61.
[3] Buschmann H, Christoph T, Friderichs E, Maul C, Sundermann B. Analgesics – from chemistry and pharmacology to clinical application, Wiley-VCH, Weinheim 2002
[4] Nemeth T, Jankovics P, Nemeth-Palotas J, Koszegi-Szalai H. Determination of paracetamol and its main impurity 4-aminophenol in analgesic preparations by micellar electrokinetic chromatography. J. Pharm. Biomed. Anal. 47(2008):746–749
[5] Kamberi M, Riley CM, X. Ma (Sharon), Chen-Wen C. Huang. A validated, sensitive HPLC method for the determination of trace impurities in acetaminophen drug substance. J. Pharm. Biomed. Anal. 34(2004):123–128
[6] Dumarey M, van Nederkassel AM, Stanimirova I, Daszykowski M, Bensaid F, Leesc M, Martin GJ, Desmurs JR, Smeyers-Verbeke J, Vander Heyden Y. Recognizing paracetamol formulations with the same synthesis pathway based on their trace-enriched chromatographic impurity profiles. Anal. Chim. Acta 655(2009):43–51
[7] Keshavarz L, Steendam RRE, Blijlevens MAR, Pishnamazi M, Frawley PJ. Influence of Impurities on the Solubility, Nucleation, Crystallization, and Compressibility of Paracetamol. Cryst. Growth Des. 19 (2019):4193–4201. https://doi.org/10.1021/acs.cgd.9b00490
[8] D:\Dokumente\PAPER\Verunreinigung in Paracetamol\Monograph Details CEPs Info.htm. Abgerufen am 30.8.2020
[9] European Pharmacopoeia, 10.2, Council of Europe, Strasbourg, 2020, Paracetamol
[10] https://www.ema.europa.eu/en/documents/report/lessons-learnt-presence-n-nitrosamine-impurities-sartan-medicines_en.pdf Abgerufen am 31.8.2020
[12] Buschmann H, Holzgrabe U, NDMA in Valsartan, DtschApothZtg 158(29):2898-2902
[13] Buschmann H, Holzgrabe U, Jung D. „Unerwartet“ verunreinigt. DtschApothZtg 159(20):1866-1874.
[14] Leistner A, Haerling S, Kreher JD, Becker I, Jung D, Holzgrabe U. Risk assessment report of potential impurities in cetirizine dihydrochloride. J. Pharm. Biomed. Anal. 189(2020):113425
[15] Wohlfart J, Jung D, Holzgrabe U, Publikation in Vorbereitung.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.