
- DAZ.online
- DAZ / AZ
- DAZ 29/2020
- Herausforderung ...
Medizin
Herausforderung nichtalkoholische Fettleber
Wenn die Leber ohne Bier und Korn ihr Fett abkriegt
Die nichtalkoholische Fettlebererkrankung (NAFLD für Nonalcoholic Fatty Liver Disease) umfasst ein Spektrum von Leberkrankheiten, die durch eine vermehrte Fettspeicherung in der Leber gekennzeichnet sind, bei denen aber Alkohol als Ursache ausgeschlossen ist. In Deutschland sind etwa 20 bis 30% der Bevölkerung davon betroffen. Im Einzelnen werden folgende Formen bzw. Stadien der NAFLD unterschieden [1 – 4]:
- Bei Patienten mit einer nichtalkoholischen Fettleber (nichtalkoholische Steatose, NAFL) ist eine Fetteinlagerung (Lipidakkumulation) in den Leberzellen von mindestens 5% nachweisbar.
- Rund 20% der Patienten mit einer NAFLD entwickeln eine nichtalkoholische Fettleberentzündung (nichtalkoholische Steatohepatitis; NASH). Hier zeigt die histologische Untersuchung ballonförmig aufgeblähte, degenerierte Leberzellen (Ballooning) und Entzündungsherde in den Leberläppchen („lobuläre Entzündung“). Eine NASH kann zudem mit einer Fibrose, also einer krankhaften Vermehrung des Bindegewebes, einhergehen.
- Bei etwa 20% der Patienten mit NASH bildet sich im Verlauf ihres Lebens schließlich eine Leberzirrhose aus. Dabei kommt es zum Umbau der Leberarchitektur, wobei die Funktionalität des Organs beeinträchtigt und der Gesamtquerschnitt der Gefäße reduziert wird. Dies hat negative Auswirkungen auf den Blutfluss, den Stoffwechsel und die Entgiftungsfunktion der Leber.
- Letztlich kann sich eine NASH bzw. eine Leberzirrhose auch in Richtung eines Leberzellkarzinoms entwickeln.
Epidemiologische Fakten
- Rund 25% der Menschen entwickeln eine nichtalkoholische Fettlebererkrankung (NAFLD).
- 20% der Patienten mit NAFLD entwickeln eine nichtalkoholische Steatohepatitis (NASH).
- Bei bis zu 5% der Patienten mit NASH bildet sich diese im Laufe der Zeit spontan zurück.
- 4% der Patienten mit NAFLD und 20% der Patienten mit NASH entwickeln eine Zirrhose.
Die Diagnose einer NAFLD beruht auf verschiedenen Säulen [4, 5]: So können anhand der Anamnese z. B. ein Alkoholabusus, eine hepatotoxische Medikation oder relevante Vorerkrankungen ausgeschlossen werden. In Laboruntersuchungen festgestellte erhöhte Werte für die Transaminasen Alanin-Aminotransferase (ALT) und/oder Aspartat-Aminotransferase (AST) sowie die γ-Glutamyltransferase (γ-GT) können auf eine Leberschädigung bzw. entzündliche Vorgänge hinweisen. In einer Sonografie des Abdomens lässt sich eine ausgeprägte Fettleber erkennen. Durch eine Leberelastografie ‒ ein Ultraschallverfahren zur Messung der Elastizität des Leberparenchyms ‒ kann der Fibrosegrad des Gewebes nichtinvasiv beurteilt werden. Mittels Leberbiopsie und nachfolgender histologischer Untersuchung kann zwischen Steatose, Steatohepatitis, Fibrose und Leberzirrhose differenziert werden. Auch die Krankheitsaktivität lässt sich basierend auf den Ergebnissen der geweblichen Untersuchung über den NAFLD-Aktivitätsscore (NAS) abschätzen (Tab. 1). Allerdings können mit der Leberpunktion zum Teil schwere Komplikationen für den Patienten verbunden sein.
SteatoseFetteinlagerung [%] in Hepatozyten | ballonierte Hepatozyten | Inflammationlobuläre Entzündungsherde (Foci) pro Gesichtsfeld | Schweregrad |
|---|---|---|---|
< 5% (0) | keine (0) | keine (0) | 0 |
5 bis 33% (1) | wenig (1) | 1 – 2 Foci pro 20-x-Feld (1) | 1 |
34 bis 66% (2) | zahlreich (2) | 2 – 4 Foci pro 20-x-Feld (2) | 2 |
> 66% (3) | > 4 Foci pro 20-x-Feld (3) | 3 |
Wie entsteht eine NAFLD und welche Risikofaktoren gibt es?
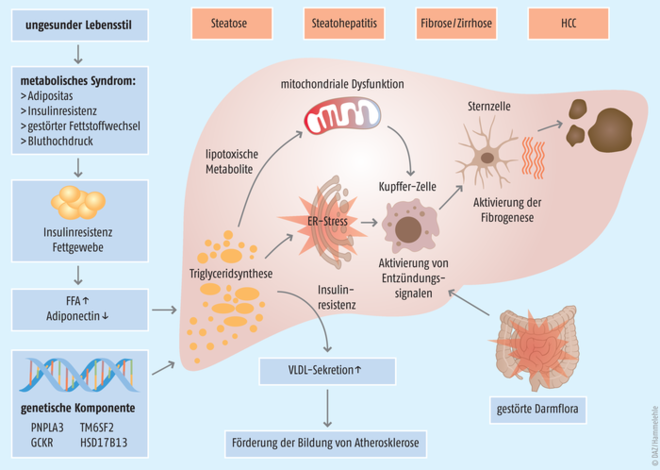
Die nichtalkoholische Fettlebererkrankung ist mit Adipositas, peripherer Insulinresistenz, arteriellem Bluthochdruck und Fettstoffwechselstörungen (Dyslipidämie) ‒ den charakteristischen Faktoren eines metabolischen Syndroms ‒ assoziiert und wird daher auch als dessen Manifestation in der Leber angesehen [2]. Die pathophysiologischen Mechanismen, die zur Ausbildung einer NAFLD sowie zum Fortschreiten in Richtung NASH führen, sind bisher noch nicht vollständig geklärt. Es wirken jedoch verschiedene Faktoren bei der Krankheitsentstehung zusammen (Multiple-Hit-Theorie; Abb. 1) [6 – 9]:
Infolge eines ungesunden Lebensstils (falsche Ernährung, mangelnde körperliche Aktivität) kann sich ein metabolisches Syndrom entwickeln, das mit der Ausbildung von Adipositas, einer Insulinresistenz sowie Fettstoffwechselstörungen einhergeht.
Die Insulinresistenz sorgt für einen Anstieg der Lipolyse im Fettgewebe. Es kommt zur vermehrten Freisetzung freier Fettsäuren, die dann von der Leber aufgenommen werden und sich dort anreichern. In der Leber steigt die Synthese von Triglyceriden an, die im Laufe der Zeit akkumulieren. Dies führt letztlich zur Ausbildung einer Steatose. Die Fettleber wiederum bewirkt eine intrahepatische Insulinresistenz mit einer vermehrten Sekretion von Lipoproteinen sehr geringer Dichte (VLDL) als Folge. Damit erhöht sich unter anderem das Risiko für den Patienten, eine Atherosklerose auszubilden.
Mit dem hohen Gehalt an freien Fettsäuren, freiem Cholesterol und anderen Lipiden in der Leber geht eine erhöhte Lipotoxizität einher. Dies führt letztlich zu Funktionseinschränkungen der Mitochondrien mit oxidativem Stress und der Produktion von reaktiven Sauerstoffspezies sowie zur Aktivierung von Stressmechanismen des endoplasmatischen Retikulums. Im weiteren Verlauf werden über die Kupffer-Zellen entzündliche Reaktionen ausgelöst ‒ es entsteht eine Steatohepatitis.
Die chronische Entzündung hat Leberzellschäden zur Folge und führt über eine Aktivierung der hepatischen Sternzellen langfristig zur Entwicklung einer Fibrose bzw. Zirrhose.
Neben all diesen Faktoren spielen auch eine gestörte Darmflora sowie genetische Prädispositionen, z. B. ein Polymorphismus im Patatin-like Phospholipase-Domain-Containing-3-Gen (PNPLA3), eine wichtige Rolle bei der Pathogenese einer NAFLD.
Abb. 1:Pathogenese der nichtalkoholischen Fettlebererkrankung; ER: endoplasmatisches Retikulum, FFA: freie Fettsäuren, HCC: Leberkrebs, VLDL: Lipoproteine sehr geringer Dichte (nach [6, 7])
Risikofaktoren für die Entstehung einer nichtalkoholischen Fettlebererkrankung sind demnach Adipositas, Diabetes mellitus und Dyslipidämie als Komponenten des metabolischen Syndroms ebenso wie eine genetische Prädisposition [6]. Darüber hinaus erhöhen männliches Geschlecht, höheres Alter und eine hispanische Abstammung die Gefahr, an einer NAFLD zu erkranken. Von einer solchen primären nichtalkoholischen Fettlebererkrankung müssen sekundäre Ursachen abgegrenzt werden, die ebenfalls zur Entwicklung einer Fettleber führen können. Hierzu gehören beispielsweise die Einnahme bestimmter Arzneimittel (Glucocorticoide, Östrogene, Amiodaron, Methotrexat, Diltiazem, Valproat), chronische Virusinfektionen (HIV, Hepatitis C), Mangelernährung (Protein-Malnutrition, rascher Gewichtsverlust, gastrointestinale Bypass-Chirurgie) und andere metabolische Erkrankungen (Lipodystrophie, Weber-Christian-Syndrom) [10].
Lifestyle-Änderung zur Gewichtsreduktion
Das Ziel einer Therapie der nichtalkoholischen Fettleber besteht darin, den Progress in Richtung nichtalkoholische Steatohepatitis zu verhindern [4]. Liegt bereits eine NASH vor, gilt es, die Ausbildung einer Fibrose bzw. Zirrhose mit den entsprechenden Komplikationen zu vermeiden. Da es bislang keine für die Indikation NAFLD zugelassenen Medikamente gibt, sind nichtmedikamentöse Therapiestrategien Mittel der Wahl. Hier wird eine Änderung des Lebensstils mit Umstellung der Ernährung und gesteigerter körperlicher Aktivität empfohlen (s. Kasten „NAFLD – was hilft und was schadet“) [4, 11, 12]. Dabei sollte eine nachhaltige Verringerung des Körpergewichts von 0,5 bis 1 kg pro Woche erreicht werden. Dass eine solche intensive Lebensstiländerung für die Betroffenen von Vorteil sein kann, zeigte z. B. eine Untersuchung, in der NASH-Patienten, die mindestens 7% ihres Ausgangsgewichts verloren hatten, durch eine signifikant geringere Krankheitsaktivität profitierten. Hier muss jedoch darauf geachtet werden, den angestrebten Gewichtsverlust an die Möglichkeiten des Patienten anzupassen und unrealistische Zielsetzungen zu vermeiden [4].
NAFLD – was hilft und was schadet
Das hilft:
- Zielgewichtsverlust (moderat): 7 bis 10% Gewichtsverlust
- hypokalorische Diät: Kalorienreduktion von 500 bis 700 kcal pro Tag
- mediterrane Diät: mehr Gemüse, Fisch, Hülsenfrüchte, Nüsse und Olivenöl essen, weniger Zucker, rotes Fleisch und verarbeitete Produkte
- komplexe Kohlenhydrate bevorzugen
- körperliche Aktivität: 150 bis 200 Minuten moderate Aktivität pro Woche
- bariatrische Chirurgie als eine Option bei ausgeprägter Adipositas erwägen
- für den Patienten individuelle und realistische Ziele setzen
- positives Feedback geben und die Diät anpassen
Abzuraten ist von:
- Monodiäten, High-Fat-Diäten (z. B. Atkins-Diät)
- Fructose-/Sucrose-haltigen Nahrungsmitteln und Getränken
- zusätzlich gesüßten Nahrungsmitteln, verarbeiteten Nahrungsmitteln
- Fast Food
- gesättigten und Trans-Fetten
- Alkoholkonsum
Die richtige Ernährung und das Problem Fructose
Die Ernährung bei Patienten mit einer nichtalkoholischen Fettleber sollte demnach hypokalorisch sein, um so bei den meistens übergewichtigen Patienten eine Verringerung des Gewichts zu erreichen. Empfohlen wird hierzu kohlenhydratarme Ernährung mit frischen, natürlichen und überwiegend pflanzlichen Lebensmitteln [13]. Geeignet ist hier z. B. die sogenannte Mittelmeer-Diät mit viel Gemüse und Salat sowie Nüssen, Fisch und Olivenöl, die auch als gesunde Fettlieferanten gelten. Verzichten sollte man dagegen auf zu viel rotes Fleisch und fetthaltige Milchprodukte. Eine positive Wirkung auf die Leber scheint Kaffee zu haben. So konnte in einer Kohortenstudie gezeigt werden, dass sich durch Kaffeekonsum von mindestens vier Tassen täglich das Risiko für chronische Leberkrankheiten bei NASH-Patienten deutlich reduziert [14]. Auch coffeinfreier Kaffee ist wirksam, nicht jedoch beispielsweise grüner Tee [13].
Bei der Auswahl der Diät sollte auch darauf geachtet werden, den übermäßigen Genuss von Fructose-haltigen Nahrungsmitteln zu vermeiden. Dabei ist nicht der Verzehr von Obst problematisch, sondern von Softdrinks, Fruchtsäften und Fertignahrungsmitteln, da hier oft große Mengen an Fruchtzucker enthalten sind. Diesem wird für die Entstehung von viszeraler Adipositas, Insulinresistenz und NASH eine zunehmende Bedeutung beigemessen [15]. Fructose kann – im Gegensatz zu Glucose – im Körper nicht gespeichert werden, sondern muss in der Leber verarbeitet werden [16]. Bei übermäßiger Zufuhr wird sie bevorzugt zu Glycerol-3-phosphat abgebaut, das zusammen mit Fettsäuren zu Triglyceriden, also zu Neutralfetten, verestert wird (De-novo-Lipogenese) [16, 17]. Des Weiteren blockiert ein Fructose-Überschuss die Beta-Oxidation, also den Abbaumechanismus der hepatischen Fettsäuren, was ebenfalls zu deren Anreicherung in der Leber führt [17]. Im Rahmen des Fructose-Metabolismus kommt es zudem zur Bildung von Harnsäure, die prooxidative und proinflammatorische Effekte aufweist. Letztendlich steigert Fructose also die Fett-Einlagerungen und fördert Entzündungen in der Leber.
Mehr Bewegung
Patienten mit einer nichtalkoholischen Fettlebererkrankung sollen regelmäßig ein Ausdauer- und/oder Krafttraining absolvieren, das jedoch an die jeweiligen Möglichkeiten des einzelnen Patienten angepasst werden muss [4]. Insbesondere regelmäßiges Ausdauertraining (z. B. Joggen, Walking, Radfahren) kann sich positiv auswirken: Schon nach wenigen Wochen kommt es zu einer Blutdrucksenkung, die Insulinempfindlichkeit im Gewebe steigt, der Blutzucker sinkt, und oft kann eine Gewichtsreduktion erreicht werden [5]. Wenn eine kompensierte NASH-Zirrhose vorliegt, sollten die Betroffenen zu einem Sportprogramm unter Anleitung motiviert werden. Bei einer dekompensierten NASH-Zirrhose sind physiotherapeutische Maßnahmen empfehlenswert, um so einem Muskelabbau entgegenzuwirken [4].
Ultima ratio: bariatrische Operation
Auch eine bariatrische Operation ist hier unter Umständen eine denkbare nichtmedikamentöse Therapieoption. So kann z. B. eine Magen-Bypass-Operation mit Roux-Y-Rekonstruktion in Betracht gezogen werden, wenn der Patient unter einer schweren Adipositas (BMI 35 kg/m2 oder mehr) leidet und eine Veränderung des Lebensstils mit gewichtsreduzierenden Diäten bzw. körperlicher Aktivität nicht den gewünschten Erfolg bringt. Eine allgemeingültige Empfehlung für die Behandlung einer NAFLD/NASH mittels bariatrischer Chirurgie kann derzeit allerdings nicht gegeben werden, da hierzu bisher keine evidenzbasierten Daten aus randomisierten klinischen Studien vorliegen. Ausgeschlossen ist ein solcher chirurgischer Eingriff, wenn der betroffene Patient unter einer fortgeschrittenen Leberzirrhose leidet [4].
Suche nach medikamentösen Therapieoptionen
Aktuell ist, wie oben erwähnt, noch kein Arzneimittel spezifisch für die Behandlung einer nichtalkoholischen Fettlebererkrankung zugelassen [1, 3]. Im Rahmen von Studien wurden bzw. werden derzeit jedoch mehrere Substanzen auf ihre Wirksamkeit und Verträglichkeit hin untersucht (Tab. 2).
Wirkstoff | Phase | Mechanismus | Indikation |
|---|---|---|---|
BI 1467335 | II | AOC-3-Inhibition: Apoptose | NASH |
Cenicriviroc | III | CCR2/CCR5-Rezeptor-Antagonist: Inflammation und Fibrose | NASH + F2/F3 |
Elafibranor | III | PPAR-α/δ-Agonist: Fett- und Glucosemetabolismus | NASH + F1 – F3 |
Emricasan | II | Caspase-Inhibitor: Apoptose | NASH + F1 – F3, F4 |
IVA 337 | II | PPAR-α/δ/γ-Agonist: Fett- und Glucosemetabolismus | NASH |
GS0976 | II | Acetyl-CoA-Carboxylase-Inhibitor: Fettsäuren-Meatbolismus | NAFLD |
GS9674 | II | FXR-Agonist: Gallensäurestoffwechsel | NASH |
Obeticholsäure | III | FXR-Agonist: Gallensäurestoffwechsel | NASH + F1 – F3 |
Pioglitazone | II | PPAR-γ-Agonist: Fett- und Glucosemetabolismus | NASH |
Selonsertib | III | ASK1-Inhibitor: oxidativer Stress und Fibrose | NASH F3 + F4 |
Semaglutid | II | GLP-1-Agonist: Glucosemetabolismus | NASH + Adipositas |
Obeticholsäure. Ein aussichtsreicher Kandidat für die Therapie der NAFLD ist Obeticholsäure, die als Ocaliva® bereits zur Therapie der primären biliären Cholangitis (PBC) eingesetzt wird [18]. Das Arzneimittel wirkt als selektiver Farnesoid-X-Rezeptor-Agonist und reguliert dadurch die Gallensäurekonzentration in den Hepatozyten. Dies kann sich positiv auf die entzündlichen und fibrotischen Prozesse in der Leber auswirken, wie die Daten einer randomisierten Phase-II-Studie zeigen [19]. In diese wurden insgesamt 283 Patienten mit einer nicht-zirrhotischen NASH eingeschlossen, die entweder Obeticholsäure (25 mg/Tag) oder stattdessen Placebo erhielten. Die Auswertung der Daten nach 72-wöchiger Therapie ergab, dass die Patienten der Verumgruppe von der Behandlung bezüglich aller histologischer Kriterien der NASH profitierten. Das heißt, sowohl die Ausprägung der Steatose als auch die Zahl der ballonierten Leberzellen und der Grad der lobulären bzw. portalen Entzündung konnten verbessert werden. Zudem wirkte sich die Obeticholsäure auch positiv auf den Fibrosegrad sowie den NAFLD-Aktivitätsscore aus. Der primäre Studienendpunkt ‒ Abnahme von ≥ 2 Punkten beim NAFLD-Aktivitätsscore ohne Verschlechterung des Fibrose-Scores ‒ wurde von signifikant mehr Patienten unter Obeticholsäure als unter Placebo erreicht (45% vs. 21%; p = 0,0002) [19].
Obeticholsäure wird aktuell auch in einer Phase-III-Studie untersucht ‒ mit ersten, positiven Ergebnissen [20]. In die doppelblinde Multicenterstudie REGENERATE wurden 931 Patienten eingeschlossen, bei denen eine NASH durch Leberbiopsie nachweisbar war und die eine Fibrose vom Grad 2 bis 3 aufwiesen. Nach Randomisierung in drei Studiengruppen erhielten die Patienten Obeticholsäure (10 mg/Tag bzw. 25 mg/Tag) oder stattdessen Placebo. Eine Interimsanalyse nach einer Studiendauer von 18 Monaten brachte folgende Ergebnisse [20]:
- Unter Obeticholsäure (10 mg/Tag) verbesserte sich bei 18% der Patienten, unter Obeticholsäure (25 mg/Tag) bei 23% die Fibrose um ≥ 1 Grad, ohne dass sich die NASH verschlechterte (erster primärer Endpunkt). Unter Placebo war dies bei 12% der Patienten der Fall (p = 0,045 bzw. 0,0002).
- Eine bessere Abheilung der NASH durch die Behandlung mit Obeticholsäure, ohne dass sich die Fibrose verschlechterte (zweiter primärer Endpunkt), konnte im Rahmen der Zwischenanalyse nicht nachgewiesen werden. Allerdings war ein entsprechender Trend erkennbar: Unter Obeticholsäure (10 mg/Tag) erreichten 11% und unter Obeticholsäure (25 mg/Tag) 12% der Patienten diesen Endpunkt vs. 8% unter Placebo (p = 0,18 bzw. 0,13).
- Die Werte der routinemäßig bei Fettlebererkrankungen untersuchten Parameter ALT, AST und γ-GT konnten durch Obeticholsäure in beiden Dosierungen deutlich reduziert werden im Vergleich zur Placebogruppe.
- Auch die Ausdehnung des Leberzellvolumens (Ballooning) und die lobuläre Inflammation wurden durch die Behandlung mit Obeticholsäure (25 mg/Tag) günstig beeinflusst.
- Die häufigste Nebenwirkung war Juckreiz (28% unter 10 mg/Tag Obeticholsäure bzw. 51% unter 25 mg/Tag Obeticholsäure), wobei auch 19% der Patienten in der Placebogruppe darüber klagten.
Die Daten geben Hinweise darauf, dass sich durch die Behandlung von Patienten, die an fibrotisierter NASH erkrankt sind, mit Obeticholsäure klinisch signifikante histologische Endpunkte deutlich verbessern lassen. Diese Ergebnisse sind auch deswegen von hoher praktischer Relevanz, da die Fibrose ein starker Prädiktor für die leberbedingte Morbidität und Mortalität bei der nichtalkoholischen Steatohepatitis ist [20].
Elafibranor
Eine weitere mögliche Option für die Behandlung einer nichtalkoholischen Fettlebererkrankung könnte in Zukunft Elafibranor sein. Die Substanz wirkt als dualer PPARα/δ-Agonist, aktiviert also die Peroxisomen-Proliferator-aktivierten Rezeptoren alpha und delta, was sich positiv auf die Insulinsensitivität, die Glucosehomöostase sowie den Lipidstoffwechsel auswirkt und antientzündliche Effekte vermittelt [21]. So wurden im Rahmen der Phase-II-Studie GOLDEN-505 insgesamt 276 Patienten untersucht, die an NASH erkrankt waren, aber keine Zirrhose aufwiesen. Diese erhielten nach Randomisierung über 52 Wochen Elafibranor 80 mg/Tag (n = 93) bzw. 120 mg/Tag (n = 91) oder stattdessen Placebo (n = 92). Eine Post-hoc-Analyse, in der eine modifizierte, stringentere Definition für die Krankheitsregression als bei der Intention-to-treat-Analyse zugrunde gelegt wurde, ergab, dass sich unter Elafibranor (120 mg/Tag) bei 19% der Patienten die NASH verbesserte ohne gleichzeitige Verschlechterung der Fibrose, während dies unter Placebo nur bei 12% der Fall war (primärer Endpunkt; p = 0,045). Bei Patienten mit einem Krankheitsaktivitätsscore ≥ 4 war der Benefit der Behandlung noch größer (20% vs. 11%; p = 0,018) [21]. Aktuell wird mit RESOLVE-IT an rund 2000 NASH-Patienten eine deutlich umfangreichere doppelblinde, randomisierte Multicenter-Studie der Phase III zur Beurteilung der Wirksamkeit und Sicherheit von Elafibranor durchgeführt [22].
Cenicriviroc
Ein potenzieller Kandidat für die Behandlung von Patienten mit nichtalkoholischer Fettlebererkrankung ist auch Cenicriviroc (CVC). Die Substanz, die als Antagonist der beiden Chemokininrezeptoren Typ 2 und 5 (CCR2/CCR5-Antagonist) wirkt, hat einen antientzündlichen bzw. antifibrotischen Effekt und kann sich daher positiv auf den weiteren Verlauf einer NAFLD auswirken [23]. Cenicriviroc konnte in einer Phase-IIb-Studie seine Wirksamkeit an insgesamt 289 Patienten mit fibrotischer NASH zeigen. Diese wurden nach Randomisierung mit CVC (150 mg/Tag) behandelt oder erhielten stattdessen Placebo. Im Ergebnis verbesserte sich unter der Therapie im Vergleich zu Placebo bei signifikant mehr Patienten die Fibrose um ≥ 1 Grad, ohne dass sich die Steatose verschlechterte (20% vs. 10%; p = 0,02). Ähnlich wie bei Elafibranor profitierten auch hier die Patienten mit höherer Krankheitsaktivität stärker von der Behandlung [23]. Im Rahmen von AURORA, einer randomisierten, doppelblinden, placebokontrollierten Multicenter-Studie der Phase III, wird aktuell die Wirksamkeit und Sicherheit von Cenicriviroc bei der Behandlung der Leberfibrose an Patienten mit nichtalkoholischer Steatohepatitis untersucht [24].
Auf einen Blick
- Die nichtalkoholische Fettlebererkrankung (NAFLD) umfasst ein Spektrum von hepatischen Erkrankungen, das von der reinen nichtalkoholischen Fettleber (NAFL) über die nichtalkoholische Steatohepatitis (NASH) gegebenenfalls mit Fibrose bis hin zu Leberzirrhose bzw. Leberzellkrebs reicht. In Deutschland sind etwa 20 bis 30% der Menschen von einer NAFLD betroffen.
- Nach der „Multiple-Hit-Theorie“ wirken bei der Pathogenese der NAFLD verschiedene Faktoren zusammen: Insulinresistenz und vermehrte Freisetzung von freien Fettsäuren im Fettgewebe – meist infolge eines metabolischen Syndroms – sorgen für eine Fettanreicherung in der Leber. In der Folge führen mehrere Mechanismen zur Entwicklung von Entzündungen, Fibrose und letztlich Zirrhose. Genetische Disposition und eine gestörte Darmflora spielen bei der Krankheitsentstehung ebenfalls eine wichtige Rolle.
- Die Therapie einer NAFLD basiert auf nichtmedikamentösen Maßnahmen, die dem metabolischen Syndrom und seinen Folgen entgegenwirken. Hierzu gehören vor allem eine Gewichtsreduktion durch Ernährungsumstellung sowie körperliche Aktivität. Insbesondere ein übermäßiger Verzehr von Fructose (z. B. in Softdrinks) sollte vermieden werden.
- Bisher ist in Deutschland noch kein Medikament speziell für die Behandlung einer NAFLD zugelassen. Aktuell befindet sich jedoch eine Reihe zum Teil vielversprechender Substanzen in der Entwicklung, wobei einige bereits in Phase-III-Studien getestet werden. Hierzu gehört unter anderem die Obeticholsäure, von der auch bereits erste positive Ergebnisse vorliegen.
Selonsertib
Selonsertib wirkt als Apoptose-signalregulierender-Kinase-1-Inhibitor (ASK-1-Inhibitor), das heißt, er hemmt die Apoptose und kann so im Tiermodell die Fibrose sowie Entzündungsprozesse verbessern [25]. In einer multizentrischen placebokontrollierten Phase-II-Studie wurden 72 NASH-Patienten über 24 Wochen lang mit Selonsertib in Dosierungen von 6 oder 18 mg/Tag alleine oder in Kombination mit dem monoklonalen Antikörper Simtuzumab untersucht. Die Daten der Selonsertib-Gruppen gleicher Dosierung (mit und ohne Simtuzumab) wurden dann jeweils gepoolt ausgewertet. Im Ergebnis konnte unter Selonsertib (18 mg/Tag) bei mehr Patienten eine Verbesserung der Fibrose um ≥ 1 Grad erreicht werden als unter Selonsertib (6 mg/Tag) bzw. Placebo (43% vs. 30% vs. 20%) [25]. Die Ergebnisse der weiterführenden Phase-III-Studien STELLAR-3 und STELLAR-4, die an jeweils über 800 Patienten mit NASH-bedingter Fibrose bzw. kompensierter Zirrhose durchgeführt wurden, waren jedoch ‒ zumindest, was die Monotherapie mit Selonsertib betrifft ‒ enttäuschend: Durch die Behandlung wurde im Vergleich zur Placebogruppe keine signifikante Verbesserung der Fibrose um ≥ 1 Grad erzielt, ohne dass sich die NASH verschlechterte (primärer Endpunkt) [26]. Auch von den untersuchten sekundären histologischen Endpunkten konnte keiner erreicht werden. Die Wirkung von Selonsertib in Kombination mit dem Acetyl-CoA-Carboxylase-Inhibitor Firsocostat und dem Farnesoid-X-Rezeptor-Agonisten Cilofexor wird derzeit im Rahmen der Phase-II-Studie ATLAS evaluiert.
Pioglitazon und Vitamin E
Die Wirksamkeit und Verträglichkeit des Insulinsensitizers Pioglitazon wurden in einer Metaanalyse untersucht, die ergab, dass sich durch die Behandlung bei Patienten mit NASH Verbesserungen der hepatischen Steatose, der entzündlichen Infiltrate und der Fibrose erreichen lassen [27]. Allerdings war die Therapie bei vielen Patienten auch mit einer deutlichen Gewichtszunahme verbunden [27]. Das Antioxidans Vitamin E verbesserte im Rahmen derselben Metaanalyse ebenfalls die hepatische Steatose und die Entzündung, nicht aber die Fibrose [27]. Gleichzeitig zeigte die Behandlung jedoch einen ungünstigen Effekt auf kardiometabolische Risikofaktoren [27]. In weiteren Studien wurde zudem eine Assoziation von erhöhter Mortalität und hochdosiertem Vitamin E beobachtet [4]. |
Literatur
[1] Sheka AC, Adeyi O, Thompson J, Hameed B, Crawford PA, Ikramuddin S. Nonalcoholic Steatohepatitis: A Review. JAMA 2020;323:1175-1183
[2] DocCheck-Flexikon. Nichtalkoholische Fettlebererkrankung; abrufbar unter: https://flexikon.doccheck.com/de/Nichtalkoholische_Fettlebererkrankung
[3] e.Medpedia. Nichtalkoholische Fettlebererkrankung (NAFLD); abrufbar unter: https://www.springermedizin.de/emedpedia/dgim-innere-medizin/nichtalkoholische-fettlebererkrankung-nafld?epediaDoi=10.1007%2F978-3-642-54676-1_153#
[4] Roeb E, Steffen HM, Bantel H, Baumann U, Canbay A, Demir M, Drebber U, Geier A, Hampe J, Hellerbrand C, Pathil-Warth A, Schattenberg JM et al. S2k-Leitlinie nicht alkoholische Fettlebererkrankungen. Z Gastroenterol 2015;53:668-723
[5] Nicht-alkoholische Fettlebererkrankung. Amboss – Fachwissen für Mediziner. www.amboss.com/de/wissen/Metabolisches_Syndrom#xid=4g03v2&anker=Ze9faee886487272a95a96a51c5aae1f0
[6] Weiß J, Rau M, Geier A. Nichtalkoholische Fettlebererkrankung: Epidemiologie, Verlauf, Diagnostik und Therapie. Dtsch Arztebl Int 2014;111:447-452
[7] Akshintala D, Chugh R, Amer F, Cusi K. Nonalcoholic Fatty Liver Disease: The Overlooked Complication of Type 2 Diabetes. In: Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, Hershman JM, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, et al. (eds.), Endotext. South Dartmouth (MA): MDText.com, Inc.; 2019
[8] Buzzetti E, Pinzani M, Tsochatzis EA. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD). Metabolism 2016;65:1038-1048
[9] Cusi K. Role of Obesity and Lipotoxicity in the Development of Nonalcoholic Steatohepatitis: Pathophysiology and Clinical Implications. Gastroenterology 2012;142:711-725.e6
[10] Schattenberg JM. Nicht-alkoholische Fettleber (NAFLD) und nicht-alkoholische Steatohepatitis (NASH): Pathophysiologie und Ernährungsaspekte. Ernährungs Umschau 2015;2:M92-M99
[11] Fettleber. Hepatitis & more online, www.hepatitisandmore.de/fettleber/fettleber.shtml
[12] Schumacher F, Tacke F. Die nicht-alkoholische Fettlebererkrankung (NAFLD). Hepatitis & more online 2017;1, www.hepatitisandmore.de/archiv/2017-1/die-nicht-alkoholische-fettlebererkrankung-nafld.shtml
[13] Häufigste Lebererkrankung Fettleber: Tipps für genussvolles Essen für eine gesunde Leber. Informationen der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS), www.dgvs.de/wp-content/uploads/2019/11/PM_2019_11-DGVS-Lebertag-2019.pdf
[14] Setiawan VW, Porcel J, Wei P, Stram DO, Noureddin N, Lu SC, Le Marchand L, Noureddin M. Coffee Drinking and Alcoholic and Nonalcoholic Fatty Liver Diseases and Viral Hepatitis in the Multiethnic Cohort. Clin Gastroenterol Hepatol 2017;15:1305-1307
[15] Schattenberg J, Schuppan D. Nonalcoholic steatohepatitis: the therapeutic challenge of a global epidemic. Current Opinion in Lipidology 2011;22:479–488
[16] Vogelreuter A. Gefährliche Fructose – Risiko für Gicht, metabolisches Syndrom und Fettleber. DAZ 2013;25:66
[17] Jensen T, Abdelmalek MF, Sullivan S, Nadeau KJ, Green M, Roncal C, Nakagawa T, Kuwabara M, Sato Y, Kang D-H, Tolan DR, Sanchez-Lozada LG, et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. J Hepatol 2018;68:1063-1075
[18] Fachinformation Ocaliva®, Stand: März 2019
[19] Neuschwander-Tetri BA, Loomba R, Sanyal AJ, Lavine JE, Van Natta ML, Abdelmalek MF, Chalasani N, Dasarathy S, Diehl AM, Hameed B, Kowdley KV, McCullough A, et al. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial. Lancet 2015;385:956-965
[20] Younossi ZM, Ratziu V, Loomba R, Rinella M, Anstee QM, Goodman Z, Bedossa P, Geier A, Beckebaum S, Newsome PN, Sheridan D, Sheikh MY, et al. Obeticholic acid for the treatment of non-alcoholic steatohepatitis: interim analysis from a multicentre, randomised, placebo-controlled phase 3 trial. Lancet 2019;394:2184-2196
[21] Ratziu V, Harrison SA, Francque S, Bedossa P, Lehert P, Serfaty L, Romero-Gomez M, Boursier J, Abdelmalek M, Caldwell S, Drenth J, Anstee QM, et al. Elafibranor, an Agonist of the Peroxisome Proliferator−Activated Receptor−α and −δ, Induces Resolution of Nonalcoholic Steatohepatitis Without Fibrosis Worsening. Gastroenterology 2016;150:1147-1159.e5
[22] ClinicalTrials.gov. Phase 3 Study to Evaluate the Efficacy and Safety of Elafibranor Versus Placebo in Patients With Nonalcoholic Steatohepatitis (NASH) (RESOLVE-IT). https://clinicaltrials.gov/ct2/show/NCT02704403
[23] Friedman SL, Ratziu V, Harrison SA, Abdelmalek MF, Aithal GP, Caballeria J, Francque S, Farrell G, Kowdley KV, Craxi A, Simon K, Fischer L, et al. A randomized, placebo-controlled trial of cenicriviroc for treatment of nonalcoholic steatohepatitis with fibrosis. Hepatology 2018;67:1754-1767
[24] ClinicalTrials.gov. AURORA: Phase 3 Study for the Efficacy and Safety of CVC for the Treatment of Liver Fibrosis in Adults With NASH; ahttps://clinicaltrials.gov/ct2/show/NCT03028740
[25] Loomba R, Lawitz E, Mantry PS, Jayakumar S, Caldwell SH, Arnold H, Diehl AM, Djedjos CS, Han L, Myers RP, Subramanian GM, McHutchison JG, et al. The ASK1 inhibitor selonsertib in patients with nonalcoholic steatohepatitis: A randomized, phase 2 trial. Hepatology 2018;67:549-559
[26] Harrison SA et al. Oral Abstracts (Abstracts 1–288). Hepatology 2019;70:Abstract 64
[27] Musso G, Cassader M, Rosina F, Gambino R. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia 2012;55:885-904























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.