
- DAZ.online
- DAZ / AZ
- DAZ 27/2020
- Totgesagte leben länger
Infektiologie
Totgesagte leben länger
Die Renaissance der Penicilline
Die Geschichte des Penicillins begann 1928 mit der Entdeckung durch Alexander Fleming [1]. Der Siegeszug des Antibiotikums begann aber erst Anfang der 1940er-Jahre, als die Massenproduktion der Substanz etabliert wurde [2]. Die Entdeckung des Penicillins war von so großer medizinischer Bedeutung, dass Alexander Fleming, Ernst Boris Chain und Howard Walter Florey* bereits 1945 mit dem Nobelpreis geehrt wurden [37]. Es folgte die Entwicklung zahlreicher Derivate der Leitsubstanz Benzylpenicillin mit verbesserten antimikrobiellen Eigenschaften oder oraler Applizierbarkeit [3]. Dem breiten Einsatz folgte die Ausbreitung von Resistenzen. Daher sind viele Penicilline inzwischen wieder vom Markt verschwunden. In den letzten Jahren konnte jedoch eine neue Entwicklung beobachtet werden, denn mit Pivmecillinam und Carbenicillin kamen zwei alte Penicilline zurück auf den deutschen Arzneimittelmarkt.
*In der Print-Ausgabe der DAZ war statt Howard Walter Florey leider der Name Norman Heatley genannt. Heatley ist zwar auch untrennbar mit dem Penicillin verbunden, hat aber nicht den Nobelpreis erhalten. Wir danken unseren aufmerksamen Lesern für den Hinweis und entschuldigen uns für den Fehler.
Wirkmechanismus
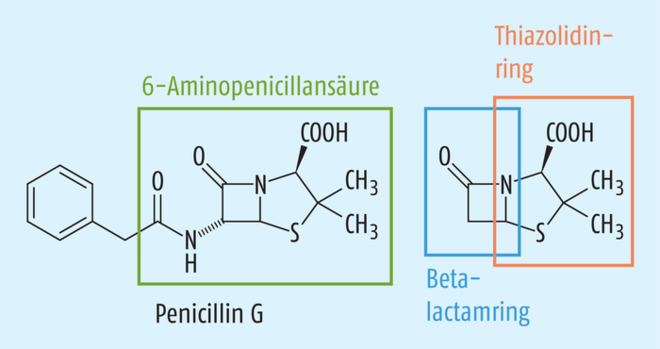
Auf proliferierende Bakterien wirken Penicilline abtötend, bei ruhenden Keimen zeigen sie nur eine wachstumshemmende Wirkung [4]. Alle Penicilline besitzen dieselbe Grundstruktur aus dem bicyclischen Peptid 6-Aminopenicillansäure (s. Abb. 1) [9]. Das Pharmakophor wird durch den Betalaktam-Ring gebildet, welcher an Penicillin-bindende Proteine (PBP) bindet. Der Thiazolidin-Ring imitiert dagegen das Substrat für die Penicillin-bindenden-Proteine [5].
Abb. 1: Grundstruktur der Penicilline. Die 6-Aminopenicillansäure-Grundstruktur (grün) in Benzylpenicillin ist links dargestellt. Das Pharmakophor bildet der β-Laktamring (blau), der Thiazolidinring (rot) imitiert das natürliche Substrat der Penicillin-bindenden Proteine.
Der Wirkmechanismus von Penicillinen beruht auf einer Hemmung der bakteriellen Zellwandsynthese [8]. Die bakterielle Zellwand besteht aus langen Peptidoglykan-Ketten, welche über kurze Peptidsequenzen quervernetzt sind [26]. Die Penicillin-bindenden Proteine als Zielstruktur von Penicillinen haben in der bakteriellen Zellwandsynthese eine duale Funktion [6]. Zum einen katalysieren sie die Verlängerung der Glykanstränge (Transglykosylierung) und zum anderen ihre Quervernetzung (Transpeptidation) [6]. Das begrenzte Wirkspektrum von Benzylpenicillin kann teilweise dadurch erklärt werden, dass es verschiedene Subtypen von Penicillin-bindenden Proteinen gibt [7]. Das in Enterokokken vorkommende Penicillin-bindende Protein 5 besitzt eine geringere Affinität für Penicillin [27]. Auch die Penicillin-Resistenz von Methicillin-resistentem Staphylococcus aureus (MRSA) beruht auf der Bildung des veränderten Penicillin-bindenden Proteins 2a [28].
Die verschiedenen Penicilline
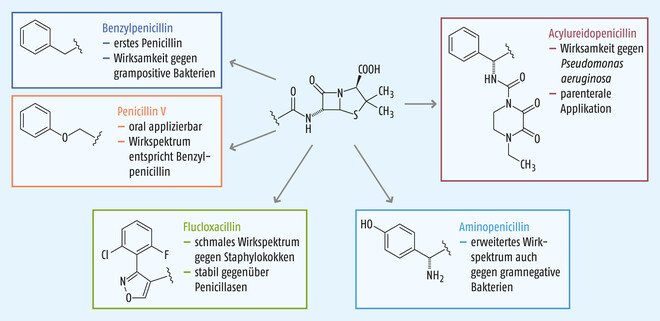
Das erste Penicillin, Benzylpenicillin (Penicillin G) ist gegen grampositive Kokken wie Streptokokken oder Pneumokokken, grampositive Stäbchen wie Clostridien, Spirochäten wie Treponema pallidum und gramnegative Kokken wie Meningokokken wirksam [29, 33]. Benzylpenicillin kann durch β-Laktamasen inaktiviert werden, weshalb es gegen Staphylokokken nur noch gelegentlich wirksam ist [33] (s. Abb. 2). Darüber hinaus ist Benzylpenicillin nicht säurestabil, was eine parenterale Applikation notwendig macht [29]. Durch das schmale Wirkspektrum sollte das Antibiotikum heute nur noch nach Erregernachweis eingesetzt werden [33]. Benzylpenicillin ist Mittel der Wahl bei Hirnhautentzündungen, wenn als Erreger Neisseria meningitidis nachgewiesen wurde [33]. Ebenso ist Benzylpenicillin bei schweren Infektionen wie Diphtherie, Tetanus, Milzbrand und Gasbrand indiziert [31]. Als Depotpräparat in Form eines Benzathin-Salzes wird Benzylpenicillin zur Behandlung von Syphilis und als Rezidivprophylaxe bei rheumatischem Fieber eingesetzt [32, 33].
Bereits Ende der 1950er-Jahre wurde das partialsynthetische Phenoxymethylpenicillin (Penicillin V) entwickelt [10, 30]. Penicillin V besitzt zwar das gleiche Wirkspektrum wie Benzylpenicillin, ist aber darüber hinaus säurestabil und kann oral appliziert werden [29]. Daher zählt Penicillin V zu den sogenannten Oralpenicillinen [32]. Penicillin V wird zur Behandlung von Atemwegsinfekten, ausgelöst durch Streptokokken, sowie zur Behandlung von Scharlach eingesetzt [31]. Weitere Indikationen sind Haut-, Zahn- und Kieferinfektionen sowie Endokarditis und Erysipel [32].
Eine weitere Klasse der Penicilline sind die partialsynthetischen Isoxazolylpenicilline wie Methicillin, Oxacillin und Flucloxacillin, welche auch als Staphylokokken-Penicilline bezeichnet werden [21]. Von den Vertretern dieser Gruppe ist nur noch Flucloxacillin in Deutschland im Handel. Flucloxacillin ist oral und parenteral applizierbar und kann nicht durch Penicillinasen abgebaut werden [20]. Das schmale Wirkspektrum beschränkt sich auf Staphylokokken, gegen Methicillin-resistenten Staphylococcus aureus wirkt es jedoch nicht [29]. Typische Indikationen sind Abszesse, Furunkel und Karbunkel [33].
Als besonders erfolgreich haben sich die Aminopenicilline wie Amoxicillin und Ampicillin erwiesen. Aminopenicilline sind säurestabil und können daher oral appliziert werden [29]. Das breitere antimikrobielle Wirkspektrum dieser Substanzen schließt auch gramnegative Bakterien wie E. coli, Salmonella ssp., Shigella ssp. und Proteus mirabilis ein [29]. Die Wirksamkeit wird dadurch erklärt, dass Aminopenicilline die Poren der äußeren Membran gramnegativer Bakterien durchdringen können [4]. Obwohl Ampicillin und Amoxicillin ein identisches Wirkspektrum besitzen, wird in der Praxis zum allergrößten Teil Amoxicillin verwendet, da Amoxicillin im Gegensatz zu Ampicillin besser resorbiert wird [5, 12]. Die Indikationen von Aminopenicillinen sind weit gefasst und beinhalten neben HNO-, Atemwegs-, Haut- und Weichteilinfektionen auch die Listeriose [32].
Acylureidopenicilline wie Mezlocillin und Piperacillin haben im Vergleich zu den Aminopenicillinen ein abermals erweitertes Wirkspektrum, sie sind aber nicht säurestabil was eine parenterale Applikation erforderlich macht [29]. Piperacillin zeichnet sich zusätzlich durch Aktivität gegen den Problemkeim Pseudomonas aeruginosa aus und wird bei schweren Infektionen eingesetzt [23]. Indikationen sind Sepsis, Endokarditis, Meningitis, Peritonitis, Pneumonie, gynäkologische Infektionen sowie Knochen- und Weichteilinfektionen [32]. Aufgrund der hohen Rate an β-Laktamase-Bildnern unter den Problemkeimen ist die alleinige Anwendung von Piperacillin eingeschränkt [33]. In der Praxis wird die Substanz daher oft mit dem β-Laktamase-Hemmer Tazobactam kombiniert [29].
Aktuelle Bedeutung
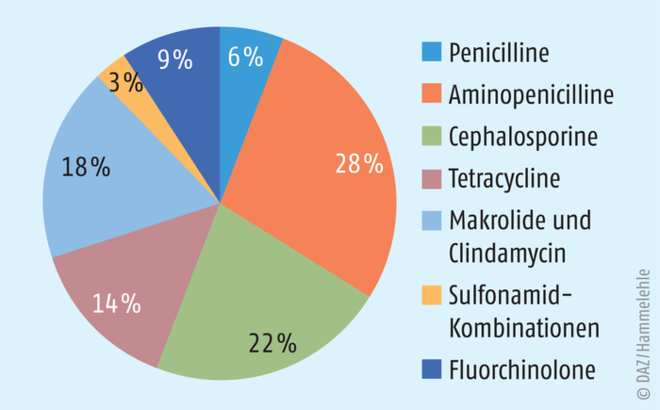
Welche Relevanz haben Penicilline in der heutigen Antibiotikatherapie? Im Hinblick auf multiresistente Keime sind die ESKAPE-Keime als Erreger schwer therapierbarer Krankenhausinfektionen von besonderer Bedeutung [17]. ESKAPE ist ein Akronym aus den Anfangsbuchstaben der folgenden einzelnen Bakterienarten: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa und Enterobacteriaceae. Hier ist hauptsächlich das partialsynthetische Piperacillin, in Kombination mit dem β-Laktamase-Hemmer Tazobactam, insbesondere bei Behandlung von Infektionen mit Pseudomonas aeruginosa von Bedeutung [18]. Betrachtet man jedoch die Verordnungszahlen aus dem Jahr 2018, so wird deutlich, dass Penicilline, vor allem Aminopenicilline, den größten Teil der Antibiotika-Verschreibungen ausmachen (s. Abb. 3) [12].
Abb. 3: Prozentuale Anteile der verordneten Tagesdosen von Antibiotika im Jahr 2018 [12]. Aminopenicilline ist die am häufigsten verschriebene Antibiotikagruppe. Bei den klassischen Penicillinen ist vor allem der Einsatz von Penicillin V, zur Behandlung von Atemwegsinfektionen, von Bedeutung.
Als Oralpenicillin ist Penicillin V bei der Behandlung bakterieller Atemwegsinfektionen bedeutsam [12]. Ein Grund hierfür ist, dass Penicillin-resistente Pneumokokken in Deutschland selten sind [33]. Im Gegensatz dazu zeigen die Verschreibungszahlen von Flucloxacillin, dass das Antibiotikum in der Praxis nur noch selten eingesetzt wird [12].
Wie erklärt sich die verbreitete Verschreibung von Aminopenicillinen? Der häufigste Grund für eine Antibiotikaverschreibung im ambulanten Bereich sind Atemwegsinfektionen [12]. Bei dieser Indikation sind (Amino-)Penicilline in Bezug auf Wirkung und Resistenzentwicklung anderen Antibiotika überlegen [12]. Vor allem Amoxicillin zeigt eine hohe Aktivität gegen Pneumokokken und ist Mittel der Wahl zur Behandlung ambulant erworbener Pneumonien [25]. Weitere Gründe für die verbreitete Verschreibung von Aminopenicillinen beruhen auf langjähriger Anwendungserfahrung, geringer Toxizität und niedrigen Tagestherapiekosten [12].
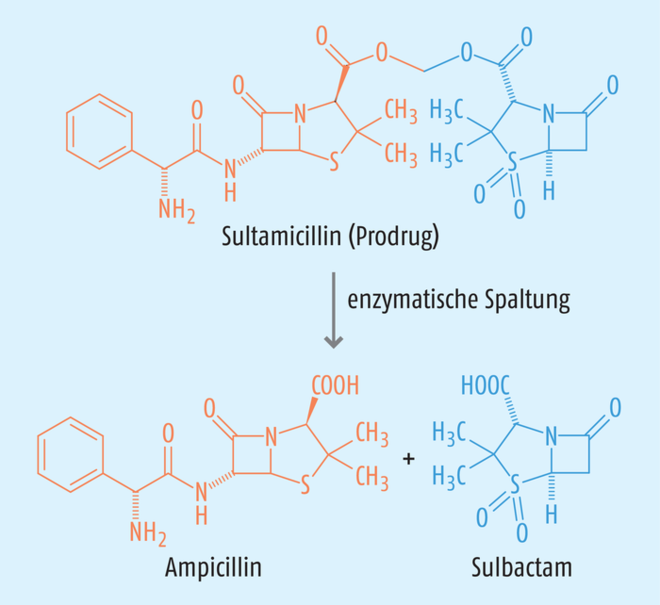
Die Verschreibungen von Kombinationspräparaten aus Amoxicillin und dem β-Laktamase-Hemmer Clavulansäure stiegen im Jahr 2018 um 15% [12]. Die Kombination aus Aminopenicillin und β-Laktamase-Hemmer erweitert das Wirkspektrum auf β-Laktamasebildner wie Moraxella ssp., Klebsiella ssp. und Staphylococcus aureus und ist erste Wahl zur Behandlung von Pneumonien mit komplizierter Vorerkrankung [12]. Neben der Kombination aus Amoxicillin und Clavulansäure ist Sultamicillin auf dem Markt. Hierbei handelt es sich um ein Prodrug, welches nach Resorption hydrolytisch in Ampicillin und Sulbactam gespalten wird (s. Abb. 4) [34].
Abb. 4: Enzymatische Aktivierung von Sultamicillin. Das inaktive Prodrug Sultamicillin wird nach Resorption von Esterasen in das Aminopenicillin Ampicillin und den β-Laktamase-Hemmer Sulbactam gespalten.
In der Praxis hat sich die Kombination aus β-Laktam-Antibiotikum und β-Laktamase-Hemmer bewährt. Weitere Beispiele sind die Kombinationen aus Piperacillin/Tazobactam, Ceftazidim/Avibactam oder die früher häufige Kombination aus Mezlocillin und Sulbactam. Es sollte aber nicht vergessen werden, dass Clavulansäure nur einen Teil der β-Laktamasen inhibieren kann [29]. Problematische β-Laktamasen wie Metallo-β-Laktamasen, Carbapenemasen oder Oxacillinasen werden nicht gehemmt [34]. Ein weiterer kritischer Punkt von Amoxicillin/Clavulansäure ist die Tablettengröße. Aufgrund der beträchtlichen Abmessungen bereitet sie oft Probleme beim Schlucken.
Resistenzen
Antibiotika müssen immer im Zusammenhang mit der Resistenzlage betrachtet werden. Wie steht es um Resistenzen gegen Penicilline? Der breiten Verwendung von Penicillin, folgte eine Ausbreitung der Resistenzen [21]. Bereits Ende der 1960er-Jahre waren 80% der Isolate von Staphylococcus aureus resistent gegen Penicillin [38]. MRSA stand lange Jahre synonym für multiresistente Problemkeime. Bei MRSA handelt es sich um einen Staphylococcus aureus, welcher gegen das Isoxazolylpenicillin Methicillin resistent ist [35]. Der Resistenzmechanismus beruht auf der Bildung eines veränderten Penicillin-bindenden Proteins (PBP2a), zu dem Penicilline nur eine geringe Affinität haben [24]. Erfreulicherweise ist der Anteil von MRSA bei den invasiven Isolaten in Deutschland im Verlauf der letzten Jahre von 11% auf 8% gefallen [18]. Gründe für die Eindämmung sind Maßnahmen zur Verhinderung der Ausbreitung des Keims, Infektionspräventionsmaßnahmen und der umsichtige Einsatz von Antibiotika [18].
Ebenso auf der Bildung veränderter Penicillin-bindender Proteine beruht die Penicillin-Resistenz von Streptococcus pneumoniae, einem häufigen Auslöser von Atemwegsinfekten [18, 36]. Die Resistenzlage von S. pneumoniae ist in Deutschland nicht bedrohlich. Im stationären Bereich sind nur 1,4%, im ambulanten Bereich nur 2,3% der Isolate resistent [40]. In Südeuropa sind Penicillin-Resistenzen gegen S. pneumoniae deutlich häufiger verbreitet [39].
Der zweite bedeutende Resistenzmechanismus gegen Penicilline beruht auf der Bildung von β-Laktamasen, dabei handelt es sich um Enzyme welche β-Laktam-Antibiotika inaktivieren können. Bereits 1940 wurden solche Enzyme nachgewiesen und mit Resistenzen assoziiert [22]. Es gibt eine Vielzahl von β-Laktamasen, die in verschiedene Klassen eingeteilt werden [34]. Die Gene für β-Laktamasen können häufig zwischen Bakterien weitergegeben werden und sind vor allem bei gramnegativen Keimen verbreitet [34].
Die Resistenzlage von gramnegativen Bakterien gegen Penicilline ist stark von der Bakterienart abhängig (s. Tab. 1) [40]. Diese aktuellen Daten des Robert Koch-Instituts zeigen, wie weit Resistenzen gegen Aminopenicilline und Piperacillin verbreitet sind. Es wird aber auch deutlich, welche Bedeutung den β-Laktamase-Hemmern bei der Überwindung von Resistenzen zukommt.
Resistenzen stationär (ambulant) [%] | ||||
|---|---|---|---|---|
Klebsiella pneumoniae | Acinetobacter baumannii | Pseudomonas aeruginosa | Escherichia coli | |
Piperacillin | 72,8 (84,4) | 66,8 (69,8) | 15,9 (9,3) | 46,1 (41,1) |
Piperacillin/Tazobactam | 12,1 (8,1) | 40,9 (47,8) | 11,9 (7,2) | 8,1 (5,7) |
Ampicillin | 100 (99,9) | 48,7 (42,3) | ||
Ampicillin/Sulbactam | 25,3 (19,4) | 43,8 (46,0) | 38,7 (32,7) | |
Im Kampf gegen multiresistente Bakterien werden große Hoffnungen in β-Laktamase-Hemmer gesetzt. Mit Avibactam, Relebactam und Vaborbactam wurden in den letzten Jahren gleich drei neuartige β-Laktamase-Hemmer zugelassen [41 – 43]. Diese β-Laktamase-Hemmer können, im Gegensatz zu den etablierten Substanzen wie Clavulansäure, Sulbactam und Tazobactam, zusätzliche β-Laktamasen, unter anderem Carbapenemasen und einige Oxacillinasen, inhibieren [44]. Da diese β-Laktamase-Hemmer selbst keine antimikrobielle Aktivität besitzen, werden sie mit etablierten β-Laktamantibiotika kombiniert (Meropenem/Vaborbactam, Imipenem/Cilastatin/Relebactam und Ceftazidim/Avibactam) [41 – 43]. Die Kombinationspartner sind zwar β-Laktam-Antibiotika aber keine Penicilline. Dass Penicilline in der Entwicklung von Antibiotika gegen multiresistente Problemkeime nachrangig sind, zeigt sich auch an den neuen β-Laktamen gegen Keime mit veränderten Penicillin-bindenden Proteinen. Ein Beispiel ist Ceftobiprol. Das Cephalosporin (ebenfalls ein β-Laktam-Antibiotikum) wirkt auch gegen Bakterien mit veränderten Penicillin-bindenden Proteinen, unter anderem PBP2a, PBP2b und PBP5 [45]. Das Potenzial der Penicilline liegt in der Kombinationstherapie. So werden Kombinationen aus Aminopenicillinen und Aminoglykosiden zur Primärtherapie bis zur Erregerisolation bei lebensbedrohlichen Infektionen, zur Verzögerung von Resistenzbildung und zur synergistischen Antibiotikatherapie eingesetzt [46].
Die Rückkehr der Penicilline
Die Anwendung von Breitspektrum-Antibiotika wird mit vermehrter Resistenzbildung assoziiert. Daher erleben die Schmalspektrum-Penicilline aktuell eine Renaissance. Mit Pivmecillinam und Temocillin sind zwei alte Penicilline wieder zurück auf dem deutschen Arzneimittelmarkt.
Mit der Änderung der S3-Leitlinie zur Behandlung von erwachsenen Patienten mit unkomplizierten Harnwegsinfektionen 2011 wurde Pivmecillinam Mittel der ersten Wahl [13]. Zu dieser Zeit war aber kein Pivmecillinam-Präparat mehr in Deutschland im Handel. Erst seit 2016 ist Pivmecillinam wieder auf dem deutschen Arzneimittelmarkt verfügbar [12]. Es handelt es sich um ein Prodrug, das durch unspezifische Esterasen im Magen-Darm-Bereich zur aktiven Substanz Mecillinam metabolisiert wird [13]. Das Antibiotikum besitzt ein schmales Wirkspektrum hauptsächlich gegen gramnegative Bakterien wie E. coli, Klebsiella ssp., Proteus ssp. und Enterobacter ssp. [13]. Diese Bakterien sind zugleich die häufigsten Auslöser von Harnwegsinfekten [14]. Erfreulicherweise sind die Resistenzraten von E. coli gegen Pivmecillinam niedrig und liegen unterhalb von 2% [15]. Pivmecillinam wird gut vertragen, in den letzten Jahren konnte ein deutlicher Anstieg an Verordnungen beobachtet werden [12, 13].
Mit Temocillin feierte 2019 ein weiteres Penicillin sein Comeback auf dem deutschen Arzneimittelmarkt. Temocillin ist ein Schmalspektrum-Antibiotikum, das Wirkspektrum beschränkt sich hauptsächlich auf gramnegative Enterobakterien wie E. coli,Salmonella ssp. und Klebsiella ssp. [56]. Gegen β-Laktamasen ist Temocillin vergleichsweise stabil, aufgrund der Säurelabilität muss das Antibiotikum jedoch parenteral appliziert werden [16, 56]. Temocillin ist zur Behandlung von komplizierten Harnwegsinfekten, Bakteriämien, Infektionen der unteren Atemwege und Wundinfektionen zugelassen, welche durch gramnegative Bakterien ausgelöst sind [16]. Da die Datenlage z. B. bei komplizierten Harnwegsinfektionen sehr gut ist, hat Temocillin in den britischen Leitlinien zur Behandlung von Infektionen mit multiresistenten gramnegativen Keimen einen festen Stellenwert [57]. Seit April 2020 gibt es europaweit einheitliche Vorgaben für die antimikrobielle Testung von Temocillin, was sicherlich zu einem breiteren Einsatz des Antibiotikums führen wird [58]. Es besteht Hoffnung, dass durch die Wiedereinführung von Schmalspektrum-Antibiotika wie Temocillin der Verbrauch an Reserveantibiotika wie Carbapenemen verringert werden kann [59]. Ob sich diese Hoffnung erfüllt, bleibt abzuwarten.
Penicillin-Allergie
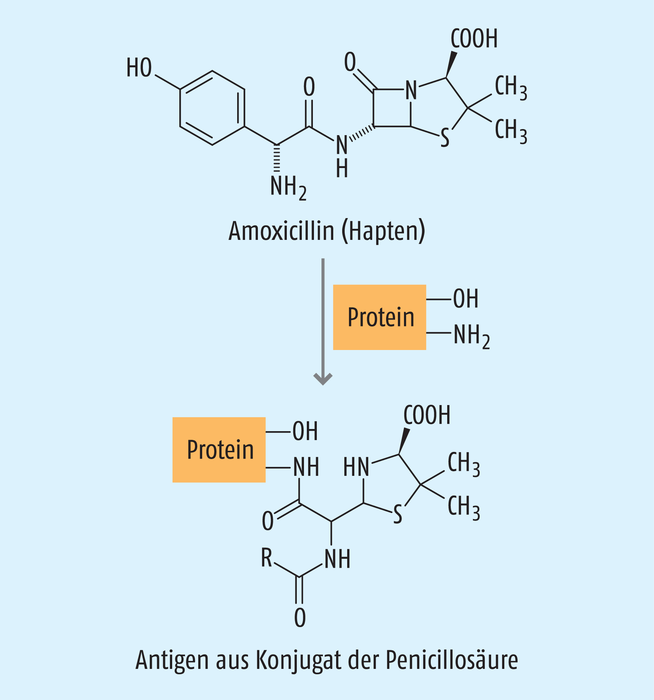
Allgemein sind Penicilline gut verträglich, dennoch sind allergische Reaktionen eine gefürchtete Nebenwirkung der Substanzen [33, 47]. Der Grund für eine Sensibilisierung liegt in der Struktur von Penicillinen, welche als Haptene an Aminogruppen von Proteinen binden können, das dadurch entstehende Konjugat bildet die Antigenstruktur (s. Abb. 5) [5]. Es gibt verschiedene Formen der Penicillin-Allergie. Die allergische Reaktion kann sich gegen alle β-Laktame, bestimmte Seitenketten z. B. Aminopenicilline oder gegen ein spezifisches Penicillin richten [49]. Auch die Manifestationen der allergischen Reaktionen sind vielfältig. Man unterscheidet zwischen Sofortreaktionen wie Urtikaria, Angioödem und Anaphylaxie sowie Spätreaktionen wie ein Exanthem oder das Steven-Johnson-Syndrom [50]. Bei den allergischen Reaktionen handelt es sich meistens um Hautreaktionen wie Urtikaria oder Exanthem [47]. Bei 1 bis 2% der Patienten tritt eine Überempfindlichkeit in Form eines Exanthems auf, bei 0,5 bis 1% ein Angioödem [33]. Amoxicillin zählt zu den häufigsten Arzneimitteln mit berichteten anaphylaktischen Reaktionen [51]. Das Risiko einer anaphylaktischen Reaktion ist aber sehr gering und liegt bei 0,015 bis 0,04% [52]. Eine Kreuzallergie zwischen β-Laktamen ist selten, wurde aber lange überschätzt [33]. Zwischen Penicillinen und Cephalosporinen tritt eine Kreuzallergie bei ca. 1% der Patienten auf. Selbst bei nachgewiesener Penicillin-Allergie tritt eine Kreuzreaktivität in nur ca. 2,5% der Fälle auf [53].
Abb. 5: Antigenbildung von Amoxicillin durch Reaktion mit einem Protein. Amoxicillin reagiert als Hapten mit einer freistehenden Aminogruppe eines Proteins. Das kovalent gebundene Konjugat bildet ein Antigen, auf das der Körper immunologisch reagieren kann.
Auf einen Blick
- Die Entdeckung der Penicilline war ein Meilenstein der modernen Medizin.
- Durch partialsynthetische Ansätze konnte das Wirkspektrum von Penicillinen erweitert und eine orale Applizierbarkeit erreicht werden.
- Aminopenicilline zählen auch heute noch zu den wichtigsten Antibiotikaklassen.
- β-Laktamasehemmer spielen bei der Überwindung von Penicillin-Resistenzen eine bedeutende Rolle.
- In den letzten Jahren konnte eine Rückkehr von Schmalspektrum-Penicillinen wie Pivmecillinam und Temocillin beobachtet werden.
- Das Risiko einer Penicillin-Allergie wird allgemein überschätzt.
Die genaue Prävalenz einer Penicillin-Allergie ist unbekannt [54]. Eine allergische Reaktion auf Penicilline muss aber von der häufigsten Nebenwirkung, einer pseudoallergischen Hautreaktion, abgegrenzt werden [33]. Obwohl „Penicillin-Allergie“ in Anamnesen häufig angegeben wird, kann nur bei ca. 10% dieser Patientengruppe eine Sensibilisierung nachgewiesen werden [19, 48]. Daraus folgt, dass der allergrößte Teil der angegebenen Penicillin-Allergien gar keine Allergien sind. Die Gründe für die Diskrepanz sind vielfältig. Oft wird ein Virusexanthem, welches bei einer Penicillin-Therapie auftreten kann, als allergische Reaktion fehlinterpretiert [55]. Zum anderen ist die Sensitivität der vorhandenen Testsysteme nicht optimal [50]. Diese fälschlich vermuteten Penicillin-Allergien führen häufig dazu, dass der Patient ein nebenwirkungsreicheres oder breiter wirksames Antibiotikum erhält und dadurch Schaden nimmt [11]. Wenn es gelingt, diese Fehlinformationen in Arztbriefen und Patientenakten zu reduzieren, werden die Verschreibungszahlen für Penicilline wieder steigen, denn „Totgesagte leben länger“. |
Literatur
[1] Fleming A. On antibacterial action of culture of penicillium, with special reference to their use in isolation of B. influenzae. Br J Exp Pathol 1929;10:226-236
[2] Parascandola J. The history of antibiotics: a symposium. American Institute of the history of Pharmacy No 5, 1980
[3] Wright AJ. The penicillins. Mayo Clin Proc 1999;74:290-307
[4] Freissmuth M. Antibakterielle Chemotherapie. In: Pharmakologie und Toxikologie. Springer Verlag, Berlin, Heidelberg 2016
[5] Steinhilber D, Schubert-Zsilavecz M, Roth H. Medizinische Chemie. 2. Auflage, Deutscher Apotheker Verlag, Stuttgart 2010
[6] Sauvage E, Kerff F, Terrak M, Ayala JA, Charlier P. The penicillin-binding proteins: structure and role in peptidoglycan biosynthesis. FEMS Microbiol Rev 2008;32:234-258
[7] Sharifzadeh S, Dempwolff F, Kearns DB, Carlson EE. Harnessing β-Lactam Antibiotics for Illumination of the Activity of Penicillin-Binding Proteins in Bacillus subtilis. ACS Chem Biol 2020, doi: 10.1021/acschembio.9b00977
[8] Blumberg PM, Strominger JL. Interaction of penicillin with the bacterial cell: penicillin-binding proteins and penicillin-sensitive enzymes. Bacteriol Rev 1974;38:291-335
[9] Hassan ME. Production, Immobilization and Industrial Uses of Penicillin G Acylase. Int J Curr Res 2016;8:11-22
[10] Ball AP, Gray JA, Murdoch JM. The Natural Penicillins – Benzylpenicillin (Penicillin G) and Phenoxymethylpenicillin (Penicillin V). In: Antibacterial Drugs Today. Springer Verlag, Dordrecht 1978
[11] Vaisman A, McCready J, Powis J. Clarifying a „Penicillin“ Allergy: A Teachable Moment. JAMA Intern Med 2017;177:269-270
[12] Kern WV. Antibiotika und antibakterielle Chemotherapie. In: Schwabe U, Paffrath D, Ludwig WD, Klauber J. Arzneiverordnungs-Report 2019. Springer-Verlag GmbH, Berlin
[13] Neubeck M et al. Pivmecillinam. Neue Arzneimittel 2019;(6):77-79
[14] Flores-Mireles AL, Walker JN, Caparon M, Hultgren SJ. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol 2015;13:269–284
[15] Kahlmeter G, Poulsen HO. Antimicrobial susceptibility of Escherichia coli from community-acquired urinary tract infections in Europe: the ECO·SENS study revisited. Int J Antimicrob Agents 2012;39:45-51
[16] Neubeck M et al. Temocillin. Neue Arzneimittel 2019;12:182-184
[17] Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, Rice LB, Scheld M, Spellberg B, Bartlett J. Bad Bugs, No Drugs: No ESKAPE! An Update from the Infectious Diseases Society of America, Clin Infect Dis 2009;48:1–12
[18] Surveillance of antimicrobial resistance in Europe 2018. European Centre for Disease Prevention and Control (ECDC), Stockholm 2019
[19] Salkind AR, Cuddy PG, Foxworth JW. The rational clinical examination. Is this patient allergic to penicillin? An evidence-based analysis of the likelihood of penicillin allergy. JAMA 2001;285:2498-2505
[20] Sutherland R. The nature of the insensitivity of gram-negative bacteria towards penicillins. J Gen Microbiol 1964;34:85-98
[21] Lobanovska M, Pilla G. Penicillinʼs Discovery and Antibiotic Resistance: Lessons for the Future? Yale J Biol Med 2017;90:135-145
[22] Abraham EP, Chain E. An enzyme from bacteria able to destroy penicillin. Rev Infect Dis 1988;10:677-678
[23] Preston SL, Drusano GL. Penicillins. Antimicrobe. E-Sun Technologies 2016
[24] Matsuhashi M, Song MD, Ishino F et al. Molecular cloning of the gene of a penicillin-binding protein supposed to cause high resistance to beta-lactam antibiotics in Staphylococcus aureus. J Bacteriol 1986;167:975–980
[25] Ewig S et al. Behandlung von erwachsenen Patienten mit ambulant erworbener Pneumonie und Prävention – Update 2016. S3-Leitlinie der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin, der Paul-Ehrlich-Gesellschaft für Chemotherapie 2016
[26] Vollmer W, Holtje JV. The architecture of the murein(peptidoglycan) in gram-negative bacteria: vertical scaffold orhorizontal layer(s)? J Bacteriol 2004;86:5978–5987
[27] Fontana R, Cerini R, Longoni P, Grossato A, Canepari P. Identification of a streptococcal penicillin-binding proteinthat reacts very slowly with penicillin. J Bacteriol 1983;155:1343–1350
[28] Hartman BJ, Tomasz A. Low-affinity penicillin-bindingprotein associated with beta-lactam resistance in Staphylococcus aureus. J Bacteriol 1984;158:513–516
[29] Geisslinger G, Menzel M, Gudermann T, Hinz. B. Ruth P. Mutschler – Arzneimittelwirkungen. 11. Auflage 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
[30] Greenwood D (2008) Antimicrobial Drugs: Chronicles of a Twentieth Century Medical Thriumph. Oxford University Press, Oxford
[31] Rote Liste 2020, Rote Liste Service GmbH, www.rote-liste.de
[32] Ruß A, Hoffmann C. Antiinfektiva XXS pocket. 3. Auflage 2014, Börm Bruckmeier Verlag GmbH, Grünwald.
[33] Kalkulierte parenterale Initialtherapie bakterieller Erkrankungen bei Erwachsenen. S2k-Leitlinie, Hrsg. Paul-Ehrlich-Gesellschaft für Chemotherapie e. V. (PEG), AWMF-Registernummer 082-006
[34] Witte W, Mielke M. β-Laktamasen mit breitem Wirkungsspektrum. Bundesgesundheitsbl 2003;46:881-890 [35] Jevons MP. „Celbenin“-resistant Staphylococci. Br Med J 1961;1:124-125
[36] Zerfaß I, Hakenbeck R, Denapaite D. An Important Site in PBP2x of Penicillin-Resistant Clinical Isolates of Streptococcus pneumoniae: Mutational Analysis of Thr338. Antimicrob Agents Chemother 2009;53:1107-1115
[37] The Nobel Prize in Physiology or Medicine. Nobelprize.org 1945, www.nobelprize.org/nobel_prizes/medicine/laureates/1945/
[38] Lowy FD. Antimicrobial resistance: the example of Staphylococcus aureus. J Clin Invest 2003;111:1265-1273
[39] Goossens H, Ferech M, Vander Stichele R, Elseviers M, Group EP. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet 2005;365:579-587
[40] ARS – Antibiotika-Resistenz-Surveillance. Informationen des Robert Koch-Instituts, https://ars.rki.de. Datenstand: 8. April 2020
[41] Vabomere® (Meropenem/Vaborbactam). European Medicines Agency, London 2018, EMA/657766/2018
[42] Recarbrio® (Imipenem/Cilastatin /Relebactam). European Medicines Agency, London 2019, EMA/680287/2019
[43] Zavicefta® (Ceftazidim/Avibactam). European Medicines Agency, London 2019, EMA/314117/2016.
[44] Aktas C, Kayacan C, Oncul O. In vitro activity of avibactam (NXL104) in combination with β-lactams against Gram-negative bacteria including OXA-48 β-lactamase-producing Klebsiella pneumoniae. Int J Antimicrob Agents 2012;39:86-89
[45] Syed YY. Ceftobiprole Medocaril: A review of ist use in patients with hospital – or community – acquired pneumoniae. Drugs 2014;74:1523-1542
[46] Frank U. Antibiotika am Krankenbett 2019 – 2020. 17. Auflage, Springer Verlag, Berlin 2019
[47] Castells M, Khan DA, Philips EJ. Penicillin Allergy. N Engl J Med 2020;381:2338–2351
[48] Trubiano JA, Adkinson MF, Philips EJ. Penicillin Allergy Is Not Necessarilly Foerever. JAMA 2017;318:2-3
[49] Sachs B, Al Masaoudi T, Merk HF, Erdmann S. Combined in vivo and in vitro approach for the characterization of penicillin-specific polyclonal lymphocyte reactivity: tolerance tests with safe penicillins instead of challenge with culprit drugs. Br J Dermatol 2004;151:809–816
[50] Sachs B, Grüger T, Pantke E. Penicillinallergie (1): Wenn die Vermutung nicht zutrifft. Dtsch Arztebl Supplement: Perspektiven der Pneumologie & Allergologie. 2018;115: 20
[51] Sachs B, Fischer-Barth W, Merk HF. Reporting rates for severe hypersensitivity reactions associated with prescription-only drugs in outpatient treatment in Germany. Pharmacoepidemiol Drug Saf 2015;24:1076–1084
[52] Macy E, Contreras R. Health care use and serious infection prevalence associated with penicillin „allergy“ in hospitalized patients: A cohort study. J Allergy Clin Immunol 2014;133:790–796
[53] Campagna JD, Bond MC, Schabelman E, Hayes BD. The use of cephalosporins in penicillin-allergic patients: a literature review. J Emerg Med 2012;42:612–620
[54] Solensky R. Hypersensivity reactions to beta-lactam antibiotics. Clin Rev Allerg Immunol 2003;24:201–209
[55] Keighley CL, Saunderson RB, Kok J, Dwyer DE. Viral exanthems. Curr Opin Infect Dis 2015;28:139–150
[56] Livermore DM, Tulkens PM. Temocillin revived. J Antimicrob Chemother 2009;63:243-245
[57] Hawkey PM, Warren RE, Livermore DM, McNulty CAM, Enoch DA, Otter JA, Wilson APR. Treatment of infections caused by multidrug-resistant Gram-negative bacteria: report of the British Society for Antimicrobial Chemotherapy/Healthcare Infection Society/British Infection Association Joint Working Party. J Antimicrob Chemother 2018;73(suppl_3):iii2-iii78
[58] Clinical breakpoints for temocillin. European Committee on Antimicrobial Susceptibility Testing, Addendum to EUCAST breakpoint tables vom 10. Januar 2020
[59] Mutters NT, Zimmermann S, Kaase M, Mischnik A. Activity of temocillin, mecillinam, ceftazidime and ceftazidime/avibactam against carbapenem-non-susceptible Enterobacteriaceae without carbapenemase production. Eur J Clin Microbiol Infect Dis 2015 ;34:2429–2437
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.