
- DAZ.online
- DAZ / AZ
- DAZ 22/2020
- Leichtes Spiel für SARS-...
Pandemie Spezial
Leichtes Spiel für SARS-CoV-2?
Einfluss von ACE-Hemmern und Sartanen auf das COVID-19-Risiko unter der Lupe
Die Ausbreitung des neuartigen Coronavirus SARS-CoV-2 stellt die Gesundheitssysteme vor große Herausforderungen. Weltweit sind bereits über 3,1 Millionen Infektionen mit SARS-CoV-2 bestätigt, in Deutschland sind ca. 160.000 Menschen an COVID-19 erkrankt und 6600 Menschen verstorben [1]. Infektionen mit SARS-CoV-2 zeigen sehr unterschiedliche Verlaufsformen von Symptomfreiheit, über milde Erkrankungen mit Fieber, Husten und Müdigkeit, aber auch Diarrhoe, bis hin zu Pneumonie und akutem Lungenversagen („acute respiratory distress syndrome“, ARDS) [2]. Viele Patienten zeigen einen Anstieg von Markern für kardiale Schädigung wie Kreatinkinase oder Troponin T, wie sie sonst bei akutem Myokardinfarkt beobachtet werden. Besonders bei Patienten mit schwerem Verlauf treten zudem kardiovaskuläre Komplikationen wie Herzinsuffizienz, Arrhythmien und disseminierte intravasale Gerinnung auf [3].
Zelluläre Aufnahme des SARS-CoV-2 über ACE2
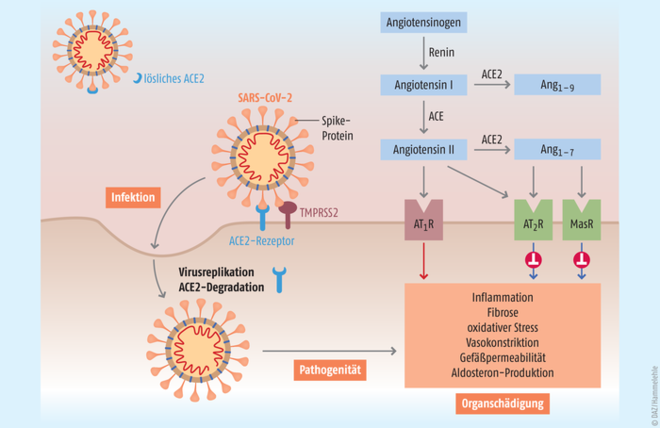
Die Infektion beginnt für gewöhnlich im oberen Respirationstrakt durch den Kontakt mit Virus-enthaltenden Aerosolen. SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) ist ein behülltes RNA-Virus. Über sogenannte spike-Proteine bindet SARS-CoV-2 an das membranständige Protein Angiotensin-konvertierendes Enzym 2 (ACE2) in der Wirtszelle und wird gemeinsam mit ACE2 internalisiert (Abb. 1). Vermittelt durch die transmembrane Serinprotease 2 (TMPRSS2) kommt es dabei zur Spaltung des spike-Proteins [4]. Ein ähnlicher Mechanismus wurde bereits für das verwandte SARS-Coronavirus nachgewiesen, das 2002/2003 die SARS-Epidemie auslöste [5]. Die Affinität von SARS-CoV-2 an ACE2 scheint jedoch stärker zu sein [6].
Abb. 1: ACE2 dient den SARS-CoV-2-Viren als Türöffner für den Eintritt in die Wirtszellen. Mit dem Start der Virusreplikation wird die ACE-2-Expression heruntergefahren. Damit werden auch die Schutzwirkungen von ACE2 reduziert, die über die Bildung von Angiotensin1-7 durch ACE2 vermittelt werden. Durch Einsatz von nicht membrangebundenem rekombinantem ACE2 sollen zum einen Viren vor dem Zelleintritt abgefangen werden, zum anderen die schützenden, durch ACE2 vermittelten Wirkungen verstärkt werden.
Bronchialepithelzellen und Epithelzellen der Mundhöhle weisen eine hohe Expression von ACE2 und TMPRSS2 auf und stellen damit wahrscheinlich die primäre Eintrittspforte für das Virus dar [7, 8]. Darüber hinaus konnte ACE2-Expression auch in vielen anderen Organen nachgewiesen werden, unter anderem in Ösophagus, Dünndarm, Leber, Niere, Blase und im Herz [9]. Dies könnte eine Infektion der entsprechenden Organe durch SARS-CoV-2 erlauben und die Ursache für Manifestationen von COVID-19 außerhalb der Lunge sein. Einzelzellanalysen des Herzens zeigen ACE2-Expression in Kardiomyozyten, Endothelzellen und Fibroblasten [10]. Bemerkenswerterweise wurden bereits Coronaviren in einer Myokardbiopsie eines Patienten mit kardiogenem Schock nachgewiesen [11].
Das Renin-Angiotensin-Aldosteron-System
ACE2 ist ein Teil des Renin-Angiotensin-Aldosteron-Systems (RAAS), das in der Pathophysiologie kardiovaskulärer Erkrankungen eine große Bedeutung hat (Abb. 1). Das Vorläuferpeptid Angiotensinogen wird in der Leber synthetisiert, sezerniert, und anschließend wird im Plasma durch Renin das Angiotensin I abgespalten. Angiotensin I wird dann vom klassischen Angiotensin-konvertierenden Enzym (ACE, Gensymbol ACE1) in Angiotensin II umgewandelt. Angiotensin II aktiviert Angiotensin-II-Typ-1(AT1)-Rezeptoren und wirkt so vasokonstriktiv, pro-inflammatorisch, pro-apoptotisch, pro-fibrotisch und pro-hypertroph im Herz-Kreislauf-System [12]. Über eine Aktivierung der Aldosteron-Produktion wird außerdem die Wasser- und Natrium-Retention gesteigert [13]. RAAS-Inhibitoren wie ACE-Hemmer und AT1-Antagonisten (Sartane) werden u. a. bei arterieller Hypertonie, koronarer Herzkrankheit und Herzinsuffizienz eingesetzt und gehören zu den am häufigsten verordneten Arzneimittelgruppen in Deutschland [14]. Alternativ kann Angiotensin I durch ACE2 zu Angiotensin(1-7) gespalten werden. Angiotensin(1-7) wirkt über den Angiotensin-II-Typ-2 (AT2)-Rezeptor und den Mas-Rezeptor natriuretisch, anti-fibrotisch, anti-proliferativ und anti-inflammatorisch und damit als funktioneller Antagonist zu den klassischen Wirkungen von Angiotensin II am AT1-Rezeptor [15]. Angiotensin(1-7) wirkt damit günstig auf die Koronargefäße und das Myokard und soll einen protektiven Einfluss bei Myokardinfarkt und Herzinsuffizienz haben [15].
Es gibt Hinweise darauf, dass die Effekte des RAAS, die im Herz-Kreislauf-System beobachtet wurden, auch bei der Pathophysiologie des akuten Lungenversagens (ARDS) eine Rolle spielen. Angiotensin II steigert in der Lunge die Vasokonstriktion und Gefäßpermeabilität, verstärkt auch hier Inflammation und Apoptose und führt zu vermehrter Ablagerung von Extrazellulärmatrix und zur Proliferation von Fibroblasten [16, 17]. Umgekehrt konnte eine protektive Rolle von ACE2 im experimentellen Modell bei ARDS gezeigt werden [17, 18]. Rekombinantes humanes ACE2 konnte in einer Phase-II-Studie bei Patienten mit ARDS die Plasmaspiegel von Angiotensin(1-7) erhöhen [19]. Daten zur klinischen Wirksamkeit von ACE2 liegen noch nicht vor. Bemerkenswerterweise zeigte sich in einer kleinen Analyse von zwölf Patienten mit COVID-19 ein Anstieg von Angiotensin II im Plasma im Vergleich zu gesunden Probanden [20]. Daten aus größeren Studien liegen bisher jedoch nicht vor. Die Wirksamkeit von rekombinantem ACE2 bei COVID-19 wird zur Zeit in weiteren klinischen Studien untersucht (clinicaltrials.gov NCT04335136).
RAAS bei COVID-19: ein zweischneidiges Schwert?
Registerstudien zeigen übereinstimmend, dass ältere Patienten und Patienten mit kardiovaskulären Begleiterkrankungen ein erhöhtes Risiko für eine Infektion und einen schweren Verlauf von COVID-19 haben [3, 21]. Angesichts der Interaktion von SARS-CoV-2 mit ACE2 wird diskutiert, ob dies mit der Aktivität des RAAS oder einer Behandlung mit ACE-Hemmern bzw. AT1-Antagonisten assoziiert ist. In der Folge entstand große Unsicherheit bei Patienten und Behandlern, ob eine bestehende Therapie mit RAAS-Inhibitoren bei COVID-19-Patienten unterbrochen werden sollte.
Pathophysiologisch ist es dabei von großer Bedeutung, die verschiedenen Phasen der Erkrankung zu betrachten. Einerseits könnte eine erhöhte Expression von ACE2 auf der Zellmembran zu einer vermehrten Aufnahme von SARS-CoV-2 in die Zelle führen und so eine Infektion erleichtern. Andererseits könnte eine erhöhte Aktivität von ACE2 die schädlichen Effekte von Angiotensin II reduzieren und so die Erkrankung bei COVID-19 mildern [22, 23].
Expression von ACE2
Es liegen wenige verlässliche Daten zur Expression von ACE2 bei verschiedenen Patientengruppen vor. Tierexperimentelle Daten zeigen eine höhere Expression von ACE2 in Herz und Nieren von männlichen gegenüber weiblichen Tieren [24]. Darüber hinaus wurde eine mit dem Alter abnehmende Expression von ACE2 in der Lunge von männlichen Tieren beschrieben [25]. Einzelzellsequenzierungen von humanen Herzbiopsien deuten darauf hin, dass die Expression von ACE2 in Kardiomyozyten und Endothelzellen bei Aortenklappenstenose oder Herzinsuffizenz gesteigert ist [10]. Der Einfluss von demografischen Faktoren, Vorerkrankungen und SARS-CoV-2-Infektion auf die Aktivität von ACE2 wird derzeit in klinischen Studien untersucht (DRKS00021206 und [26]).
Regulation von ACE2 unter RAAS-Inhibitoren
RAAS-Inhibitoren können direkt oder indirekt die Expression von RAAS-Komponenten beeinflussen. Der Einfluss von ACE-Hemmern und AT1-Antagonisten auf die Expression von ACE2 wurde mehrfach in Tiermodellen und in kleiner Fallzahl an Patienten untersucht. In Tiermodellen wurde die Expression von ACE2-mRNA oder -Protein in Herz- oder Nierengewebe untersucht. In einzelnen Studien wurde dabei eine Hochregulation von ACE2 nach Gabe von AT1-Antagonisten beobachtet, insgesamt sind die Befunde jedoch inkonsistent und erlauben keine eindeutige Aussage [27, 28]. Die Gabe von ACE-Hemmern hatte keinen nachweisbaren Einfluss auf die ACE2-Expression [27, 28]. Im Plasma oder Urin von Patienten konnte hingegen kein signifikanter Zusammenhang zwischen der Einnahme von ACE-Hemmern bzw. AT1-Antagonisten und der Expression oder Aktivität von ACE2 gefunden werden [27, 28].
Datenlage zu RAAS-Inhibitoren
Der Einfluss von kardiovaskulären Begleiterkrankungen und der Behandlung mit RAAS-Inhibitoren auf COVID-19 wurde in mehreren großen Registerstudien untersucht. In einer Fall-Kontroll-Studie in der von SARS-CoV-2 besonders betroffenen italienischen Region Lombardei wurden 6272 Patienten mit COVID-19 mit 30.759 nach Alter und Geschlecht passenden Versicherten verglichen [29]. Übereinstimmend mit früheren Studien zeigte sich, dass Patienten mit COVID-19 eine höhere Rate von Begleiterkrankungen wie koronare Herzkrankheit, Herzinsuffizienz oder Niereninsuffizienz aufwiesen. Die Behandlung mit ACE-Hemmern oder AT1-Antagonisten war jedoch mit keinem erhöhten Risiko für eine SARS-CoV-2-Infektion verbunden [29]. Darüber hinaus hatte die Behandlung mit RAAS-Inhibitoren keinen Einfluss auf die Häufigkeit eines schweren oder tödlichen COVID-19-Verlaufs [29]. Zu einem vergleichbaren Ergebnis kommt eine Registerstudie mit 12.594 Patienten, die an der Universität von New York (USA) mit vermuteter SARS-CoV-2-Infektion untersucht wurden. Hier zeigte sich in einer Propensity-Analyse kein häufigeres Auftreten von SARS-CoV-2 unter Behandlung mit ACE-Hemmern oder AT1-Antagonisten [30].
In einer retrospektiven Multicenter-Analyse von 8910 Patienten aus Asien, Europa und Nordamerika, die aufgrund von COVID-19 in stationärer Behandlung waren, betrug die Gesamtmortalität 5,8% [31]. Dabei zeigte sich, dass Alter über 65 Jahre, Herz-Kreislauf-Erkrankungen, chronisch-obstruktive Lungenerkrankung und Tabakrauchen jeweils mit einem bis zu vierfach erhöhten Mortalitätsrisiko verbunden waren [31]. Es ergab sich kein Hinweis auf eine erhöhte Mortalität durch Einnahme von RAAS-Inhibitoren [31]. Dies bestätigt die Ergebnisse früherer Registerstudien mit 1128 Patienten aus Wuhan (China) und 5700 Patienten aus New York (USA), die ebenfalls keine erhöhte Mortalität bei COVID-19 durch die Behandlung mit RAAS-Inhibitoren feststellen konnten [32, 33]. Interessanterweise wurde in zwei dieser Register sogar eine Reduktion der Mortalität bei Behandlung mit ACE-Hemmern, nicht jedoch mit AT1-Antagonisten, beobachtet [31, 32]. Die Ursache für diesen Befund ist unklar. Es kann spekuliert werden, dass andere Effekte neben einer verminderten Angiotensin-II-Wirkung beteiligt sind. Dies wird derzeit in zahlreichen prospektiv-randomisierten Studien untersucht (clinicaltrials.gov NCT04353596, NCT04364893, NCT04338009, NCT04330300, NCT04329195, NCT04322786, NCT04351581, NCT04335786, NCT04345406, NCT04355936).
Fazit
Die vorliegenden klinischen Studien ergeben keinen Hinweis auf ein erhöhtes Risiko für eine Infektion oder einen schweren Verlauf von COVID-19 unter Therapie mit ACE-Hemmern oder AT1-Antagonisten. Dementsprechend empfehlen die kardiologischen Fachgesellschaften derzeit übereinstimmend, die Therapie mit RAAS-Hemmern den Leitlinien entsprechend unverändert fortzuführen [34, 35]. Es muss jedoch betont werden, dass alle vorliegenden klinischen Daten auf retrospektiven Analysen aus Registern beruhen. Ob die Fortführung oder Initiierung einer Behandlung mit ACE-Hemmern oder AT1-Antagonisten einen Einfluss auf den Verlauf von COVID-19 hat, müssen die laufenden klinischen Studien klären. |
Literatur
[1] Weltgesundheitsorganisation. WHO Situation report. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200503-covid-19-sitrep-104.pdf. Accessed 04.05.2020
[2] Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 395: 497-506 (2020)
[3] Guzik TJ, Mohiddin SA, Dimarco A, Patel V, Savvatis K, Marelli-Berg FM, Madhur MS, Tomaszewski M, Maffia P, D‘Acquisto F, Nicklin SA, Marian AJ, Nosalski R, Murray EC, Guzik B, Berry C, Touyz RM, Kreutz R, Wang DW, Bhella D, Sagliocco O, Crea F, Thomson EC, McInnes IB. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc. Res. (2020), https://doi.org/10.1093/cvr/cvaa106
[4] Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Muller MA, Drosten C, Pohlmann S. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 181: 271-280 (2020)
[5] Wan Y, Shang J, Graham R, Baric RS, Li F. Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade-Long Structural Studies of SARS Coronavirus. J Virol. 94: e00127-20 (2020)
[6] Wang Q, Zhang Y, Wu L, Niu S, Song C, Zhang Z, Lu G, Qiao C, Hu Y, Yuen KY, Zhou H, Yan J, Qi J. Structural and functional basis of SARS-CoV-2 entry by using human ACE2. Cell 181:894-904 (2020)
[7] Lukassen S, Chua RL, Trefzer T, Kahn NC, Schneider MA, Muley T, Winter H, Meister M, Veith C, Boots AW, Hennig BP, Kreuter M, Conrad C, Eils R. SARS-CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. EMBO J. 39:e105114 (2020)
[8] Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, Li T, Chen Q. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int. J. Oral. Sci. 12: 8 (2020)
[9] Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front. Med. 14: 185-192 (2020)
[10] Nicin L, Abplanalp WT, Mellentin H, Kattih B, Tombor L, John D, Schmitto JD, Heineke J, Emrich F, Arsalan M, Holubec T, Walther T, Zeiher AM, Dimmeler S. Cell type-specific expression of the putative SARS-CoV-2 receptor ACE2 in human hearts. Eur. Heart J. 41: 1804-1806 (2020)
[11] Tavazzi G, Pellegrini C, Maurelli M, Belliato M, Sciutti F, Bottazzi A, Sepe PA, Resasco T, Camporotondo R, Bruno R, Baldanti F, Paolucci S, Pelenghi S, Iotti GA, Mojoli F, Arbustini E. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur. J. Heart Fail. (2020), doi:10.1002/ejhf.1828
[12] Forrester SJ, Booz GW, Sigmund CD, Coffman TM, Kawai T, Rizzo V, Scalia R, Eguchi S. Angiotensin II signal transduction: An update on mechanisms of physiology and pathophysiology. Physiol. Rev. 98: 1627-1738 (2018)
[13] Lother A, Moser M, Bode C, Feldman RD, Hein L. Mineralocorticoids in the heart and vasculature: new insights for old hormones. Annu. Rev. Pharmacol. Toxicol. 55: 289-312 (2015)
[14] Schwabe U, Paffrath D, Ludwig W-D, Klauber J. Arzneiverordnungsreport. Springer, Berlin (2019)
[15] Santos RAS, Sampaio WO, Alzamora AC, Motta-Santos D, Alenina N, Bader M, Campagnole-Santos MJ. The ACE2/Angiotensin-(1-7)/MAS axis of the renin-angiotensin system: Focus on angiotensin-(1-7). Physiol. Rev. 98: 505-553 (2018)
[16] Zhang H, Baker A. Recombinant human ACE2: acing out angiotensin II in ARDS therapy. Crit. Care 21: 305 (2017)
[17] Sriram K, Insel PA. A hypothesis for pathobiology and treatment of COVID-19: the centrality of ACE1/ACE2 imbalance. Br. J. Pharmacol. (2020) doi:10.1111/bph.15082
[18] Kaparianos A, Argyropoulou E. Local renin-angiotensin II systems, angiotensin-converting enzyme and its homologue ACE2: their potential role in the pathogenesis of chronic obstructive pulmonary diseases, pulmonary hypertension and acute respiratory distress syndrome. Curr Med Chem 18: 3506-3515 (2011)
[19] Khan A, Benthin C, Zeno B, Albertson TE, Boyd J, Christie JD, Hall R, Poirier G, Ronco JJ, Tidswell M, Hardes K, Powley WM, Wright TJ, Siederer SK, Fairman DA, Lipson DA, Bayliffe AI, Lazaar AL. A pilot clinical trial of recombinant human angiotensin-converting enzyme 2 in acute respiratory distress syndrome. Crit. Care 21: 234 (2017)
[20] Liu Y, Yang Y, Zhang C, Huang F, Wang F, Yuan J, Wang Z, Li J, Feng C, Zhang Z, Wang L, Peng L, Chen L, Qin Y, Zhao D, Tan S, Yin L, Xu J, Zhou C, Jiang C, Liu L. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci. China Life Sci. 63: 364-374 (2020)
[21] Li B, Yang J, Zhao F, Zhi L, Wang X, Liu L, Bi Z, Zhao Y. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin. Res. Cardiol. 109: 531-538 (2020)
[22] Sommerstein R, Kochen MM, Messerli FH, Grani C. Coronavirus disease 2019 (COVID-19): Do angiotensin-converting enzyme inhibitors/angiotensin receptor blockers have a biphasic effect? J. Am. Heart Assoc. 9: e016509 (2020)
[23] AlGhatrif M, Cingolani O, Lakatta EG. The dilemma of coronavirus disease 2019, aging, and cardiovascular disease: Insights from cardiovascular aging science. JAMA Cardiol. (2020) doi:10.1001/jamacardio.2020.1329
[24] Chappell MC, Marshall AC, Alzayadneh EM, Shaltout HA, Diz DI. Update on the Angiotensin converting enzyme 2-Angiotensin (1-7)-MAS receptor axis: fetal programing, sex differences, and intracellular pathways. Front. Endocrinol. (Lausanne) 4: 201 (2014)
[25] Xie X, Chen J, Wang X, Zhang F, Liu Y. Age- and gender-related difference of ACE2 expression in rat lung. Life Sci. 78: 2166-2171 (2006)
[26] Wild PS, Dimmeler S, Eschenhagen T. An epidemiological study exploring a possible impact of treatment with ACE inhibitors or angiotensin receptor blockers on ACE2 plasma concentrations. J Mol Cell Cardiol. 141: 108-109 (2020)
[27] Sriram K, Insel PA. Risks of ACE inhibitor and ARB usage in COVID-19: evaluating the evidence. Clin. Pharmacol. Ther. (2020) doi:10.1002/cpt.1863
[28] Kreutz R, Algharably EAE, Azizi M, Dobrowolski P, Guzik T, Januszewicz A, Persu A, Prejbisz A, Riemer TG, Wang JG, Burnier M. Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc. Res. (2020) doi:10.1093/cvr/cvaa097
[29] Mancia G, Rea F, Ludergnani M, Apolone G, Corrao G. Renin-angiotensin-aldosterone system blockers and the risk of Covid-19. N. Engl. J. Med. (2020) doi:10.1056/NEJMoa2006923
[30] Reynolds HR, Adhikari S, Pulgarin C, Troxel AB, Iturrate E, Johnson SB, Hausvater A, Newman JD, Berger JS, Bangalore S, Katz SD, Fishman GI, Kunichoff D, Chen Y, Ogedegbe G, Hochman JS. Renin-angiotensin-aldosterone system inhibitors and risk of Covid-19. N. Engl. J. Med. (2020) doi:10.1056/NEJMoa2008975
[31] Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN. Cardiovascular disease, drug therapy, and mortality in Covid-19. N. Engl. J. Med. (2020) doi:10.1056/NEJMoa2007621
[32] Zhang P, Zhu L, Cai J, Lei F, Qin JJ, Xie J, Liu YM, Zhao YC, Huang X, Lin L, Xia M, Chen MM, Cheng X, Zhang X, Guo D, Peng Y, Ji YX, Chen J, She ZG, Wang Y, Xu Q, Tan R, Wang H, Lin J, Luo P, Fu S, Cai H, Ye P, Xiao B, Mao W, Liu L, Yan Y, Liu M, Chen M, Zhang XJ, Wang X, Touyz RM, Xia J, Zhang BH, Yuan Y, Rohit L, Liu PP, Li H. Association of inpatient use of angiotensin converting enzyme inhibitors and angiotensin II receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. Circ. Res. (2020) doi:10.1161/CIRCRESAHA.120.317134
[33] Richardson S, Hirsch JS, Narasimhan M, Crawford JM, McGinn T, Davidson KW, Barnaby DP, Becker LB, Chelico JD, Cohen SL, Cookingham J, Coppa K, Diefenbach MA, Dominello AJ, Duer-Hefele J, Falzon L, Gitlin J, Hajizadeh N, Harvin TG, Hirschwerk DA, Kim EJ, Kozel ZM, Marrast LM, Mogavero JN, Osorio GA, Qiu M, Zanos TP. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York city area. JAMA e206775 (2020)
[34] ESC Position statement of the ESC Council on Hypertension on ACE-inhibitors and angiotensin receptor blockers. https://www.escardio.org/Councils/Council-on-Hypertension-(CHT)/News/position-statement-of-the-esc-council-on-hypertension-on-ace-inhibitors-and-ang. Accessed 05.05.2020
[35] Bozkurt B, Kovacs R, Harrington B. Joint HFSA/ACC/AHA statement addresses concerns re: using RAAS antagonists in COVID-19. J. Card. Fail. 26: 370 (2020)
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.