
- DAZ.online
- DAZ / AZ
- DAZ 15/2020
- Favipiravir gegen COVID-...
Pandemie Spezial
Favipiravir gegen COVID-19?
Individueller Heilversuch wäre in Deutschland möglich
Zum gegenwärtigen Zeitpunkt ist Favipiravir in Deutschland nicht zugelassen. Seine Anwendung bei Patienten mit COVID-19 wäre nur als individueller Heilversuch möglich. Laut Bundesgesundheitsministerium sollte der Einsatz daher „vorrangig bei schweren Verlaufsformen erwogen und patientenindividuell unter sorgfältiger Abwägung des Nutzen-Risiko-Verhältnisses erfolgen“. Entwickelt wurde Favipiravir von Toyama Chemical Co., Ltd, einer Tochterfirma der Fujifilm Holdings. In Japan ist der Wirkstoff unter dem Handelsnamen Avigan® seit 2014 zur Behandlung von Infektionen durch Influenza-Viren zugelassen, die auf andere antivirale Wirkstoffe nicht ansprechen. Während der Ebola-Epidemie in Afrika kam Favipiravir zwischen 2014 und 2016 auch außerhalb dieser Indikation zum Einsatz. Basis dafür war eine Stellungnahme der WHO, nach der es ethisch vertretbar sei, bestimmte Substanzen, die im Tierversuch bereits erfolgreich gegen Ebola-bedingte Erkrankungen getestet worden waren, auch ohne Zulassung bei Patienten mit Ebolafieber einzusetzen.
Jetzt auch Phase-III-Studien mit Favipiravir
In der Folgezeit wurde Favipiravir, allein oder in Kombination mit anderen Wirkstoffen, in klinischen Studien hauptsächlich bei Ebolafieber sowie bei unkomplizierten Influenza-Infektionen geprüft. Das Studienregister clinicaltrials.gov listet derzeit (Stand 6. April 2020) 13 abgeschlossene oder noch laufende Studien auf. Diese Anzahl kann sich praktisch stündlich ändern, da zurzeit ein regelrechter Boom der Forschungsaktivitäten auf dem Gebiet COVID-19 zu verzeichnen ist. Für eine Zulassung von Favipiravir als Arzneimittel gegen die neue Erkrankung sind jedoch Phase III-Studien erforderlich. Eine solche wurde beispielsweise gerade in Japan aufgelegt. Der japanische Zulassungsinhaber prüft darin „seinen“ Influenza-Wirkstoff bei Patienten mit COVID-19.
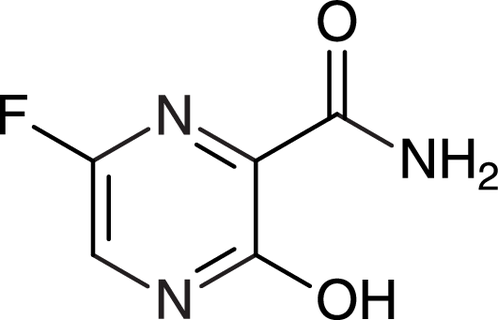
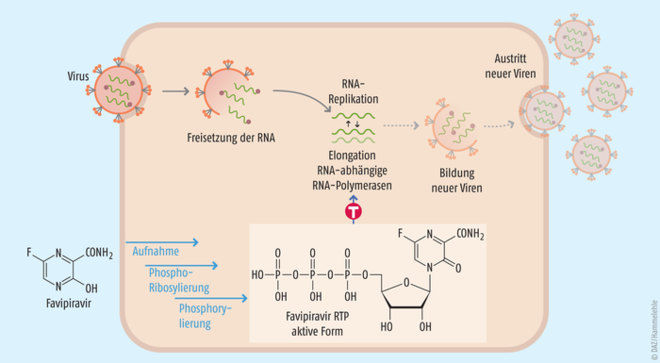
Abb. 2: Das Prodrug Favipiravir wird nach der Aufnahme in die Wirtszelle ribosyliert und phosphoryliert. Das aktive Favipiravir-ribofuranosyl-5‘-triphosphat (F-RTP) ist ein Purin-Nukleosidanalogon. Daher basiert seine Wirkung auf einer kompetitiven Substrathemmung der viralen RNA-abhängigen RNA-Polymerase. In Studien mit Influenza A H1N1-Viren fand man zudem nach Anwendung von Favipiravir letal verlaufene Mutationen im Virus-Genom.
Favipiravir mit Kombinationspartnern
Seit Mitte Februar ist Avigan®, zunächst auf fünf Jahre befristet, auch in China gegen Influenza zugelassen. Außerdem hat ein chinesisches Pharmaunternehmen eine Genehmigung zur Durchführung klinischer Studien zur Behandlung von COVID-19-Patienten mit Favipiravir erhalten. Interessant ist z. B. eine neu aufgelegte dreiarmige klinische Studie, die an einer Pekinger Klinik durchgeführt wird. Darin soll Favipiravir an Patienten mit COVID-19 als Monotherapie und in Kombination mit dem IL-6-Antikörper Tocilizumab geprüft werden. In einem dritten Arm wird Tocilizumab, das bereits seit 2009 zur Behandlung der rheumatoiden Arthritis zugelassen ist (RoActemra®), als Monotherapie getestet. Der Hintergrund dafür ist, dass Tocilizumab sowohl an lösliche als auch an membrangebundene IL-6-Rezeptoren bindet und dadurch die Aktivität dieses proinflammatorischen Zytokins reduziert. In der Lunge könnten infolge der auf diese Weise gedämpften Immunreaktionen Schäden an Lungenbläschen verhindert werden. Favipiravir wird in dieser Studie über maximal sieben Tage oral verabreicht. Am ersten Behandlungstag erhalten die Teilnehmer zweimal täglich 1600 mg Favipiravir, an den Folgetagen zweimal täglich 600 mg. Primärer Endpunkt ist die Heilung innerhalb von drei Monaten. An einer weiteren Klinik in der chinesischen Hauptstadt wird Favipiravir an 150 Patienten mit einer SARS-CoV-2-bedingten Pneumomie in Kombination mit Chloroquin gegen eine Monotherapie sowie gegen Placebo geprüft. Zu den primären Endpunkten zählt hier die Verringerung bzw. das Verschwinden der respiratorischen Symptome. Mit dem Abschluss dieser beiden Studien rechnen die Initiatoren bereits im Mai bzw. im Juni dieses Jahres.
Zentrale Beschaffung potenzieller COVID-19-Therapeutika
Das Bundesministerium für Gesundheit hatte kürzlich mitgeteilt, dass neben den in Japan zugelassenen Arzneimitteln Avigan® (Favipiravir) und Foipan® (Camostat) auch Chloroquin-haltige Arzneimittel sowie das HIV-Therapeutikum Kaletra® (Lopinavir, Ritonavir) zentral beschafft werden sollen. Sobald sie verfügbar sind, werde die Bundeswehr kostenfrei deren gleichmäßige Verteilung an ausgewählte Apotheken von Universitätskliniken sowie an Apotheken der STAKOB(Ständiger Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger)-Behandlungszentren übernehmen. Zu den zu beliefernden Klinikapotheken zählen z. B. die des Uniklinikums Hamburg-Eppendorf (UKE), des Robert Bosch Krankenhauses in Stuttgart und des Klinikums St. Georg gGmbH in Leipzig. Die gesetzliche Grundlage dafür ist § 79 Absatz 5 des Arzneimittelgesetzes (AMG), wonach bei einem Versorgungsmangel mit zugelassenen Arzneimitteln nicht zugelassene, aber potenziell wirksame Arzneimittel in Deutschland in den Verkehr gebracht werden dürfen.
Einsatz in der Schwangerschaft nicht möglich
Ein Vorteil ist, dass von Favipiravir trotz der bislang nur geringen therapeutischen Bedeutung viele Eigenschaften bekannt sind. Neben pharmakokinetischen Parametern zählen dazu auch einige Kontraindikationen, Neben- und Wechselwirkungen. So erhöhte beispielsweise bei gesunden Probanden eine gleichzeitige Gabe mit Paracetamol die Blutspiegel des Analgetikums etwa um 20%. Schwangeren und Stillenden darf Favipiravir nicht verabreicht werden, da in Tierstudien Missbildungen und embryonale Todesfälle beobachtet worden waren. Männer, die mit Favipiravir behandelt werden, müssen bei sexueller Aktivität Kondome verwenden, da der Wirkstoff in die Spermienflüssigkeit ausgeschieden wird. Geschlechtsverkehr mit schwangeren Frauen ist während der Behandlung verboten. Außerdem wurden als Nebenwirkung von Favipiravir dosisabhängig asymptomatische Erhöhungen der Serum-Harnsäurespiegel beobachtet. Daher sollte Favipiravir bei Hyperurikämie oder Gicht mit Vorsicht angewendet werden. Weitere mögliche Nebenwirkungen sind Durchfall, Anstieg der Transaminasen oder ungewöhnlich niedrige Neutrophilenzahlen. |
Literatur
Blasius H. Avigan aus Japan: So steht es um die Forschung zu COVID-19. DAZ.online, Meldung vom 6. April 2020, www.deutsche-apotheker-zeitung.de/news/artikel/2020/04/06/laeuft-ein-nischenprodukt-zu-voller-form-auf/chapter:2
BMG: Zentrale Beschaffung von Arzneimitteln zur Therapie schwerwiegender Verläufe COVID-19 infizierter Patienten und Verteilung an Apotheken durch die Bundeswehr, AMK-Mitteilung vom 24. März 2020. DAZ 2020;13:102
Clinical Trial of Favipiravir Tablets Combine With Chloroquine Phosphate in the Treatment of Novel Coronavirus Pneumonia. ClinicalTrials.gov Identifier: NCT04319900 www.clinicaltrials.gov, Abruf am 3. April 2020
Ethical considerations for use of unregistered interventions for Ebola viral disease Report of an advisory panel to WHO. https://apps.who.int/iris/bitstream/handle/10665/130997/WHO_HIS_KER_GHE_14.1_eng.pdf;jsessionid=FCA28FBCCED35B829807C4F0858F5D92?sequence=1, Abruf am 3. April 2020
Favipiravir Combined With Tocilizumab in the Treatment of Corona Virus Disease 2019, ClinicalTrials.gov Identifier: NCT04310228, www.clinicaltrials.gov, Abruf am 3. April 2020
Fujifilm commences Phase III trial of Avigan for Covid-19. Meldung vom 1. April 2020, www.clinicaltrialsarena.com/news/fujifilm-avigan-covid-19-trial-japan/, Abruf am 3. April 2020
Furuta Y et al. T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections. Antiviral Research 2009;82(3):95-102
Furuta Y et al. Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase. Proc Jpn Acad 2017;B(93)7:449-463, DOI: 10.2183/pjab.93.027
Hayden FG, Shindo N. Influenza virus polymerase inhibitors in clinical development. Curr Opin Infect Dis 2019;32:176–186, DOI:10.1097/QCO.0000000000000532
Smither SJ et al. Post-exposure efficacy of oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model. In: Antiviral Research 2014;104(4):153–155





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.