
- DAZ.online
- DAZ / AZ
- DAZ 11/2020
- Warum wir sind, wie wir ...
Mikrobiom
Warum wir sind, wie wir sind
Was wir über unsere bakteriellen Mitbewohner wissen
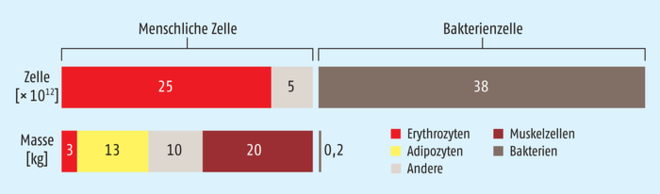
Abb. 1: Verteilung der Zellzahl und Masseanteil für verschiedene Zelltypen in einem 70 kg schweren „Standard“-Mann. Zusätzlich zu den Zellmassen kommt noch der Anteil der extrazellulären Matrix dazu, der bei weiteren ca. 24 kg liegt. Die Bakterienzellen liefern gerade einmal 200 g zur Gesamtmasse.
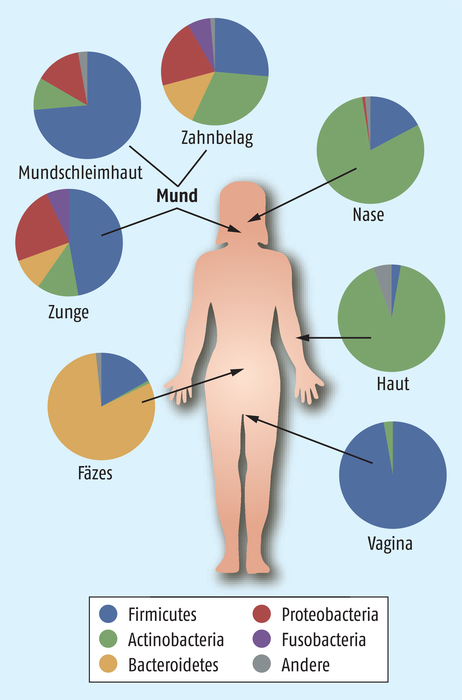
Dass wir zusammen mit Mikroorganismen leben, ist eine uralte Entwicklung. Nicht zuletzt geht schließlich die Entstehung aller eukaryontischer Zellen darauf zurück, dass prokaryontische Zellen als Endosymbionten aufgenommen wurden und seither als Mitochondrien und Chloroplasten ihre Dienste leisten. Aber es geht eben noch weiter: Jedes Lebewesen, egal ob Fisch, Insekt, Reptil oder Säugetier ist mit Mikroben besiedelt, so wie generell jeder Lebensraum voll mit Mikroorganismen ist. Sehen konnte man die Zellen erstmals, als der niederländische Wissenschaftler Antoni van Leeuwenhoek im 17. Jahrhundert ein erstes einfaches Mikroskop entwickelt hatte und damit den menschlichen Zahnbelag analysierte. Ähnlich wie die Zusammenarbeit zwischen Mitochondrium und eukaryontischer Wirtszelle im Laufe der Evolution arbeitsteilig optimiert wurde, haben sich die Bakterien, Archaeen, Pilze und Viren an ihren Wirtsorganismus und hier auch an die unterschiedlichen Regionen angepasst. So finden wir im Zahnbelag und in der Mundhöhle andere Bakterien als im Magen, im Darm oder auf der Haut (Abb. 2). An all diesen Stellen üben die Mikroorganismen spezielle schützende und metabolische Funktionen aus und sorgen dafür, dass sich andere, eventuell pathogene Keime dort nicht ansiedeln können.
Abb. 2: Durchschnittliche Verteilung der fünf häufigsten Bakteriengruppen nach Whole-Shotgun-Sequenzierung der Mikrobiota-Proben.
Die Gesamtheit aller Mikroorganismen, die in und auf uns leben, wird eigentlich als „Mikrobiota“ bezeichnet. Häufig wird synonym dazu der Begriff „Mikrobiom“ verwendet, obwohl diese Bezeichnung streng genommen für die Gesamtheit der genetischen Information dieser Zellen steht. Wie viele Bakterien letztlich unsere Mikrobiota ausmacht, dazu variieren die Angaben in der Literatur: Häufig ist zu finden, dass die Mikroorganismen zehn Mal mehr als unsere Körperzellen sind. Zum Teil taucht sogar das Verhältnis 100 : 1 auf. Neuere Kalkulationen gehen eher davon aus, dass sich die Anzahl der Bakterienzellen ungefähr die Waage hält mit der Zahl unserer Körperzellen (Abb. 1, Tab. 1). Der Masseanteil ist natürlich deutlich unterschiedlich: Nur ca. 200 g Mikroorganismen befinden sich in einem durchschnittlichen 70-kg-Menschen. Bezüglich der Anzahl der Gene sind die Bakterien uns jedoch deutlich überlegen. Während wir nur auf ca. 23.000 Gene kommen, werden die gesamten mikrobiellen Gene auf 2.000.000 geschätzt. Das sind alles große Zahlen, die mit einer gewissen Unsicherheit zu betrachten sind. Ganz sicher ist allerdings, dass die vielen Mikroorganismen einen erheblichen Einfluss auf ihren Wirtsorganismus ausüben.
Person | Körper-gewicht [kg] | Alter [Jahre] | Blutvolumen [l] | Erythro-zytenzahl [1012/l] | Colon-Inhalt [g] | Bakterienkonzentration [1011/g Nassgewicht] | Anzahl Human-zellen [1012] | Anzahl Bakterienzellen [1012] | B : H |
|---|---|---|---|---|---|---|---|---|---|
Standard-Mann | 70 | 20 bis 30 | 4,9 | 5,0 | 420 | 0,92 | 30 | 38 | 1,3 |
Standard-Frau | 63 | k. A. | 3,9 | 4,5 | 480 | 0,92 | 21 | 44 | 2,2 |
Säugling | 4,4 | 4 Wochen | 0,4 | 3,8 | 48 | 0,92 | 1,9 | 4,4 | 2,3 |
Kleinkind | 9,6 | 1 | 0,8 | 4,5 | 80 | 0,92 | 4 | 7 | 1,7 |
Älterer | 70 | 66 | 3,8 | 4,8 | 420 | 0,92 | 22 | 38 | 1,8 |
übergewichtig | 140 | k. A. | 6,7 | 5,0 | 610 | 0,92 | 40 | 56 | 1,4 |
Die Mikrobiota-Forschung
2007 wurde an den National Institutes of Health in den USA das Human Microbiome Project (HMP) ins Leben gerufen, das in Analogie zum Humanen Genom-Projekt einen möglichst umfassenden Katalog aller unserer Mitbewohner aufstellen sollte. Parallel dazu starteten andernorts ähnliche, große Initiativen wie beispielsweise das Metagenomics of the Human Intestinal Tract (MetaHIT) Konsortium der Europäischen Union, die Canadian Microbiome Initiative oder auch das Japanese Human Metagenome Consortium. Zusätzlich taten sich verschiedene Forschergruppen zu Projekten wie METACARDIS, MyNewGut oder INDIGO zusammen, die Zusammenhänge zwischen Darm-Mikrobiota und speziellen Krankheitsbildern wie kardiometabolische Erkrankungen, Störungen des endokrinen und Nervensystems oder Morbus Basedow aufklären wollen. Immense Mengen an Fördergelder sind in den letzten Jahren in diese Projekte geflossen. Unmengen an Daten wurden gesammelt und stehen zur weiteren Analyse zur Verfügung. Dank moderner molekularbiologischer Methoden ist es mittlerweile möglich, aus geringsten Zellmengen und aus komplex zusammengesetzten Populationen DNA zu isolieren, die entweder direkt oder nach Amplifikation üblicherweise des Gens für die 16S-rRNA sequenziert wird. Diese sogenannte Metagenomik wird ergänzt durch andere Omik-Analysen, wobei vor allem das Metabolom der Bakterien interessant ist, also das, was die Mikroorganismen an verschiedenen Stoffwechselprodukten liefern und dem Wirtsorganismus anbieten. Auch in diesem Ansatz werden die mehr oder weniger kleinen Moleküle einfach aus Blut- und Stuhlproben über massenspektrometrische Analysen untersucht, ohne sie direkt speziellen Mikroorganismen zuzuordnen. Die erhaltenen Ergebnisse lassen sich gegen die in großen Datenbanken, z. B. des Human Microbiome Projects, hinterlegten Sequenzen und Substanzen abgleichen. Der große Vorteil der Methode ist zweifellos, dass nicht erst einzelne Bakterien aus Stuhlproben isoliert und kultiviert werden müssen, bevor sie für eine DNA- oder Metaboliten-Analyse genutzt werden können. Gerade bei bestimmten Bakterien aus dem Darm ist eine Kultivierung der eventuell strikt anaerob lebenden Organismen mitunter nicht einfach. Der Nachteil ist allerdings, dass das Ergebnis der Metagenomik- und Metabolomik-Analyse nur so gut sein kann, wie es die Datenbank hergibt, mit der die erhaltenen Sequenzen und Messwerte abgeglichen werden. Ist dort ein bestimmtes Bakterium (noch) nicht hinterlegt, kann es bei einem Vergleich auch nicht gefunden werden.
Welche Auswirkungen eine bestimmte Zusammensetzung der Darm-Mikrobiota auf den Wirtsorganismus haben kann, wird sehr eindrucksvoll an Studien mit Nagetieren gezeigt. Mäuse lassen sich zunächst keimfrei und gänzlich ohne Darm-Mikrobiota züchten und anschließend mit bestimmten Bakterienpopulationen beimpfen. Inwieweit die an Mäusen mit einem anderen Verdauungssystem und einer anderen Ernährungsweise gefundenen Ergebnisse allerdings tatsächlich auf den Menschen übertragbar sind, muss hinterfragt werden. Allerdings geben sie natürlich klare Hinweise auf die generelle Bedeutung der Mikrobiota für den Gesamtorganismus.
Entwicklung der Darm-Mikrobiota
Bereits Ende des 19. Jahrhunderts hatte der Kinderarzt Theodor Escherich postuliert, dass der Darm von Neugeborenen keimfrei sei. Diese Meinung ist nach wie vor weit verbreitet. Mittlerweile mehren sich aber die Hinweise, dass bereits in Utero ein erster Kontakt mit Bakterien zustande kommt und über das Fruchtwasser die erste Besiedelung des Darms bevorzugt mit Lactobacillus, Staphylococcus und Enterobacteriaceae erfolgt. Bei Mekonium-Proben von Neugeborenen zeigten sich interindividuelle Unterschiede in der Mikrobiota.
Bei der Geburt kommt es zur nächsten, wichtigen Begegnung mit Mikroorganismen. Erfolgt die Entbindung vaginal, trifft das Neugeborene auf die Vaginal-Mikrobiota (z. B. Lactobacillus, Prevotella oder Sneathia). Demgegenüber lernt ein per Kaiserschnitt geborenes Baby zunächst Bakterien der Haut und des Operationssaals (z. B. Staphylococcus, Corynebacterium oder Propionibacterium) kennen. Diese Art Schädigung kann wieder teilweise normalisiert werden, wenn das Neugeborene nach dem Kaiserschnitt mit Vaginalflüssigkeit in Kontakt gebracht wird. Trotzdem scheint es für die Diversität der Mikrobiota und für die Etablierung des angeborenen Immunsystems insgesamt wesentlich besser zu sein, auf natürlichem Weg das Licht der Welt zu erblicken: Mit einer Kaiserschnittgeburt besteht wohl ein erhöhtes Risiko, an Asthma, Fettleibigkeit, Zöliakie oder Diabetes mellitus Typ 1 zu erkranken. Bei der Zusammensetzung der Mikrobiota ist auffällig, dass sich nach vaginaler Entbindung wesentlich mehr Bifidobacterium-, Bacteroides- und Lactobacillus-Arten im Darm der Neugeborenen ansiedeln, während sich bei Kindern nach Kaiserschnittgeburt eher Clostridien und nicht klassifizierte Enterobakterien breitmachen können.
Wie sich die Darm-Mikrobiota weiterentwickelt, hängt von verschiedenen Faktoren ab. Vor allem davon, ob die Mutter stillt und ob sie in der Zeit kurz vor oder nach der Geburt Antibiotika oder aber Probiotika eingenommen hat. Ursprünglich hatte man auch von der Muttermilch angenommen, dass sie steril sei. Mittlerweile kann man davon ausgehen, dass ein Baby, das im Schnitt pro Tag 800 ml Milch trinkt, zwischen 1 × 105 und 1 × 107 Bakterien vor allem der Gattungen Lactobacillus, Staphylococcus, Enterococcus, und Bifidobacterium zu sich nimmt. Anscheinend werden diese Bakterien zum Teil über dendritische Zellen und Makrophagen der Mutter aus ihrem Darm in die Milchdrüse transportiert. Für die Ansiedelung und Ernährung der „richtigen“ Bifidobakterien und Lactobacillen enthält die Muttermilch spezielle Oligosaccharide. „Falsche“ Bakterien werden hingegen durch Antikörper der Mutter bekämpft.
Die Diversität der sich entwickelnden Darm-Mikrobiota wird weiter erhöht, wenn das Kind in einem Haushalt mit mehreren Geschwistern und Haustieren aufwächst, in dem nicht jeder Fleck direkt mit einem bakteriziden Desinfektionsmittel entfernt wird. Aber auch genetische Faktoren des Wirts und natürlich die Ernährung spielen eine wichtige Rolle für die Etablierung der Bakterienpopulation. Im Alter von zwei bis drei Jahren besitzt das Kind eine Darm-Mikrobiota, die es ohne wesentliche Veränderungen bis ins Erwachsenenalter behält, außer es wird massiv eingegriffen, wie z. B. mit einer Antibiotika-Therapie oder mit einer wesentlichen Änderung der Ernährungsweise. Hunderte bis tausende verschiedene Bakterien-Spezies finden sich im Darm eines Erwachsenen, allerdings verschlechtert sich die Diversität im Alter. Innerhalb des Darms nimmt die Menge an Bakterien vom Jejunum mit ca. 103-5 Kolonie-bildenden Einheiten/g (cfu/g) über das distale Ileum mit 107-8 cfu/g bis ca. 1011-12 cfu/g im aufsteigenden Colon zu.
Vor allem dominieren die Gruppen der Bacteroidetes und Firmicutes in der Mikrobiota, aber auch Actinobacteria und Proteobacteria kommen in signifikanten Mengen vor (Tab. 2). Anhand der Zusammensetzung der Bakteriengruppen, lassen sich sogenannte Enterotypen unterscheiden:
- Bacteroides-Stämme stehen für den Enterotyp 1,
- Prevotella-Arten dominieren beim Enterotyp 2 und
- die Gattung Ruminococcus repräsentiert den Enterotyp 3.
Bakteriengruppe | Gattungen | Eigenschaften |
|---|---|---|
Firmicutes | Clostridium | baut Resteiweiße ab |
Lactobacillus | sorgt für Epithelerneuerung und -integrität | |
Ruminococcus | setzt Cellulasen frei | |
Eubacterium | produziert Butyrat | |
Faecalibacterium | produziert Butyrat | |
Roseburia | produziert Butyrat | |
Bacteroidetes | Bacteroides | baut Ballaststoffe ab, produziert Propionat |
Prevotella | baut Ballaststoffe ab, produziert Propionat | |
Xylanibacter | baut Ballaststoffe ab, produziert Propionat | |
Actinobacteria | Bifidobacterium | Hauptproduzent von Folat |
Proteobacteria | Escherichia | produziert über gemischte Säuregärung Essigsäure, Milchsäure und Bernsteinsäure |
Desulfovibrio | kann durch anaerobe Atmung Sulfat reduzieren | |
Verrucomicrobia | Akkermansia | baut Mucus ab |
Richtig unterscheiden lassen sich eigentlich nur die Enterotypen 1 und 2. Mittlerweile geht man auch eher von graduellen Zusammensetzungen aus. Beeinflusst wird die Bildung der Enterotypen durch die Art der Ernährung: Bei einer nicht-westlichen und faserreichen Diät werden besonders die Prevotella-Arten gefordert, die sehr viel besser Pflanzenmaterial verdauen können als tierische Fette und Proteine. Ernährt sich der Mensch jedoch überwiegend von Protein und gesättigten Fetten, fühlen sich die Bacteroides besonders wohl. Der Enterotyp 1 zeichnet sich auch dadurch aus, dass Saccharose ein wesentlicher Energielieferant ist, weshalb damit ein erhöhtes Adipositasrisiko assoziiert ist. Eine grobe Einschätzung, zu welchem Enterotyp die eigene Darm-Mikrobiota gehört, lässt sich über die Stuhlkonsistenz machen: Bacteroides werden eher mit einer längeren Transitzeit und einem härteren Stuhl in Verbindung gebracht, während Prevotella-Arten häufiger nach kürzeren Transitzeiten in weicherem Stuhl zu finden sind.
Aufgaben der Darmbakterien
Unsere Darm-Mikrobiota spielt eine wichtige Rolle bei der Aufrechterhaltung der Schleimhautbarriere und beim Schutz vor Pathogenen. In der Symbiose mit dem Wirtsorganismus stellen sie verschiedene Nährstoffe wie z. B. Vitamine bereit oder helfen bei der Aufarbeitung komplexer Polysaccharide, die wir selbst nicht verdauen können. Bacteroides produzieren vor allem die Vitamine C, B2, B5 und H, während in der Gattung Prevotella die Produzenten von Vitamin B1 und Folsäure überwiegen. Allerdings sind Prevotella-Arten auch dafür bekannt, dass sie den Mucus im Darm abbauen können, weshalb sie mit der Entstehung eines Morbus Crohn in Verbindung gebracht werden.
Abhängig von der Ernährung und der Zusammensetzung der Darm-Mikrobiota werden unterschiedliche Substanzen gebildet, die sich im Blutkreislauf des Wirtsorganismus wiederfinden. Durch die Vielzahl an Genen, die von der Darm-Mikrobiota bereitgestellt wird, stehen eine Vielfalt an Enzymen und Stoffwechselwegen zur Verfügung, die ganz unterschiedliche Produkte herstellen. Vor allem der Aminosäure- und der Lipidmetabolismus sowie Xenobiotika sind von der Art der Nahrungszufuhr und von den beteiligten Bakterien abhängig. Aus Polysacchariden entstehen dabei wichtige Metabolite, wie die kurzkettigen Fettsäuren (short chain fatty acids, SCFA) Propionat, Butyrat und Acetat. Während Acetat von den meisten Anaerobiern im Darm hergestellt wird, sind Bacteroidetes für die Produktion von Propionat und die Firmicutes für Butyrat zuständig. Butyrat ist bekannt für seine antiinflammatorischen sowie antikanzerogenen Eigenschaften. Außerdem dient es als wesentliche Energiequelle für Darm-Epithelzellen und sorgt für dichte Tight Junctions zwischen den Epithelzellen sowie für eine ausgewogene Mucin-Synthese, wodurch die Barrierefunktion des Darms zusätzlich verstärkt wird. In der Leber fördern Butyrat und auch Acetat die Lipogenese, während Propionat die Gluconeogenese aktiviert. Sowohl Propionat als auch Butyrat wirken als Histondeacetylase-Inhibitoren, die über diese Funktion die Expression verschiedener Gene modulieren. Propionat wirkt zudem auf die β-Zellfunktion und verringert das Frust-Essverhalten. Andere wichtige Metabolite, die durch die Wirkung der Darm-Mikrobiota entstehen, sind beispielsweise Gallensäure-Derivate, Aminosäure-Derivate oder Cholin-Metabolite sowie je nach Nahrungsbestandteile noch weitere spezielle Abbauprodukte. Insgesamt scheint sich eine Ernährungsweise mit stark prozessierten Fertigmahlzeiten und weniger frisch zubereiteten pflanzenbasierten Nahrungsmitteln eher negativ auf die Darm-Mikrobiota auszuwirken.
Die Wirkungen, die Darm-Mikrobiota und ihre Metaboliten auf ihren Wirtsorganismus haben, sind vielfältig und komplex. Seit Langem ist bekannt, dass unsere Bakterien an der Reifung des Immunsystems und an der Etablierung von Autoimmunerkrankungen beteiligt sind. Darüber hinaus scheinen die Bakterien auch Infektionskrankheiten, Lebererkrankungen, Tumorerkrankungen, ein metabolisches Syndrom, Atemwegserkrankungen und psychische Störungen zu beeinflussen.
Dysbiose in der Darm-Mikrobiota
Verringert sich die Vielfalt der Mikrobiota, verschiebt sich das Gleichgewicht zwischen den verschiedenen Bakteriengruppen oder verändert sich das Expressionsmuster des Mikrobioms, hat das verschiedene Folgen für den Wirtsorganismus. Erste Hinweise sind oftmals Veränderungen der Stuhlkonsistenz. Zusätzlich kann die Barrierefunktion der Darmwand nachlassen, was eventuell zu einer Dysregulation des Immunsystems führt. Bei einigen Krankheitsbildern wurden bereits Korrelationen mit einer Dysbiose identifiziert (Tab. 3). Beispielsweise sieht man bei Fettleibigkeit ein erhöhtes Verhältnis von Firmicutes: Bacteroidetes und eine verringerte Vielfalt an Darmbakterien.
Organ | Einflüsse durch die Darm-Mikrobiota | mit einer Dysbiose/mikrobiellen Metaboliten assoziierte Krankheit |
|---|---|---|
Fettgewebe | Adipozytenvolumen Thermogenese braunes Fettgewebe Entzündung | Fettleibigkeit/Insulin-Resistenz Insulin-Resistenz |
Leber | Gallensäuremetabolismus Lipogenese Energieverbrauch | nicht-alkoholische Fettleber (NAFLD)/nicht-alkoholische Steatohepatitis (NASH) |
Pankreas | Insulin-Sekretion | Diabetes mellitus Typ 2 |
ganzer Körper | Körperwachstum | Unterernährung |
kardiovaskuläres System | Schlaganfall Atherosklerose Thrombose | |
Gehirn | Verhalten Serotonin-Metabolismus intestinale Gluconeogenese Blut-Hirn-Schranke Appetit-Regulation | Autismus-Spektrum-Störung Stressantwort metabolisches Syndrom |
Lunge | Gen-Expression | allergisches Asthma |
Derzeit lernen wir immer noch sehr viel über die Zusammenhänge zwischen der Mikrobiota und unserer Gesundheit. Die zweite Phase des Human Microbiome Project (HMP), die 2014 begann, beschäftigte sich weniger mit der Katalogisierung der verschiedenen Bakterienarten, als vielmehr mit dem Zusammenspiel von Bakterien und Wirtsorganismus in einem ganzheitlichen Ansatz – der Mensch als Holobiont. Drei Konstellationen wurden dabei besonders betrachtet: Schwangerschaft und Frühgeburt im Zusammenspiel mit der Vaginal-Mikrobiota, entzündliche Darmerkrankungen bzw. Prädiabetes in der Korrelation mit der Darm-Mikrobiota. In Literaturdatenbanken mehren sich weitere Forschungsarbeiten, die verschiedene Erkrankungen im Kontext mit der Besiedelung durch Mikroorganismen untersuchen.
Nach wie vor ist noch nicht abschließend geklärt, was bei dem gleichzeitigen Auftreten bestimmter Mikroorganismen mit einer Krankheit die Ursache und was der Effekt ist. Aber je mehr Daten gesammelt werden, desto näher kommen wir insgesamt dem Ziel, dass eine gezielte Beeinflussung der Mikrobiota zur Therapie bestimmter Krankheitsbilder möglich wird. Erste Erfolge wurden mit dem fäkalen Mikrobiota-Transfer bei wiederkehrenden Clostridioides-difficile-Infektionen sowie in einzelnen Fällen bei chronisch entzündlichen Darmerkrankungen erzielt. Allerdings ist nach wie vor nicht bekannt, wie sich eine gesunde Mikrobiota zusammensetzt.
Spätestens seit durch eine Stuhltransplantation auch Antibiotika-resistente, so genannte ESBL-produzierende Escherichia-coli-Zellen übertragen wurden, die bei zwei Patienten zu einer Bakteriämie und bei einem zum Tod geführt haben, sind sehr strikte Vorgaben für einen Stuhlspender einzuhalten und umfangreiche Voruntersuchungen durchzuführen.
Wir wissen derzeit, dass unsere Mikrobiota einen großen Einfluss auf uns hat. Noch sind aber nicht alle Zusammenhänge geklärt, wie die Bakterien auf der Haut mit denen im Mund-Rachen-Raum oder denen im Darm zusammenwirken und den Menschen mit seinen spezifischen Genprodukten genau beeinflussen. Insofern ist es vielleicht für den ein oder anderen ganz spannend, sich bei einem der Anbieter im Internet die eigene Darm-Mikrobiota analysieren zu lassen. Aber was das Ergebnis letztlich bedeutet und welche Konsequenzen folgen, wenn man über eine Änderung der Ernährung diese Mikrobiota beeinflusst, lässt sich im Moment noch nicht vorhersagen. |
Literatur
Chanyi RM, Craven L, Harvey B, Reid G, Silverman MJ,Burton JP. Faecal microbiota transplantation: Where did it start? What have studies taught us? Where is it going? SAGE Open Med 2017;5:1-6
Costea PI, Hildebrand F, Arumugam M et al. Enterotypes in the landscape of gut microbial community composition. Nat Microbiol 2018;3:8-16
DeFilipp Z, Bloom PP, Torres Soto M et al. Drug-Resistant E. coli Bacteremia Transmitted by Fecal Microbiota Transplant. N Engl J Med 2019;381:2043-2050
Donaldson GP, Lee SM, Mazmanian SK. Gut biogeography of the bacterial microbiota. Nat Rev Microbiol 2016;14: 20–32
Fernández L, Langa S, Martín V, Maldonado A, Jiménez E, Martín R, Rodríguez JM. The human milk microbiota: origin and potential roles in health and disease. Pharmacol Res 2013;69:1-10
Hadrich D. Research Is Becoming the Key to Better Understanding Health and Nutrition. Front Genet 2018;9:212
Iqbal S, Quigley EM. Progress in Our Understanding of the Gut Microbiome: Implications for the Clinician. Curr Gastroenterol Rep 2016;18:49
Jeffery IB, Claesson MJ, Oʼ‘Toole PW, Shanahan F. Categorization of the gut microbiota: enterotypes or gradients? Nat Rev Microbiol 2012;10:591-592
Jones RM. The Influence of the Gut Microbiota on Host Physiology: In Pursuit of Mechanisms. Yale J Biol Med 2016;89:285-297
Koleva PT, Kim JS, Scott JA, Kozyrskyj AL. Microbial programming of health and disease starts during fetal life. Birth Defects Res C Embryo Today 2015;105:265-277
NIH HMP Working Group: The NIH Human Microbiome Project. Genome Res 2009;19:2317-2323
Proctor LM. The National Institutes of Health Human Microbiome Project. Semin Fetal Neonatal Med 2016;21:368-372
Rutayisire E, Huang K, Liu Y, Tao F. The mode of delivery affects the diversity and colonization pattern of the gut microbiota during the first year of infantsʼ life: a systematic review. BMC Gastroenterol 2016;16:86
Schroeder BO, Bäckhed F. Signals from the gut microbiota to distant organs in physiology and disease. Nat Med 2016;22:1079-1089
Sender R, Fuchs S, Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans Cell 2016;164:337-340
Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol 2016;14:e1002533
Tang ZZ, Chen G, Hong Q, et al. Multi-Omic Analysis of the Microbiome and Metabolome in Healthy Subjects Reveals Microbiome-Dependent Relationships Between Diet and Metabolites. Front Genet 2019;10:454
Thursby E, Juge N. Introduction to the human gut microbiota. Biochem J 2017;474:1823-1836
Velasquez-Manoff M. Gut microbiome: the peacekeepers. Nature 2015;518:3-11























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.