
- DAZ.online
- DAZ / AZ
- DAZ 10/2020
- Wenn keiner liefern kann...
DAZ-Spezial COVID-19
Wenn keiner liefern kann …
Herstellung von Desinfektionsmitteln in der Apotheke
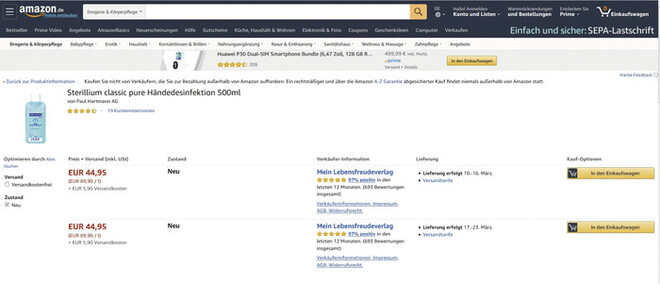
Zum Kundenservice einzelner Großhändler werden Apotheken derzeit erst durchgestellt, nachdem sie eine Bandansage gehört haben, die ihnen mitteilt, dass Desinfektionsmittel leider ausverkauft sind. Während die Kunden am HV-Tisch Schlange stehen, um eventuell doch noch zumindest eine kleine Menge Desinfektionsmittel zu ergattern, erhält man von Produzenten die Auskunft: „Trotz Erhöhung der Produktionskapazitäten sind wir leider nicht in der Lage, den aktuellen Bedarf zu decken.“ Die letzten verfügbaren Fläschchen werden derweilen von hemmungslosen Geschäftemachern online zum Vier- bis Zehnfachen des Normalpreises (Abb. 1) angeboten. Szenen, die man sich hierzulande bis vor Kurzem kaum hätte vorstellen können. Einzige Möglichkeit dem Versorgungsauftrag gerecht zu werden, ist daher – einmal mehr – die Besinnung auf eine pharmazeutische Kernkompetenz: die Herstellung von Desinfektionsmitteln in Rezeptur- oder Defekturmaßstab.
Unter bestimmten Voraussetzungen kann auch eine Standardzulassung genutzt werden (siehe Abschnitt „Alternative: Standardzulassung“).
Abb. 1: Angebot und Nachfrage Im Internet steigen die Preise für Desinfektionsmittel in utopische Höhen verglichen mit dem Apothekenverkaufspreis laut Lauer-Fischer-Taxe: 500 ml Sterillium: 11,95 Euro. Stand 2. März 2020.
Wirksames Ethanol, Propanol und 2-Propanol
Es gibt verschiedene geprüfte Standardrezepturen, die mehrheitlich auf der desinfizierenden Wirkung von Ethanol, Propanol oder 2-Propanol basieren. Die Wirkung dieser einwertigen, aliphatischen, kurzkettigen Alkohole beruht auf einer unspezifischen Denaturierung von Oberflächen- bzw. Membranproteinen. Auch Coronaviren werden von alkoholischen Desinfektionsmitteln schnell und zuverlässig abgetötet. Ethanol wirkt ab einer Konzentration von etwa 10% mikrobiostatisch und ab 30% mikrobiozid. Die optimale Konzentration liegt zwischen 70 und 80%. Bei höheren Konzentrationen nimmt die Wirkung wieder ab, da zur Vermittlung der Wirksamkeit von Ethanol auch eine bestimmte Wassermenge erforderlich ist. Gerade auf der Haut wirken jedoch auch hochkonzentrierte Ethanol-Lösungen oft besser als erwartet, da Hände selbst in aller Regel eine gewisse Feuchtigkeit aufweisen. Die mikrobiozide Wirkung von Propanol beginnt bereits bei einer Konzentration von 13%. Der optimale Wirkbereich liegt zwischen 50 und 60%. Bei 2-Propanol beginnt die mikrobiozide Wirkung bei einer Konzentration von 30%, der optimale Wirkbereich liegt zwischen 60 und 85%. In Kombination eingesetzt können aufgrund synergistischer Wirkung niedrigere Konzentrationen der genannten Alkohole ausreichend sein.
Vollständige Herstellungsanweisungen
Um den Apotheken die Herstellung der Desinfektionsmittel so leicht wie möglich zu machen, wurden den Nutzern des „Dr. Lennartz Laborprogramms für Apotheken“ im Rahmen der „Ziegler Rezepturbibliothek® (ZRB)“ kurzfristig vollständige Herstellungsanweisungen zu den in diesem Artikel beschriebenen Desinfizienzien zur Verfügung gestellt. Die Dokumente enthalten neben einer ausführlichen Beschreibung der einzelnen Herstellungsschritte rezepturspezifische Hinweise und Kommentare, sowie alle relevanten Angaben für das Rezepturetikett. Die Standardvorschriften lassen sich auf eine beliebige Ansatzmenge skalieren und alle Angaben mit wenigen Mausklicks in das Herstellungsprotokoll übernehmen, so dass alle hier beschriebenen Desinfektionsmittel ganz kurzfristig sehr einfach und unkompliziert in der Apotheke hergestellt werden können, um die derzeit klaffende Versorgungslücke zu schließen.
H2O2 gegen Sporen, Glycerol für bessere Akzeptanz
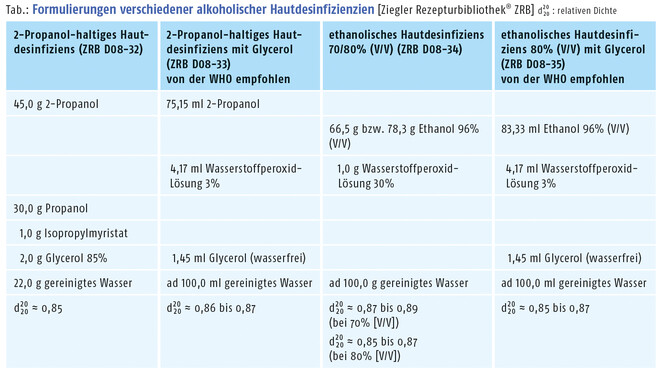
Die meisten alkoholischen Hautdesinfektionsmittel enthalten Wasserstoffperoxid, das eventuell in der Lösung vorhandene Sporen abtötet. Dieser Prozess ist konzentrationsabhängig und benötigt eine gewisse Zeit, weshalb die Rezeptur der Ziegler Rezepturbibliothek® (ZRB) D08-34 (0,3% H2O2) erst 24 Stunden, die von der WHO empfohlenen Rezepturen ZRB D08-33 bzw. ZRB D08-35 (0,125% H2O2) gar erst 72 Stunden nach der Zubereitung eingesetzt bzw. abgegeben werden dürfen. Zur Verbesserung der Akzeptanz des Produkts, wird Glycerol als Hautpflege-Feuchthaltemittel zugesetzt. Um die Klebrigkeit des Produkts zu reduzieren, kann gegebenenfalls eine Verringerung des Glycerol-Anteils in Betracht gezogen werden. Mitunter wird auch Isopropylmyristat als rückfettendes Agens zugesetzt, um die Verträglichkeit des Desinfiziens bei häufiger Anwendung zu verbessern. Aus dem Krankenhausbereich stammt der Vorschlag, Hautdesinfizienzien mit Patentblau V in 0,0001-%iger Konzentration einzufärben. Die Blaufärbung ist dabei weniger ein Indikator dafür, welche Hautflächen bereits behandelt wurden, als vielmehr eine Erkennungsfarbe zur Vermeidung von Verwechslungen bzw. eine Warnfarbe zum Schutz vor falscher, z. B. parenteraler Anwendung. Für die Abgabe in der öffentlichen Apotheke erscheint eine solche Färbung, bei ordnungsgemäßer Kennzeichnung des Produkts, daher überflüssig.
Ausgangsstoffe mit und ohne Biozid-Zertifikat?
Im Zusammenhang mit der Eigenherstellung von Desinfektionsmitteln in der Apotheke stellt sich immer zugleich auch die Frage, inwieweit ein solches Vorgehen vor dem Hintergrund der Biozid-Verordnung zulässig ist bzw. inwieweit dabei Biozid-zertifizierte Ausgangsstoffe einzusetzen sind. Hierzu ist anzumerken, dass die in diesem Beitrag genannten Hautdesinfizienzien zur Anwendung am menschlichen Körper bestimmt sind und als Arzneimittel in Verkehr gebracht werden. Sie unterliegen damit dem Arzneimittelgesetz und nicht der Biozid-Verordnung, vergleichbar den als Fertigarzneimittel eingestuften alkoholischen Desinfizienzien der Firmen Caelo, Apomix, Hetterich, Braun oder Hartmann. Falls der Kunde ein solches, als Hautdesinfiziens hergestelltes und abgegebenes Arzneimittel, dann auch auf Flächen und Gegenständen anwendet, liegt dies in seinem eigenen Ermessen. Die desinfizierende Wirkung wird hierbei – rein fachlich betrachtet – in gleicher Weise eintreten, wichtig ist es demnach lediglich aus regulatorischen Gründen, dass die Mischung als Arzneimittel und nicht als Flächendesinfektionsmittel in Verkehr gebracht wird. Für den Fall, dass es Biozid-zertifizierte Alkohole sein sollen, steht auf den Seiten der Europäischen Chemikalienagentur (European Chemical Agency, ECHA, https://echa.europa.eu/de/) eine europaweite Liste aller Anbieter entsprechender Produkte zur Verfügung [Stand: 14. Februar 2020]. Geben Sie den Webcode F9XD4 in die Suchfunktion bei DAZ.online unter www.deutsche-apotheker-zeitung.de ein und Sie gelangen direkt zu der Liste. Die Anbieter von Ethanol sind auf Seite 116 ff. des Dokuments, die von 2-Propanol auf Seite 177 ff. zu finden.
Herstellung und Qualitätskontrolle
Bei der Herstellung werden die einzelnen Rezepturkomponenten, ohne Anwendung von Wärme, in einem Becherglas miteinander gemischt. Das Endprodukt ist eine klare, transparente Flüssigkeit, die charakteristisch nach den jeweils eingesetzten Alkoholen riecht. Neben der organoleptischen Beurteilung kommt als mögliche Qualitätskontrolle insbesondere die Bestimmung der relativen Dichte d2020 infrage. Üblicherweise wird die relative Dichte mithilfe eines Pykno- oder Aräometers ermittelt, die Sollwerte für die Qualitätskontrolle sind der Tabelle zu entnehmen. Die WHO sieht für die von ihr empfohlenen Rezepturen (ZRB D08-33 bzw. ZRB D08-35) die Verwendung eines Alkoholmeters vor, das nichts anderes ist als ein Aräometer, an dessen Skala statt der Dichte unmittelbar der Ethanolgehalt in Vol.-% abgelesen werden kann. Bei Verwendung eines Alkoholmeters liegen die vorgegebenen Grenzwerte für ZRB D08-35 bei 75 bzw. 85 Vol.-%, für ZRB D08-33 bei 76 bzw. 78 Vol.-%. Die Abweichung zwischen Messwert und tatsächlichem Alkoholgehalt bei 2-Propanol-haltigem Hautdesinfiziens mit Glycerol ist dadurch bedingt, dass Alkoholmeter auf Ethanol kalibriert sind und sich die Dichten von Ethanol und 2-Propanol bei gleichen Konzentrationen unterscheiden. Bis 2007 gab es im NRF noch eine Rezeptur „Desinfektionsspiritus“ (damals NRF 11.27.), die nach NRF-Angaben infolge der Nichtverfügbarkeit von Propanol und aufgrund der Verfügbarkeit von ausreichenden Alternativen auf dem Markt aus dem NRF gestrichen wurde. Beide Aussagen treffen derzeit nicht mehr zu. Zum einen ist Propanol von den auf der ECHA-Liste ab Seite 175 ff. genannten Herstellern beziehbar. Und zum anderen ist eine momentan unzureichende Verfügbarkeit von Handelspräparaten der Grund für diesen Beitrag. Die Formulierung ist im aktuellen NRF zwar nicht mehr zu finden, jedoch online im Rezepturfinder im geschlossenen Bereich des NRF einsehbar.
Zu dieser Tabelle wird in DAZ 2020, Nr. 11, ein "Erratum" erscheinen. Hier in der Online-Version ist die Tabelle (betrifft Zeile 3) bereits korrigiert, das Erratum betrifft die Printausgabe der DAZ. Wir bitten, den Fehler in der Printversion der DAZ zu entschuldigen.
Herstellung im Defektur-Maßstab
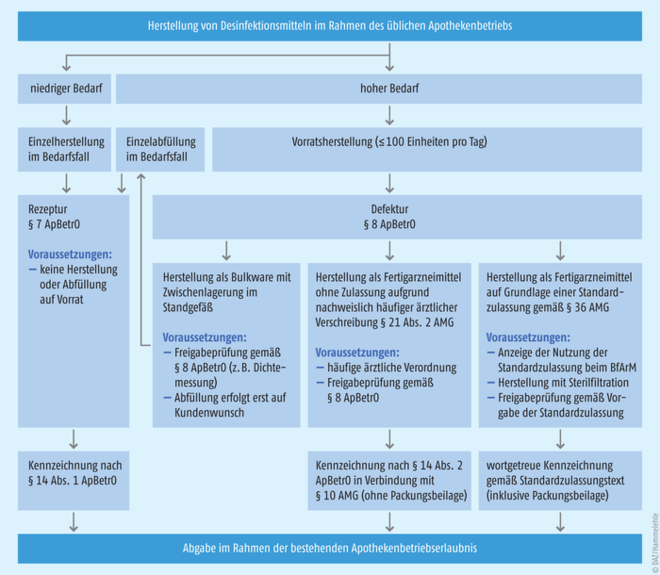
Eine Herstellung im Defektur-Maßstab gemäß § 8 der Apothekenbetriebsordnung ist ebenfalls möglich. Dies setzt – anders als bei der Herstellung als Rezepturarzneimittel – eine Qualitätsprüfung voraus, die sich am Risikopotenzial des jeweiligen Arzneimittels orientiert. Da die Dichte der Zubereitungen unmittelbar mit deren Alkoholgehalt korreliert, kann die oben beschriebene Dichtemessung bei der Herstellung im Defekturmaßstab auch als einfache und praktikable Freigabeprüfung dienen. Werden Desinfektionsmittel in einer abgabefertigen Packung als Fertigarzneimittel vorrätig gehalten, würde dies laut Arzneimittelgesetz das Vorliegen einer häufigen ärztlichen oder zahnärztlichen Verschreibung erfordern. Eine praktikablere Option wäre hingegen die Herstellung als Bulkware. Diese Variante der Vorratsherstellung erfordert keine regelmäßige ärztliche Verordnung, da die Apotheke das Arzneimittel dann erst auf Kundenwunsch abfüllt und nicht bereits als abgabefertiges Fertigarzneimittel bereithält (Abb. 2). In der Würdigung aller regulatorischen Rahmenbedingungen ist dies die niederschwelligste Option, eine größere Anzahl von Patienten mit in der Apotheke hergestellten Desinfektionsmitteln zu versorgen.
Literaturtipp
Ohne Zulassung, ohne Registrierung – Eigenherstellung rechtlich sichern
Selbst hergestellte Arzneimittel stehen bei den Patienten hoch im Kurs. Für die Eigenherstellung bilden die Standardzulassungen dabei das rechtliche, wissenschaftliche und pharmazeutische Grundgerüst. Sie befreien den Hersteller von der Pflicht des aufwendigen behördlichen Zulassungs- oder Registrierungsverfahrens.
Das Werk umfasst die etwa 280 Standardzulassungen, ergänzt um Kommentare. Diese enthalten auch Übergangsvorschriften für Kennzeichnung, Packungsbeilage und Fachinformation. Nun kommen mit der 19. Aktualisierungslieferung etwa 340 Standardregistrierungen hinzu.
Standardzulassungen und Standardregistrierungen, unentbehrlich für Apotheker in Offizin, Krankenhaus und Industrie – und für die Sicherheit der Patienten!
Von Rainer Braun (Hrsg.) und Thomas Zapf (Hrsg.)
Standardzulassungen und Standardregistrierungen für Fertigarzneimittel
Text und Kommentar
4 Ringordner, zur Fortsetzung, 1. Aufl. inkl. 19. Akt.lfg., 2928 S., 17,0 × 24,0 cm, 128,00 Euro
ISBN 978-3-7692-7115-7
Deutscher Apotheker Verlag 2019
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
Tel. 0711 2582-341, Fax: 0711 2582-290
E-Mail: service@deutscher-apotheker-verlag.de
oder unter www.deutscher-apotheker-verlag.de
Alternative: Standardzulassung
Alternativ können Apotheken gemäß Standardzulassung reine Ethanol- bzw. 2-Propanol-Wasser-Mischungen als Fertigarzneimittel in Verkehr bringen (Abb. 2). Da diese Mischungen kein sporozides Wasserstoffperoxid enthalten, ist eine Sterilfiltration in keimarme bzw. sterile und sporenfreie Behältnisse erforderlich. Voraussetzung für die Nutzung einer Standardzulassung durch Apotheken ist eine Anzeige beim BfArM, die auf elektronischem Weg über das Portal www.pharmnet-bund.de vorzunehmen ist. Um das Portal nutzen zu können, müssen sich Apotheken einmalig bei PharmNet.Bund registrieren. Hierfür wird die sogenannte pharmazeutische Unternehmernummer (PNR) benötigt, die – sofern nicht bereits vorhanden – formlos unter der E-Mail-Adresse AMIS-PU@bfarm.de beantragt werden kann. Anschließend ist eine Kopie der Anzeige an die zuständige Behörde zu schicken, die die Apothekenbetriebserlaubnis erteilt hat. Die Gebühr für eine Nutzungsanzeige der Standardzulassung für Ethanol- bzw. 2-Propanol-Wasser-Mischungen durch Apotheken beträgt jeweils 25,00 Euro. Bei der Nutzung von Standardzulassungen ist zu beachten, dass in diesem Fall Herstellung, Prüfung und Kennzeichnung (einschließlich Abgabe einer Packungsbeilage!) exakt den Vorgaben der Monographie entsprechen müssen. Hinsichtlich der Kennzeichnung sind jedoch zumindest für Ethanol 70% (V/V) und 2-Propanol 70% (V/V) entsprechende Standardetiketten erhältlich (Abb. 3).
Bei 2-Propanol-Mischungen wird die praktische Umsetzung durch die nasschemische Qualitätsprüfung erschwert, die in der entsprechenden Monographie vorgeschrieben wird, während diese bei Ethanol-Wasser-Mischungen nicht vorgesehen ist. Die vollständigen Monographie-Texte sind in folgendem Werk zu finden: „Braun/Zapf: Standardzulassungen und Standardregistrierungen für Fertigarzneimittel“, Deutscher Apotheker Verlag, Stuttgart 2019 (siehe „Literaturtipp“).
Abb. 2: Mittel zum Desinfizieren der Haut dürfen in der Apotheke hergestellt werden, wenn sie als Arzneimittel in Verkehr gebracht werden. Sie unterliegen damit dem Arzneimittelgesetz und nicht der Biozid-Verordnung.
Abb. 3: Etikett nach Standardzulassung Ethanol 70% (V/V), erhältlich z. B. bei der Wepa Apothekenbedarf GmbH
Kennzeichnung
Aufgrund des hohen Alkoholgehalts sind alle in der Tabelle genannten Desinfektionsmittel leicht entzündlich und von Zündquellen fernzuhalten. Eine entsprechende Warnung auf dem Rezepturetikett scheint daher geboten. Des Weiteren sollte in der Kennzeichnung darauf hingewiesen werden, dass die Zubereitungen nicht mit Augen oder Schleimhäuten in Kontakt gebracht werden darf. Die bestätigte Haltbarkeit der alkoholischen Desinfektionsmittel beträgt mindestens ein Jahr, liegt in der Praxis aber vermutlich deutlich darüber. |
DAZ-Spezial COVID-19
Weitere Beiträge:
- Herausforderung COVID-19: Fieberhafte Suche nach Impfstoffen und antiviralen Therapien
- Gefährliches Hamstern: Horten von Desinfektionsmitteln, Mund- und Atemschutzmasken gefährdet die Klinikversorgung
- „Notfallvorsorge ist immer unpopulär, außer im Notfall selbst“: Krisenmanagement liegt in der Verantwortung eines jeden Apothekenleiters


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.