
- DAZ.online
- DAZ / AZ
- DAZ 7/2019
- Handlungsoptionen zu ...
DAZ aktuell
Handlungsoptionen zu Securpharm
Securpharm e. V. und ABDA informieren zur Anlaufphase des neuen Fälschungsschutzsystems
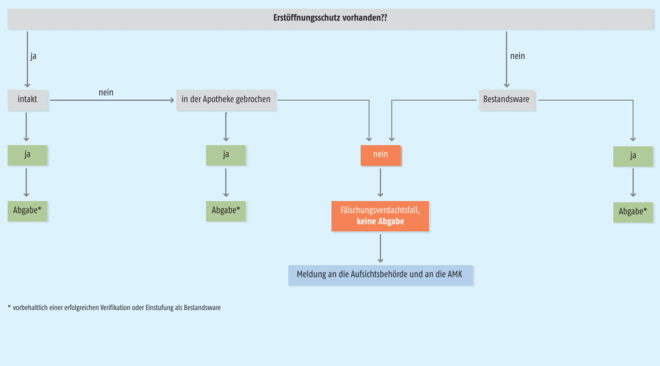
Seit dem 9. Februar 2019 gelten die EU-weiten Regelungen zu den neuen Sicherheitsmerkmalen für Arzneimittel in der legalen Lieferkette. Am selben Tag ist ein neu gefasster § 21 Apothekenbetriebsordnung (ApBetrO) in Kraft getreten. In dieser Vorschrift geht es um den Umgang mit Arzneimittelrisiken und die Behandlung nicht verkehrsfähiger Arzneimittel. Dazu zählen auch Fälschungsverdachtsfälle, die das Securpharm-System ausfindig macht. So ist nun etwa in § 21 Abs. 5 ApBetrO bestimmt:
(5) Im Vertriebsnetz festgestellte gefälschte Arzneimittel und im Vertriebsnetz festgestellte Arzneimittel, bei denen ein Verdacht besteht, dass sie gefälscht sind, hat der Apothekenleiter oder das von ihm beauftragte Personal bis zur Entscheidung über das weitere Vorgehen getrennt von verkehrsfähigen Arzneimitteln und gesichert aufzubewahren, um Verwechslungen zu vermeiden und einen unbefugten Zugriff zu verhindern. Der Apothekenleiter oder das von ihm beauftragte Personal hat diese Arzneimittel eindeutig als nicht zum Verkauf bestimmte Arzneimittel zu kennzeichnen. Über das Auftreten von Fälschungen eines Arzneimittels, das nicht die Sicherheitsmerkmale nach § 10 Absatz 1c des Arzneimittelgesetzes trägt, sowie über den Verdacht von Fälschungen eines solchen Arzneimittels hat der Apothekenleiter die zuständige Behörde unverzüglich zu informieren. Er oder das von ihm beauftragte Personal hat die getroffenen Maßnahmen zu dokumentieren.
Wer vorsätzlich oder fahrlässig nicht dafür sorgt, dass die in § 21 ApBetrO genannten Maßnahmen bei Arzneimittelrisiken oder nicht verkehrsfähigen Arzneimitteln getroffen werden, begeht eine Ordnungswidrigkeit.
Fehlermeldung – was nun?
Doch was heißt das nun konkret für das weitere Vorgehen bei einem Fälschungsverdachtsfall? Da gerade in der Anfangsphase mit Fehlalarmen zu rechnen ist, die nichts mit einer Fälschung zu tun haben dürften, hat Securpharm ein Informationsschreiben verfasst, das beschreibt, wie die individuellen Erkennungsmerkmale zu prüfen sind – und welche Optionen im Fall eines negativen Verifikationsergebnisses bestehen (siehe hierzu die Abbildung 1). Denn wenn es sich um Bestandsware handelt und auch sonst keine Auffälligkeiten bestehen, kann diese weiterhin abgegeben werden.
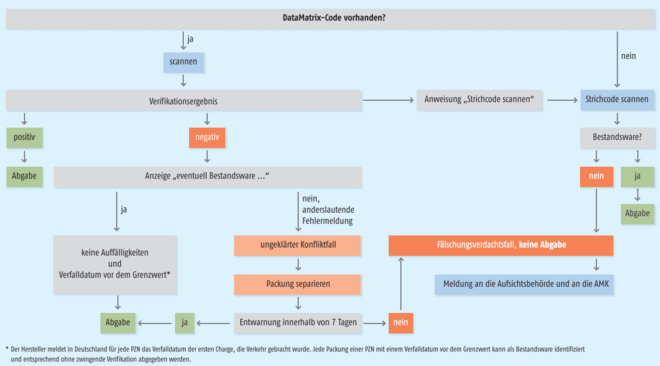
Retoure an Lieferanten oder Quarantäne in der Apotheke?
Handelt es sich jedoch nicht um Bestandsware, beginnt eine 7-Tage-Frist. Innerhalb dieser findet eine Securpharm-interne Untersuchung der Fehlermeldung statt (s. DAZ 2019, Nr. 6, S. 20 ff.). In den im Januar aktualisierten Securpharm-FAQ der ABDA heißt es, dass während dieser Zeit zwei Möglichkeiten bestehen, mit der Packung zu verfahren: Sie könne entweder an den Lieferanten zurückgegeben oder in der Apotheke separat aufbewahrt werden. Auch in ersterem Fall könne bei der Erhärtung des Verdachts noch die Behördenmeldung unternommen werden, so die ABDA. Die Netzgesellschaft Deutscher Apotheker mbH – NGDA stelle die Systemdaten hierfür zur Verfügung. Bleibe die Packung in der Apotheke, könne sie später erneut verifiziert und abgegeben werden, wenn der Status auf „abgabebereit“ gewechselt habe.
In einem vergangene Woche veröffentlichten Informationsblatt beleuchtet die ABDA diesen Punkt ausführlicher – und erklärt, dass sie bei der Frage, ob das separierte Arzneimittel an den Großhandel zurückgegeben werden kann, eine andere Auffassung vertritt als das BMG. Aus Sicht des BMG, das rein apotheken- und arzneimittelrechtlich argumentiert, sollte es zunächst nicht zurückgesendet werden, „da es sich um ein Arzneimittel handelt, bei dem zumindest ein Anfangsverdacht besteht, dass es gefälscht sein könnte und dieses mindestens solange nicht in das Vertriebsnetz gelangen dürfe bis die Entscheidung über das weitere Vorgehen getroffen wurde“. Zudem sei vorgesehen, dass Securpharm das Ergebnis der Untersuchung an die verifizierende Stelle zurückmeldet. Damit würden bei einer Rücksendung der Ware von der Apotheke an den Großhandel Informations- und Warenströme auseinanderlaufen.
Nach Auffassung der ABDA ist dies aber nicht die einzige Auslegungsvariante. Sie betont, dass auch Großhändler die Pflicht hätten, verdächtige Packungen zu kennzeichnen und zu separieren. Und was die getrennten Warenströme angeht, gebe es technische Möglichkeiten: Über das neue NGDA-Portal (www.securpharm-gui.ngda.de) könnten Apotheken alle bestätigten Verdachtsfälle ersehen, sodass sie dann die erforderlichen Meldungen an ihre Aufsichtsbehörden vornehmen können. Ein physischer Besitz der betreffenden Packung sei nicht zwingend erforderlich. Letztlich schreibt die ABDA: „Die Entscheidung, welche der beiden Varianten – Quarantänelagerung in der Apotheke oder gekennzeichnete Retoure an den Großhändler – im Einzelfall in Betracht kommt, sollte nach unserer Auffassung der Apothekenleiter in eigener Verantwortung treffen können“.
Bleiben Sie auf dem Laufenden mit DAZ.online
Mehr zu Securpharm erfahren Sie auf DAZ.online, wenn Sie den Webcode J9WK4 in die Suchmaske eingeben. Die neuen Handlungsoptionen von ABDA und Securpharm finden sie mit dem Webcode D5ZJ5.
Zu beachten ist: Die apothekenrechtliche Bewertung sagt nichts aus über Ansprüche aus dem Kaufrecht. Auch die ABDA verweist darauf, dass ein Abgabeverbot infolge eines Fälschungsverdachts ein Sachmangel ist, der gesetzliche Gewährleistungsansprüche der Apotheke gegenüber dem Lieferanten begründet. Dabei steht an erster Stelle der Anspruch auf Nacherfüllung, also auf Lieferung eines mangelfreien Arzneimittels. Im Handelsrecht ist zu beachten, dass Mängelrügen „unverzüglich“ erfolgen müssen – sonst droht der Verlust dieser Rechte. Der Lieferant sollte also in jedem Fall über einen Fälschungsverdacht informiert werden. Wie sich eine Mängelrüge im konkreten Einzelfall rechtlich auswirkt, hängt maßgeblich von den individuell zwischen Apotheke und Großhändler vereinbarten Vertragsbedingungen ab. |





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.