
- DAZ.online
- DAZ / AZ
- DAZ 50/2019
- Risikoreiche Verordnungen
Arzneimittelsicherheit
Risikoreiche Verordnungen
Die Gefahren durch Fluorchinolon-Antibiotika in Zahlen
Seit Jahren wird weltweit berichtet, dass Antibiotika aus der Gruppe der Fluorchinolone mit schwerwiegenden und zum Teil irreversiblen Risiken für die Patienten verbunden sind. Gerade diese Antibiotika werden aber in Deutschland im Vergleich häufig verordnet. Nach Berechnungen des Wissenschaftlichen Instituts der AOK (WIdO) auf Basis von Verordnungsdaten der AOK-Versicherten wurden diese Arzneimittel allein im Jahr 2018 an 3,3 Mio. Patienten in Deutschland verordnet – noch immer zu häufig angesichts der Tatsache, dass es sich bei den Fluorchinolonen um Reserve-Antibiotika handelt. Bei Bagatellerkrankungen wie unkomplizierten Harnwegsinfekten oder einfachen Atemwegsinfekten kann auf den Einsatz von Antibiotika ganz verzichtet werden.
Fluorchinolone sind Antibiotika, deren Wirkstoffname auf „floxacin“ endet, wie Ciprofloxacin (Handelsname, z. B. Ciprobay®) oder Levofloxacin (Handelsname, z. B. Tavanic®). Sie sind antibakteriell wirksam und können schwerwiegende, lebensbedrohliche Infektionen heilen. In wenigen Fällen verursachen sie jedoch lebensverändernde Schädigungen und Langzeitbeschwerden. Angesichts möglicher schwerwiegender und langandauernder Nebenwirkungen wie Sehnenrissen oder psychischen Störungen wie Depressionen und Angstzuständen sollten diese Reserve-Antibiotika nur nach gründlicher Nutzen-Risiko-Abwägung und nur in alternativlosen Fällen eingesetzt werden. Patienten müssen intensiv über die Gefahren und Alternativen dieser Medikamente aufgeklärt werden und im Schadensfall gezielt Unterstützung bekommen.
Nebenwirkungen werden seit mindestens 30 Jahren beschrieben
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) teilte Anfang April 2019 mit, dass Ärzte die in Deutschland sehr häufig verordneten Antibiotika aus der Gruppe der Fluorchinolone wegen schwerer Nebenwirkungen nur noch im Einzelfall verschreiben sollen [1]. Diese Warnung erfolgte allerdings erst spät. Dass Fluorchinolon-Antibiotika schwerwiegende Nebenwirkungen haben, ist seit mehr als zehn Jahren bekannt: Im Februar 2017 war ein europäisches Risikobewertungsverfahren bei der Europäischen Arzneimittelagentur (EMA) zu diesen Arzneimitteln eingeleitet worden [2]. Verspätet, denn bereits seit dem Jahr 2008 hat die amerikanische Arzneimittelbehörde (FDA) über schwerwiegende Nebenwirkungen informiert, die französische Arzneimittelbehörde hat im Jahr 2015 deutlich zu Sicherheitsmaßnahmen aufgerufen und die FDA im Jahr 2016 angeordnet, diese Antibiotika bei zahlreichen Infektionen nur noch als letzte Möglichkeit anzuwenden. Das Toxizitätsmuster der Chinolone und Fluorchinolone wird inzwischen als spezielles FQAD-Syndrom (Fluoroquinolone-Associated Disability) bezeichnet.
Um Patienten vor dem Einsatz schädigender Arzneimittel zu schützen, werden Meldungen von Nebenwirkungen unter anderem durch das BfArM erfasst. Je nach Häufigkeit und Schwere der gemeldeten Nebenwirkungen kann bei der EMA ein Risikobewertungsverfahren angestoßen werden. Von den einst 16 Vertretern der Fluorchinolone sind derzeit in Deutschland nur noch fünf im Handel. Die restlichen elf wurden zum Teil kurz nach ihrer Einführung – meist wegen toxischen Komplikationen oder Unverträglichkeiten – wieder vom Markt genommen.
Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) hatte die Ärzte immer wieder auf die Risiken der Fluorchinolon-Antibiotika hingewiesen und für deren maßvollen Einsatz geworben. Auch das pharmaunabhängige „arznei-telegramm“ berichtet seit 1989 über folgenschwere unerwünschte Wirkungen der Stoffgruppe, einschließlich zentralnervöser Effekte bis hin zu Psychosen und Sehnenschäden [3]. Jedoch müssen die pharmazeutischen Hersteller erst jetzt, nach Abschluss des über zwei Jahre dauernden Verfahrens, auf Veranlassung des BfArM aktiv werden und in der Packungsbeilage ihrer Arzneimittel deren Anwendungsbereiche massiv einschränken. In einem sogenannten Rote-Hand-Brief informierten sie am 8. April 2019 über Risiken von „die Lebensqualität beeinträchtigenden, langanhaltenden und möglicherweise irreversiblen Nebenwirkungen bei der Anwendung von systemischen und inhalativen Chinolon-Antibiotika“. Zusätzlich müssen die Hersteller diesen Warnhinweis in jeder Packungsbeilage aufnehmen.
Allmählicher Verordnungsrückgang seit 2010
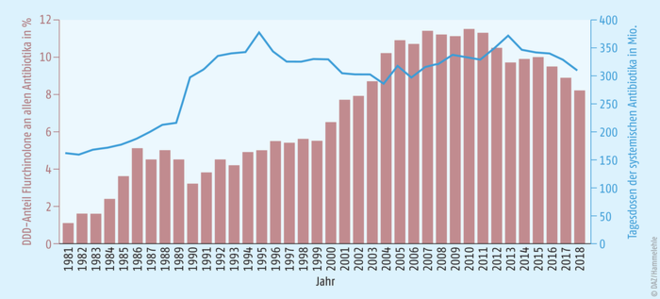
Mehr als jeder vierte GKV-Versicherte hat im Jahr 2018 mindestens einmal von seinem Arzt eine Antibiotika-Verordnung erhalten. Von den insgesamt 310 Millionen verordneten Antibiotika-Tagesdosen des Jahres 2018 entfallen 8,2 Prozent (25,6 Millionen Tagesdosen) auf die Gruppe der Fluorchinolon-Antibiotika (siehe Abb. 1).
Abb. 1: Verordnete Tagesdosen aller Antibiotika (ATC-Code J01) sowie der Anteil der verordneten Tagesdosen der Fluorchinolon-Antibiotika (ATC-Code J01MA) an allen Antibiotika von 1981 bis 2018, Quelle: GKV-Arzneimittelindex im WIdO und Fricke et al. (2019).
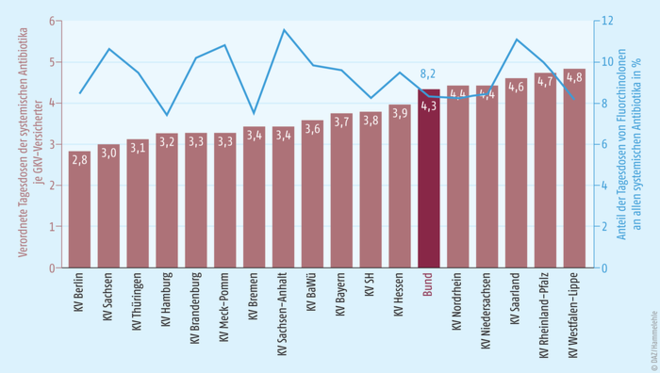
Aus Abb. 2 ist zu erkennen, dass im Durchschnitt jeder GKV-Versicherte im Jahre 2018 rein rechnerisch 4,3 verordnete Antibiotika-Tagesdosen erhalten hat, darunter 0,35 aus der Gruppe der Fluorchinolon-Antibiotika, entsprechend einem Anteil von 8,2 Prozent. Im regionalen Vergleich zeigen sich deutliche Unterschiede bei der Anzahl der Antibiotika-Verordnungen: Während die ambulant tätigen Kassenärzte in Berlin mit 2,8 Antibiotika-Tagesdosen für die dort wohnhaften GKV-Versicherten auskommen, liegt der Vergleichswert in Westfalen-Lippe mit 4,8 Tagesdosen je GKV-Versicherter in 2018 um mehr als 40 Prozent darüber. Doch ein Zusammenhang zwischen der Anzahl der Antibiotika-Verordnungen und dem Anteil der Fluorchinolone lässt sich nicht erkennen. Die wenigsten Fluorchinolon-Tagesdosen pro GKV-Versichertem wurden 2018 in Hamburg (0,24 Tagesdosen) und Bremen (0,25 Tagesdosen) verordnet. Den Spitzenplatz belegt das Saarland (0,50 Tagesdosen), das zugleich mit vergleichsweise vielen Antibiotika-Verordnungen den dritten Platz belegt.
Abb. 2: Verordnete Tagesdosen der systemischen Antibiotika je GKV-Versicherter sowie der Anteil der Tagesdosen von Fluorchinolonen an allen systemischen Antibiotika im Jahr 2018 nach Kassenärztlichen Vereinigungen, Quelle: GKV-Arzneimittelindex im WIdO und [4].
Auch wenn seit 2016 die Verordnungen rückläufig sind, wurden seit dem Jahr 2017 nach einer Schätzung auf Basis von AOK-Daten immer noch etwa 7,1 Millionen Patienten (3,8 Mio. Patienten 2017 und 3,3 Mio. Patienten 2018) und damit jährlich ca. 5 Prozent der mehr als 72 Millionen GKV-Versicherten mit mindestens einer Fluorchinolon-Therapie behandelt (Tab. 1). Und dies, obwohl diese Wirkstoffe weltweit als Reserve-Antibiotika gelten und erst nach Versagen anderer Alternativen zur Anwendung kommen sollten. Vor allem sollten sie nicht bei leichteren Erkrankungen wie einfachen Erkältungen oder Blasenentzündungen eingesetzt werden, die meist gar nicht mit Antibiotika behandelt werden sollten. Das Ausmaß der Verordnungen in Deutschland lässt darauf schließen, dass Fluorchinolon-Antibiotika nicht nur als Mittel der Reserve und auch nicht ausschließlich bei schwerwiegenden und lebensbedrohlichen Infektionen zum Einsatz kommen. Führend bei den Fluorchinolonen ist Ciprofloxacin mit fast zwei Dritteln der Verordnungen (64 Prozent).
Verordnungen 2018 in Millionen | Verordnete Tagesdosen 2018 in Millionen | Patienten/Versicherte 2018 in Millionen/Anteil | |
|---|---|---|---|
Ciprofloxacin (z. B. Cipro Basics®) | 2,78 | 15,15 | 2,26 |
Levofloxacin (z. B. Levofloxacin Aurobindo®) | 0,89 | 6,2 | 0,7 |
Moxifloxacin (z. B. Moxifloxacin Aurobindo®) | 0,33 | 2,51 | 0,28 |
Ofloxacin (z. B. Oflox Basics®) | 0,16 | 0,84 | 0,14 |
Norfloxacin (z. B. Norfloxacin AL®) | 0,15 | 0,88 | 0,13 |
alle Fluorchinolone (J01MA) | 4,32 | 25,57 | 3,32* |
| 12,4% | 8,2% | 17,3% |
alle systemisch wirkenden Antibiotika (J01) | 34,72 | 310,32 | 20,37 |
| 5,3% | 0,7% | 28,0% |
alle Arzneimittel | 661,17 | 41.385,60 | 72,80 |
* 3,52 Mio. Patienten, wenn Patienten, die 2018 mit verschiedenen Wirkstoffen therapiert wurden, mehrfach gezählt werden | |||
Schätzung des WIdO: Wie viele Patienten waren bisher von Nebenwirkungen betroffen?
Das WIdO hat mit Unterstützung von Prof. Dr. Winfried V. Kern vom Zentrum Infektionsmedizin am Universitätsklinikum Freiburg eine Schätzung vorgenommen, wie viele Patienten in Deutschland einem Risiko für bestimmte Fluorchinolon-assoziierte Nebenwirkungen ausgesetzt waren. Basierend auf verschiedenen epidemiologischen Untersuchungen kann ein zusätzliches Risiko im Vergleich zur Behandlung mit besser verträglichen Antibiotika für ausgewählte unerwünschte Arzneimittelwirkungen und schädigende Wirkungen ermittelt werden [5 – 9]. Aufgrund solcher Schätzungen und der Meldung möglicherweise anhaltender Nebenwirkungen im Bereich des Nervensystems und Bewegungsapparates wurde die Anwendung der Fluorchinolone massiv eingeschränkt. Die Schätzungen ergeben, dass unter 100.000 Fluorchinolon-Anwendern zusätzlich 1161 Nebenwirkungen des Nervensystems (vor allem Verwirrtheit und Unruhe), 33 Sehnenrupturen (Sehnenrisse), 8,2 Aorten-Aneurysmen (Gefäßschädigungen der Hauptschlagader) sowie vier kardiovaskuläre Todesfälle auftreten können. Unterstellt man, dass eine oder sogar mehrere der oben aufgeführten Nebenwirkungen prinzipiell bei der Einnahme jeder Packung auftreten können, würde dies für 2018 einer Zahl von mehr als 40.000 solcher Nebenwirkungen bei 3,5 Mio. Arzneimittelfällen entsprechen, die beim Einsatz eines anderen Antibiotikums nicht vorgekommen wären. In diesen Berechnungen sind eine große Anzahl von weiteren Komplikationen, zum Beispiel Hyperglykämien bei Diabetikern, das zusätzlich erhöhte Risiko bei älteren Menschen oder bei gleichzeitiger Behandlung mit Corticosteroiden nicht berücksichtigt. Darüber hinaus kann nach diesen Studienergebnissen von 140 Todesfällen ausgegangen werden, die durch die Verwendung anderer Antibiotika oder durch Antibiotika-Verzicht hätten vermieden werden können.
Was können wir daraus lernen?
Millionen Antibiotika-Patienten in Deutschland wurden jahrelang zusätzlichen Risiken ausgesetzt, obwohl den pharmazeutischen Herstellern bereits die besonderen Gefahren von Fluorchinolonen und die daraus resultierenden Maßnahmen aus anderen Ländern bekannt waren. So wurden nach der vorgenommenen Schätzung allein in den beiden letzten Jahren – während das Risikobewertungsverfahren durchgeführt wurde – insgesamt 86.000 Patienten meist unnötigerweise mit diesen zusätzlichen Komplikationen belastet. Auch wenn das Leid der betroffenen Patienten nicht rückgängig gemacht werden kann, stellt sich die Frage nach der Haftung der Hersteller und einer für die Patienten unkomplizierten Regelung von Schadensersatzansprüchen. Zwar besteht nach dem Arzneimittelgesetz eine Gefährdungshaftung des Herstellers, doch für den einzelnen Patienten ist es momentan nahezu unmöglich, Schadensersatz für eine Fluorchinolon-assoziierte Schädigung vom Pharmaunternehmen einzufordern. Zum Teil liegen Monate zwischen Arzneimitteleinnahme und Auftreten einer Nebenwirkung. Ein medizinischer Zusammenhang lässt sich im Einzelfall nur schwer beweisen. Gleichzeitig ist eindeutig belegt, dass Fluorchinolone genau diese Schädigungen hervorrufen.
Hier muss eine gesetzliche Umkehr hin zur Stärkung von Patientenrechten stattfinden. So wird eine vorausschauende Risikoeinschätzung bei den pharmazeutischen Herstellern erreicht. Diese müssten bei Hinweisen auf toxische Nebenwirkungen frühzeitiger mit einem Marktrückruf oder einer Anpassung in den Fachinformationen reagieren, weil sie ansonsten Klagen mit hohen finanziellen Schadensersatzansprüchen fürchten müssten. Auch in Deutschland müssten erste Verdachtsmomente über Risiken von Arzneimitteln deutlich schneller in der Praxis ankommen. Nur so kann die Patientensicherheit erhöht werden.
Es bleibt nunmehr abzuwarten, wie sich der zuletzt noch immer hohe Anteil der umstrittenen Fluorchinolone nach dem Warnhinweis des BfArM in der Verordnungspraxis entwickeln wird. Erste Ergebnisse, basierend auf den vorläufigen Verordnungsdaten der Gesetzlichen Krankenversicherung von Mai bis September 2019, zeigen einen Anteil nach Tagesdosen der Fluorchinolone von 5,1 Prozent an allen ambulanten systemischen Antibiotika. Der Vergleichswert für diesen Zeitraum im Vorjahr hatte noch bei 8,9 Prozent gelegen. Ob der Einsatz der Fluorchinolone in diesem Zeitraum immer auch indikationsgerecht erfolgte, kann mit den vorliegenden Daten nicht beantwortet werden. Angesichts der zahlreichen Informationen, wie beispielsweise auch die mehr als 40 Rote-Hand-Briefe zu verschiedenen Arzneimitteln im Jahr 2018, besteht die Gefahr, dass die einzelne Information bei der individuellen Verordnung unberücksichtigt bleibt. In Zeiten der Digitalisierung könnten die verordnenden Ärzte noch besser unterstützt werden, wenn eine verordnungsauslösende Diagnose auf dem Rezeptblatt einzutragen wäre. Konkrete Hinweise in der Praxissoftware könnten den Arzt darin unterstützen, Arzneimittel ausschließlich bei den von der Zulassungsbehörde zugelassenen Indikationen einzusetzen. Werden zusätzlich Rote-Hand-Briefe dem einzelnen Arzneimittel direkt passend zugeordnet, können digitale Systeme zielgenau für eine noch bessere Arzneimittelversorgung der Patienten genutzt werden. Aber auch die Apothekerinnen und Apotheker können beispielsweise im Rahmen von Qualitätszirkelarbeit die Ärztinnen und Ärzte sinnvoll beraten. Es sollte allen an der Arzneimittelversorgung teilnehmenden Partnern ein Anliegen sein, an dem zielgerichteten und therapeutisch sinnvollen Einsatz der Fluorchinolone mitzuwirken. |
Literatur
[1] Bundesinstitut für Arzneimittel und Medizinprodukte (2019): Rote-Hand-Brief zu Fluorchinolon-Antibiotika: Schwerwiegende und anhaltende, die Lebensqualität beeinträchtigende und möglicherweise irreversible Nebenwirkungen. 8. April 2019
[2] Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) (2017) Information über die Einleitung eines europäischen Risikobewertungsverfahrens nach Art. 31 der RL 2001/83/EG für Antibiotika aus der Gruppe der Fluorchinolone und Chinolone. 10. Februar 2017
[3] arznei-telegramm. Gyrasehemmer: Risikoreiche Verordnungen. arznei-telegram 2019;50(6):56
[4] Fricke U, Günther J, Niepraschk-von Dollen K, Zawinell A (Hrsg.) (2019) Anatomisch-therapeutisch-chemische Klassifikation mit Tagesdosen für den deutschen Arzneimittelmarkt. Methodik der ATC-Klassifikation und DDD-Festlegung. ATC-Index mit DDD-Angaben. Stand Mai 2019. https://www.wido.de/publikationen-produkte/arzneimittel-klassifikation/ zugegriffen am 21. Mai 2019
[5] Gorelik E, Masarva R, Perlman A, Rotshild V, Abbasi M, Muszkat M, Matok I. Fluoroquinolones and Cardiovascular Risk: A Systematic Review, Meta-analysis und Network Metaanalysis. Drug Saf. 2018;42:529-538
[6] Morales DR, Slattery J, Pacurariu A, Pinheiro L, McGettigan P, Kurz X. Relative and Absolute Risk of Tendon Rupture with Fluoroquinolone and Concomitant Fluoroquinolone/Corticosteroid Therapy: Population-Based Nested Case-Control Study. Clin Drug Investig 2019;39:205-213
[7] Pasternak, B, Inghammar M, Svanström H. Fluoroquinolone use and risk of aortic aneurysm and dissection: nationwide cohort study. BMJ 2018;360:k678.
[8] Persson R, Jick S. Clinical implications of the association between fluoroquinolones and tendon rupture: The magnitude of the effect with and without corticosteroids. Br J Clin Pharmacol 2019;85:949-959
[9] Tandan M, Cormican M, Vellinga A. Adverse events of fluoroquinolones vs. other antimicrobials prescribed in primary care: A systematic review and meta-analysis of randomized controlled trials. Int J Antimicrob Agents 2018;52:529-540

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.