
- DAZ.online
- DAZ / AZ
- DAZ 42/2019
- Dicke (oder dünne) Luft
Physiologie
Dicke (oder dünne) Luft?
Nobelpreis-würdige Erforschung des zellulären Sauerstoffmesssystems
Bereits seit Ende des 19. Jahrhunderts ist bekannt, dass sich die Zahl der roten Blutkörperchen bei einem Aufenthalt in Gegenden, die 3000 bis 5000 m über dem Meeresspiegel liegen, erhöht, um den niedrigeren Sauerstoffpartialdruck in der Luft und damit auch die geringere Versorgung mit dem lebensnotwendigen Gas auszugleichen. Es dauerte dann allerdings noch bis in die 1950er-Jahre bis Erythropoetin als Wachstumsfaktor für die Bildung von Erythrozyten identifiziert und die Rolle der Niere für die Produktion dieses Hormons aufgeklärt war. Unklar war jedoch weiterhin, wie die Verbindung zwischen Sauerstoff und Erythropoetin aussah. An dieser Stelle kamen Gregg Semenza, William Kaelin und Peter Ratcliffe ins Spiel.
Der Weg des Sauerstoffs
Wir atmen – ständig. Etwa 10- bis 20-mal pro Minute. Beim Einatmen vergrößern wir unser Lungenvolumen, wodurch der Luftdruck in unseren Lungenbläschen niedriger als in der Umgebung wird und die Luft in die Alveolen strömen kann. Dieser Vorgang wird natürlich umso schwieriger, je niedriger der Luftdruck in der Umgebung ist – sprich z. B. im Hochgebirge. In der Lunge angekommen kann O2 im Austausch gegen CO2 in das Kapillarblut diffundieren, der Rest wird wieder ausgeatmet. Das Ganze ist kein quantitativer Vorgang: Enthält die Inspirationsluft ca. 21 Vol.-% O2 und 0,03 Vol.-% CO2, hat die Expirationsluft immer noch einen Gehalt von 17 Vol.-% O2 und nur 4 Vol.-% CO2.
Im Blut angekommen befindet sich nur ca. 1,5 % des O2 gelöst im Plasma, der Rest wird in den Erythrozyten an Hämoglobin gebunden. An dieser Stelle des Sauerstoffwegs finden sich drei frühere Nobelpreisträger für Chemie: 1930 ging der Preis an Hans Fischer für seine Arbeiten zum Aufbau von Hämin und Chlorophyll sowie die Synthese des Hämins, 1962 an Max F. Perutz und John C. Kendrew für ihre Studien zur Strukturaufklärung des Hämoglobins. Jedes Hämoglobin-Molekül, das bei Erwachsenen überwiegend aus je zwei α- und β-Ketten besteht, kann über die Häm-Gruppen vier Moleküle O2 transportieren. In unserem Blut befinden sich durchschnittlich 12 – 16 g/dl (Frauen) bzw. 13 – 18 g/dl (Männer) Hämoglobin, die insgesamt mehr als 1000 ml O2 pro Minute im Gewebe verteilen können. Interessanterweise besteht das Hämoglobin eines menschlichen Babys während der Entwicklung im Mutterleib bis zu einem Alter von ca. drei Monaten aus je zwei α- und γ-Ketten und weist dadurch eine höhere Affinität zu O2 auf, was eine ausreichende Versorgung mit Sauerstoff während der Schwangerschaft sicherstellt.
Im Blutkreislauf ändert sich die Affinität des Hämoglobins zu O2 bedingt durch die höhere CO2-, H+- und 2,3-Diphosphoglycerat-Konzentration derart, dass in den arbeitenden Geweben Sauerstoff abgegeben wird. Das Hämoglobin wird während der Entstehung der roten Blutkörperchen in den Proerythroblasten gebildet und ist damit abhängig von der durch Erythropoetin stimulierten Erythropoese.
Die Niere – ein besonderes Organ
Obwohl unsere Nieren relativ klein sind und weniger als 0,5% unserer Gesamtkörpermasse ausmachen, sind sie enorm gut durchblutet: Sie erhalten 20 – 25 % des Herzzeitvolumens und werden mit ca. 1200 ml Blut pro Minute durchspült. Über ihre ausgeklügelte Anatomie können sie ihrer Aufgabe, Stoffwechselendprodukte aus dem Blut zu entfernen und den Wasserhaushalt und das Blutvolumen sowie die Ionenzusammensetzung zu regulieren, hervorragend nachkommen. Ganz nebenbei messen sie auch noch die Sauerstoffkonzentration und schütten bei Bedarf Erythropoetin aus.
Während die Sauerstoffkonzentration in anderen Organen und Geweben steigt sobald sie stärker durchblutet werden, ist das in den Nieren nicht der Fall. Werden die nämlich stärker durchblutet, steigt auch die Filtrationsrate und die Na+/K+-ATPase ist schwer damit beschäftigt, Natrium wieder aufzunehmen – ein enorm energie- und damit auch sauerstoffverbrauchender Schritt. Als Endergebnis bleibt der O2-Gehalt in den Nieren unter physiologischen Bedingungen relativ konstant. Erst wenn sich der Sauerstoffgehalt des Blutes – beispielsweise im Hochgebirge – dramatisch ändert, variiert auch die O2-Konzentration in den Nieren stärker.
Gelangt Sauerstoff in die Nierenzellen, wird er von den Prolyl-4-hydroxylasen PHD1, PHD2 und PHD3 dazu benutzt, in Anwesenheit von 2-Oxoglutarat spezifische Prolinreste in Proteinen zu hydroxylieren. Diese Hydroxylasen wurden parallel von den Arbeitsgruppen von Peter J. Ratcliffe und William Kaelin Jr. charakterisiert. Als besonders wichtig stellten sich zwei Prolinreste in einem Transkriptionsfaktor heraus, der in den frühen 1990er-Jahren von Gregg Semenza und seinen Mitarbeitern identifiziert und als Hypoxia Inducible Factor oder kurz HIF bezeichnet wurde. HIF wurde damals als das entscheidende Steuerelement identifiziert, das die Expression des Erythropoetin-Gens reguliert.
HIF und VHL
Mittlerweile sind drei HIF-Proteine bekannt, wobei HIF-1α und HIF-2α (EPAS1) bisher am besten charakterisiert wurden. HIFs sind Heterodimere, die jeweils aus einer von drei möglichen hydroxylierbaren α-Untereinheiten und einer β-Untereinheit bestehen. Erst im Zellkern dimerisieren die beiden Proteine und binden an kurze Kontrollsequenzen, sogenannte Hypoxia Responsive Elements (HREs), entsprechender Gene und steigern deren Expression. Während HIF-1β konstitutiv exprimiert wird und bereits im Zellkern vorliegt, sind die α-Untereinheiten im normalen Sauerstoffmilieu nicht nachweisbar. Grund dafür ist der sehr schnelle Abbau des Proteins, der durch die Bindung an das Tumorsuppressor-Protein VHL eingeleitet wird.
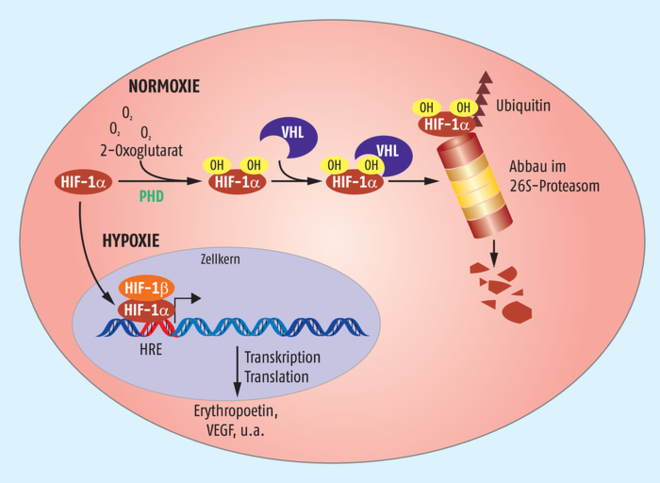
William Kaelin Jr. interessierte sich bereits Mitte der 1990er-Jahre für die von-Hippel-Lindau-(VHL)-Erkrankung, einem seltenen, autosomal dominant vererbten Tumor, der verschiedene Organe betreffen kann, und identifizierte ein mit dieser Krankheit assoziiertes Protein, das VHL. Es fungiert als Tumorsuppressor und ist für die Substraterkennung einer E3-Ubiquitin-Ligase verantwortlich. Peter J. Ratcliffe brachte VHL und HIF zusammen und zeigte, dass durch Bindung von VHL an den hydroxylierten HIF der Transkriptionsfaktor umgehend dem Abbau durch das zelluläre Proteasom zugeführt wird (Abb. 1). Erst wenn nicht mehr genügend Sauerstoff für die Hydroxylierung von HIF-α zur Verfügung steht, wird das Protein stabilisiert, kann in den Zellkern wandern und dort zusammen mit HIF-1β die Genexpression steuern.
Abb. 1: Sauerstoffmessung in Zellen. In Anwesenheit von Sauerstoff (Normoxie) wird HIF-1α von Prolyl-4-hydroxylasen (PHD) hydroxyliert und dadurch die Bindung an den von-Hippel-Lindau-Faktor (VHL) ermöglicht. VHL vermittelt die Polyubiquitinierung von HIF-1α und damit den proteasomalen Abbau. Fehlt hingegen der Sauerstoff unter hypoxischen Bedingungen, wird HIF-1α stabilisiert, kann in den Zellkern wandern und dort nach Dimerisierung mit HIF-1β die Expression verschiedener Proteine stimulieren.
Zu den unter HIF-Kontrolle exprimierten Proteinen zählen neben Erythropoetin auch der vaskuläre endotheliale Wachstumsfaktor VEGF, die Phosphoglyceratkinase, die Hexokinase, Transferrin und Transferrinrezeptor sowie weitere Proteine, die im Glucosemetabolismus und in der Gefäßentwicklung und -remodellierung involviert sind, allerdings auch PHD2 und PHD3, so dass HIF im Falle einer erneuten Versorgung mit Sauerstoff schnell abgebaut wird.
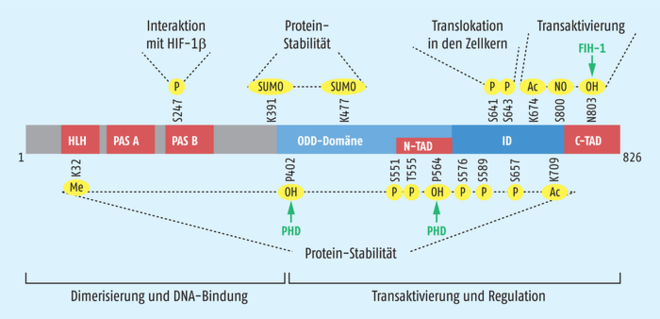
Ein anderer sauerstoffabhängiger Regulationsmechanismus für HIF wurde ebenfalls von Gregg Semenza aufgeklärt: Ein Protein, das als Factor Inhibiting HIF (FIH-1) bezeichnet wurde, hydroxyliert einen Asparaginrest in der N-terminalen Aktivierungsdomäne (NTAD) von HIF-1α und HIF-2α. Dadurch kann keine Interaktion mit dem Transkriptions-Ko-Aktivator-Komplex p300/CBP erfolgen und die Genexpression von z. B. Erythropoetin wird nicht initiiert. Viele weitere Mechanismen sind mittlerweile identifiziert, die die Expression, Stabilität und Funktion von HIF-1α auf verschiedenen Ebenen kontrollieren (Abb. 2). Diese sehr subtile Kontrolle zeigt die zentrale Bedeutung des Transkriptionsfaktors.
Abb. 2: Schematischer Aufbau von HIF-1α. Der Transkriptionsfaktor enthält einige konservierte Domänen, die für die Dimerisierung, DNA-Bindung, Kernlokalisierung und Transaktivierung benötigt werden. Neben den von Gregg Semenza identifizierten Sauerstoff-abhängigen Hydroxylierungen an den Prolinen 402 und 564 sowie am Asparagin 803 sind mittlerweile etliche weitere Modifikationen des Proteins bekannt, die von verschiedenen Proteinen (hier nicht eingezeichnet) reguliert werden und ebenfalls HIF-1α inaktivieren. Ac = Acetylierung; C-TAD = C-terminale Transaktivierungsdomäne; FIH = Factor Inhibiting HIF; HLH = Helix-Loop-Helix-Motiv; ID = Inhibitor-Domäne; Me = Methylierung; NO = Nitrosylierung; N-TAD = N-terminale Transaktivierungsdomäne; ODD = Sauerstoff-abhängige Degradation; OH = Hydroxylierung; P = Phosphorylierung; PAS = Per-Arnt-Sim-Domäne; PHD = Prolyl-4-hydroxylase; SUMO = SUMOylierung.
Pharmakologische Angriffspunkte
Nachdem der molekulare Zusammenhang zwischen Hypoxie, Prolyl-4-hydroxylase und Erythropoetin hergestellt war, dauerte es nicht lange, bis erste PHD-Inhibitoren wie Vadadustat, Daprodustat oder Roxadustat entwickelt wurden, die zum Teil bereits in Klinischer Phase III zur Behandlung einer Anämie bei Nierenerkrankungen getestet werden. In Japan und China ist Roxadustat bereits zugelassen und unter Evrenzo® bzw. Ai Rui Zhuo® zur Therapie einer Anämie bei chronischer Niereninsuffizienz verfügbar. Außerdem erhofft man sich durch eine pharmakologisch erhöhte HIF-Funktion auch eine Besserung bei einer Reihe ganz unterschiedlicher Erkrankungen und Symptome wie gestörte Immunfunktion, Wundheilung und Knorpelbildung. Da HIF auch an der Gefäßneubildung und an der Regulierung des vaskulären Tonus beteiligt ist, muss eine Steigerung der Funktion des Transkriptionsfaktors kritisch verfolgt werden: Im Tumorgewebe und bei einigen kardiovaskulären Erkrankungen findet man erhöhte HIF-Konzentrationen, weshalb in diesen Fällen eher eine Inhibition von HIF in Betracht gezogen werden sollte. Und auch da gibt es z. B. mit RO7070179 oder EZN-2968 Inhibitoren der HIF-1α-Expression, die bei Leberzellkarzinom bzw. Lymphomen in Phase I getestet wurden.
Fazit
Die Aufklärung des „missing link“ zwischen der Sauerstoffversorgung und der Expressionskontrolle von Erythropoetin waren wesentliche Grundlagenexperimente, die den Nobelpreis wirklich verdient haben. Inwieweit daraus tatsächlich therapeutische Ansätze entwickelt werden können, bleibt abzuwarten: HIFs sind wesentliche Transkriptionsfaktoren, die in eine Vielzahl wichtiger Prozesse involviert sind. An diesen Stellschrauben zu drehen, könnte auch zu etlichen unerwünschten Arzneimittelwirkungen führen. |






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.