
- DAZ.online
- DAZ / AZ
- DAZ 4/2019
- Stromstöße für mehr ...
Medizin
Stromstöße für mehr Bewegung
Die tiefe Hirnstimulation hat sich bei Morbus Parkinson bewährt
Ein komplex verknüpftes System motorischer Schaltstationen in der Tiefe des Gehirns sorgt dafür, dass der Mensch seine Muskulatur in funktionell angemessener Weise aktivieren kann, ohne sich dessen ständig bewusst sein zu müssen. Die sogenannten Basalganglien sind eine Gruppe miteinander in Verbindung stehender subkortikaler Kernregionen, die nicht nur an kognitiven und mnemonischen (Gedächtnisleistung) Funktionen beteiligt sind, sondern auch an der Initiierung, Ausführung und Kontrolle von Bewegungen. Sie sind wichtige funktionelle Bestandteile der extrapyramidal-motorischen Bahnen und sind somit für sichere, effiziente und fein abgestimmte motorische Abläufe unerlässlich.
Lokalisiert sind die Basalganglien unterhalb des Kortex des Vorderhirns, wobei sie im Stammhirn dem Thalamus auf beiden Seiten vorne und seitlich anliegen. Sie bestehen aus mehreren neuronenreichen Kernkomplexen, wie z. B. dem Striatum (Corpus striatum, bestehend aus Nucleus caudatus und Putamen), dem Pallidum (Globus pallidus) und (funktionell) dem Nucleus subthalamicus. In diesem motorischen Netzwerk modulieren die Neurotransmitter Dopamin und Acetylcholin die Intensität der GABA(γ-Amino-Buttersäure)-ergen inhibitorischen Wirkung. Die extrapyramidal-motorischen Informationen werden von den Basalganglien über den Thalamus zum Motorkortex weitergeleitet und schließlich über die Medulla oblongata zum Rückenmark.
Dopamin als modulierender Transmitter
Funktionell eingegliedert in diese Schaltkreise ist die Substantia nigra, ein im Mittelhirn gelegener Kernkomplex. Morphologisch lassen sich zwei Anteile unterscheiden, eine dunkle Pars compacta aus dicht gelagerten melaninhaltigen Nervenzellen und eine durch einen hohen Eisengehalt rötlich erscheinende Pars reticulata. In den dopaminergen Neuronen der Pars compacta kommt es zur Ausschüttung von Dopamin, einem Zwischenprodukt in der von der Aminosäure Tyrosin ausgehenden Biosynthese von Adrenalin. Tyrosin wird durch die Tyrosinhydroxylase in Levodopa umgewandelt und dieses wiederum durch die L-Dopa-Decarboxylase in Dopamin, welches dann in den präsynaptischen Speichervesikeln aufgenommen wird. Freigesetzt wird das Dopamin bedarfsangepasst, die Substantia nigra zeigt hier also eine zusätzliche „Pufferfunktion“. Nicht gespeichertes Dopamin wird durch die mitochondriale Monoaminooxidase B abgebaut.
Die komplexe Wirkungsweise der dopaminergen Rezeptorsubtypen in den Basalganglien ist nur partiell bekannt. Vereinfacht dargestellt unterscheidet man
- exzitatorische D1-Rezeptoren auf den GABAergen Neuronen des Striatums,
- inhibitorische D2-Rezeptoren, über welche die GABAerge Wirkung vor allem an den Synapsen im Pallidum oder Nucleus subthalamicus bedarfsgerecht angepasst wird.
Zelluntergang in der Substantia nigra
In den Autopsiebefunden verstorbener Patienten mit Morbus Parkinson ist die physiologische Dunkelfärbung der Pars compacta der Substantia nigra durch Melanin nicht mehr nachzuweisen. So geht man bereits seit Anfang des 20. Jahrhunderts davon aus, dass die Degeneration der dortigen dopaminergen Neurone für die motorischen Störungen der Parkinson-Erkrankung von entscheidender Bedeutung ist. Aufgrund seines Mangels ist die bedarfsangepasste Wirkung des Dopamins auf die GABAergen Projektionen zu gering, es kommt zu einer Dysbalance: Vor allem die exzitatorischen Impulse des Nucleus subthalamicus stören den physiologischen „Stromkreis“ der Basalganglien, sodass deren Signale letztlich ungefiltert über die motorischen Thalamuskerne bis zum Rückenmark gelangen.
Nach der Alzheimer-Demenz ist die Parkinson-Erkrankung die zweihäufigste neurodegenerative Erkrankung. Laut Angabe der Deutschen Gesellschaft für Parkinson und Bewegungsstörungen (DPG e. V.) sind weltweit rund 4,1 Millionen Menschen an Parkinson erkrankt. In Deutschland sind etwa 250.000 bis 280.000 Personen betroffen, Männer etwas häufiger als Frauen. Die Erkrankung beginnt meist zwischen dem 50. und 79. Lebensjahr.
Parkinson-Ursache bleibt oft unklar
Histopathologisches Kennzeichen des Morbus Parkinson ist die abnorme Akkumulation und Ablagerung des Proteins α-Synuclein überwiegend in den dopaminergen Neuronen des zentralen Nervensystems. Dies geschieht in Form intrazellulärer Einschlusskörperchen, der sogenannten „Lewy bodies“. Nach einer inzwischen weit verbreiteten Hypothese sind diese Ablagerungen nicht nur für die Entwicklung der „Lewy-Demenz“ verantwortlich, sondern auch für den beschleunigten Zelltod in der Pars compacta. Interessanterweise lassen sich bei Parkinson-Patienten auch extrazerebral α-Synuclein-Ablagerungen nachweisen, insbesondere in gastrointestinalen Neuronen.
Die Ursachen der Erkrankung bleiben in vielen Fällen unbekannt, sodass man aufgrund des variablen klinischen Bildes von einer Kombination verschiedener pathogenetischer Einflüsse ausgehen muss. In den Leitlinien der Deutschen Gesellschaft für Neurologie (DGN) werden die Parkinson-Syndrome in vier Gruppen unterteilt (s. Kasten „Einteilung der Parkinson-Syndrome).
Einteilung der Parkinson-Syndrome
idiopathisches Parkinson-Syndrom (IPS)
- ca. 75% aller Erkrankungen
- z. B. akinetisch-rigider Typ
- z. B. Tremor-Dominanz-Typ
genetische Formen des Parkinson-Syndroms
- inzwischen über 15 verschiedene Genmutationen mit autosomal dominantem oder rezessivem Erbgang bekannt
atypische Parkinson-Syndrome
- im Rahmen anderer neurodegenerativer Erkrankungen)
- z. B. Demenz vom Lewy-Körper-Typ (DLK)
- z. B. Multisystematrophie (MSA): Parkinson-Typ (MSA-P) oder zerebellärer Typ (MSA-C)
symptomatische (sekundäre) Parkinson-Syndrome
- medikamenteninduziert (z. B. klassische Neuroleptika, Antiemetika, Lithium, Valproinsäure, Calcium-Antagonisten wie Cinnarizin)
- tumorbedingt
- posttraumatisch (z. B. durch Boxen, s. Muhammad Ali)
- toxininduziert (z. B. durch Kohlenmonoxid, Pestizide/Herbizide, Schwermetalle wie Mangan, Blei, Eisen)
- entzündlich (AIDS-Enzephalopathie oder seltene Enzephalitiden)
- metabolisch (z. B. Morbus Wilson, Hypoparathyreoidismus)
Quelle: Deutscher Gesellschaft für Neurologie (DGN)
Nicht nur motorische Symptome sind belastend
Erste typische Krankheitszeichen fallen erst auf, wenn ca. 55 bis 60% der dopaminergen Zellen der Substantia nigra abgestorben sind. Parkinson-Syndrome sind definiert (s. Tab. 1) durch das Kardinalsymptom der Bewegungsarmut (Brady- bis Akinese), flankiert von mindestens einem der folgenden Symptome wie
- erhöhtem Muskeltonus (Rigor),
- Muskelzittern (Tremor),
- Störung der Haltungsstabilität (posturale Instabilität).
Symptom |
Beschreibung |
|---|---|
Bradykinese/Akinese |
|
Rigor |
|
Tremor |
|
posturale Instabilität |
|
Neben den motorischen Haupt- zeigen sich oft fakultative nichtmotorische Begleitsymptome (s. Tab. 2), die beispielsweise vegetativer oder psychischer Natur sein können. Auch bei peripheren Symptomen wie Obstipation, verstärktem Speichelfluss, Schlafstörungen, orthostatischer Dysregulation oder Miktionsstörungen dürfte die Verschiebung des cholinergen/dopaminergen Gleichgewichts durch Abnahme der Dopamin-Verfügbarkeit und Zunahme der Acetylcholin-Rezeptorstimulation eine wichtige Rolle spielen. Ebenso dürften auch psychische und kognitive Einschränkungen wie Depressionen, Halluzinationen und Demenz auf eine verminderte Dopamin-Rezeptorstimulation zurückzuführen sein. Die Substantia nigra projiziert nämlich nicht nur zum Striatum, sondern aktiviert auch andere Dopamin-Rezeptoren, vor allem im Neokortex, dem „Sitz“ der Wahrnehmung, des Gedächtnisses und des Willens.
sensorische Symptome |
|
vegetative Symptome |
|
psychische Symptome |
|
kognitive Symptome |
|
Problematische Langzeitbehandlung mit L-Dopa
Die Parkinson-Erkrankung schreitet progredient voran, kausale Behandlungsmöglichkeiten stehen bislang noch nicht zur Verfügung, ebenso wenig sind Maßnahmen zur Prävention bekannt. Die Therapie der motorischen Symptome zielt vorwiegend auf die Kompensation des dopaminergen Defizits ab. Da Dopamin die Blut-Hirn-Schranke nicht überwinden kann, verbietet sich seine Gabe als Mittel der ersten Wahl. Für die medikamentöse Behandlung stehen dennoch verschiedene Substanzen zur Verfügung, auf die hier jedoch nicht im Detail eingegangen werden soll.
Hauptsächlich werden L-Dopa-Präparate in Kombination mit einem Decarboxylase-Hemmer (z. B. Carbidopa) oder – bei eher jüngeren Patienten – Dopamin-Agonisten eingesetzt. Daneben können MAO-B-Hemmer (Selegilin, Rasagilin) eingesetzt werden und insbesondere bei Tremor auch Anticholinergika. Zur Verlängerung der Wirkung können im fortgeschrittenen Stadium Levodopa-Präparate zusätzlich mit COMT-Hemmern (Entacapon, Tolcapon) kombiniert werden.
Die unerwünschten Wirkungen, die in der Langzeitbehandlung mit L-Dopa zunehmend problematischer werden und die Lebensqualität der Betroffenen zusätzlich beeinträchtigen, sind Überbewegungen (Dyskinesien) und Wirkungsschwankungen (Fluktuationen). Diese Störungen sind weniger als direkte Arzneimittelnebenwirkungen zu werten, sondern vielmehr als „Spätkomplikation“ des Morbus Parkinson. Durch die Progression der zellulären Veränderungen verliert die Substantia nigra mehr und mehr ihre obengenannte Pufferfunktion. Als Folge wird das aus L-Dopa umgewandelte Dopamin nicht mehr adäquat gespeichert und „verbraucht“. Als Reaktion auf die schwankende Stimulierung durch Dopamin verändern sich darüber hinaus die Dopamin-Rezeptoren, vor allem im Striatum. Dadurch kommt es bei vielen Patienten zu belastenden On-Off-Fluktuationen: Nach Einnahme von L-Dopa ergibt sich für kurze Zeit eine gute und angemessene Motorik, dann zeigen sich jedoch wieder Bradykinese und Rigor oder beim Versuch zu gehen eine Starthemmung (freezing).
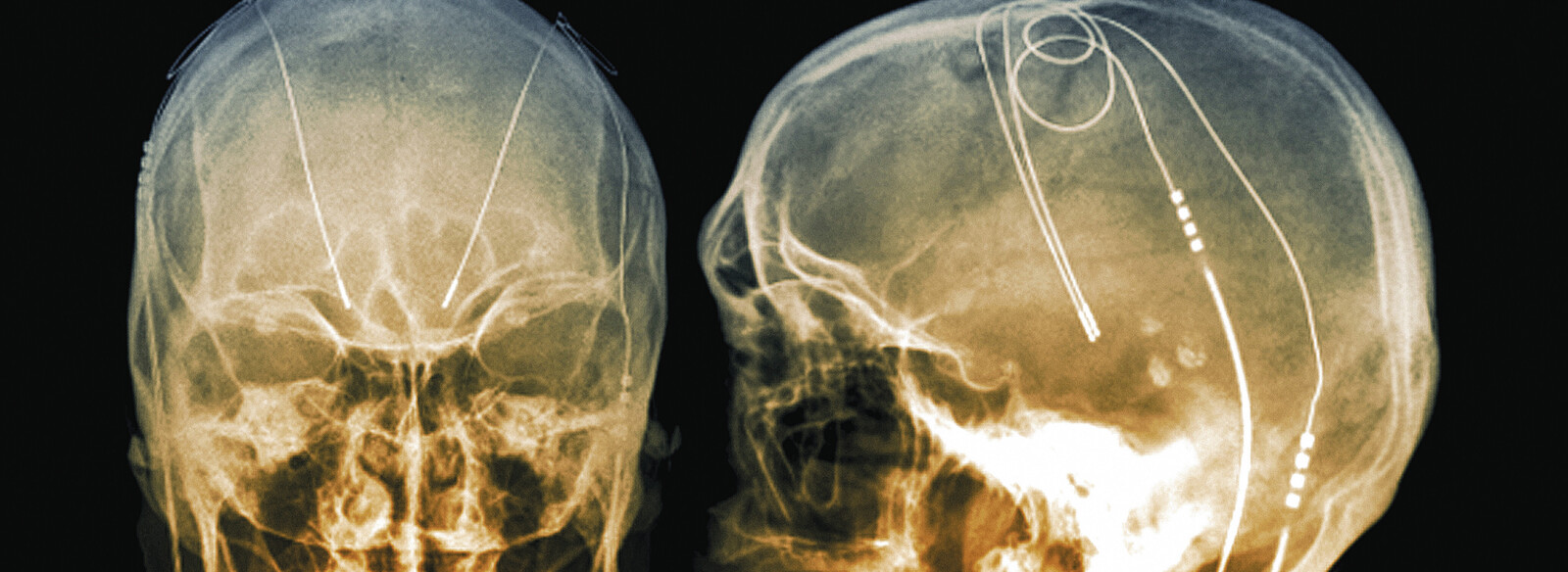
Hirnstimulation durch implantierte Elektroden
Bei abnehmender Wirkdauer von L-Dopa bzw. sehr häufigen Einnahmefrequenzen, bei intolerablen Dyskinesien und Fluktuationen und medikamentös nicht beherrschbaren schmerzhaften Blockaden sowie bei Tremor kann die Indikation zur tiefen Hirnstimulation (THS) gestellt werden. In den 1970er-Jahren zum ersten Mal zur Therapie des chronischen Schmerzes eingesetzt, gilt sie heute als etabliertes Verfahren zur Behandlung der fortgeschrittenen Parkinson-Krankheit. Daher wurde das Verfahren auch in den Leistungskatalog aller gesetzlichen und privaten Krankenkassen aufgenommen. Andere Indikationen sind Epilepsie, Dystonien und psychiatrische Erkrankungen wie Zwangsstörungen.
Bei der tiefen Hirnstimulation werden individuell gesteuerte hochfrequente Strompulse (typischerweise 130 Hz) mithilfe
- eines subkutan implantierten Impulsgenerators sowie
- in tiefere Hirnregionen eingeführter Stimulationselektroden
- gezielt an strategische intrazerebrale Punkte geleitet.
Vermutlich zeigen diese Impulse eine vorwiegend aktivierende Wirkung auf axonale Strukturen. Welcher tatsächliche Effekt sich durch die Stimulation letztlich ergibt, hängt von der Funktion des individuellen Neurons ab: inhibitorisch oder exzitatorisch.
Stereotaktischer Eingriff erforderlich
Die Elektroden werden in einem sogenannten funktionellen stereotaktischen Eingriff im Patientengehirn platziert. Hierunter versteht man ein minimalinvasives Verfahren der Neurochirurgie, bei der die zu operierende Struktur nicht operativ freigelegt wird. Bei dieser Methode sind der Kopf des Patienten und die neurochirurgischen Instrumente in einem fest verschraubten Rahmensystem fixiert. Mithilfe bildgesteuerter (Röntgendurchleuchtung, CT, MRT) sowie mechanischer bzw. computerassistierter Zielführungssysteme ist eine genaue Lokalisation möglich, sodass eine sehr exakte Intervention erfolgen kann. Dadurch können die Stimulationselektroden über ein kleines Bohrloch im Schädel (wenige Millimeter Durchmesser) an genau vorausberechneten Positionen platziert werden.
Verbunden sind die Elektroden mit einem Schrittmacher, der in einem zweiten Teil der Operation – pektoral oder abdominal – subkutan implantiert wird. Während das Anlegen des Rahmens, die Bohrungen und die Schrittmacherimplantation in (Kurz-)Narkose durchgeführt werden, genügt für das Einbringen der Elektroden eine Lokalanästhesie, da Manipulationen im Gehirn selbst schmerzfrei sind. Dies ist ein essenzieller Vorteil, da während der Elektrodenplatzierung Testreizungen erforderlich sind, die eine Mitarbeit des Patienten erfordern.
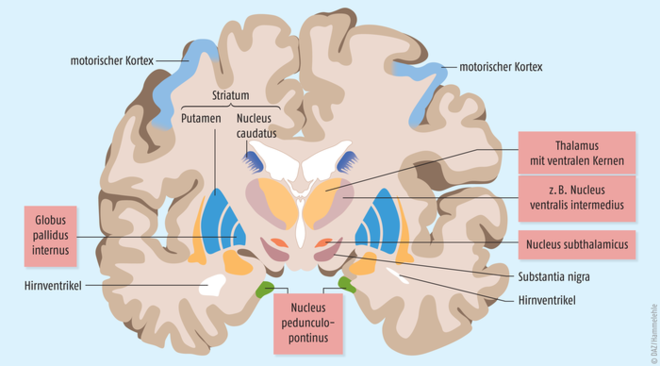
Zurzeit vier Hirnregionen im Fokus
Beim Morbus Parkinson kommen als Zielorte der Stimulation derzeit vier verschiedene Hirnregionen in Betracht (Abb. 1):
- Nucleus subthalamicus (STN),
- Globus pallidus internus (GPI),
- Nucleus ventralis intermedius des Thalamus (VIM),
- pedunculopontiner Kern (PPN).
Die Stimulation der beiden letztgenannten Areale (Thalamus und N. pedunculopontinus) ist Patienten mit einer überwiegenden Tremorsymptomatik vorbehalten, während die Stimulation der beiden erstgenannten Areale (N. subthalamicus und Globus pallidus internus) in erster Linie auf die Linderung der motorischen Komplikationen der Levodopa-Therapie abzielt.
Nach der aktuellen Studienlage können die tiefe Hirnstimulation des Nucleus subthalamicus und die des Globus pallidus internus als gleichwertige Behandlungsoptionen bei motorischen Wirkfluktuationen oder Dyskinesien betrachtet werden. Ebenso zeigten vergleichende Studien dieser beiden Zielgebiete ähnliche Ergebnisse im Hinblick auf die Kardinalsymptome Rigor, Tremor und Hypokinese, wobei allerdings ein tendenziell besseres Ansprechen der Akinese bei der Stimulation des N. subthalamicus beobachtet wurde.
Stimulation des Nucleus subthalamicus
Dennoch dient heute in Europa zumeist der Nucleus subthalamicus als Zielgebiet der ersten Wahl, insbesondere auch bei jüngeren Patienten. Ein Grund hierfür ist die in Langzeitverläufen beobachtete nachlassende Wirkung der GPI-Stimulation, die nur durch einen Wechsel auf den Nucleus subthalamicus als neuen Zielort behoben werden konnte. Darüber hinaus ist die Stimulation des Nucleus subthalamicus der Stimulation des Globus pallidus internus in Bezug auf eine Reduktion der dopaminergen Medikation überlegen.
In verschiedenen Studien zeigte die tiefe Hirnstimulation des Nucleus subthalamicus beispielsweise die folgenden positiven Wirkungen:
- Rückgang von Rigor, Hypokinese und meist auch des Parkinson-Tremors um 41 bis 50% (Unified Parkinson Disease Rating Scale [UPDRS] Motor Score)
- Verbesserung der Lebensqualität um ca. 25% (Parkinson’s Disease Questionnaire [PDQ] 39)
- Rückgang von Dyskinesien (um 54% auf einer Dyskinesie-Skala) und Nebenwirkungen wie Halluzinationen oder Impulskontrollstörungen durch Reduktion der Begleitmedikation
- Linderung auch nichtmotorischer Beschwerden wie Dranginkontinenz, Obstipation, Schmerzen und Schlafstörungen
Laut Leitlinie der Deutschen Gesellschaft für Neurologie soll die bilaterale elektrische Stimulation des Nucleus subthalamicus Patienten mit nachgewiesener idiopathischem Parkinson-Syndrom angeboten werden, die eine der folgenden Krankheitsausprägungen aufweisen:
- medikamentös nicht behandelbare motorische Fluktuationen und Dyskinesien oder
- einen medikamentös nicht kontrollierbaren Tremor.
Als zusätzliche obligate Kriterien werden genannt:
- Ansprechen der bisherigen Symptome auf Levodopa (außer Tremor),
- keine Frühsymptome einer Demenz,
- keine signifikante psychische oder somatische Komorbidität,
- keine neurochirurgischen Kontraindikationen.
Wirkung und Nebenwirkung über verschiedene Nervenbahnen
Als unerwünschte Effekte der Stimulation des Nucleus subthalamicus ließen sich in einem Review von 82 Publikationen vor allem neuropsychiatrische Symptome ermitteln:
- kognitive Beeinträchtigungen (ca. 40%), z. B. in Bezug auf das Arbeitsgedächtnis,
- Depressionen (ca. 8%), Hypomanie (ca. 4%) und Apathie,
- Angststörungen (ca. 2%), Suizidversuche (ca. 0,4%),
- Persönlichkeitsveränderungen, Hypersexualität, Aggression (jeweils ca. 0,5%).
Weitere Informationen
- Zentrum für Tiefe Hirnstimulation: www.ukr.de/zentren/tiefe-hirnstimulation/Weiterf__hrende_Links/index.php, www.dystonie.de
- Website der Deutschen Dystoniegesellschaft e. V. (DDG): www.dystonie.de
- Patienteninformationsseite über essenziellen Tremor: www.tremor.org
- Website der Deutschen Parkinsonvereinigung e. V. (dPV): www.parkinson-vereinigung.de
- Arbeitsgemeinschaft Tiefe Hirnstimulation e. V. (AG THS): www.tiefehirnstimulation.de
- Kompetenznetz Parkinson: www.kompetenznetz-parkinson.de
- International Parkinson and Movement Disorder Society: www.movementdisorders.org
Als Ursachen vermutet man nicht nur die Grunderkrankung und den Vorgang der Hirnstimulation als solchen, sondern auch Adaptationsprobleme durch den lebensverändernden Eingriff, ein eventuelles Implantationstrauma sowie eine zerebrale Sensitivierung durch eine gegebenenfalls langjährige Dopamin-Substitution.
Mit einem durch Bildgebung und simulierenden Netzwerkanalysen gestützten Verhaltensexperiment wurde kürzlich der Einfluss der tiefen Hirnstimulation auf motorische sowie kognitive Nervenbahnen untersucht [5]. Hierbei konnten die Forscher nachweisen, dass motorische Effekte zur Verbesserung der Motorik über andere neuronale Pfade vermittelt werden als unerwünschte kognitive Effekte. So verminderte die Stimulation des Nucleus subthalamicus bei Parkinson-Patienten die adäquate Anpassung der Reaktionszeit an eine Aufgabenstellung, was zwar ein vorschnelles, aber auch fehlerhaftes Handeln bewirkte. Dies geschah jedoch unabhängig von der therapeutischen Verbesserung des motorischen Ablaufs. Mit dieser Erkenntnis erhofft man sich ein noch tieferes Verständnis der beteiligten neuronalen Netzwerke. Ziel sind noch effektivere und an die individuelle Konstellation des Patienten angepasste intelligente Stimulationsalgorithmen, welche die Funktion unterschiedlicher neuronaler Pfade berücksichtigen. |
Literatur
[1] Strüder HK et al. Physiologie und Pathophysiologie der Basalganglien – Einfluss auf die Motorik. Deutsche Zeitschrift für Sportmedizin 2001;12(52):350-360
[2] Debove ID, Lachenmayer L, Müllner J, Sturzenegger M. Parkinson-Syndrom und Parkinson-Krankheit. Swiss Medical Forum 2017;17(20):448-455
[3] S3-Leitlinie Idiopathisches Parkinson-Syndrom der Deutschen Gesellschaft für Neurologie (DGN), Aktualisierung 2016. AWMF-Register-Nummer: 030-010
[4] Coenen VA, Amtage F, Volkmann J, Schläpfer TE. Tiefe Hirnstimulation bei neurologischen und psychiatrischen Erkrankungen. Dtsch Arztebl Int 2015;112:519–526, DOI: 10.3238/arztebl.2015.0519
[5] Neumann WJ, Schroll H, de Almeida Marcelino AL et al. Functional segregation of basal ganglia pathways in Parkinson‘s disease. Brain 2018;141:2655-2669






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.