
- DAZ.online
- DAZ / AZ
- DAZ 39/2019
- Spermien in Gefahr
AMTS
Spermien in Gefahr
Negative Wirkungen von Arzneimitteln auf die Zeugungsfähigkeit
Bei den multifaktoriellen Ursachen eines unerfüllten Kinderwunsches (für den Mann: siehe Kasten „Risikofaktoren“ auf S. 49), muss heutzutage einem Faktor größere Aufmerksamkeit geschenkt werden: Da sich Paare immer später dazu entscheiden, eine Familie zu gründen und manche Männer im höheren Alter (erneut) den Schritt ins Familienglück wagen, nimmt auch die Zahl derjenigen werdenden Eltern zu, die sporadisch oder chronisch Arzneimittel anwenden [6]. Die meisten Untersuchungen fokussieren dabei auf der Teratogenität als Folge einer Behandlung der Frau, schließlich besteht von der Reifung der Eizelle bis zur Geburt ein langer Expositionszeitraum. Die Historie lehrt uns, dass viele tragische Schicksale mit der Einnahme von Arzneimitteln während der Schwangerschaft verknüpft sind – Thalidomid, Retinoide, Antiepileptika, um nur einige zu nennen. Neben den teratogenen Effekten mancher Wirkstoffe können Arzneistoffe aber auch schon die Fruchtbarkeit beeinträchtigen, bei Frauen wie bei Männern. Dabei versteht man unter Unfruchtbarkeit oder Infertilität das Unvermögen, ein Kind zu zeugen bzw. zu empfangen. Nach WHO-Definition liegt sie beim Menschen vor, wenn nach zwölf Monaten trotz regelmäßigen, ungeschützten Geschlechtsverkehrs keine Schwangerschaft eintritt.
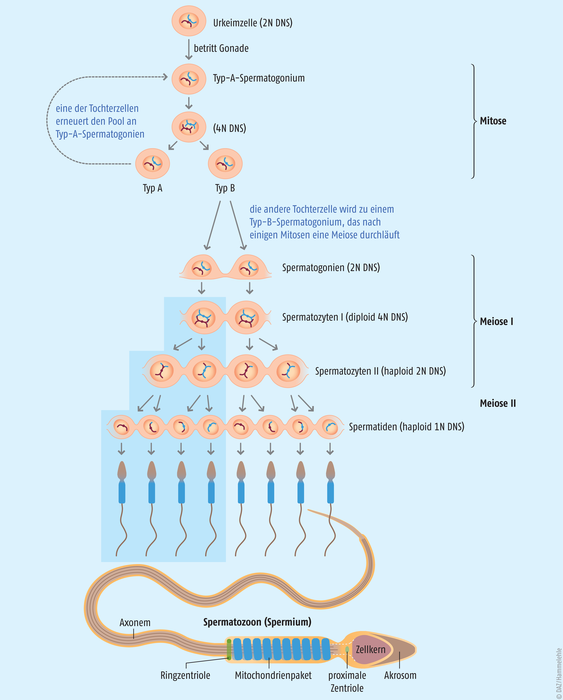
Schematische Darstellung der Spermatogenese Bereits zu einem frühen Zeitpunkt der Embryogenese wandern Keimzellen zu den Gonadenanlagen und werden dort zu Spermatogonien (Stammzellen). Mit der Pubertät beginnend entstehen durch mitotische Teilung immer wieder und zeitlebens neue Spermatogonien (Vermehrungsperiode). Die sogenannten Typ-A-Zellen kehren zum Zellpool zurück und teilen sich erneut. Typ-B-Zellen teilen sich und gehen in die Wachstumsperiode über, sie werden etwa doppelt so groß wie die Spermatogonien und werden als Spermatozyten I. Ordnung bezeichnet. In der Reifungsperiode entstehen hieraus Spermatozyten II. Ordnung (Präspermatiden), welche sich weiter in je zwei Spermatiden mit einfacher Chromosomenbestückung meiotisch teilen. Im letzten Schritt der Umbildungsperiode erfolgt die abschließende Differenzierung zu befruchtungsfähigen Spermien. Aus einer Stammzelle werden somit vier Spermatozoen (Spermien). [nach Boron WF, Boulpaep EL. Medical Physiology, 3rd ed., Elsevier 2016]
Arzneistoffe können zum Beispiel bei Männern negative Auswirkungen auf das Ejakulat und seine Zusammensetzung haben, indem sie gonadotoxische Effekte ausüben oder in hormonelle Regelkreise eingreifen, die wiederum die Spermatogenese (siehe Abb.) stören. Je nach Ausprägung der Störung(en) ist die Zeugungsfähigkeit leicht, deutlich oder stark eingeschränkt bis unmöglich und es werden bei einer mikroskopischen Untersuchung verschiedene Varianten eines atypischen Spermiogramms sichtbar:
- Aspermie: Fehlen eines Ejakulats trotz Orgasmus
- Oligozoospermie: verminderte Anzahl von Spermien im Ejakulat (Konzentration < 15 Millionen Spermien/ml Ejakulat)
- Kryptozoospermie: stark verminderte Anzahl von Spermien im Ejakulat (Konzentration < 1 Millionen Spermien/ml Ejakulat)
- Azoospermie: vollständiges Fehlen von Spermien im Ejakulat
- obstruktive Azoospermie: Spermatogenese nicht gestört, Spermien können aber aufgrund eines Verschlusses der Samenwege nicht ejakuliert werden
- nicht-obstruktive Azoospermie: gestörte Spermatogenese
- Asthenozoospermie: verminderte Motilität der Spermien im Ejakulat (< 32% der Spermien sind progressiv beweglich)
- Nekrozoospermie : nur unbewegliche, abgestorbene Spermien im Ejakulat vorhanden
- Teratozoospermie: Auftreten nicht regulär geformter Spermien im Ejakulat (< 4% der Spermien weisen eine normale Morphologie auf)
- Oligoasthenoteratozoospermie (OAT-Syndrom): Kombination der drei Parameter Oligo-, Astheno- und Teratozoospermie (Anzahl, Motilität und Form der Spermien sind abweichend von einem normalen Spermiogramm)
Darüber hinaus kann die sexuelle Funktionsfähigkeit durch Arzneistoffe, aber auch durch zugrundeliegende Erkrankungen wie eine Depression gemindert werden (Libidoverlust, Erektions- und Ejakulationsstörungen).
Medien-Lieblinge
Medienwirksam sind Fälle, die nicht nur die Zeugungsfähigkeit, sondern vor allem die Potenz (im engeren Sinne Erektionsfähigkeit) negativ beeinträchtigen. Grund zur Sorge besteht besonders dann, wenn die Störung über das Therapieende hinaus besteht (siehe DAZ 2018, Nr. 16, S. 26 – 30: Jungmayr P. „Haarwuchs mit Folgen – Erfolgreiche Finasterid-Behandlung kann zu dauerhaften Problemen führen“ und DAZ 2019, Nr. 30 , S. 20 – 22: Rausch R. „Genitale Taubheit nach SSRI und SNRI – Sexuelle Funktionsstörungen können über Jahre nach Therapieende anhalten“). Den selektiven Serotonin-Wiederaufnahmehemmern (SSRI) lasten solche möglicherweise persistierenden sexuellen Funktionsstörungen an. Kritiker sagen, dass sie durch die Bezeichnung PSSD (post-SSRI sexual dysfunction, persistierende sexuelle Funktionsstörung nach Absetzen von SSRI) „geadelt“ wurden, welche im Jahr 2013 in das psychiatrische Klassifikationssystem DSM-5 (Diagnostic and Statistical Manual of Mental Disorders) aufgenommen wurde. Auch die Europäische Arzneimittelagentur entschied im Sommer dieses Jahres, einen entsprechenden Warnhinweis zu persistierenden sexuellen Funktionsstörungen nach dem Absetzen von selektiven Serotonin-Wiederaufnahmehemmern und Serotonin-Noradrenalin-Inhibitoren (SNRI) in den Fach- und Gebrauchsinformationen zu veröffentlichen. Mit der Einnahme von SSRI werden aber auch reversible Beeinträchtigungen der Spermienqualität in Verbindung gebracht, weshalb ebenfalls in den Fachinformationen vor diesem möglichen Zusammenhang gewarnt wird.
Klinische Relevanz
Fraglich ist jedoch immer, ob Veränderungen in der Spermienzahl oder -qualität von klinischer Relevanz sind und eine Infertilität oder gar Fehlbildungen nach sich ziehen können. Dieser Fragestellung ging man beispielsweise bei den SSRI nach: Obschon morphologische Veränderungen und eine erhöhte Zahl an DNA-Fragmentierungen bei Spermien von Männern beobachtet wurden, zeigen sich bei den gezeugten Nachkommen keine negativen Effekte. In einer großen prospektiven schwedischen Studie war eine Antidepressiva-Einnahme des Erzeugers über einen Zeitraum von mindestens vier Wochen vor und nach der Befruchtung nicht mit Frühgeburtlichkeit, Missbildungen, Autismus und Lernschwierigkeiten assoziiert [1].
Spermien auf Eis
Unstrittig ist, dass reproduktionstoxische Arzneistoffe – um die es in diesem Artikel nicht primär geht – vor der Anwendung bei Männern eine Kryokonservierung des Spermas erfordern. Da die Spermatogenese aber erst mit Eintreten in die Pubertät beginnt, ist dies bei einer Chemotherapie präpubertärer Jungen nicht möglich, auch wenn es aufgrund negativer Effekte auf die spätere Zeugungsfähigkeit wünschenswert wäre. Für die Gruppe der Alkylanzien konnte beispielsweise gezeigt werden, dass die Höhe der im Kindesalter verabreichten Cyclophosphamid-Dosierung in negativer Korrelation zur Spermienkonzentration im Erwachsenenalter stand [2]. Des Weiteren reduzierte sich unter Chemotherapieprotokollen im Kindes- und Jugendalter mit Beteiligung von hochdosiertem Cyclophosphamid, Ifosfamid, Procarbazin oder Cisplatin bei erwachsenen Männern die Wahrscheinlichkeit, Kinder zu zeugen, gemessen im Vergleich zur Zeugungsfähigkeit ihrer Geschwister [3]. Zudem nimmt die Gefahr von Missbildungen der Nachkommen eines mit Chemotherapeutika behandelten Mannes zu, da sie meist mutagenes Potenzial besitzen. Ein Risiko, welches sich im Tierversuch nicht immer zuverlässig abbilden lässt. Auch bei einer hochdosierten Methotrexat-Therapie sollten Männer zu Möglichkeiten der Spermakonservierung beraten werden.
Auf einen Blick
- Der Einfluss von Arzneistoffen auf die Fertilität des Mannes erstreckt sich von direkten gonadotoxischen Effekten auf Veränderungen hormoneller Regelkreise und sexuelle Funktionsstörungen.
- Auffälligkeiten im Spermiogramm (Veränderungen der Spermienkonzentration und -qualität) können konkreten Arzneistoffen zugeordnet werden, über Alternativen entscheiden erfahrene Ärzte.
- Für Männer gelten auch für reproduktionstoxische Arzneistoffe gesonderte Vorsichtsmaßnahmen, die häufig im Rahmen eines Schwangerschaftsverhütungsprogrammes abgebildet sind.
Deutsche Daten
In ihrer Dissertationsschrift befasste sich Apothekerin Dr. Sina Vanessa Pompe mit dem Einfluss von Arzneimitteln auf die männliche Fertilität [6]. Die Studienpopulation umfasste Männer, die aufgrund eines unerfüllten Kinderwunsches in der andrologischen Ambulanz der Urologischen Klinik und Poliklinik der Ludwig-Maximilians-Universität (LMU) München erstmalig vorstellig wurden. In einer prospektiven Untersuchung von 40 Fällen konnte gezeigt werden, dass eine Medikationsanalyse geeignet war, um Arzneimittel zu identifizieren, die als Risikofaktor für die beeinträchtigte Spermienqualität und Fertilitätseinschränkung in Betracht kamen. In einer ebenfalls durchgeführten retrospektiven Analyse von 522 Patienten mit unerfülltem Kinderwunsch wurde aufgezeigt, dass fast jeder Zweite Arzneimittel einnahm. Jeder zweite Wirkstoff wirkte dabei negativ auf die männliche Sexualfunktion, am häufigsten standen die Wirkstoffe mit einer Reduktion der Libido, Potenzstörungen und Hormonveränderungen in Verbindung. Darüber hinaus bestand bei 16% der Wirkstoffe gemäß Literatur das Potenzial, die männliche Fertilität zu beeinträchtigen.
Risikofaktoren
Risikofaktoren und Ursachen der männlichen Sterilität, insbesondere der gestörten Spermatogenese [adaptiert nach 5].
endokrine Erkrankungen
- Anomalien der Hypothalamus-Hypophysen-Gonaden-Achse (z. B. durch Hypophysentumor, Arzneimitteleinfluss)
- Nebennierenerkrankungen
- Hyperprolaktinämie (z. B. durch Prolaktinom, Arzneimitteleinfluss)
- Primärer oder sekundärer Hypogonadismus
- Hypothyreose
- Diabetes mellitus
genetische Erkrankungen
- Gonadendysgenesie (Fehlentwicklung der Keimdrüsen)
- Mikrodeletionen von Abschnitten des Y-Chromosoms (10 – 15% der Männer mit stark eingeschränkter Spermatogenese)
- Klinefelter-Syndrom
organische / urogenitale Ursachen
- Kryptorchismus (Hodenhochstand)
- Hodenverletzung
- Hodenatrophie
- Varikozele (Krampfadernbildung des Venengeflechts im Samenstrang)
- Obstruktionen oder Verschlüsse der ableitenden Samenwege (zum Beispiel bei zystischer Fibrose oder durch Entzündungen im Bereich der ableitenden Samengänge)
- Infektionen (zum Beispiel sexuell-übertragbare Krankheiten)
- Mumps-Orchitis (Mumps-bedingte Hodenentzündung)
- Störung des Spermientransports
- Immunologische Sterilität (Autoantikörper gegen Spermien)
- Nieren- und Lebererkrankungen
verhaltensbedingte Ursachen
- Fehl- oder Unterernährung
- Genussmittel (Alkohol, Tabak)
- Drogen (Marihuana, Anabolika-Missbrauch)
- Stress
- Adipositas, insbesondere androide Körperfettverteilung
Überwärmung der Hoden
- übermäßige Wärme innerhalb der letzten drei Monate
- Fieber
- häufige Saunabesuche
- Sitzheizung im Auto
- „heiße“ Arbeitsplätze
sonstige
- Alter
- Bestrahlung des kleinen Beckens
- Operationen wegen Hodenhochstand, Leistenbruch
- Umweltgifte
- Idiopathische Infertilität
Andere exogene Faktoren wie Arzneimittel und Toxine zeigen die Tabellen 1 bis 6.
Nicht eigenmächtig absetzen
Nehmen Männer Arzneimittel ein, die mögliche Auswirkungen auf die Fruchtbarkeit haben können, sollten sie diese keinesfalls absetzen, ohne ihren Arzt zurate gezogen zu haben. Mitunter sind die im Verdacht stehenden Wirkstoffe für die Behandlung einer Grunderkrankung essenziell! Erfahrene Ärzte können dem Patienten Behandlungsalternativen vorschlagen oder – falls möglich – zu einer gezielten Therapiepause raten, in der die Konzeption dann gegebenenfalls fallen kann. Manchmal sind die potenziellen Beeinträchtigungen auch folgenlos, zum Beispiel, wenn die Spermienzahl unter bestimmten Wirkstoffen leidet, kann eine Zeugung nach wie vor möglich sein. Kritisch ist jedoch, wenn die Spermien an Qualität einbüßen oder ein Missbildungspotenzial durch veränderte Keimzellen zu erwarten ist. Hier müssen teilweise effektive Verhütungsmaßnahmen zur Vermeidung einer Schwangerschaft ergriffen werden, wie zum Beispiel beim mutagen und teratogen wirkenden Azathioprin. In diesem Fall sind die empfängnisverhütenden Maßnahmen auch mindestens sechs Monate über das Therapieende hinaus erforderlich. Einen Sonderfall stellt die Anwendung von Thalidomid bei Männern dar. Der hochgradig teratogene Wirkstoff verändert nicht die Spermien als solche, sondern kann in der Samenflüssigkeit, dem Sperma, nachgewiesen werden. Aus diesem Grund müssen bei einer Thalidomid-Behandlung auch Männer Maßnahmen des Schwangerschaftsverhütungsprogramms durchlaufen. Sie müssen über die teratogenen Risiken aufgeklärt werden und mit Kondomen verhüten, wenn ihre Partnerin schwanger sein sollte oder sie sich im gebärfähigen Alter befindet und keine zuverlässige Verhütungsmethode angewendet wird. Diese Vorsichtsmaßnahmen müssen auch von vasektomierten (sterilisierten) Patienten ergriffen werden. Ähnliche Empfehlungen werden für den teratogenen Wirkstoff Mycophenolsäure ausgesprochen, hier ist allerdings wissenschaftlich nicht genau gesichert, ob und in welchen Mengen es in den Samen oder die Samenflüssigkeit gelangt. Man geht davon aus, dass die durch Geschlechtsverkehr übertragenen Mengen nicht bedenklich sind. Dennoch wird als Vorsichtsmaßnahme empfohlen, während und bis 90 Tage nach Behandlungsende effektiv zu verhüten. Ein Kinderwunsch sollte unter der Therapie sorgfältig abgewogen werden. |
Wirkstoffgruppe/Wirkstoff | in der Literatur beschriebene Nebenwirkung | Nebenwirkungsangaben in den Fachinformationen | Hinweise aus Tierversuchen |
|---|---|---|---|
ACE-Hemmer |
|
|
|
Betablocker |
|
| |
Calciumkanal-Blocker |
|
|
|
Diuretika |
|
|
|
Wirkstoffgruppe/Wirkstoff | in der Literatur beschriebene Nebenwirkung | Nebenwirkungsangaben in den Fachinformationen | Hinweise aus Tierversuchen |
|---|---|---|---|
5α-Reduktase-Hemmer |
|
|
|
α-Blocker |
|
|
|
Phosphodiesterase-Hemmer |
|
|
|
Wirkstoffgruppe/Wirkstoff | in der Literatur beschriebene Nebenwirkung | Nebenwirkungsangaben in den Fachinformationen | Hinweise aus Tierversuchen |
|---|---|---|---|
Aminoglykoside | negative Effekte auf die Spermatogenese | keine Informationen: Amikacin, Gentamicin, Tobramycin, Vancomycin | |
Cotrimoxazol | Effekte auf das Spermiogramm widersprüchlich |
| keine Fertilitätsstörungen |
Ketoconazol | verminderte Testosteron-Produktion |
| Auswirkungen auf Nebenniere und Gonaden, Abnormalitäten des Spermas und geringere Fertilität |
Makrolide | möglicherweise Asthenozoospermie oder Nekrozoospermie bei hoher Dosierung | keine Informationen: Azithromycin, Erythromycin, Clarithromycin | Roxithromycin: toxische Veränderungen an den Gonaden |
Nitrofurantoin | möglicherweise Hemmung der Spermatogenese und reduzierte Spermienzahl bei hoher Dosierung | Hemmung der Spermatogenese: sehr selten, reversibel |
Wirkstoffgruppe/Wirkstoff | in der Literatur beschriebene Nebenwirkung | Nebenwirkungsangaben in den Fachinformationen | Hinweise aus Tierversuchen |
|---|---|---|---|
selektive Serotonin-Wiederaufnahmehemmer (SSRI) |
|
|
|
selektive Noradrenalin-Wiederaufnahmehemmer (SNRI) |
|
| |
tricyclische Antidepressiva |
|
|
|
Monoaminooxidase-Hemmer |
|
| |
Lithium |
|
|
Wirkstoffgruppe/Wirkstoff | in der Literatur beschriebene Nebenwirkung | Nebenwirkungsangaben in den Fachinformationen | Hinweise aus Tierversuchen |
|---|---|---|---|
onkologische Wirkstoffe | Gonadotoxizität durch Schädigung spermatogonaler Stammzellen, Sertoli-Zellen oder Leydig-Zellen |
|
|
Chlorambucil |
| ||
Imatinib | Störung der Leydigzellen mit erniedrigten Testosteron-Spiegeln |
|
|
Bicalutamid |
|
| |
Buserelin |
| ||
Cyproteronacetat |
| ||
Goserelin |
| ||
Leuprorelin |
| ||
Mesalazin |
| ||
Mercaptopurin |
| ||
Tacrolimus |
| ||
Testosteron | gestörte Spermatogenese |
|
Wirkstoffgruppe/Wirkstoff | in der Literatur beschriebene Nebenwirkung | Nebenwirkungsangaben in den Fachinformationen | Hinweise aus Tierversuchen |
|---|---|---|---|
Cimetidin |
| ||
Isotretinoin |
|
| |
Methotrexat |
| ||
Opioide |
|
| |
Sulfasalazin |
|
|
Literatur
[1] Viktorin A et al. Paternal use of antidepressants and offspring outcomes in Sweden: nationwide prospective cohort study. BMJ 2018;361:k2233
[2] Green D et al. Cumulative alkylating agent exposure and semen parameters in adult survivors of childhood cancer: a report from the St Jude Lifetime Cohort Study. Lancet Oncol 2014;15:1215–1223
[3] Chow EJ et al. Pregnancy after chemotherapy in male and female survivors of childhood cancer treated between 1970 and 1999: a report from the Childhood Cancer Survivor Study cohort. Lancet Oncol 2016;17(5):567–576
[4] Samplaski MK, Nagia NK. Adverse effects of common medications on male fertility. Nat Rev Urol 2015;12:401–413
[5] Rebar RW. Spermastörungen. MSD Manuals 2017. www.msdmanuals.com/de-de/profi/gyn%C3%A4kologie-und-geburtshilfe/unfruchtbarkeit/spermastörungen, Abruf am 11. September 2019
[6] Pompe SV. Der Einfluss von Arzneimitteln auf die männliche Fertilität. Dissertation, LMU München: Medizinische Fakultät 2017. https://edoc.ub.uni-muenchen.de/22291/, Abruf am 16. September 2019






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.