
- DAZ.online
- DAZ / AZ
- DAZ 35/2019
- Unterschätztes ...
Arzneimittel und Therapie
Unterschätztes Lipoprotein(a)
Ein weiterer Risikofaktor für kardiovaskuläre Erkrankungen
Aufgrund der umfassenden Datenlage aus genetischen, epidemiologischen und klinischen Studien mit Arzneimitteln, die die Konzentration von LDL-Cholesterol im Blut senken, gilt die Assoziation zwischen LDL-Cholesterol und der Entwicklung einer atherosklerotischen kardiovaskulären Erkrankung als kausal gesichert [1]. Die in regelmäßigen Abständen durchgeführten Metaanalysen der Statin-Studien durch die Cholesterol Treatment Trialists umfassen inzwischen mehr als 170.000 Patienten, die in insgesamt 27 Statin-Studien eingeschlossen wurden. Die Senkung des LDL-Cholesterol-Spiegels durch Statine um 1 mmol/l (= 38,6 mg/dl) senkt das relative Risiko für schwerwiegende vaskuläre Ereignisse (koronarer Tod, nicht tödlicher Herzinfarkt, koronare Revaskularisierung oder Schlaganfall) um etwa ein Fünftel [2]. Wird die lipidsenkende Pharmakotherapie durch die Behandlung mit Ezetimib oder Antikörpern gegen die Proproteinkonvertase Subtilisin/Kexin Typ 9 (PCSK9) zusätzlich zu Statinen intensiviert, kommt es zu einer noch stärkeren Senkung des LDL-Cholesterol-Spiegels und das Risiko für vaskuläre Ereignisse wird weiter gesenkt [3 – 5].
Genomweite Assoziationsstudien und Mendelsche Randomisierungsstudien haben aber auch eine kausale Assoziation zwischen erhöhten Lipoprotein(a)-Werten und vaskulärer Atherosklerose, kardiovaskulären Ereignissen und atheriosklerotisch bedingter Aortenstenose nachgewiesen [6, 7].
Lp(a) und LDL ähneln sich
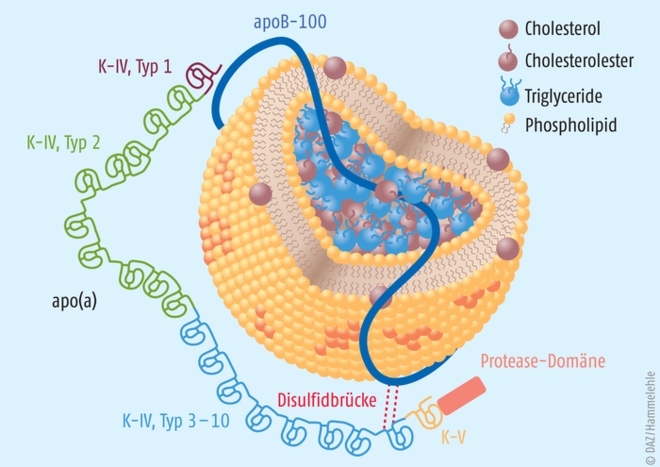
Lipoprotein(a) oder Lp(a) hat eine weitgehende Strukturähnlichkeit mit LDL-Cholesterol (s. Abbildung). Lp(a) enthält zwei Apolipoproteine: Apolipoprotein-B-100, das auch bei LDL und VLDL vorkommt, sowie zusätzlich Apolipoprotein(a). Lp(a) ist wahrscheinlich stärker atherogen als LDL-Cholesterol, weil es neben den pro-atherogenen Eigenschaften von LDL-Cholesterol zusätzlich erhöhte Mengen an pro-inflammatorisch wirkenden oxidierten Phospholipiden enthält, die kovalent an Apolipoprotein(a) gebunden sind. Die zusätzlich vorhandenen thrombotischen Eigenschaften werden mit der Strukturähnlichkeit von Lp(a) und Plasminogen und der Interferenz von Apolipoprotein(a) bei der Umwandlung von Plasminogen zu Plasmin und der daraus resultierenden Inhibition der Fibrinolyse erklärt.
Abb.: Schematische Darstellung des Lipoprotein(a) Der Kern besteht aus neutralen Lipiden (Triglyzeride, Cholesterolester). Die Oberfläche setzt sich aus freiem Cholesterol und Phospholipiden zusammen. Darin eingebettet befindet sich ein Apolipoprotein-B100-Molekül. Über eine Disulfidbrücke ist dieses zusätzlich mit einem Apolipoprotein(a)-Molekül verbunden. Dieses weist insbesondere in den „Kringle“(K)-Regionen eine strukturelle Ähnlichkeit zu Plasminogen auf.
Die individuelle Lp(a)-Konzentration im Blutplasma ist überwiegend genetisch determiniert. Zur prognostischen Bedeutung von erhöhten Lp(a)-Werten hat die Copenhagen City Heart Study wichtige Erkenntnisse geliefert [8]. In der prospektiven, epidemiologischen, longitudinalen Untersuchung wurde Lipoprotein(a) bei 9330 Teilnehmern bei Einschluss in die Studie in den Jahren 1991 bis 1994 gemessen. Die Probanden wurden über zehn Jahre nachverfolgt.
Erhöhtes Herzinfarktrisiko
Die Untersucher konnten einen schrittweisen Anstieg des Risikos für Myokardinfarkt mit zunehmenden Lp(a)-Wert beobachten. Extrem hohe Lp(a)-Spiegel gehen mit einem drei- bis vierfach erhöhten Risiko für Myokardinfarkt bei einem absoluten Zehn-Jahres-Risiko von 20% bzw. 35% bei Frauen und Männern einher.
Willeit et al. haben Ende 2018 in der Fachzeitschrift „Lancet“ interessante Befunde zur Beziehung zwischen Lp(a) und dem Risiko für kardiovaskuläre Ereignisse (tödlicher oder nicht tödlicher Myokardinfarkt, Schlaganfall oder revaskularisierende Eingriffe) veröffentlicht [9]. Sie haben dazu die Daten von 29.069 Patienten aus sieben großen placebokontrollierten Statin-Studien, die sowohl in der Primär- als auch in der Sekundärprävention mit Atorvastatin, Lovastatin, Pravastatin, Rosuvastatin bzw. Simvastatin durchgeführt wurden, auf individueller Patientenbasis ausgewertet. Lp(a) wurde dabei sowohl bei Einschluss in die Studie als auch im Verlauf der Teilnahme gemessen. Es zeigte sich, dass Patienten mit moderat erhöhten Lp(a)-Werten (30 bis 50 mg/dl) ein erhöhtes Risiko für kardiovaskuläre Ereignisse hatten, welches bei noch höheren Werten (> 50 mg/dl) von Lp(a) weiter zunimmt. Diese Assoziation war bei Patienten unter Statinen ausgeprägter als unter Placebo und war bei jüngeren Patienten (< 60 Jahre) besonders evident. Die statistische Adjustierung für bekannte kardiovaskuläre Risikofaktoren wie vorbestehende kardiovaskuläre Erkrankungen, Diabetes, Rauchen, systolischen Blutdruck, LDL- und HDL-Cholesterol hatte keinen wesentlichen Einfluss auf diese Assoziation.
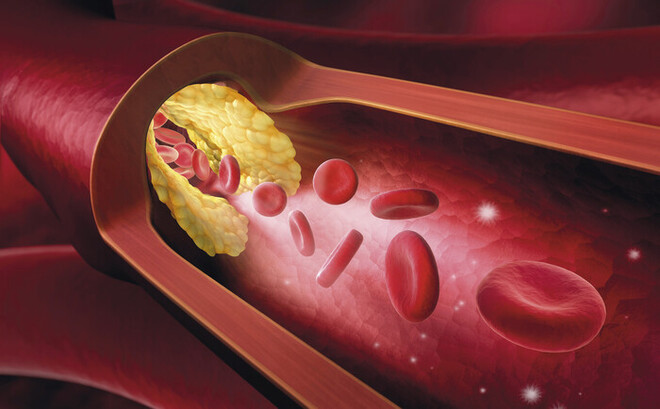
Einem Herzinfarkt liegen meist atherosklerotische Veränderungen zugrunde. Cholesterol- und lipidhaltige Plaques verengen die Gefäße. Bei einer Ruptur kommt die Durchblutung in dem betroffenen Bereich zum Erliegen.
Statine erhöhen Lp(a)-Spiegel
In einer weiteren Studie haben Tsimikas und Kollegen direkt den Einfluss von Statinen auf die Plasmakonzentration von Lp(a) untersucht [10]. Sie konnten dafür auf die Lp(a)-Werte von 5256 Teilnehmern aus sechs Studien mit Statinen zurückgreifen. Es zeigte sich, dass die Konzentration von Lipoprotein(a) unter der Behandlung mit Statinen im Mittel anstieg, während unter Placebo keine Veränderung der gemittelten Konzentration von Lp(a) nachweisbar war. Der Effekt war allerdings nicht einheitlich, sondern interindividuell sehr unterschiedlich ausgeprägt. In der Placebo-Gruppe, aber auch bei den Statin-behandelten Patienten wurden sowohl Ab- als auch Zunahmen von Lp(a) gemessen. Insgesamt war der Anteil der Patienten mit deutlicher Lp(a)-Zunahme unter Statinen jedoch wesentlich höher als unter Placebo. Auf der Suche nach einer mechanistischen Erklärung für den Anstieg von Lp(a) unter Statinen führten die Autoren zusätzlich In-vitro-Studien mit einer humanen Leberzelllinie durch, die sie zusammen mit Atorvastatin oder Pravastatin inkubierten. Statine erhöhten die Lipoprotein mRNA und die Apolipoprotein(a)-Synthese und Sekretion. Diese Ergebnisse deuten darauf hin, dass Statine über eine Induktion der Produktion von Apolipoprotein(a) die Plasmakonzentration von Lp(a) erhöhen. Die Zunahme der LDL-Rezeptoren unter der Statin-Therapie hat in dem Kontext keine wesentliche Bedeutung, da Lp(a) nur eine niedrige Affinität zu diesen Rezeptoren besitzt.
Welche klinische Bedeutung kommt diesen Befunden zu?
Schätzungen gehen davon aus, dass bis zu 1,4 Milliarden Menschen weltweit eine erhöhte Lp(a)-Plasmakonzentration von über 50 mg/dl aufweisen. Ob Lp(a) bei Patienten nach kardiovaskulären Ereignissen und nachfolgender Statin-Therapie ein unabhängiger Risikofaktor für nachfolgende klinische Ereignisse ist, wird derzeit kontrovers diskutiert. Die Datenlage ist hierzu spärlich, insbesondere, weil es bisher keine zugelassene spezifische pharmakologische Therapie zur Senkung von Lp(a) gibt. Abgesehen von Statinen reduzieren andere LDL-Cholesterol-senkende Arzneimittel auch Lp(a): Unter Ezetimib nimmt der Lp(a)-Spiegel im Mittel um 7% ab, PCSK9-Antikörper senken die Lp(a)-Werte um etwa 20 bis 30% und haben damit eine ähnliche Wirkung wie die nicht mehr zugelassene Nicotinsäure. Die Lp(a)-Senkung unter diesen Therapien ist allerdings zu gering, um einen prognostischen Nutzen sicher nachweisen zu können. Zudem liegen keine spezifischen Studien zu dieser Fragestellung mit diesen Therapieansätzen vor.
Die effektivste Senkung von Lp(a) um bis zu 70% wird derzeit mit dem aufwendigen Lipidapherese-Verfahren (Blutwäsche) erreicht. Wenngleich eine Reduktion klinischer Ereignisse bei Patienten nach Beginn einer Lipidapherese berichtet wird, fehlen bisher größere randomisierte klinische Endpunktstudien für dieses Therapiekonzept.
Die in klinischer Entwicklung stehenden Antisense-Oligonukleotide wie AKCEA-APO(a)-LRx eröffnen hier in Zukunft möglicherweise neue Therapieoptionen. Bei einmal wöchentlicher subkutaner Injektion von AKCEA-APO(a)-LRx kann der Lp(a)-Spiegel um bis zu 80% gesenkt werden [11]. Aus Studien mit Mendelscher Randomisierung wurde bereits abgeschätzt, dass eine Senkung von LP(a) in der Größenordnung von 65 bis 100 mg/dl erforderlich ist, um eine vergleichbare Reduktion kardiovaskulärer Ereignisse wie durch eine Senkung von LDL-Cholesterol um 38,6 mg/dl zu erreichen. Daher werden Studien mit Antisense-Oligonukleotiden derzeit in erster Linie bei Patienten mit sehr hohen Lp(a)-Werten durchgeführt.
Lp(a)-Messung bei familiärem Risiko
Zusammenfassend kann daher festgestellt werden, dass zum gegenwärtigen Zeitpunkt Statinen nach wie vor die zentrale Rolle in der Behandlung der Hypercholesterolämie zukommt. Die Messung von Lipoprotein(a) kann derzeit eine Option für Patienten darstellen, die eine Familienanamnese von kardiovaskulären Ereignissen in jüngerem Alter haben oder wenn kardiovaskuläre Ereignisse aufgetreten sind, ohne dass etablierte Risikofaktoren vorliegen. Inwieweit die Messung von Lp(a) künftig in Screening-Untersuchungen aufgenommen werden soll, wird gegenwärtig in Fachkreisen diskutiert. |
Literatur
[1] Ference BA et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017;38(32):2459-2472
[2] Cholesterol Treatment Trialists‘ (CTT) Collaboration. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet 2015;385(9976):1397-1405
[3] Cannon CP et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015;372(25):2387-2397
[4] Sabatine MS et al. Efficacy and Safety of Evolocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med 2015;372(16):1500-1509
[5] Schwartz GG et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med 2018;379(22):2097-2107
[6] Tsimikas S. A Test in Context: Lipoprotein(a): Diagnosis, Prognosis, Controversies, and Emerging Therapies. J Am Coll Cardiol 2017;69(6):692-711
[7] Nordestgaard BG, Langsted A. Lipoprotein (a) as a cause of cardiovascular disease: insights from epidemiology, genetics, and biology. J Lipid Res 2016;57(11):1953-1975
[8] Kamstrup PR et al. Extreme lipoprotein(a) levels and risk of myocardial infarction in the general population: the Copenhagen City Heart Study. Circulation 2008;117(2):176-184
[9] Willeit P et al. Baseline and on-statin treatment lipoprotein(a) levels for prediction of cardiovascular events: individual patient-data meta-analysis of statin outcome trials. Lancet 2018;392(10155):1311-1320
[10] Tsimikas S et al. Statin therapy increases lipoprotein(a) levels. Eur Heart J 2019; doi:10.1093/eurheartj/ehz310
[11] Tsimikas S et al. Safety and efficacy of AKCEA-APO(a)-LRx to lower lipoprotein(a) levels in patients with established cardiovascular disease: A phase 2 dose-ranging trial. Präsentation beim Kongress der American Heart Association, 10. bis 12. November 2018 in Chicago, USA. www.crtonline.org/presentation-detail/safety-efficacy-of-akcea-apo-lrx-to-lower-lipoprot; Abruf am 10 Juni 2019






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.