
- DAZ.online
- DAZ / AZ
- DAZ 25/2019
- Reumütig zurück zum ...
Medizin
Reumütig zurück zum reinen Metallstent?
Beschichtung mit Paclitaxel bei PAVK in der Diskussion
Der Begriff periphere arterielle Verschlusskrankheit (PAVK) bezieht sich im gängigen klinischen Sprachgebrauch in der Regel auf einen eingeschränkten Blutfluss in der distalen Aorta (kurz vor der Aortengabel) bzw. in den Becken-/Beinarterien. Die Störung kann graduell sein im Sinne einer Stenose oder komplett als Gefäßokklusion.
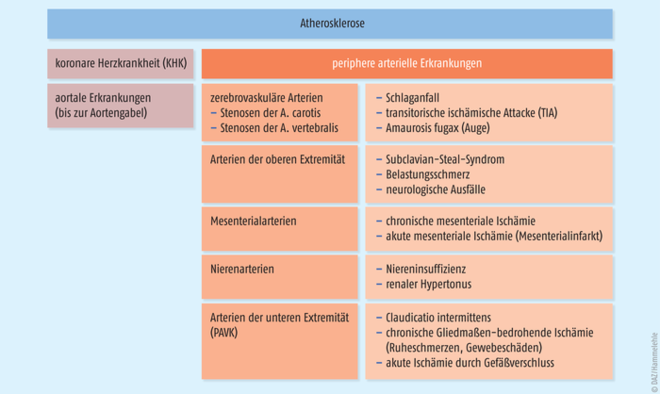
Demgegenüber umfasst laut der European Society of Cardiology (ESC) die Definition periphere arterielle Erkrankungen (PAE) alle arteriellen Erkrankungen außer denen der Koronararterien und der Aorta (s. Abb. 1). Den gemeinsamen pathophysiologischen Hintergrund bilden vor allem atherosklerotische Ablagerungen an der Gefäßwand. Durch Plaquebildung kommt es bekanntlich zu einer progredienten Verengung des Gefäßlumens. Zwischen der peripheren arteriellen Verschlusskrankheit und anderen Manifestationen atherosklerotischer Erkrankungen besteht eine signifikante Assoziation. So ist für einen Patienten mit peripherer arterieller Verschlusskrankheit das Risiko für einen Herzinfarkt dreifach und für einen Schlaganfall vierfach erhöht.
Schaufensterkrankheit – klingt harmlos, ist es aber nicht
Von der peripheren arteriellen Verschlusskrankheit waren im Jahr 2013 weltweit über 200 Millionen Patienten betroffen, allein in Deutschland wurden rund 232.000 invasive Behandlungen abgerechnet. Mit einer altersspezifisch zunehmenden Prävalenz und somit steigenden Belastung für das globale Gesundheitssystem ist zu rechnen. In Deutschland beträgt die Prävalenz bei über 70-Jährigen um die 20%. Allerdings geben nur 25% aller Betroffenen typische Symptome an. Häufige – meist zunächst einseitig auftretende – Warnzeichen sind zum Beispiel:
- Muskelschmerzen bei Belastung in Wade, Oberschenkel oder Gesäß mit zeitweisem Hinken (Claudicatio intermittens) und Verkürzung der schmerzfreien Gehstrecke,
- schlecht oder gar nicht mehr tastbare Fußpulse (A. dorsalis pedis),
- Sensibilitätsstörungen,
- kühle, bleiche und marmoriert aussehende Haut, zurückgehende Beinbehaarung,
- schlecht verheilende kleine Wunden.
Den obligaten, nicht selten „getarnten“ Erholungspausen ist die volkstümliche Bezeichnung „Schaufensterkrankheit“ zu verdanken. Beim Stehenbleiben verschwindet der Schmerz regelmäßig binnen weniger Minuten, um beim Weitergehen stereotyp nach derselben schmerzfreien Gehstrecke wieder aufzutreten. Zur Einteilung der Patienten mit peripherer arterieller Verschlusskrankheit hat sich in Deutschland die nach dem französischen Chirurgen René Fontaine (1899 bis 1979) benannte Klassifikation im Alltag durchgesetzt (s. Tab. 1). Im Hinblick auf die erforderlichen Therapieregimes unterscheidet man das Stadium der Claudicatio intermittens (CI) und das Stadium der kritischen Extremitätenischämie (critical limb ischemia, CLI), den Fontaine-Stadien III und IV entsprechend.
Stadium |
klinische Zeichen |
|---|---|
I |
Beschwerdefreiheit (bei bereits nachgewiesenen Gefäßveränderungen) |
II |
Claudicatio intermittens (intermittierendes schmerzhaftes Hinken) |
|
|
|
|
III |
ischämischer Ruheschmerz (häufig in Fuß/Zehen im Liegen) |
IV |
Gewebeschädigung |
|
|
|
|
Revaskularisation bei kritischer Ischämie
In den Fontaine-Stadien I und II genügen in der Regel rein konservative Therapiemaßnahmen samt strukturiertem Gefäßtraining sowie die Risikoreduktion in Bezug auf kardiovaskuläre Erkrankungen (s. Kasten „ESC-Empfehlungen“). Bei starker schmerzbedingter Einschränkung der Lebensqualität kann natürlich die Indikation für eine Revaskularisationsmaßnahme gestellt werden.
ESC-Empfehlungen
Eine konservative Therapie für Patienten mit peripheren arteriellen Erkrankungen empfiehlt die European Society of Cardiology (ESC):
- falls indiziert, konsequente Raucherentwöhnung
- falls indiziert, antihypertensive Therapie (Ziel-Blutduck < 140/90 mmHg)
- bei allen Patienten Statin-Gabe (Ziel-LDL 70 mg/dl)
- bei symptomatischen PAVK-Patienten Sekundärprophylaxe kardiovaskulärer Ereignisse mit Thrombozytenaggregationshemmern
- bei Claudicatio intermittens strukturiertes Gehtraining unter regelmäßiger Anleitung
- bei Patienten mit Diabetes Optimierung der Stoffwechsellage
Im Stadium der kritischen Extremitätenischämie besteht bei fehlender arterieller Revaskularisation ein signifikant erhöhtes Ein-Jahres-Risiko einer Majoramputation (= oberhalb des Knöchels) von etwa 25%. Daher sollte hier zeitnah interventionell und/oder gefäßchirurgisch revaskularisiert werden. Hierbei gilt, dass diese Maßnahmen stets eine symptomatische Therapie bedeuten und weder die Atherosklerose als Ursache noch etwaige Komorbiditäten bekämpfen. Grundsätzlich sollen hierbei endovaskuläre Techniken bevorzugt werden, wenn kurz- und langfristig die gleiche symptomatische Verbesserung erzielt werden kann wie mit einer gefäßchirurgischen Operation.
Im Einzelfall richtet sich das Behandlungsregime nach der Länge des betroffenen Gefäßsegmentes. So empfehlen die ESC-Leitlinien eine primäre Stent-Implantation
- für femoropopliteale Gefäßverschlüsse unter 25 cm Länge, wobei hier auch medikamentenfreisetzende Stents (und Ballons) „erwogen werden“ können,
- für aortoiliakale Gefäßverschlüsse über eine kurze Strecke von unter 5 cm Länge.
Stets zu berücksichtigen sind Befundkonstellationen, bei denen primär eine gefäßchirurgische Behandlung indiziert ist, beispielsweise
- Verschlüsse der A. iliaca externa oder der A. femoralis superficialis, die bis an die A. femoralis communis heranreichen,
- langstreckige Verschlüsse der A. femoralis sowie der A. poplitea und ihrer Aufteilung in die Unterschenkelarterien.
Gezieltes Erweitern und Offenhalten betroffener Gefäße
Die minimal-invasive Erweiterung eines verengten Gefäßes bezeichnet man als perkutane transluminale Angioplastie (PTA). Nach Punktion (in der Regel der Leistenarterie) wird unter Röntgendurchleuchtung mithilfe eines Führungsdrahtes (Seldinger-Technik) ein Katheter bis zur Stenose vorgeschoben. Die perkutane transluminale Angioplastie der Herzkranzgefäße wird als PTCA bezeichnet (entwickelt wurden Gefäßdilatation und Stent-Technologie zunächst zur interventionellen Behandlung von Koronarstenosen).
Zur Aufweitung des betroffenen Arterienabschnitts gibt es zwei Verfahren, die auch kombiniert werden können:
- Ballondilatation: An der Katheterspitze befindet sich ein zusammengefalteter Ballon von ca. 2 mm Dicke, der „vor Ort“ auf seinen vorgegebenen Durchmesser (zwischen 2 und 10 mm) aufgeblasen wird. Hierdurch werden die stenosierenden Plaques zur Seite gedrückt und das ursprüngliche Gefäßlumen wiederhergestellt.
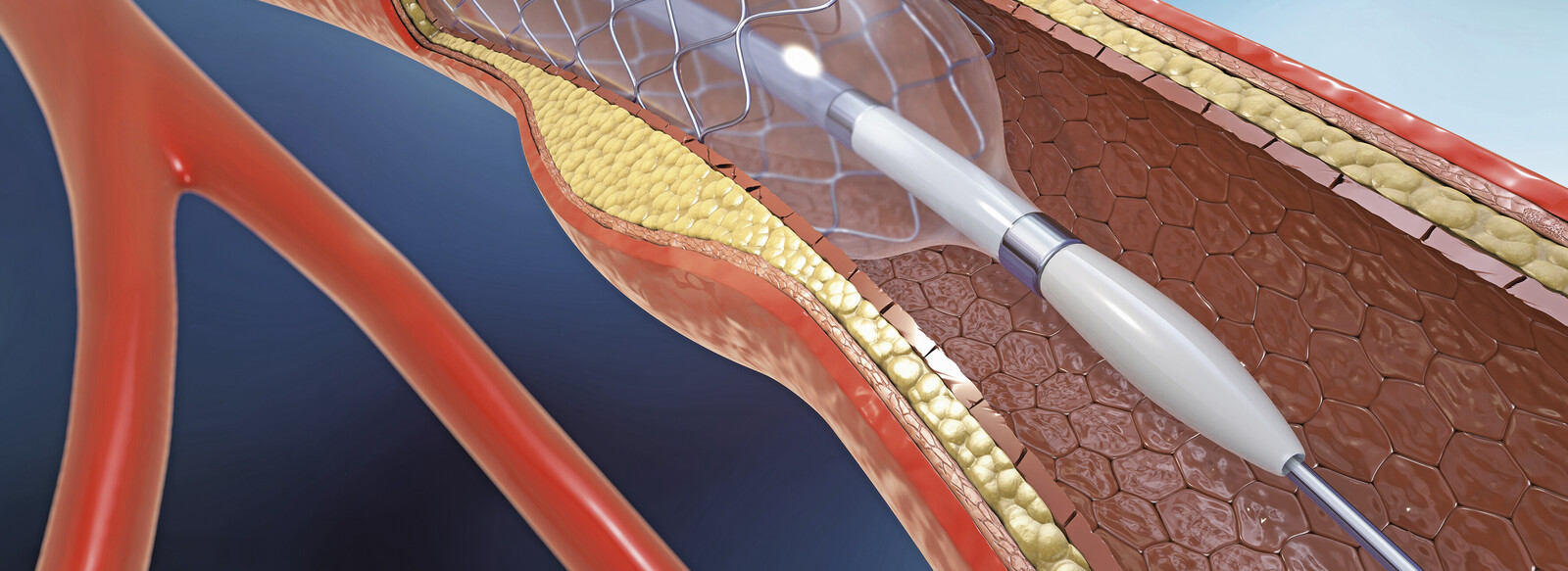
- Stent-Implantation: Ein Stent ist ein bioverträglicher, aus feinen Metallfäden oder -streben bestehender Schlauch, der über den Katheter als Implantat an der Engstelle platziert wird. Wird die ihn umgebende Plastikhülle zurückgezogen, kann er sich passgerecht entfalten und als „inneres Korsett“ die Gefäßwand stützen (Abb. 2). Dadurch wächst der Stent in die Gefäßwand ein. Seit 1989 wird das Prinzip des Ballon-expandierenden Stents genutzt. Als „klassische“ Form wurde zunächst nur der reine unbeschichtete Metallstent eingesetzt (bare metal stent, BMS).
Frühe Thrombose bei Metallstents
Mit ihrer Einführung ließ sich – zumindest teilweise – eine Komplikation der reinen Ballondilatation vermeiden, nämlich die Re-Stenosierung als response to injury der (in der Regel koronaren) Gefäßwand. Dafür kam es bei einem Teil der mit einem unbeschichteten Metallstent behandelten Patienten – häufig bereits innerhalb von 30 Tagen – zu einer Stent-Thrombose. Einerseits lässt sich das Phänomen als Folge einer durch den metallenen Fremdkörper induzierten massiven lokalen Thrombozytenaktivierung verstehen, der mit einer Prophylaxe aus Acetylsalicylsäure und Clopidogrel zur dualen Thrombozytenaggregationshemmung wirksam begegnet werden kann. Andererseits ist zu berücksichtigen, dass ein eingeführter Metallstent zwar die Schrumpfung des Gefäßes mechanisch verhindert, nicht jedoch die Proliferation von Gefäßmuskelzellen, diese kann durch die mechanische Reizung sogar stimulieren werden (sogenannte Neointima-Proliferation).
Stent-Beschichtung soll Zellwachstum hemmen
Sowohl die Proliferation als auch die Migration glatter Gefäßmuskelzellen werden durch verschiedene Mediatoren wie Zytokine und Wachstumsfaktoren reguliert. Die Tatsache, dass dieser Prozess durch immunsuppressive und zellwachstumshemmende Substanzen unterdrückt werden kann, führte zum Konzept der Applikationen dieser Substanzen direkt am Ort der Stent-Implantation. Die beiden wichtigsten Vertreter medikamentös beschichteter Stents (drug eluting stents, DES) der ersten Generation waren ab 2002 mit dem Immunsuppressivum Sirolimus und ab 2003 mit dem Zytostatikum Paclitaxel beschichtete Stents. In den folgenden Jahren konnte in verschiedenen Studien nachgewiesen werden, dass die Reendothelialisierung nach Implantation von Drug-Eluting-Stents deutlich geringer ausfällt als unter Bare-Metal-Stents. Andererseits ergab sich, dass Sirolimus und Paclitaxel die Expression von Tissue Factor, einem Schlüsselenzym in der Gerinnungsaktivierung, in Endothelzellen induzieren können, was einem prothrombotischen Effekt gleichkommen würde. Tatsächlich zeigte die klinische Erfahrung, dass unter medikamentös beschichteten Stents selbst ein bis zwei Jahre nach Implantation akute Gefäßverschlüsse auftreten können. Seither wurden zahlreiche Pro- und Kontra-Studien zum Vergleich der unterschiedlichen Stent-Arten veröffentlicht, die Datenlage ist nach wie vor nicht eindeutig, und die Diskussionen sind keinesfalls abgeschlossen. Nicht nur Komplikationen wie die Stent-Thrombose stehen hierbei im Fokus, sondern auch Endpunktdaten wie die Patientensterblichkeit. Vor allem zu Paclitaxel-beschichteten Stents und Ballons gibt es zurzeit eine Kontroverse.
Paclitaxel – vom Zelltod zur erhöhten Langzeitsterblichkeit?
Paclitaxel ist eine in der Rinde der Pazifischen Eibe (Taxus brevifolia) vorkommende Substanz aus der Gruppe der Taxane mit zytotoxischer Aktivität. Zwischenzeitlich konnte eine dem Paclitaxel verwandte Substanz aus den Nadeln der Europäischen Eibe (Taxus baccata) in Paclitaxel umgewandelt werden, als Standardmethode wird Paclitaxel nun direkt aus Eiben-Zellkulturen gewonnen. Seine zytotoxische und proliferationshemmende Wirkung beruht auf der Intervention am Spindelapparat der sich teilenden Zellen. Die Mitosespindel besteht aus den Mikrotubuli, die bei der Zellteilung an den Chromosomen ansetzen, sich dann verkürzen und auf diese Weise die Schwesterchromatiden gleichmäßig auf die beiden Tochterzellen verteilen. Paclitaxel dockt an die Mikrotubuli an und stabilisiert sie so weit, dass sie nicht mehr abgebaut werden können. Hierdurch werden weitere Zellteilungsvorgänge blockiert und somit ein programmierter Zelltod (Apoptose) ausgelöst. Somit gehört Paclitaxel zur Familie der sogenannten Zytoskelett-Inhibitoren.
Die derzeitige Diskussion um Paclitaxel bezieht sich jedoch nicht, wie man vielleicht vermuten könnte, auf „klassische“ Zytostatika-Nebenwirkungen wie Knochenmarksuppression oder Neuropathie bei einem nicht onkologischen Krankheitsbild wie der peripheren arteriellen Verschlusskrankheit. Vielmehr beklagte eine Ende letzten Jahres veröffentlichte Metaanalyse von Katsanos et al. eine erhöhte Langzeitmortalität nach Behandlung mit Paclitaxel-beschichteten Stents und Ballonkathetern [5].
Führen Mikropartikel zu Mikroembolien?
In 28 randomisierten Studien wurden insgesamt 4663 PAVK-Patienten mit femoropoplitealen Stenosen berücksichtigt, wobei sich 24 Studien auf beschichtete Ballons (drug-coated ballon, DCB) bezogen und vier auf beschichtete Stents (DES). Als Kontrollgruppen wurden Patienten mit Metallstents oder perkutaner transluminaler Angioplastie ohne beschichtete Ballons genannt. Die Gesamtmortalität wurde wie folgt angegeben:
- nach einem Jahr jeweils 2,3% in beiden Behandlungsgruppen,
- nach zwei Jahren 7,2% unter DES/DCB vs. 3,8% in den Kontrollgruppen,
- nach fünf Jahren 14,5% unter DES/DCB vs. 8,1% in den Kontrollgruppen.
Eine klare Ursache für diese Diskrepanz können die Autoren nicht benennen. Vermutungen betreffen die überwiegend kristalline Form der Paclitaxel-Beschichtung. Zunächst beträgt ihre Halbwertszeit Wochen bis Monate – im Gegensatz zur gelösten Form für die intravenöse Anwendung in der Chemotherapie mit einer Halbwertszeit von etwa sechs Stunden. Dann ermöglicht die kristalline Form eine höhere Aufnahme in die Gefäßwand und somit biologische Wirksamkeit – allerdings um den Preis der Ausbildung von Mikropartikeln, die möglicherweise in der distal durchbluteten Muskulatur zu Mikroembolien führen. Leider präzisierten die wenigsten Studien die tatsächlichen Todesursachen, genannt wurde lediglich eine Assoziation Paclitaxel-beschichteter DES/DCB mit mehr kardiovaskulären, aber auch pulmonalen, infektiösen und gastrointestinalen Ursachen. Nichtsdestotrotz wurde im Gefolge der Metaanalyse die Rekrutierung neuer Patienten für zwei große DES-Studien vorerst ausgesetzt.
Gegenstimmen: Mortalität unter Paclitaxel geringer
Demgegenüber verweist die Deutsche Gesellschaft für interventionelle Radiologie und minimal-invasive Therapie (DeGIR) in einer Stellungnahme auf zwei kurz darauf erschienene Publikationen. Es wird betont, dass „eine unabhängige Patienten-basierte Mortalitätsanalyse eines Teils der Studien, welche auch in der Analyse von Katsanos inkludiert waren, erstellt“ worden sei. Ein genauer Vergleich mit den Originalstudien (der Metaanalyse) zeige außerdem, dass Patienten, für die kein Follow-up verfügbar war, zum Teil nicht adäquat berücksichtigt worden seien, sodass die errechneten Mortalitätsraten teilweise auch inkorrekt seien.
So ergaben sich der Analyse der IN.PACT-Studien von Schneider et al. mit 1980 Patienten Fünf-Jahres-Mortalitätsraten von 9,3% nach dem Einsatz beschichteter Ballons vs. 11,2% in der „unbeschichteten“ Kontrollgruppe [6], während Albrecht et al. [9] über Zwei-Jahres-Mortalitätsraten von 8,7% (beschichteter Ballon) und 7,0% (Kontrollgruppe) berichten. Daher kommt die DeGIR „zum jetzigen Zeitpunkt“ zu dem Schluss, dass „ein Einsatz Paclitaxel-beschichteter Produkte nach entsprechender Abwägung von Risiken und Vorteilen weiterhin gerechtfertigt“ sei. Neben den IN.PACT-Daten wurde auf dem diesjährigen „Leipzig Interventional Course“ eine weitere Studie zitiert, die im Fünf-Jahres-Follow-up ebenfalls einen Mortalitätsvorteil für einen Paclitaxel-beschichteten Stent gezeigt habe.
Die FDA rät bis auf weiteres ab
Letztgenannte Resultate wiederum wurden zwischenzeitlich zumindest relativiert. Zum einen seien aufgrund fehlerhafter Programmierung in den IN.PACT-Auswertungen verschiedene Todesfälle nicht berücksichtigt worden, zum anderen seien die relativen Häufigkeiten der Fünf-Jahres-Mortalität zu Ungunsten der Kontrollgruppen vertauscht worden. Angesichts der widersprüchlichen Datenlage hat sich auch die nordamerikanische Zulassungsbehörde – bereits zum zweiten Mal – zu Wort gemeldet. In einem ersten Schreiben an alle Gesundheitsdienstleister der USA empfahl die FDA, Patienten mit peripherer arterieller Verschlusskrankheit über Nutzen und Risiken aller verfügbaren Therapieoptionen aufzuklären sowie sämtliche Patienten, die bereits mit Paclitaxel-beschichteten Ballons und Stents behandelt wurden, weiterhin konsequent zu überwachen. Klang diese Stellungnahme noch einigermaßen zurückhaltend, schlug die Behörde in einem zweiten Brief im März 2019 einen deutlicheren Ton an [8]: Angesichts der möglichen Sicherheitsrisiken solle zum jetzigen Zeitpunkt für die meisten Patienten mit peripherer arterieller Verschlusskrankheit eine perkutane transluminale Angioplastie mit Ballonkathetern oder Stents ohne Paclitaxel-Beschichtung gewählt werden. Die genaue Formulierung lautet: „Because of this concerning safety signal, we believe alternative treatment options should generally be used for most patients.“ Als mögliche Ausnahme nennt die FDA lediglich Patienten mit einem hohen Re-Stenoserisiko. Dennoch, ein letztes Wort zur Sicherheit medikamentenbeschichteter Stents dürfte hiermit noch nicht gesprochen sein. Zusätzliche Nachanalysen sowie die Auswertung langfristiger Follow-up-Daten sind erforderlich, um das Ausmaß langfristiger Risiken zu erfassen. Insbesondere muss geklärt werden, über welchen Mechanismus die Paclitaxel-Beschichtung die Langzeitmortalität bei Patienten mit peripherer arterieller Verschlusskrankheit überhaupt erhöhen könnte. Für den 19. und 20. Juni 2019 hat die FDA ein Meeting des amerikanischen Circulatory System Devices Panel einberufen. |
Literatur
[1] Lawall H, Huppert P, Espinola-Klein C, Rümenapf G. Diagnostik und Therapie der peripheren arteriellen Verschlusskrankheit. Dtsch Arztebl Int 2016;113:729–736, DOI: 10.3238/arztebl.2016.0729
[2] Diagnose und Therapie der peripheren arteriellen Erkrankungen. ESC Pocket Guidelines, Version 2017, Deutsche Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e. V. (DGK)
[3] Diagnostik, Therapie und Nachsorge der peripheren arteriellen Verschlusskrankheit. S3-Leitlinie der Deutschen Gesellschaft für Angiologie – Gesellschaft für Gefäßmedizin. AWMF-Register Nr. 065/003, Stand September 2015
[4] Lüscher TF, Steffel J. Drug-Eluting-Stents: Segen oder Zeitbombe? Schweiz Med Forum 2008;8:11-14
[5] Katsanos K, Spiliopoulos S, Kitrou P et al. Risk of Death Following Application of Paclitaxel-Coated Balloons and Stents in the Femoropopliteal Artery of the Leg: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Am Heart Assoc 2018;7:e011245, DOI: 10.1161/JAHA.118.011245
[6] Schneider PA, Laird JR, Doros G et al. Mortality Not Correlated With Paclitaxel Exposure. An Independent Patient-Level Meta-Analysis. https://doi.org/10.1016/j.jacc.2019.01.013
[7] Secemsky EA, Kundi H, Weinberg I et al. Association of Survival With Femoropopliteal Artery Revascularization With Drug-Coated Devices. JAMA Cardiol 2019;4(4):332-340, doi:10.1001/jamacardio.2019.0325
[8] Treatment of Peripheral Arterial Disease with Paclitaxel-Coated Balloons and Paclitaxel-Eluting Stents Potentially Associated with Increased Mortality – Letter to Health Care Providers, U.S. Food and Drug Administration. 15. März 2019
[9] Albrecht T, Schnorr B, Kutschera M, Waliszewski M. Two-Year Mortality After Angioplasty of the Femoro-Popliteal Artery with Uncoated Balloons and Paclitaxel-Coated Balloons - A Pooled Analysis of Four Randomized Controlled Multicenter Trials. CardioVascular and Interventional Radiology. Cardiovasc Intervent Radiol 2019;42(7):949-955, doi: 10.1007/s00270-019-02194-w





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.