
- DAZ.online
- DAZ / AZ
- DAZ 25/2019
- Hanta-Viren auf dem ...
Infektiologie
Hanta-Viren auf dem Vormarsch
Warum 2019 zu einem „Hanta-Jahr“ werden kann
Im Jahr 2019 und mehr als 8000 km entfernt schlagen Epidemiologen Alarm, dass die Zahl der Hantavirus-Infektionen in Deutschland wieder zunimmt. Während Infektionen mit Hanta-Viren in Deutschland bis zum Ende des vorigen Jahrhunderts noch fast unbekannt waren, gehören heute die Hantavirus-Erkrankungen zusammen mit Rotavirus- und Norovirus-Erkrankungen, der Hepatitis C und der Influenza zu den fünf häufigsten meldepflichtigen Viruserkrankungen. Nach deutlich niedrigeren Fallzahlen in 2018 im Vergleich zum bisherigen Rekordjahr 2017 könnte das Jahr 2019 wieder zu einem „Hanta-Jahr“ werden.
Das Virus und seine Übertragung
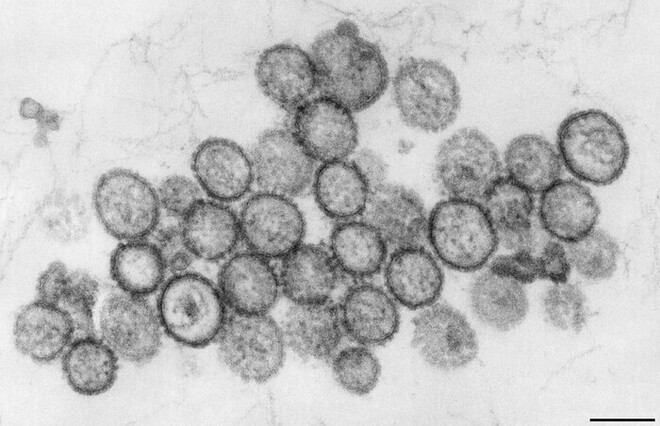
Hanta-Viren sind behüllte einzelsträngige RNA-Viren aus der Familie der Bunyaviridae mit einem Durchmesser von 80 bis 120 nm. Sie lassen sich in zwei Gruppen einteilen: die Hantaan-Gruppe, mit den Vertretern Hantaan-Virus und Dobrava-Virus, und die Puumala-Gruppe, zu der unter anderem das Puumala-Virus gehört [1]. Abbildung 2 zeigt eine elektronenmikroskopische Aufnahme des Puumala-Virus.
Bei Hantavirus-Infektionen handelt es sich um Zoonosen – das Virus braucht zur Verbreitung also einen tierischen Wirt [3]. Die Viren werden von infizierten Nagetieren über Speichel, Urin und Kot ausgeschieden. Hanta-Viren kommen weltweit vor. Aufgrund der unterschiedlichen Verbreitung der jeweiligen Wirtstiere sind die verschiedenen Hantavirus-Spezies ebenfalls geografisch unterschiedlich verteilt. Im asiatischen Teil Russlands, in China und auf der koreanischen Halbinsel ist das Hantaan-Virus (HTNV) endemisch, in den Balkanländern, Mitteleuropa und im europäischen Teil Russlands findet man das Puumala-Virus (PUUV) und das Dobrava-Virus (DOBV), während in Nord- und Westeuropa fast ausschließlich das Puumala-Virus vorkommt (siehe Tab. 1). In Deutschland sind nach Untersuchungen des Nationalen Konsiliarlaboratoriums für Hanta-Viren [4] und des Robert Koch-Instituts Infektionen mit dem Puumala-Virus (vor allem im Süden und Westen des Landes) und einer Form des Dobrava-Virus (vor allem im Osten und Norden) vorherrschend. Regional unterschiedliche Durchseuchungsgrade der jeweiligen Nagetierpopulationen beeinflussen die Infektionshäufigkeit des Menschen. Ausbrüche von Hantavirus-Infektionen werden als Folge periodischer Zunahmen der Populationsgröße bzw. der Dichte der entsprechenden Nagetierreservoire angesehen.
Virus-Typ |
Wirt |
Verbreitung |
|---|---|---|
Puumala (PUUV) |
Rötelmaus (Myodes glareolus)
|
Nord-, West- und Mitteleuropa |
Dobrava (DOBV) |
Brandmaus (Apodemus agrarius)
Gelbhalsmaus (Apodemus flavicollis)
|
Mittel- und Osteuropa, Balkan |
Hantaan (HTNV) |
Brandmaus (Apodemus agrarius)
|
Südostasien, Südeuropa, östliches Russland |
Jede Hantavirus-Spezies hat ihren eigenen spezifischen Reservoir-Wirt, der nur eine oder mehrere eng verwandte Nagerspezies umfasst. In Deutschland ist die Rötelmaus (Myodes glareolus) (Abb. 1) der wichtigste Überträger des Puumala-Virus, während die Dobrava-Infektionen vor allem von der Brandmaus (Apodemus agrarius) oder der Gelbhalsmaus (Apodemus flavicollis), aber auch von Ratten, ausgehen. Die infizierten Tiere selbst zeigen keine Krankheitssymptome. Einmal angesteckt, scheiden sie die Viren jedoch lebenslang aus. Die Übertragung auf den Menschen erfolgt durch Kontakt mit Ausscheidungen von infizierten Nagern wie die Inhalation von virushaltigen Aerosolen (z. B. aufgewirbelter Staub). Da die Viren mehrere Wochen überdauern können und auch in getrocknetem Zustand infektiös bleiben, ist zur Ansteckung kein direkter Kontakt mit den infizierten Wirtstieren nötig. Selten werden die Viren auch durch den Biss eines infizierten Tieres übertragen. Als besonders gefährdet gelten Berufsgruppen, die sich viel im Freien aufhalten wie Jäger, Forstwirte, Land- und Waldarbeiter. Ein erhöhtes Risiko besteht auch beim Reinigen lange ungenutzter und unbelüfteter Räume z. B. Scheunen, Dachböden, Garagen, Lagerräume oder Werkstätten, in denen sich Mäuse oder Ratten aufhalten könnten. Auch eine Übertragung durch Lebensmittel, die mit Ausscheidungen infizierter Nagetiere kontaminiert wurden, wird als möglich erachtet. Eine Übertragung von Mensch zu Mensch sowie eine Ansteckung über Haustiere oder über Mücken oder Zecken ist wissenschaftlich nicht belegt.
Betrachtet man die Infektionszahlen der vergangenen Jahre, so fällt auf, dass in unregelmäßigen Abständen deutliche Zunahmen der dokumentierten Hantavirus-Infektionen zu verzeichnen sind. Da die Infektion seit dem Jahr 2001 meldepflichtig ist, liegen erst seit diesem Zeitpunkt belastbare Daten über die Häufigkeit der Hantavirus-Infektionen in Deutschland vor. Meldepflichtig beim zuständigen Gesundheitsamt ist nach § 7 Infektionsschutzgesetz (IfSG) „der direkte oder indirekte Nachweis“ des Erregers im Labor. Die hämorrhagische Verlaufsform der Infektion ist nach § 6 Infektionsschutzgesetz (IfSG) auch für den behandelnden Arzt meldepflichtig [5]. Die Meldungen müssen dem Gesundheitsamt spätestens 24 Stunden nach erlangter Kenntnis vorliegen.
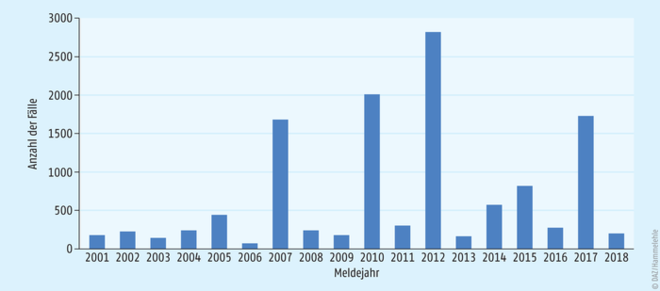
Basierend auf veröffentlichten Daten des Robert Koch-Instituts [6] ergibt sich der in Abbildung 3 dargestellte Verlauf.
So waren in den Jahren 2010, 2012 und 2017 ganz besonders viele Hantavirus-Infektionen registriert worden. Die erhöhten Fallzahlen resultieren aus einer erhöhten Mäusedichte in den sogenannten Mastjahren von Bäumen, deren Früchte die Nahrungsgrundlage für die Rötelmäuse darstellen. So erlebten 2016 die Buchen in Deutschland ein Mastjahr: Sie produzierten enorme Mengen an Früchten (Bucheckern) und Samen. Solche Jahre besonders starker Samenproduktion treten bei heimischen Laubbäumen mit einer gewissen Regelmäßigkeit auf, in einem für jede Baumart spezifischen Zyklus. In Deutschland gibt es beispielsweise alle drei bis sechs Jahre eine Buchenmast [7]. Diese Mastjahre bedeuten ein besonders reiches Nahrungsangebot für den krankheitsübertragenden Nager im darauffolgenden Frühjahr. Das führt oft zu einem starken Anstieg der Populationsdichte und damit zu mehr infizierten Rötelmäusen, was letztlich auch das Infektionsrisiko für den Menschen erhöht. Tatsächlich gingen den infektionsreichen Jahren 2010, 2012 und 2017 jeweils Mastjahre voraus. Diese Zusammenhänge machen auch verständlich, warum der Laubwaldanteil in einem geografischen Gebiet einen Einfluss auf die Nahrungsverfügbarkeit für die Nager, die Nagerdichte und schließlich das Infektionsrisiko des Menschen hat. Dass sich auch das aktuelle Jahr 2019 zu einem „Hanta-Jahr“ entwickeln könnte, zeichnet sich aus aktuellen Zahlen ab: bis zum 15. Mai 2019 wurden allein in Baden-Württemberg bereits 211 Hantavirus-Infektionen registriert [8]. Im vergangenen Jahr gab es dort im gleichen Zeitraum nur zwölf Fälle.
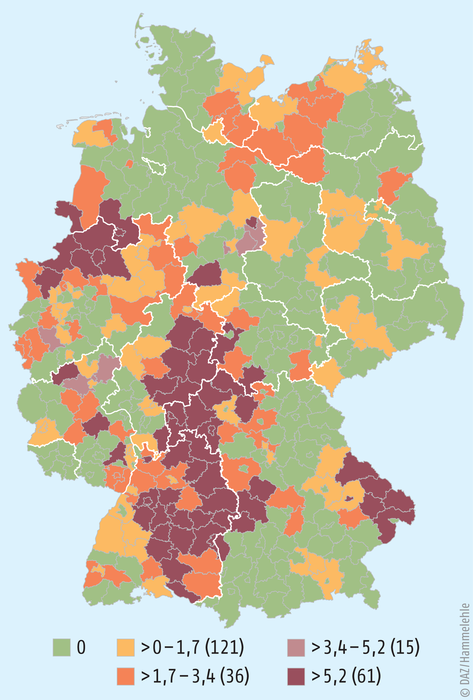
Hantavirus-Infektionen können das ganze Jahr über auftreten. Besonders hoch ist die Infektionsgefahr jedoch von April bis September. Die geografische Verteilung der Hantavirus-Erkrankungen wird vor allem durch die regionale Verbreitung infizierter Reservoirtiere bestimmt. Im Jahr 2017 wurden 68% aller registrierten Erkrankungen aus Baden-Württemberg (802 Erkrankungen; Inzidenz 7,4 Erkrankungen/100.000 Einwohner) und Bayern (375 Erkrankungen; Inzidenz 2,9 Erkrankungen/100.000 Einwohner) übermittelt [9]. Die wichtigsten Ausbruchsregionen mit jeweils molekularepidemiologisch unterscheidbaren Virus-Varianten liegen vor allem in der Schwäbischen Alb, dem Bayerischen Wald, dem Spessart, in Nordost-Hessen, dem Teutoburger Wald und im Münsterland (siehe Abb. 4).
Das Krankheitsbild
Die Inkubationszeit bei Hantavirus-Infektionen beträgt üblicherweise zwei bis vier Wochen, in Ausnahmefällen kann sie nur fünf Tage oder bis zu 60 Tage betragen. Ein großer Teil der Hantavirus-Infektionen verläuft asymptomatisch bzw. mit unspezifischen Symptomen, so dass häufig keine diagnostische Abklärung veranlasst wird. Dies wird unter anderem auch daran deutlich, dass 1 bis 2% der Bevölkerung in Deutschland Hantavirus-spezifische Antikörper aufweisen [10], die Zahl der gemeldeten Erkrankungen aber deutlich darunter liegt. Symptomatische Erkrankungen werden unter dem Begriff „hämorrhagisches Fieber mit renalem Syndrom“ (HFRS) zusammengefasst, wobei der Schweregrad des Verlaufs unter anderem von der Art des Hanta-Virus abhängt. Weltweit werden jährlich etwa 200.000 bis 300.000 Fälle des hämorrhagischen Fiebers mit renalem Syndrom beobachtet. Mitteleuropäische Hantavirus-Arten verursachen eher grippeähnliche Symptome mit abrupt einsetzendem, über drei bis vier Tage anhaltendem hohen Fieber (über 38 °C) sowie unspezifische Allgemeinsymptome wie Schüttelfrost, Kopf-, Bauch- und Rückenschmerzen, außerdem häufig Rachenrötung und Husten (Phase 1 der Erkrankung). Im Gegensatz zu viralen Erkältungen fehlen in der Regel Symptome wie Husten oder Schnupfen. Drei bis sechs Tage nach Fieberbeginn können Schwindel, Sehstörungen (sowie eine Lichtempfindlichkeit der Augen), Durchfälle und Erbrechen auftreten (Phase 2). Bei einem Teil der Erkrankten kann es bereits während der Fieberphase oder wenige Tage danach zu einem Anstieg des Nierenretentionswertes Serumkreatinin, einer Proteinurie, dem Auftreten von Ödemen sowie einem Blutdruckabfall kommen. Weiterhin besteht zu diesem Zeitpunkt oft eine milde Thrombozytopenie und eine Leukozytose (Phase 3). Die Nierenfunktionsstörungen können schließlich in schweren Fällen zum akuten Nierenversagen führen. Häufig im Initialstadium verordnete Analgetika – insbesondere nichtsteroidale Antirheumatika (NSAR) – können dabei fälschlich in ursächlichen Zusammenhang zu den Nierenschädigungen gebracht werden. Sehr selten kann sich die Erkrankung auf die Lunge auswirken oder deutlich sichtbare, äußere Blutungen verursachen [11]. Derartige Virusstämme kommen weniger in Europa, sondern vor allem in Nord- und Südamerika vor. Ausgeprägte hämorrhagische Komplikationen sind bei einer Infektion mit dem in Deutschland vorkommenden Puumala-Virus ebenfalls sehr selten, treten beim in Südostasien vorherrschenden Hantaan-Virus jedoch in 80% der Fälle auf. Die Rekonvaleszenzphase kann mehrere Wochen lang anhalten und von einer renalen Hypertonie begleitet sein. Die Letalität liegt bei den in Deutschland relevanten Puumala-Infektionen deutlich unter 1%, bei solchen durch Dobrava-Infektionen wurde sie mit 0,3 bis 0,9% bestimmt. Überstandene Hantavirus-Infektionen hinterlassen zumindest für einige Jahre eine Immunität. Für Deutschland gilt: Das gemeinsame Auftreten mehrerer der folgenden Symptome kann auf eine mögliche Hantavirus-Erkrankung (hämorrhagisches Fieber mit renalem Syndrom) hinweisen und sollte unbedingt eine gezielte ärztliche Diagnostik nach sich ziehen:
- akuter Krankheitsbeginn mit Fieber > 38,5 °C,
- Rücken- und/oder Kopf- und/oder Abdominalschmerz,
- Proteinurie und/oder Hämaturie,
- Serumkreatinin-Erhöhung,
- Thrombozytopenie,
- Oligurie bzw. nachfolgend Polyurie [12].
Diagnostik und Therapie
Die Diagnose einer Hantavirus-Infektion wird in der Regel anhand des klinischen Bildes und der serologischen Untersuchungsergebnisse gestellt. Die Virusdiagnostik basiert entscheidend auf serologischen Methoden zum Antikörpernachweis mit hoher Sensitivität und Spezifität mittels Enzyme-linked Immunosorbent Assay (ELISA), Immunoblots oder Immunfluoreszenz-Assays (IFA) zum Nachweis von spezifischen Immunglobulinen IgG und IgM. Seltener wird der direkte Erregernachweis mit der Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) durchgeführt, da dieser nur im Frühstadium (7 bis 15 Tage) gelingt. Durch Virusneutralisationstests mit dem Patientenserum, die auf der spezifischen Bindung von Antikörpern an bestimmte Oberflächenstrukturen des Virus basieren und in Speziallaboratorien der biologischen Sicherheitsstufe 3 durchgeführt werden, ist eine sehr aufwendige, spezifische Serotypisierung des Virus möglich [12].
Die Hantavirus-Erkrankung wird symptomatisch behandelt. Dies umfasst die Gabe von Analgetika und Antipyretika (möglichst keine NSAR), gegebenenfalls eine intensivmedizinische Betreuung zur Beherrschung von Blutungen und zur Stabilisierung des Kreislaufs sowie bei Nierenbeteiligung die Kontrolle und den Ausgleich des Flüssigkeits-, Elektrolyt- und Säure-Basen-Haushalts, bei akutem Nierenversagen auch Peritoneal- oder Hämodialyse. In einzelnen Fällen erwies sich die frühzeitige antivirale Chemotherapie mit Ribavirin als erfolgreich.
Infektionsschutz und Hygienemaßnahmen
Aktuell stehen weder ein zugelassener Impfstoff noch eine spezifisch gegen das Hanta-Virus gerichtete Therapie zur Verfügung. Daher steht die Expositionsprophylaxe an erster Stelle der empfohlenen Maßnahmen. Der wirksamste Schutz besteht im Vermeiden von Kontakt mit den Ausscheidungen von Nagetieren, insbesondere den in Deutschland hauptsächlichen Wirten Rötelmaus und Brandmaus. In der Umgebung menschlicher Wohnbereiche wie Kellern, Dachböden, Schuppen etc. sollten diese Schädlinge intensiv bekämpft werden. Beim Aufenthalt in von Mäusen verunreinigten Räumen sollten entsprechende Schutzmaßnahmen eingehalten werden. So kann eine mögliche Staubentwicklung in kontaminierten Bereichen durch Befeuchten vermieden werden. Bei unvermeidlicher Staubentwicklung sollten unbedingt Handschuhe und Atemschutzmasken (Feinstaubmaske FFP3) getragen werden. Ausführliche Hinweise zu prophylaktischen Maßnahmen beschreibt das vom Robert Koch-Institut herausgegebene Merkblatt „Informationen zur Vermeidung von Hantavirus-Infektionen“ [11]. Eine Absonderung von erkrankten Personen ist nicht erforderlich, da keine Ansteckung von Mensch zu Mensch stattfindet. Aus dem gleichen Grund sind auch für Kontaktpersonen von Infizierten keine besonderen Maßnahmen zu ergreifen.
Zehn Tipps gegen eine Ansteckung mit Hanta-Viren
- Nach dem Aufenthalt im Freien oder in Kellern, Schuppen oder Dachböden sorgfältig Hände waschen.
- Mäuse und Ratten besonders im Umfeld menschlicher Wohnbereiche bekämpfen.
- Lebensmittel und Tierfutter fest verschlossen aufbewahren, um keine Nagetiere anzulocken.
- Abfall in verschließbaren Mülltonnen entsorgen und Essensreste nicht auf den Hauskompost geben.
- Kontakt mit Ausscheidungen von Nagern, insbesondere Mäusen, vermeiden.
- Vor der Reinigung von eventuell kontaminierten Räumen mindestens 30 Minuten lüften.
- Durch vorheriges Anfeuchten der zu reinigenden Flächen Staubentwicklung vermeiden und keinen Staubsauger benutzen.
- Atemschutzmaske (Klasse FFP3) und Einmalhandschuhe tragen.
- Bei der Reinigung benutzte Lappen und Schwämme anschließend entsorgen.
- Wichtig: nach der Reinigung Hände waschen!
Atemschutzmasken
Bei richtiger Anwendung schützen Atemschutzmasken sicher vor Aerosolen und Feinstaubpartikeln. Wichtig sind dabei ein möglichst passgenauer Sitz und die Auswahl einer geeigneten Maske. Ihre Schutzfunktion ist europaweit nach EN149:2001 normiert. Diese unterscheidet die drei verschiedenen Schutzklassen FFP1, FFP2 und FFP3, wobei das Kürzel FFP für filtering face piece steht. Die drei Schutzklassen bieten abhängig von der Gesamtleckage und der Filterung von Partikelgrößen bis zu 0,6 μm Atemschutz für unterschiedliche Konzentrationen von Schadstoffen [13]. Die Gesamtleckage kommt zustande durch den Filterdurchlass und Undichtigkeiten an Gesicht und Nase.
Schutzklasse FFP1
- Gesamtleckage max. 25%; Mittelwerte max. 22%
- Überschreitung des Arbeitsplatzgrenzwertes darf maximal vierfach sein
- Schutz vor ungiftigen und nichtfibrogenen Stäuben
Schutzklasse FFP2
- Gesamtleckage maximal 11%; Mittelwerte maximal 8%
- Überschreitung des Arbeitsplatzgrenzwertes darf maximal zehnfach sein
- Schutz vor festen und flüssigen gesundheitsschädlichen Stäuben, Rauch und Aerosolen
Schutzklasse FFP3
- Gesamtleckage maximal 5%; Mittelwerte maximal 2%
- Überschreitung des Arbeitsplatzgrenzwertes darf maximal 30-fach sein
- Schutz vor krebserregenden und radioaktiven Schadstoffen und Krankheitserregern wie Viren, Bakterien und Pilzsporen
Ein Blick in die Zukunft
Der Hanta-Virus wurde erstmals im Jahr 1977 isoliert. Vor wenigen Jahrzehnten wurden auch erste Hantavirus-Infektionen in Deutschland dokumentiert, zunächst nur vom harmloseren Typ Puumala. 1998 wurde dann der erste Fall einer Infektion mit dem gefährlicheren Typ Dobrava beschrieben [14]. Seit 2001 die Meldepflicht eingeführt wurde, dokumentieren die Infektionszahlen ein ausgeprägt zyklisches Verhalten von Hantavirus-Infektionen beim Menschen. Alle paar Jahre tritt die eigentlich seltene Krankheit gehäuft auf. Doch neben dem Zyklus zeichnet sich ein Trend ab: Infektionen mit dem Hanta-Virus scheinen in Deutschland seit der Einführung der Meldepflicht langsam zuzunehmen. In Belgien, das schon seit 1983 Hantavirus-Infektionen überwacht, ist der Trend seit etwa dem Beginn des Jahrtausends sichtbar. 2009 beschrieb der Epidemiologe Jan Clement vom belgischen Hantavirus-Referenzzentrum den Erreger als seit 2005 praktisch epidemisch [15]. Wahrscheinliche Ursache ist für Clement der Klimawandel, und zwar über den gleichen Mechanismus, der bisher die zyklischen Epidemien auslöst. Mit dem Klimawandel und damit einhergehend der zunehmenden Häufigkeit und Intensität der Fruchtbildung der Bäume könnte es künftig häufiger Mastjahre geben, die zu einem Anstieg der Mäusepopulation und damit auch der Infektionsfälle führen. Auf das Drei- bis Vierfache könnten die Infektionszahlen in „Hanta-Jahren“ durch die Erwärmung ansteigen – so die Prognosen. Das wären etwa 10.000 Infizierte pro Jahr. Zumindest aber scheint bisher keine Gefahr zu bestehen, dass sich der Erreger weiterverbreitet oder gar aggressivere Hanta-Viren aus anderen Regionen nach Europa kommen. Die Mäuse sind standorttreu – und damit auch die Viren. Molekularbiologische Befunde zeigten, dass die Hanta-Viren selbst in benachbarten Regionen genetisch unterschiedlich sind. Das deutet auf wenig Bewegung hin. Eine flächenmäßige Ausbreitung des Hanta-Virus ist daher aus heutiger Sicht eher nicht zu erwarten. |
Literatur
[1] Hofmann J, Krüger DH, Loyen M. Hantavirus-Infektionen in Deutschland – ein Rückblick auf das Ausbruchsjahr 2017. Robert Koch-Institut. Epid Bull 2018;15:143-146, www.rki.de
[2] Puumala virus (Hanta-Viren). www.rki.de/DE/Content/Infekt/NRZ/EM/Aufnahmen/EM_Tab_Hanta.html, abgerufen am 18. Mai 2019
[3] Krüger DH, Ulrich RG, Hofmann J. Hanta-Viren als zoonotische Krankheitserreger in Deutschland. Dtsch Arztebl Int 2013;110:461-467
[4] Informationen des Nationalen Konsiliarlaboratoriums für Hanta-Viren. https://virologie-ccm.charite.de/diagnostik/konsiliarlaboratorium_fuer_hantaviren/, abgerufen am 18. Mai 2019
[5] Gesetz zur Verhütung und Bekämpfung von Infektionskrankheiten beim Menschen (Infektionsschutzgesetz – IfSG. Stand: zuletzt geändert durch Art. 6 G vom 11. Dezember 2018, www.sozialgesetzbuch-sgb.de/ifsg/1.html
[6] Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2010 bis 2018. Datenstand: 1. März 2018, Robert Koch-Institut, www.rki.de
[7] NN. Bäume: Mastjahre folgen einem Taktgeber. Meldung vom 24. Januar 2018, www.wissenschaft.de/umwelt-natur/baeume-mastjahre-folgen-einem-taktgeber, abgerufen am 18. Mai 2019
[8] www.hanta-vorhersage.de, abgerufen am 18. Mai 2019
[9] Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2017. Datenstand: 1. März 2018, Robert Koch-Institut, www.rki.de
[10] Krüger DH. Hantavirus-Infektionen. Gesellschaft für Virologie e. V., pdf, abgerufen am 20. Mai 2019
[11] Informationen zur Vermeidung von Hantavirus-Infektionen. Merkblatt für Ärzte, Robert Koch-Institut, www.rki.de
[12] Hantavirus-Erkrankungen. Robert Koch-Institut, Epid Bull 2015;25:221-225, www.rki.de
[13] Die Bedeutung der FFP-Schutzklassen. Informationen der Uvex Safety Group. www.uvex-safety.com/de/wissen/normen-und-richtlinien/atemschutzmasken/die-bedeutung-der-ffp-schutzklassen/, abgerufen am 20. Mai 2019
[14] Meisel H, Lundkvist A, Gantzer K, Bär W, Sibold C, Krüger DH. First Case of Infection with Hantavirus Dobrava in Germany. Eur J Clin Microbiol Infect Dis 1998;17:884-885
[15] Clement J, Vercauteren J, Verstraeten WW, Ducoffre G, Barrios JM, Vandamme AM, Maes P, van Ranst M. Relating increasing hantavirus incidences to the changing climate: the mast connection. Int J Health Geograph 2009;8:1























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.