
- DAZ.online
- DAZ / AZ
- DAZ 24/2019
- Arzneimitteltherapie im ...
Chronobiologie
Arzneimitteltherapie im Takt
Wie sich Erkenntnisse der Chronopharmakologie nutzen lassen
Eine der ältesten Beobachtungen zur Chronopharmakologie sind von Caelius Aurelianus überliefert, der im 5. Jahrhundert lebte und die Erkenntnisse von Soranus von Ephesus (98 bis 138 v. Chr.) übernommen haben soll [Lemmer 2019]. Von ihm stammt wohl die erste genauere Beschreibung des Asthmas mit den Hinweisen, dass Männer mehr betroffen sind als Frauen, Ältere häufiger als Jüngere und dass diese Krankheit während der Nacht und im Winter häufiger auftritt als während des Tages und im Frühling [Aurelianus 1722]. Auch berichtet er erstmals von einer – wie wir heute sagen würden – chronopharmakologischen Beobachtung: Er erwähnt ein Narcoticum, das in der Nacht gegeben werden soll, jedoch den Schmerz nicht völlig beseitigen kann. Erst 1500 Jahre später konnten verschiedene Autoren die eingeschränkte Wirkung von Lokalanästhetika beim Zahnschmerz in der Nacht nachweisen [Lemmer und Wiemers 1989, Pollmann et al. 1974, Reinberg und Reinberg 1977]. Aus diesen Berichten ergibt sich zwangsläufig, dass auch Fremdstoffe bzw. Arzneimittel bei Tieren und Menschen in ihrem Verhalten im Körper (Pharmakokinetik) und in ihren Wirkungen bzw. unerwünschten Wirkungen/Toxizität (Pharmakodynamik) nicht unabhängig von der zeitlichen Strukturierung des Organismus sein können. Umfassende Übersichten über die Chronopharmakologie bieten [Lemmer 1989, 2012, Reinberg und Halberg 1971, Reinberg und Smolensky 1983].
Chronopharmakokinetik
Das Verhalten eines Arzneimittels im Körper wird durch viele Faktoren beeinflusst. Zahlreiche Untersuchungen haben gezeigt, dass auch die Körperfunktionen, die die Pharmakokinetik bestimmen, biologischen Rhythmen unterliegen [Lemmer 2012, Lemmer und Bruguerolle 1994]. In der Tabelle 1 sind die wesentlichen Faktoren nach dem LADME-Modell (Liberation, Absorption, Distribution, Metabolismus und Elimination) zusammengefasst, die nach oraler Gabe eines Arzneimittels die Rhythmik in der Pharmakokinetik beeinflussen können.
Liberation |
Absorption |
Distribution |
Metabolismus |
Elimination |
|---|---|---|---|---|
Magen-Darm-Trakt |
Leber |
Niere |
||
(zeitspezifizierte Freisetzung, programmierbar) |
Durchblutung |
Durchblutung |
Durchblutung |
Durchblutung |
Magen-pH-Wert |
Blutverteilung |
First-Pass-Effekt |
renaler Plasmafluss |
|
Säuresekretion |
peripherer Widerstand |
glomeruläre Filtration |
||
Motilität |
Blutzellen |
(Enzymaktivität) |
renale Exkretion |
|
Magenentleerung |
Serum-Proteine |
Urin-pH-Wert |
||
Proteinbindung |
Elektrolyte |
|||
Ruhe/Aktivität |
Ruhe/Aktivität |
Ruhe/Aktivität |
||
Da sehr viele Arzneistoffe vor allem im Dünndarm resorbiert werden, ist nach oraler Applikation die Magenentleerungszeit ein wichtiger Faktor. So erfolgt die Entleerung fester Bestandteile aus dem Magen morgens signifikant schneller als abends [Goo et al. 1987], was auch für Arzneimittel gelten sollte. Um aufgenommene Fremdstoffe wieder zu eliminieren, existieren Transportproteine in der Zellmembran. So können Exportpumpen unter Energieverbrauch (ATP) aktiv Fremdstoffe aus dem Zellinneren herausbefördern, sie gehören zur Familie der ABC(ATP-binding cassette)-Transporter. Es wurde vor allem in Tierversuchen auch eine Rhythmik in diesen Arzneimitteltransportern nachgewiesen. Auch die Durchblutung des Magen-Darm-Traktes ist nicht konstant über einen Zeitraum von 24 Stunden, die Durchblutung ist nachts und am frühen Morgen am höchsten, um die Mittagszeit herum am geringsten [Lemmer und Nold 1991]. Für Geschwindigkeit und Ausmaß der Arzneimittelresorption spielt die Geschwindigkeit der Magenentleerung und vor allem das Ausmaß der gastrointestinalen Durchblutung eine besondere Rolle. Wesentlich ist dabei tmax, die Zeit bis zum Erreichen der maximalen Arzneistoffkonzentration Cmax.
Beim Menschen sind für zahlreiche lipophile Arzneimittel – vor allem bei nichtretardierten Formen – bei morgendlicher oraler Applikation eine kürzere tmax und/oder eine größere Cmax nachgewiesen worden, wie Tabelle 2 zu entnehmen ist. Sehr hohe morgendliche Plasmakonzentrationen können zu verstärkten unerwünschten Wirkungen führen, wie für nichtsteroidale Analgetika (NSAR), Diazepam, Nitrate und Amitriptylin nachgewiesen. Für einige Retardformulierungen, zum Beispiel für Nifedipin und Isosorbid-5-Mononitrat (IS-5-MN) ließen sich keine kinetischen Unterschiede nach Applikation zu verschiedenen Tageszeiten nachweisen (Tab. 2, Übersicht siehe [Lemmer 2012]).
Cmax [µg/l]
|
tmax [h]
|
|||
|---|---|---|---|---|
Wirkstoff |
morgens |
abends |
morgens |
abends |
Digoxin |
3,6* |
1,8 |
1,2 |
3,2 |
Doxazosin |
17,0 |
15,8 |
3,5 |
5,6 |
Enalaprilat |
46,7 |
53,5 |
3,5* |
5,6 |
IS-5-MN i.r. |
1605,0 |
1588,0 |
0,9* |
2,1 |
IS-5-MN s.r. |
509,0 |
530,0 |
5,2 |
4,9 |
Nifedipin i.r. |
82,0* |
45,7 |
0,4* |
0,6 |
Nifedipin s.r. |
48,5 |
50,1 |
2,3 |
2,8 |
Propranolol |
38,6* |
26,2 |
2,5 |
3,0 |
Verapamil |
59,4* |
25,6 |
1,3 |
2,0 |
Verapamil s.r. |
389,0 |
386,0 |
7,2* |
10,6 |
Atorvastatin |
95,0 |
65,9 |
1,9 |
2,9 |
Pravastatin |
28,0* |
11,0 |
1,0 |
1,5 |
Theophyllin |
morgens ≥ |
abends |
morgens ≥ |
abends |
Terbutalin |
24,0* |
10,0 |
3,5* |
6,2 |
Diazepam |
250,0* |
170,0 |
1,0* |
2,0 |
NSAR |
morgens ≥ |
abends |
morgens ≥ |
abends |
Amitriptylin |
90* |
70 |
3,1 |
4,2 |
Sertralin |
24,5 |
24,4 |
7,0 |
7,3 |
Dabei scheint die Rhythmik in der Resorption – bedingt durch Rhythmen in der Magenentleerungszeit und der gastrointestinalen Durchblutung – eine entscheidende Rolle zu spielen. Im Gegensatz zu Nagern sind deutliche tageszeitabhängige Unterschiede in der Metabolisierung von Arzneimitteln bzw. in der Enzymaktivität (CYP2D6) beim Menschen nur selten dokumentiert worden.
Da die verschiedenen Funktionen der Niere ausgeprägten Tagesrhythmen unterliegen, wird auch die renale Ausscheidung von Arzneimitteln durch diese physiologischen Rhythmen beeinflusst. Beim Menschen ändert sich auch die renale Elimination leicht basischer oder saurer Arzneimittel (z. B. Amphetamin), Sulfonamiden (z. B. Sulfasymazin, Sulfisomidin) sowie die Salicylat-Ausscheidung durch Veränderung des Dissoziationsgrades der Pharmaka aufgrund circadianer Variation im pH-Wert des Urins mit der Tageszeit. Nebenbei sei bemerkt, dass chronokinetische Studien nicht getrennt bei Morgen- oder Abendtypen durchgeführt wurden bzw. in eigenen Studien keine Unterschiede gefunden wurden.
Herz-Kreislauf-System
Praktisch alle Funktionen des Herz-Kreislauf-Systems wie Blutdruck, Herzfrequenz, Schlagvolumen, Durchblutung und peripherer Widerstand sowie EKG-Parameter unterliegen einem circadianen Rhythmus [Lemmer 2012], beteiligt sind humorale wie auch nervale Mechanismen. Die Symptome kardiovaskulärer Erkrankungen sind ebenfalls ausgeprägt tagesrhythmisch. Charakteristisch für koronarspastisch bedingte Angina-pectoris-Anfälle mit den dazugehörigen EKG-Veränderungen (Erhöhung der ST-Strecke) ist, dass sie vermehrt früh morgens zwischen vier und sechs Uhr auftreten. Eine stabile Belastungsangina ist dagegen häufiger tagsüber zu beobachten, da sie auf einer verringerten Koronarreserve beruht und durch körperliche Belastung getriggert wird. Gut dokumentiert ist die erhöhte Inzidenz von Myokardinfarkten und plötzlichen kardial bedingten Todesfällen morgens zwischen acht und zwölf Uhr. Gleiches gilt auch für die vermehrte Häufigkeit ischämischer oder hämorrhagischer Schlaganfälle in diesem Zeitraum. Vom hämodynamischen Standpunkt aus spielen für die morgendliche Häufung kardialer Ereignisse vor allem die schnelle Erhöhung des Blutdrucks und der Herzfrequenz sowie der dadurch gesteigerte myokardiale Sauerstoffverbrauch eine Rolle, dabei sollten circadiane Rhythmen in Neurotransmittersystemen und der Plättchenaggregation nicht vergessen werden. Gerade bei kardiovaskulären pathophysiologischen Ereignissen ist aber der durch „innere“ Uhren gesteuerte Anteil beim Menschen bisher nicht bekannt.
„Wir würden unendlich mehr Gutes stiften, wenn wir mit diesen Veränderungen des Körpers die Zeit und die Dose der Medicamente in ein harmonisches Verhältnis bringen würden.“
Für die medizinische Praxis von außerordentlicher Bedeutung ist die 24-Stunden-Rhythmik in Blutdruck und Herzfrequenz, die heute mittels der ambulatorischen 24-Stunden-Blutdruckmessung (ABPM) sehr gut erfasst werden kann. Neben der genaueren Bestimmung des Blutdrucks im 24-Stunden-Mittel erlaubt die ABPM-Messung auch eine Beurteilung der tageszeitlichen Schwankungen. So ist es nur auf der Basis von Langzeitmessungen des Blutdrucks möglich und inzwischen auch klinisch üblich, die Patienten einzuteilen in
- Dipper mit nächtlichem Blutdruckabfall, ca 15%,
- Non-Dipper mit fehlendem/unzulänglichem nächtlichen Blutdruckabfall, der mit einem erhöhten Risiko von Endorganschäden verbunden ist,
- Super-Dipper mit einem verstärkten Blutdruckabfall in der Nacht und
- inverted Dipper mit einer Blutdruckerhöhung in der Nacht.
Bedeutsam ist, dass sowohl ein zu geringer als auch ein zu starker nächtlicher Blutdruckabfall mit vermehrten Endorganschäden verbunden ist.
Die Frage, ob und in welcher Weise Antihypertensiva das circadiane Blutdruckprofil beeinflussen, ist aus zwei Gründen wichtig: Erstens ist es durch die Analyse tageszeitabhängiger Wirkungen möglich, den Beitrag verschiedener neurohumoraler Systeme zur circadianen Blutdruckregulation abzuleiten. Und zweitens könnte eine unterschiedliche Beeinflussung des Blutdruckprofils das Auftreten von Endorganschäden vermindern und damit prognostische Konsequenzen nach sich ziehen. Um derartige Aussagen treffen zu können, müssen Daten in chronopharmakologischen Studien erhoben werden, in denen die jeweiligen Pharmaka zu unterschiedlichen Tageszeiten verabreicht werden. Nur durch solche Untersuchungen lässt sich der Einfluss des Einnahmezeitpunktes sicher beurteilen. Im Folgenden werden daher überwiegend derartige Cross-over-Studien vorgestellt, in denen die Arzneimitteleinnahme am Morgen mit der am Abend verglichen wurde. Da bisher nicht für jede Antihypertensiva-Gruppe adäquate chronopharmakologische Daten vorliegen, müssen teilweise auch andere, für diese Fragestellung weniger aussagefähige Studien herangezogen werden.
In den Tabellen 3 bis 5 sind Ergebnisse zusammengefasst, die zeigen, dass Calciumkanal-Blocker vom Dihydropyridin-Typ (langwirkende) und AT1-Rezeptor-Antagonisten unabhängig von der morgendlichen/abendlichen Gabe den Blutdruck senken und das 24-Stunden-Profil sowohl bei Dippern als auch bei Non-Dippern nicht verändern, während ACE-Hemmer bei abendlicher Gabe bei Dippern zu einer verstärkten nächtlichen Blutdrucksenkung führt, die ein Risiko für einen pharmakoinduzierten Apoplex sein könnte (Übersicht s. [Lemmer 2006, Lemmer 2007a]). Von Bedeutung ist, dass bei Non-Dippern die abendliche Gabe eines Calcium-Kanal-Blockers – wie für Isradipin und Amlodipin nachgewiesen – nicht nur den Blutdruck senkte, sondern auch zu einer Normalisierung des 24-Stunden-Blutdruckprofils führte.
Wirkstoff |
Patienten[n] |
Dosis[mg] |
Dauer |
Einnahme-Zeitpunkt
(Uhrzeit)
|
Blutdrucksenkung |
||
|---|---|---|---|---|---|---|---|
Tag |
Nacht |
24-h-Profil |
|||||
primäre Hypertoniker (Dipper) | |||||||
Amlodipin |
20 |
5 |
4 Wochen |
morgens |
↓↓ |
↓↓ |
erhalten |
abends |
↓↓ |
↓↓ |
erhalten |
||||
Amlodipin |
12 |
5 |
3 Wochen |
8.00 |
↓ |
↓ |
erhalten |
20.00 |
↓ |
↓ |
erhalten |
||||
Isradipin |
18 |
5 |
4 Wochen |
7.00 |
↓↓ |
↓↓ |
erhalten |
19.00 |
↓↓ |
↓↓ |
erhalten |
||||
Lacidipin |
33 |
4 |
6 Wochen |
morgens |
↓↓ |
↓ |
erhalten |
abends |
↓ |
↓ – ↓↓ |
erhalten? |
||||
Nifedipin GITS |
10 |
30 |
1 bis 2 Wochen |
10.00 |
↓↓ |
↓↓ |
erhalten |
22.00 |
↓↓ |
↓↓ |
erhalten |
||||
Nisoldipin ER |
39 |
20 |
4 Wochen |
7.00 – 9.00 |
↓↓ |
↓(↓) |
erhalten |
21.00 – 23.00 |
↓↓ |
↓↓ |
erhalten |
||||
Nitrendipin |
41 |
20 |
4 Wochen |
6.00 |
↓ |
↓ |
erhalten |
18.00 |
↓ |
↓ |
erhalten |
||||
Nitrendipin |
6 |
10 |
0,5 Wochen |
6.00 |
↓↓ |
↓↓ |
erhalten |
18.00 |
↓ |
↓ |
verändert |
||||
sekundäre Hypertoniker (Non-Dipper) | |||||||
Amlodipin |
39 |
5 |
3 Wochen |
8.00 |
↓ |
↓↓ |
normalisiert |
20.00 |
↓ |
↓↓ |
normalisiert |
||||
Isradipin |
16 |
5 |
3 Wochen |
8.00 |
↓↓ |
↓↓ |
gestört |
20.00 |
↓ |
↓↓↓ |
normalisiert |
||||
Nisoldipin ER |
36 |
20 |
4 Wochen |
7.00 – 9.00 |
↓↓ |
↓↓↓ |
normalisiert |
21.00 – 23.00 |
↓↓ |
↓↓↓ |
normalisiert |
||||
Wirkstoff |
Patienten[n] |
Dosis[mg] |
Dauer |
Einnahme-Zeitpunkt
(Uhrzeit)
|
Blutdrucksenkung |
||
|---|---|---|---|---|---|---|---|
Tag |
Nacht |
24-h-Profil |
|||||
AT1-Rezeptor-Antagonisten (Dipper)
| |||||||
Valsartan |
90 |
160 |
3 Monate |
morgens |
↓↓ |
↓↓ |
erhalten |
abends |
↓↓ |
↓↓ |
erhalten |
||||
Irbesartan |
20 |
100 |
6 Wochen |
morgens |
↓↓ |
↓↓ |
erhalten |
abends |
↓↓ |
↓↓ |
erhalten |
||||
Olmesartan |
18 |
20 (40) |
12 Wochen |
8.00 |
↓↓ |
↓↓ |
erhalten |
20.00 |
↓↓ |
↓↓ |
erhalten |
||||
Telmisartan |
215 |
80 |
12 Wochen |
morgens |
↓↓ |
↓↓ |
erhalten |
abends |
↓↓ |
↓↓(↓) |
erhalten? |
||||
AT1-Rezeptor-Antagonisten (Non-Dipper)
| |||||||
Valsartan |
148 |
160 |
3 Monate |
morgens |
↓↓ |
↓↓ |
erhalten |
abends |
↓↓ |
↓↓↓ |
erhalten |
||||
Wirkstoff |
Patienten[n] |
Dosis[mg] |
Dauer |
Einnahme-Zeitpunkt
(Uhrzeit)
|
Blutdrucksenkung |
||
|---|---|---|---|---|---|---|---|
Tag |
Nacht |
24-h-Profil |
|||||
Benazepril |
10 |
10 |
1 Tag |
9.00 |
↓↓↓ |
↓↓ |
erhalten |
21.00 |
↓ |
↓↓ |
verändert |
||||
Enalapril |
10 |
10 |
1 Tag |
8.00 |
↓↓ |
↓ |
erhalten |
19.00 |
↓↓ |
↓↓ |
verändert |
||||
Enalapril |
10 |
10 |
3 Wochen |
8.00 |
↓↓ |
↓ |
erhalten |
19.00 |
↓ |
↓↓ |
verändert |
||||
Perindopril |
18 |
2 |
4 Wochen |
19.00 |
↓↓ |
↓ |
erhalten |
21.00 |
↓ |
↓↓ |
verändert |
||||
Quinapril |
18 |
20 |
4 Wochen |
8.00 |
↓↓ |
↓ |
erhalten |
22.00 |
↓↓ |
↓↓ |
erhalten |
||||
Ramipril |
33 |
2,5 |
4 Wochen |
8.00 |
↓ |
(↓) |
erhalten |
20.00 |
(↓) |
↓ |
erhalten |
||||
Trandolapril |
30 |
1 bis 2 |
8 Wochen |
morgens |
↓↓ |
↓↓ |
keine Profile |
abends |
↓↓ |
↓↓ |
gezeigt |
||||
Aus den chronopharmakologischen Daten ergeben sich folgende Forderungen:
- Bei den Patienten sollte zunächst ein 24-Stunden-Blutdruckprofil erstellt werden, um auch das nächtliche Blutdruckverhalten zu erfassen (Unterscheidung Dipper – Non-Dipper).
- AT1-Rezeptor-Antagonisten sind die Antihypertensiva der ersten Wahl, sie sind gut verträglich und haben kaum unerwünschte Wirkungen. Bei Dippern können sie morgens, bei Non-Dippern abends verordnet werden, gleiches Dosierungsschema gilt für Calciumkanal-Blocker.
- ACE-Hemmer sollten bei Dippern nie abends verordnet werden.
- Unter einer Therapie sollte dann erneut ein 24-Stunden-Blutdruckprofil erstellt werden.
Schlaf und psychiatrische Erkrankungen
Störungen des Schlafes sind schon seit mehr als 200 Jahren berichtet worden. 1764 beschrieb der Mannheimer Arzt Friedrich Casimir Medicus die offensichtliche Jahresrhythmik im Auftreten depressiver Symptome mit Schlafstörungen in seinem Buch „Die Geschichte Periode haltender Krankheiten“: „Alle Jahre bemerkte Helwig im Dezember bei einem Manne eine Schwermut wiederkehren, die sich durch Schlaflosigkeit meldete ...“ [Medicus 1764]. Und Geiger beschrieb bereits 1652 die Tagesrhythmik in der depressiven Symptomatik: „Der Melancholiker schläft nie ganz ruhig; er fährt sehr oft aus dem Schlafe auf: und fühlt sich des Morgens mehrentheils müder als am Abend“ [Geiger 1652].
Die Regulation des Schlaf-Wach-Rhythmus unterliegt komplexen Interaktionen zwischen der endogenen Uhr, Uhrengenen und einem homöostatischen Schlafantrieb. Die circadiane Uhr ist dafür verantwortlich, den Wachzustand während des Tages und den Schlaf während der Nacht zu fördern. Schlafstörungen sind das Ergebnis einer gestörten Kopplung zwischen der biologischen Uhr und physikalischen und sozialen 24-Stunden-Umweltbedingungen. Schlafstörungen sind eines der charakteristischsten Merkmale depressiver Erkrankungen, einschließlich der sogenannten Winterdepression (s. [Wirz-Justice 2006]).
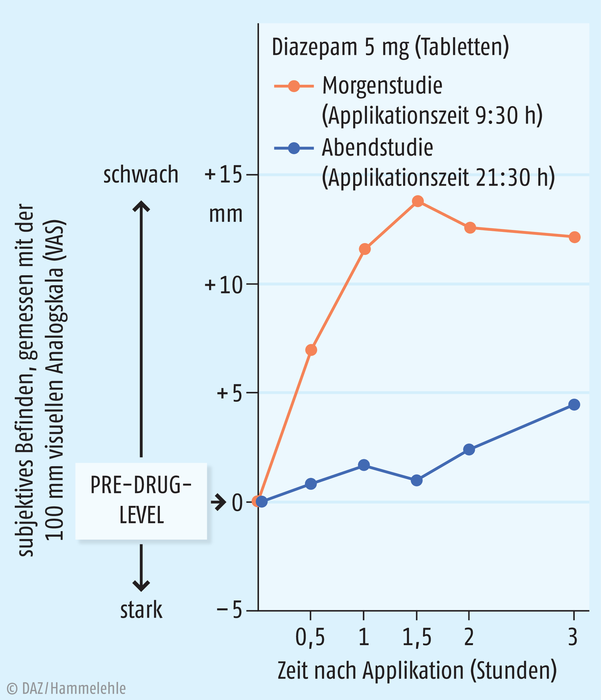
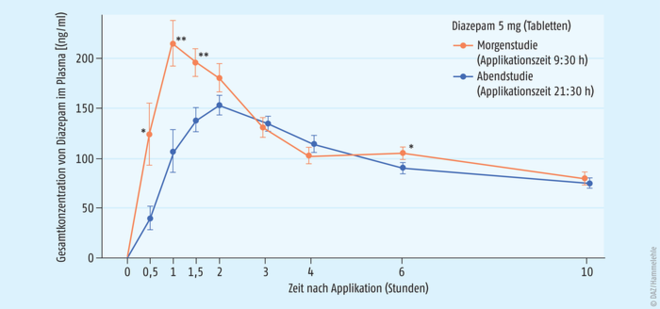
Zahlreiche Gruppen von Arzneistoffen werden zur Behandlung von Schlafstörungen eingesetzt. Die alten Barbiturat-Abkömmlinge sind heute obsolet, im Vordergrund stehen Benzodiazepin-Derivate bzw. sogenannte Nicht-Benzodiazepine wie Zolpidem und Zopiclon. Beide Gruppen agieren jedoch über Benzodiazepin-Rezeptoren, wobei die Nicht-Benzodiazepine weniger Nebenwirkungen haben sollen. Schlaftabletten sollen helfen, die Bedürfnisse der inneren Uhr mit der Schlafarchitektur und einem Schlafdefizit zu koordinieren. Alle diese Arzneimittel erzeugen jedoch nicht einen „natürlichen“ Schlaf, sondern einen „pharmakologischen“ Schlaf. Sowohl im Tierversuch als auch beim Menschen sind eine Vielzahl von Schlafmitteln (Barbiturate, Benzodiazepine, Nicht-Benzodiazepine), Melatonin und auch helles Licht und Schlafentzug in ihren Wirkungen untersucht worden, wenn sie zu verschiedenen Tageszeiten eingenommen bzw. angewendet wurden. Eine Übersicht über chronopharmakologische Ergebnisse bei Mensch und Tier bietet [Lemmer 2007b]. Klinische Untersuchungen zeigen, dass sedierende Arzneimittel, Alkohol und Benzodiazepine wie Diazepam morgens eingenommen stärker sedierend wirken (Abb. 1), als wenn sie abends eingenommen werden [Nakano 1989]. Gleichzeitig zeigt Diazepam morgens auch einen schnelleren Anstieg in der Plasmakonzentration mit höheren Werten (Abb. 2). Somit scheinen für die stärkere morgendliche Empfindlichkeit pharmakokinetische Faktoren, aber auch eine stärkere Empfindlichkeit des Gehirns verantwortlich zu sein.
Bei den sedierenden Wirkungen bestehen sehr große interindividuelle Unterschiede in der Empfindlichkeit und in den unerwünschten Wirkungen, Abhängigkeit und Rebound-Phänomene, was auch für die sogenannten Nicht-Benzodiazepine gilt. Melatonin, das nur in der Nacht ausgeschüttet wird, scheint für den Körper ein wichtiges Signal für die Nachtphase zu sein, durch Licht wird seine Bildung und Ausschüttung unterdrückt. Bisher ist ein retardiertes Melatonin-Präparat (Circadin®) zur kurzzeitigen Behandlung der primären Insomnie bei Patienten ab 55 Jahren zugelassen, nach Aussage der European Medicines Agency (EMA) ist das Präparat wirksam, wenn auch das Ausmaß der Wirkung nur gering ist [European Medicines Agency 2007].
Ein retardiertes Melatonin-Präparat (Slentyo®
) wurde von der EMA im September 2018 zur Behandlung von Schlafstörungen bei Kindern und Jugendlichen mit Autismusstörungen und/oder Smith-Magenis-Syndrom zugelassen, wenn bei ihnen Maßnahmen der Schlafhygiene nicht ausreichten. Die EMA bezieht sich dabei auf eine Studie, die im Vergleich mit Placebo (19 Minuten längere Schlafzeit) eine Verlängerung der Schlafzeit um 51 Minuten nachwies. Leider handelt es sich dabei erneut um ein retardiertes Präparat, während das natürliche Melatonin pulsatil freigesetzt wird und eine kurze Halbwertszeit von 30 Minuten hat. Auch wenn die Zulassung ein wenig wie ein Schnellschuss wirkt, kann das Präparat eine Hilfe sein, da es bisher nichts für diese Patienten gibt. Melatonin wirkt nicht als Hormon, sondern als Impulsgeber der circadianen Uhr und des Schlafs. Eine Studie mit nicht-retardiertem Melatonin wäre dringend erforderlich, denn leider sind keine nichtretardierten Melatonin-Präparate auf dem Markt, sie werden bei Erwachsenen, Kindern und beim Jet-Lag fast ausschließlich off label eingesetzt. Melatonin-Präparate, die rezeptfrei erhältlich sind, unterliegen nicht dem Arzneimittelgesetz und damit kann es möglich sein, dass sind un
zureichend in Zusammensetzung und Galenik kontrolliert sind. Melatonin-haltige Nahrungsergänzungsmittel und Arzneimittel sollten vor allem nicht aus dubiosen Quellen über das Internet bezogen werden.
Literaturtipp
Der Gang der inneren Uhren
Leben ist ohne biologische Rhythmen nicht möglich! Lassen Sie sich von dem Autor mitnehmen in die faszinierende Welt der inneren Uhren und Rhythmen und erfahren Sie, welche interessanten Auswirkungen die chronobiologischen Gesetzmäßigkeiten auf die Wirkung von Arzneistoffen haben können.
- Wie beeinflusst unsere innere Uhr die Pharmakokinetik von Arzneistoffen?
- Welchen Einfluss hat die Tageszeit auf Krankheitssymptome?
- Wie lässt sich die Wirksamkeit von Arzneimitteln optimieren?
Das Buch beantwortet diese Fragen und spannt dabei den Bogen von der Grundlagenforschung bis hin zur therapeutischen Umsetzung.
Von Björn Lemmer
Chronopharmakologie
Biologische Rhythmen und Arzneimittelwirkung
4., überarbeitete und erweiterte Auflage, XII, 204 S.,
181 farb. Abb., 26 farb. Tab., 15,3 × 23,0 cm, gebunden,
36,80 Euro
ISBN 978-3-8047-2786-1
Wissenschaftliche Verlagsgesellschaft Stuttgart 2012
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
Tel. (0711) 25 82 341, Fax: (0711) 25 82 290
E-Mail: service@deutscher-apotheker-verlag.de
oder unter www.deutscher-apotheker-verlag.de
Zusammenfassung
Die Ergebnisse der Grundlagenforschung zu Mechanismen und Regulation innerer Uhren und epidemiologischer und klinisch-chronopharmakologischer Studien zeigen, dass biologische Rhythmen das Leben und Überleben aller Lebewesen ganz wesentlich steuern und dass der Faktor „Tageszeit“ eine zunehmende Rolle in der Diagnose von Erkrankungen und der Pharmakotherapie spielt. Die innere Uhr hat antizipatorischen Charakter und ist für die Synchronisation der körpereigenen Rhythmen mit der physikalischen und sozialen 24-Stunden-Umwelt verantwortlich. Die Arzneimittelkommission der deutschen Ärzteschaft hat diesen Parameter nun auch in ihren Empfehlungen zum Beispiel zur Arzneiverordnung bei Asthma und zu den Protonenpumpeninhibitoren berücksichtigt. Sowohl die tageszeitlich unterschiedliche Applikation von Arzneimitteln als auch die tageszeitlich unterschiedliche Empfindlichkeit der Zielorgane auf Arzneimittel sind dabei zu berücksichtigen [Lemmer 2012]. |
Literatur
Aurelianus C. De morbis acutis & chronicis. Wetsten. Amsterdam 1722
European Medicines Agency. Circadin – Europäischer öffentlicher Beurteilungsbericht EPAR 2007. European Medicines Agency Report 07/02/2019 Circadin – EMEA/H/C/000695 – T/0058
Geiger M. Microcosmus hypochondriacus sive de melancholia hypochondriaca tractatus ... Lucam Straub. Monachii, München, 1652
Goo RH, Moore JG, Greenberg E, Alazraki NP. Circadian variation in gastric emptying of meals in humans. Gastroenterology 1987;93:515-518
Lemmer B. Circadian rhythms and clinical pharmacology. Internist (Berl) 2004;45:1006-1020
Lemmer B. Chronopharmacology and controlled drug release. Expert Opin Drug Deliv 2005;2:667-681
Lemmer B. The importance of circadian rhythms on drug response in hypertension and coronary heart disease – from mice and man. Pharmacol Ther 2006;111:629-651
Lemmer B. Chronobiology and chronopharmacology of hypertension. 2007a:413-435, in White WB ed. Clinical Hypertension and Vascular Disease: Blood Pressure Monitoring in Cardiovascular Medicine and Therapeutics. Totowa, NewYork: Humana Press
Lemmer B. The sleep-wake cycle and sleeping pills. Physiol Behav 2007b;90:285-293
Lemmer B. Discoveries of rhythms in human biological functions: a historical review. Chronobiology International 2009b;26:1019-1068
Lemmer B. Chronopharmakologie. 4. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart 2012
Lemmer B. Caelius Aurelianus‘ textbook on medicine of thefifth century: rhythm in asthma, pain, and drugeffects. Chronobiology International 2019, DOI 10.1080/07/07420528.2019.1595639
Lemmer B (ed). Chronopharmacology – Cellular and Biochemical Interactions. Marcel Dekker.New York, Basel 1989
Lemmer B, Bruguerolle B. Chronopharmacokinetics. Are they clinically relevant? Clin Pharmacokinet 1994;26:419-427
Lemmer B, Nold G. Circadian changes in estimated hepatic blood flow in healthy subjects. Br J Clin Pharmacol 1991;32:627-629
Lemmer B, Wiemers R. Circadian changes in stimulus threshold and in the effect of a local anesthetic drug in human teeth: studies with an electronic pulptester. Chronobiology International 1989;6:157-162
Medicus FC. Geschichte Periode haltender Krankheiten. Macklot, GL Carlsruhe 1764:43
Nakano S. Temporal aspects of the pharmacokinetics and effects of psychotropic drugs in humans. 1989:267-280, in Lemmer B, ed. Chronopharmacology – Cellular and Biochemical Interactions. New York, Basel: Marcel Dekker 1989
Pollmann L, Hildebrandt G, Schnell H. The diurnal changes in pain threshold and the capacity to differentiate thicknesses in the front teeth. Dtsch Zahnarztl Z 1974;29:238-243
Portaluppi F, Lemmer B. Chronobiology and chronotherapy of ischemic heart disease. Adv Drug Deliv Rev 2007;59:952-965
Reil JC. Von der Lebenskraft. Arch Physiol 1796;1:8-162
Reinberg A, Halberg F. Circadian chronopharmacology. Annu Rev Pharmacol 1971;11:455-492
Reinberg A, Reinberg MA. Circadian changes of the duration of action of local anaesthetic agents. Naunyn Schmiedebergs Arch Pharmacol 1977;297:149-152
Reinberg A, Smolensky MH. Biological Rhythms and Medicine. Springer Verlag, New York, Berlin, Heidelberg 1983
Wirz-Justice A. Biological rhythm disturbances in mood disorders. Int Clin Psychopharmacol 2006;21(Suppl1):11-15
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.