
- DAZ.online
- DAZ / AZ
- DAZ 20/2019
- Chronisch entzündet
Darmerkrankungen
Chronisch entzündet
Wissenswertes zur Therapie von Morbus Crohn und Colitis ulcerosa
Morbus Crohn und Colitis ulcerosa stellen die beiden Hauptentitäten der chronisch-entzündlichen Darmerkrankungen (CED) dar. Sie zählen zu den häufigsten immunologisch vermittelten Erkrankungen auf dem Gebiet der Gastroenterologie. Die Darmerkrankungen zeichnen sich durch akute und chronische, in Schüben verlaufende Entzündungen der intestinalen Schleimhaut aus. Klinisch können bei den betroffenen Patienten abdominelle Schmerzen, Diarrhöen und insbesondere bei der Colitis ulcerosa auch mukosale Blutungen auftreten [1, 2]. Während bei Patienten mit Morbus Crohn Abschnitte des gesamten Verdauungstrakts – vom Mund bis zum Anus – betroffen sein können, ist die Colitis ulcerosa auf den Dick- und Enddarm begrenzt. Beim Morbus Crohn handelt es sich um eine transmurale entzündliche Erkrankung, d. h. alle Schichten der Darmwand können entzündet sein. Bei der Colitis ulcerosa spielt sich das Entzündungsgeschehen nur in der Darmschleimhaut ab.
Schäden durch die Inflammation sind umso komplexer und schwerwiegender, je früher die Krankheit auftritt. Der permanente Betreuungsbedarf gerade von Kindern und Jugendlichen aber auch ihrer Bezugspersonen ist vielschichtig. Eine besondere Herausforderung stellt der Wechsel (Transition) in die Erwachsenenmedizin dar [3].
In Deutschland leiden etwa 320.000 bis 400.000 Menschen an einer chronisch-entzündlichen Darmerkrankung, auf Europa bezogen kann von ca. 2,5 bis drei Millionen betroffenen Patienten ausgegangen werden. Weltweit stieg die Inzidenz insbesondere in den industrialisierten Ländern in den letzten Jahren an [4]. Jeder fünfte Betroffene erkrankt vor dem 20. Lebensjahr an einem Morbus Crohn. Bei den meisten Patienten manifestiert sich die Erkrankung im dritten Lebensjahrzehnt. Die Colitis ulcerosa macht sich in der Regel später bemerkbar, die Erkrankung wird häufig im Alter von 30 bis 40 Jahren diagnostiziert.
Trotz der eindrücklichen klinischen Leitsymptome erfolgt die Diagnosestellung bei den betroffenen Patienten oftmals verspätet [5]. Die Abgrenzung eines Morbus Crohn oder einer Colitis ulcerosa zu einer mikroskopischen Colitis, die ähnliche Symptome aufweist, gestaltet sich oft schwierig [6]. Hilfestellung bei der Diagnose und der Therapie der chronisch-entzündlichen Darmerkrankung bieten zahlreiche europäische und nationale Leitlinien. In Deutschland stehen drei Leitlinien der höchsten Evidenzstufe zur Verfügung:
- S3-Leitlinie Diagnostik und Therapie des Morbus Crohn (Stand 01/2014; gültig bis 31. Dezember 2018; derzeit in Überarbeitung)
- S3-Leitlinie Diagnostik und Therapie der Colitis ulcerosa (Stand Mai 2018; gültig bis 15. Mai 2022)
- S3-Leitlinie Klinische Ernährung in der Gastroenterologie (Teil 4) – Chronisch-entzündliche Darmerkrankungen (Stand Juli 2014; gültig bis 31. Juli 2019)
Vielzahl an Therapiestrategien
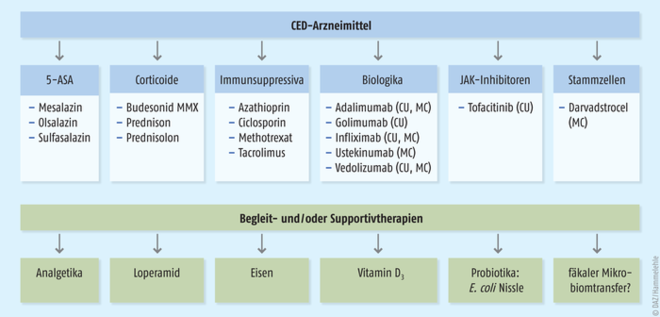
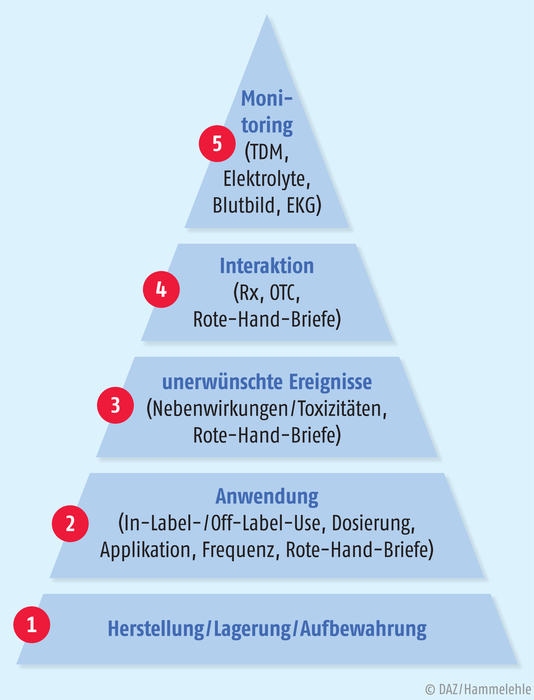
Mit vielen rationalen therapeutischen Strategien (s. Abbildung 1) werden unabhängig vom Befallsmuster die folgenden grundlegenden Behandlungsziele angestrebt: Induktion und langfristige Erhaltung einer Steroid-freien Remission sowie Prävention von Erkrankungs- oder Therapiekomplikationen. Das gelingt mit topisch (Suppositorien, Klysmen, Schäume) oder systemisch (Injektion, Infusion, orale Darreichungsformen) zu applizierenden Arzneimitteln, setzt jedoch eine hohe Adhärenz des Patienten voraus. Im Medikationsmanagement sind zahlreiche AMTS-Risiken bekannt, die es sowohl bei den „typischen“ CED-Arzneimitteln als auch bei der Begleit- und/oder Supportivtherapie zu beachten gilt (s. Abbildung 2) [7]. Die Vor- und Nachteile der verschiedenen Arzneistoffgruppen sowie die Herausforderungen in Bezug auf die AMTS-Risiken sind in Tabelle 1 zusammengefasst.
Treten unter einer remissionserhaltenden Therapie erneute Schübe auf, so wird die Behandlung stufenweise eskaliert. Bei der Wahl und der Dauer einer geeigneten Schub- und Erhaltungstherapie sind verschiedene Faktoren zu berücksichtigen. So hängt die Therapieentscheidung unter anderem von der Häufigkeit und dem Schweregrad der Erkrankungsschübe, dem Ansprechen auf vorherige Therapien sowie dem Nebenwirkungsprofil der Arzneimittel ab. Zudem sind Unterschiede zwischen pädiatrischen und erwachsenen Patienten zu beachten (s. Tabelle 2) [8].
Arzneistoff(-gruppe) |
Anwendung |
Vorteile |
Nachteile |
AMTS-Risiken |
|---|---|---|---|---|
|
5-Aminosalicylate
(Mesalazin, Olsalazin, Sulfasalazin)
|
Mesalazin: Remissionsinduktion und Erhaltungstherapie bei leichter bis moderater CU
Olsalazin: CU
Sulfasalzin: MC
|
rezidiv-prophylaktische Wirkung,
gute Toleranz,
verschiedene Darreichungsformen und Kombinations-anwendungen (Tabletten/Klysmen/
Suppositorien)
|
Adhärenz je nach Darreichungsform und Patientenalter,
Preis (v. a. Schäume)
|
① Lagerung
② Handhabung
③ Übelkeit, Erbrechen, Kopfschmerzen, Hautausschlag
④ Thiopurine, Eisen
⑤ Niere, Leber, Blutbild
|
|
Corticoide
(Budesonid MMX, Prednison, Prednisolon)
|
Schubtherapie für moderate/schwere MC- oder CU-Exazerbationen |
gute Ansprechrate, schneller Wirkeintritt,
preiswert,
verschiedene Applikationsformen,
lokale Wirksamkeit (Budesonid)
|
Nebenwirkungen (Kurzzeit/Langzeit), kein Rezidivschutz (keine Dauermedikation) |
① Lagerung (v. a Schäume)
② Handhabung
③ Schlafstörungen, Stimmungsschwankungen, Hautveränderungen, Hypertonie, Osteopenie/Osteoporose, Infektionen
④ Impfung (bei systemischer Therapie, Hochdosistherapie), Antidiabetika, Diuretika
⑤ Blutdruck, Lipide, Knochendichte
|
|
Immunsupressiva
(Azathioprin, Methotrexat)
[off label: Ciclosporin, Tacrolimus]
|
Rezidivprophylaxe bei mittlerer/hoher MC- oder CU-Erkankungsaktivität, Steroid-refraktärem Verlauf |
gute rezidiv-prophylaktische Wirkung (Steroid-sparend) |
langsamer Wirkeintritt (zwei bis drei Monate),
schwerwiegende Nebenwirkungen
|
① Lagerung
② Sonnenschutz
③ Panzytopenie, Lymphomrisiko, Hautkrebsrisiko
④ Impfung; Azathioprin: Allopurinol, Febuxostat, Aminosalicylate; Methotrexat: PPI, NSAR, Schleifendiuretika, Penicilline
⑤ Blutbild, Niere, Leber, evtl. TDM, Hautscreening
|
|
TNF-alpha-Inhibitoren
(Infliximab, Adalimumab, Golimumab)
|
bei hoher Erkrankungsaktivität bei Versagen etablierter Therapien |
gute Ansprechrate als Schubtherapie, gute rezidiv-prophylaktische Wirkung, Remissionserhaltung über mehrere Jahre |
Preis (trotz Biosimilar),
Nebenwirkungen (v. a. durch Kombinationstherapien)
|
① Lagerung, IFX: Verdünnung, Filter
② (multipler) Switch, Sonnenschutz
③ Infusions-/Injektionsreaktionen, Infektionen, Herzinsuffizienz
④ Impfung
⑤ Gewicht, TDM (Talspiegel, Anti-Drug-Antikörper), Hautscreening
|
|
Integrin-Inhibitoren
(Vedolizumab)
|
bei mittlerer/schwerer, aktiver MC- oder CU-Erkrankung bei Versagen konservativer Therapie oder unzureichendem Ansprechen eines TNF-alpha-Inhibitors |
gute Wirksamkeit |
Preis |
① Lagerung (Kühlschrank), Herstellung
② Aufdosierung
③ Nasopharyngitis, Kopfschmerzen, Arthralgie, Husten, Übelkeit, Hautausschlag, Infusionsreaktionen
④ Lebendimpfstoffe (Vorsicht)
⑤ TDM (Talspiegel, Anti-Drug-Antikörper)
|
|
Interleukin-(12/23)-Inhibitoren
(Ustekinumab)
|
bei hoher Erkrankungsaktivität bei Versagen etablierter MC-Therapien |
gute Responserate bei Schubtherapie (Gelenkbeteiligung) |
Preis |
① Lagerung (Kühlschrank), Herstellung (Verdünnung, Filter)
② Wechsel von Infusion (Induktionstherapie) auf Selbstinjektion (Erhaltungstherapie)
③ Nasopharyngitis, Kopfschmerzen,
④ Impfung
⑤ TDM (Talspiegel, Anti-Drug-Antikörper)
|
|
JAK-Inhibitoren
(Tofacitinib)
|
bei mittlerer/schwerer, aktiver CU-Erkrankung bei Erwachsenen |
schnelles Ansprechen,
orale Gabe,
keine Antikörperbildung
|
Preis,
Nebenwirkungen
|
① Lagerung
② Dosisreduktion (meist) nach acht Wochen
③kardiovaskulär (Hypertonie), Arthralgie, Kopfschmerzen
④ Impfung, Azolantimykotika, Tacrolimus, Ciclosporin, Rifampicin
⑤ Gewicht, Blutbild, Niere, Leber, Hautscreening
|
|
Stammzellen
(Darvadstrocel)
|
komplexe perinale Fisteln bei Erwachsenen mit nichtaktivem/gering aktivem luminalem MC und unzureichendem Ansprechen auf mindestens eine konventionelle oder biologische Therapie |
spezielle Zentren/Praxen |
Preis,
geringe Ansprechrate
|
① Lagerung (15 bis 25 °C), lichtgeschützt
② Fistelvorbereitung, intraläsionale Injektion nicht mit Nadeln dünner als 22G
③ Analabszesse, Proktalgie, Analschmerzen
④ Farbstoffe, Lokalanästhetika, Impfung
⑤ Infektionsanzeichen
|
klinischer/therapeutischer Aspekt |
ältere Patienten
(> 60 Jahre)
|
Kinder/Jugendliche
(< 18 Jahre)
|
|---|---|---|
Genetik |
geringe Rolle |
bedeutsam |
CED-Symptome |
eher subtil |
eher typisch |
Klinikaufenthalte |
häufig |
kaum |
Infektionen |
häufiger und schwerer |
weniger häufig und leicht |
Krebsrisiko |
erhöht |
gering |
Polypharmazie (≥ 5 Arzneimittel) |
häufig |
selten |
Corticoide |
mehr Nebenwirkungen |
geringere Nebenwirkungen |
Thiopurine |
Nutzen unklar |
klarer Nutzen |
Methotrexat |
höhere Toxizität |
bessere Verträglichkeit |
Cyclosporine |
mehr Kontraindikationen |
geringere Nebenwirkungen |
TNF-alpha-Inhibitoren |
geringeres Ansprechen, mehr Nebenwirkungen |
höheres Ansprechen, geringere Nebenwirkungen |
Auch das Geschlecht kann die Wirksamkeit und Verträglichkeit einer Therapie beeinflussen. Beispielsweise ist die Biologika-Clearance bei Frauen geringer als bei Männern, hingegen ist die Aktivität der Thiopurin-S-Methyltransferase bei Männern erhöht. Diese und andere Genderaspekte werden im Alltag bislang allerdings wenig beachtet [9 – 16].
Herausforderung Patientenadhärenz
Dass die multifaktoriell beeinflusste Therapietreue auch bei CED-Patienten eine Herausforderung ist, liegt auf der Hand. Faktoren wie Patientenalter (Kind/Jugendlicher vs. Erwachsener), Geschlecht, Applikationsart (topisch vs. systemisch), CED-Stadium (Schub vs. Remission) und Therapieregime (komplex vs. einfach; Selbstmanagement vs. Infusion) spielen eine Rolle. Bei CED-Patienten wurden Adhärenzwerte zwischen 40% und 80% ermittelt [17]. Dabei scheint eine Biologika-Therapie für die Patienten einfacher zu befolgen zu sein als eine Therapie mit klassischen Therapeutika [18]. Doch auch bei den Biologika unterscheiden sich die Adhärenzwerte stark: Während für die intravenös verabreichten Substanzen Vedolizumab und Infliximab mit 83% bzw. 70% vergleichsweise hohe Werte ermittelt wurden, zeigten Patienten unter den subkutan applizierten Biologika Adalimumab und Certolizumab mit 57% bzw. 50% eine deutlich schlechtere Adhärenz. Diese Daten verdeutlichen einmal mehr, dass neben den Patientenpräferenzen eine fachliche Assistenz bei der Selbstinjektion von Vorteil ist und die Applikation in der Arztpraxis oder Klinikambulanz erfolgen sollte [19, 20]. Eine Therapieadhärenz unter 80% ist mit einem massiven Verlust des Therapieerfolges verbunden [21].
Therapieoptimierung mit Biomarkern
Zahlreiche Biomarker (invasiv, nichtinvasiv, serologisch, fäkal) stehen zur individuellen Einschätzung der mukosalen entzündlichen Aktivität zur Verfügung. Damit lässt sich bei einem Entzündungsschub frühzeitig reagieren, was wiederum den Krankheitsverlauf entscheidend bessern kann. Andererseits ist damit eine Therapiesteuerung möglich (s. auch Exit-Strategie), um keine Patienten umsonst potenziell nebenwirkungsträchtigen und gegebenenfalls kostspieligen Therapien auszusetzen.
Anhand der Spiegel des C-reaktiven-Proteins (CRP > 10 mg/l) und des fäkalen Calprotectin (fCalprotectin: Mittelwert aus zwei Messungen > 150 µg/g) kann eine entzündliche Aktivität rasch und relativ kostengünstig nachgewiesen werden. Auch für die regelmäßige Verlaufskontrolle (Richtwert alle drei Monate) bei Morbus Crohn scheinen diese Marker geeignet zu sein [22, 23]. Für die Patientenselbstmessung gibt es App-unterstützte Selbsttests für fCalprotectin (z. B. QuantOn Cal®), deren Kosten aber bisher nicht von den Krankenkassen übernommen werden.
Bio-Original oder Bio-Similar?
Das Prinzip der schrittweisen Therapiesteigerung beim Morbus Crohn und der Colitis ulcerosa führt zu einem zunehmenden frühen Einsatz von Therapien, die gegen den Tumornekrosefaktor (TNF) alpha gerichtet sind. Dies bewegt auch die Kostenträger mit Blick auf die wirtschaftliche Verordnungsweise umsatzstarker Biologika und den Einsatz von Biosimilars. In der Therapie der chronisch-entzündlichen Darmerkrankungen spielen derzeit Infliximab- und Adalimumab-Biosimilars eine Rolle.
Bei den Infliximab-Verordungen war der Anteil der Biosimilars bezogen auf 2016 in der privaten Krankenversicherung mit 12,2% vergleichsweise gering, in der gesetzlichen Krankenversicherung lag der Anteil der Biosimilar-Verordnungen mit 31,8% etwas höher [24]. Die Verordnung des Referenzbiologikums bei Verfügbarkeit eines preiswerteren Biosimilars verursacht Mehrkosten ohne patientenrelevanten Zusatznutzen, sodass der Biosimilar-Verordnungsanteil als Indikator für verantwortliches wirtschaftliches Handeln angesehen wird. Dass dieses Einsparpotenzial in gebotenem Umfang genutzt wird, sieht der Barmer Arzneimittelreport 2018 auch mit der Verfügbarkeit von Adalimumab-Biosimilars nicht sichergestellt [25].
Zahlreiche Switch-Daten belegen zusammenfassend das vergleichbare Wirkungs- und Sicherheitsprofil der Biosimilars. Für den mehrfachen Wechsel zwischen Referenzprodukt und Biosimilar gibt es allerdings nur Daten zu Etanercept (EGALITY-Studie) [26] – der TNF-alpha-Hemmer wird bei CED-Patienten allerdings nicht eingesetzt.
Welt-CED-Tag
Der World IBD (Inflammatory Bowl Disease) Day findet jährlich am 19. Mai statt. An diesem Tag soll für die chronisch-entzündlichen Darmerkrankungen sensibilisiert werden. Als Zeichen der Unterstützung tragen viele Menschen lila Kleidung oder lila Schleifen und berühmte Bauwerke auf der ganzen Welt erstrahlen in lila Licht. Koordiniert werden die weltweiten Aktionen von der European Federation of Crohn‘s & Ulcerative Colitis Associations (EFCCA).
Das Patientenwissen zu Biosimilars ist gering, die Unsicherheit beispielsweise bezogen auf Langzeitprobleme hoch, die Akzeptanz zurückhaltend und die wichtige Adhärenz dadurch in Gefahr [27]. Der Aufklärungsbedarf ist insgesamt hoch und zeitintensiv [28]. Wie Daten zur Biosimilar-Therapie (Infliximab, Etanercept) bei Rheumapatienten belegen, kann die Akzeptanz durch Einbeziehen der fachlichen pharmazeutischen Kompetenz im Rahmen einer optimierten Kommunikationsstrategie verbessert werden [29].
Eine gute Akzeptanz ist jedoch ausschlaggebend für den Behandlungserfolg einer Biologika-Therapie: Denn dieser steht und fällt mit den Wirkstoffspiegeln im Blut. Eine geringe Wirkstoffkonzentration ist ein „Double Whammy“, da es zu einer Krankheitsaktivierung und zur Bildung von neutralisierenden Anti-Drug-Antikörpern kommen kann, welche die Wirksamkeit der Arzneimittel herabsetzen. Gerade auch im Hinblick auf den wachsenden Biosimilar-Markt sind rationale und kosteneffektive Strategien zu ermitteln, mit denen die Immunogenität der Biologika durch Monitoring der Blutspiegel vermindert werden kann [30].
Cave Schmerzmedikation
Schmerzen sind ein häufiges Begleitsymptom der chronisch-entzündlichen Darmerkrankungen und mit großen Auswirkungen auf die gesundheitsbezogene Lebensqualität verbunden. In einer Schweizer CED-Kohorte gaben 71% der Patienten Schmerzen an, nur 24% dieser Patienten erhielten keine Schmerztherapie. Neben Abdominalschmerzen, Kopf-und Rückenschmerzen sind auch Schmerzen durch extraintestinale Manifestationen (v. a. in den Gelenken) relevant. Die Anwendung von nichtsteroidalen Antirheumatika (NSAR) ist begrenzt durch das Risiko der Krankheitsverschlimmerung und Exazerbation (Schubauslösung). Dennoch nahmen in der Schweizer Kohorte 13% der Patienten NSAR und 3% der Patienten COX-2-Inhibitoren ein. Zwischen Patienten mit Morbus Crohn und Colitis ulcerosa bestand dabei kein Unterschied [31]. Bei der Wahl der geeigneten Schmerzmedikation sollte die Erfahrung des Patienten berücksichtigt werden. So ist es sinnvoll zu erfragen, was der Patient bisher gut vertragen hat. Alternativen zu NSAR sind Paracetamol, Metamizol und kurzzeitig Opioide (< vier Wochen) [32].
Stellenwert der Vitamin-D3-Supplementierung
CED-Patienten haben ein höheres Risiko für einen Vitamin‑D-Mangel, der sowohl im Schub als auch in der Remission existiert und schon bei Kindern zum Zeitpunkt der Diagnosestellung festzustellen ist [33, 34]. Dieser Mangel sorgt neben einem erhöhten Osteoporoserisiko auch für eine höhere Krankheitsaktivität der chronisch-entzündlichen Darmerkrankung. Ein signifikanter Zusammenhang zwischen dem Vitamin-D-Status und der CED-Remission unter einer Anti-TNF-alpha-Therapie (Infliximab oder Adalimumab) wurde in einer Studie mit 173 CED-Patienten ermittelt. Die Remissionsrate nach drei Monaten war bei Patienten mit normalen Vitamin-D-Spiegeln (> 33 ng/ml) zu Beginn der Anti-TNF-alpha-Therapie um den Faktor 2,64 signifikant höher als bei Patienten mit Vitamin-D-Mangel (9 bis 33 ng/ml). Diesen interessanten Zusammenhang müssen nun größere Studien belegen [35]. Neben einer antibiotischen und antientzündlichen Wirkqualität wird Vitamin D3 als pleiotropem Hormon auch ein Einfluss auf das Mikrobiom (Schutz vor Dysbiose) zugeschrieben [36, 37].
Der Blutspiegel an 25-OH-Vitamin-D3 sollte regelmäßig gemessen und ein Mangelzustand entsprechend individuell ausgeglichen werden. Dies scheint bei schweren Verläufen und bei Jugendlichen dringend erforderlich zu sein, zumal der effektive Blutspiegel (> 30 ng/ml) auch nach Supplementierung meist nicht erreicht wird [34]. Allerdings fehlen diesbezüglich sowohl Untersuchungen mit großen Patientenzahlen als auch gute randomisierte kontrollierte Studien. Dennoch zeigte eine Metaanalyse, in der 19 sehr heterogene Studien berücksichtigt wurden, dass die Schubrate durch eine Vitamin-D3-Supplementation unabhängig von der Dosierung verringert werden kann [38].
Stellenwert der Eisen-Supplementierung
Zu den vielen CED-Krankheitskomplikationen zählt auch der Eisen-Mangel – zwischen 36% bis 90% der Patienten sind davon betroffen. Bei vielen Patienten wird ein bestehender Eisen-Mangel trotz vorhandener Symptome nicht diagnostiziert und somit auch nicht behandelt. Die Lebensqualität der CED-Patienten wird dadurch beträchtlich reduziert. Die Eisen-Absorption ist bei aktiven Erkrankungen (im Schub) herunterreguliert. Das ohnehin schlecht bioverfügbare Eisen wird dann kaum resorbiert. Dadurch kommt es zu ausgeprägten Veränderungen des Mikrobioms mit entzündlichen Veränderungen durch reaktive Sauerstoffspezies [39]. Die mukosale Entzündung führt zu einem Anstieg akuter Phase-Proteine (CRP, Hepcidin, Ferritin) und hemmt die Eisen-Freigabe ins Blut. Diese Kaskade wird durch antientzündliche Strategien (5-ASA, TNF-alpha-Inhibitoren) durchbrochen. Im Schub verbietet sich eine orale Eisen-Supplementierung mit Eisen-II-Salzen, die bei Colitis ulcerosa kontraindiziert sind (Fumarat, Gluconat, Sulfat) [40]. Ist schnell der individuelle Eisen-Status des Patienten zu verbessern, so ist dies nur mittels intravenöser Eisen-III-Zubereitungen möglich [41]. Aber auch hier kann es zu Unverträglichkeitsreaktionen kommen.
Krebsrisiko und UV-Expositionsschutz
Aufgrund des erhöhten Hautkrebsrisikos ist bei CED-Patienten jährlich eine dermatologische Kontrolle durchzuführen. Leider findet das Screening nur selten statt; weniger als 3% der Patienten werden regelmäßig kontrolliert. Zudem wird das Screening bei jungen Patienten mit überproportionalem Risiko oft vergessen. Patienten mit Hautkrebs in der Familienanamnese werden häufiger überwacht. Apps können die Selbstbeurteilung des Patienten unterstützen [42].
Bei der Therapie mit Azathioprin, Ciclosporin, Methotrexat, Sulfasalazin und TNF-alpha-Inhibitoren ist durch die erhöhte Lichtempfindlichkeit der Haut auf einen ausreichenden UV-Schutz zu achten: mindestens Lichtschutzfaktor 50 (UV-B- und UV-A-Schutz), Tragen langärmliger Kleidung, Meidung von Sonnenexposition zwischen elf und 15 Uhr. Eine Monotherapie mit einem Biologikum scheint nach einem aktuellen Review mit einem geringeren Hautkrebsrisiko verbunden zu sein [43]. Das höchste Risiko besitzen die Thiopurine (s. Abbildung 3).
Bei der berechtigten Patientenfrage nach dem Stellenwert von Probiotika zum Remissionserhalt sind diese mit Mesalazin gleichwertig zu sehen (s. aktuelle Colitis-Leitlinie 2018). Jedoch kann nur mit Mesalazin durch seine chemoprotektive Wirkung der Entstehung von Darmkrebs vorgebeugt werden. Doch auch unter der Mesalazin-Einnahme liegen Fallberichte zu Lichtempfindlichkeitsreaktionen vor. Der Pathomechanismus ist nicht geklärt. Es wird von phototoxischen Effekten ausgegangen. Nach Absetzen von Mesalazin dauert es unterschiedlich lange, bis die Hautveränderungen (Erythem, Puritis) vollständig abgeklungen sind.
Exit-Strategien gefragt
Wichtig für den Therapieeffekt ist, dass der Patient keine eigenmächtigen Pausen nach dem Motto „mir geht es ja gut“ einlegt. Ein generelles Absetzen einer Therapie aufgrund klinischer Beschwerdefreiheit birgt für einige Patienten ein deutliches Rückfallrisiko. Dennoch stellt sich den behandelnden Ärzten in Anbetracht der hohen Kosten einer Biologika-Therapie die Frage nach einem geeigneten Absetzzeitpunkt. Bei der Evaluation sollten der bisherige Krankheitsverlauf (Dauer der klinischen Remission, Wirkstoffspiegel) und die Komorbiditäten (z. B. Tumorerkrankungen) berücksichtigt werden. Die Ergebnisse der STORI-Studie („Stop infliximab in patients with Crohn’s disease“) mit 115 Patienten zeigen, dass nach Absetzen des Biologikums Infliximab nach einer mindestens einjährigen Remission unter einer Kombinationstherapie mit einem Antimetaboliten (z. B. Azathioprin) noch 60% in Remission bleiben. Bei einem Rückfall innerhalb von sechs Monaten konnte dieser mit der erneuten Gabe von Infliximab in 98% der Fälle erfolgreich behandelt werden [44].
Basierend auf weiteren Parametern (Crohn’s Disease Endoscopic Index of Severity < 2, CRP < 5 mg/dl, Hämoglobin > 14,5 g/dl) gelang in einer kleinen deutschen Studie mit Infliximab bei 70% der 40 Probanden ein Remissionserhalt nach dem Exit [45]. Zusätzlich zum CRP kann auch das fCalprotectin für die Entscheidung von Therapiepausen genutzt werden [46].
CED: Das Wichtigste auf einen Blick
- Symptome können intestinal (Oberbauchschmerzen, Diarrhöen auch nachts) und extraintestinal (Hautentzündungen, Aphthen, Arthritis, Uveitis) auftreten.
- Die Erkrankungen verlaufen chronisch und sind derzeit nicht heilbar.
- Die Therapie richtet sich nach dem Alter des Patienten und der Schwere der Erkrankung.
- Arzneimittelinteraktionen sind zu beachten.
- Die Adhärenz liegt zwischen 40% und 8.0% und ist entscheidend für den Therapieerfolg.
- Mithilfe von Biomarkern kann die Therapie optimiert werden.
- Ein regelmäßiges Monitoring (Endoskopie, Blutbild, Biomarker) wird empfohlen.
- Cave NSAR-Einsatz: Risiko der Krankheitsverschlimmerung und Exazerbation.
- Vitamin-D-Mangel wirkt sich negativ auf den klinischen Verlauf und das Therapieansprechen aus.
- Eisen-Supplementierung sollte im Schub i. v. erfolgen.
Was bringt die Zukunft?
Eine hohe Adhärenz sichert die Effektivität der medikamentösen Therapie und kann eine Therapieeskalation verzögern. Dennoch werden neue Wirkstoffe sowie Ansatzpunkte bei der individualisierten CED-Therapie benötigt, da nur etwa ein Drittel der Patienten unter den Biologika in klinischer Remission bleiben [47]. Die neuen Therapiestrategien adressieren die endotheliale Enterozyten-Permeabilität, die Beeinflussung der Dysbiose, die Produktion proinflammatorischer Zytokine sowie die immunologische Migration [48]. Zudem liegen interessante Fallberichte und -serien zu bisher nicht in klinischen Studien untersuchten Arzneimittelkombinationen vor [49]. Ebenfalls befinden sich zur Verbesserung des Eisen-Status bei entzündlichen Erkrankungen Hepcidin-Antagonisten in der klinischen Entwicklung [50]. Damit bleibt das maßgeschneiderte Medikationsmanagement bei jungen wie alten CED-Patienten auch künftig komplex. Die Lebensqualität ist in der Remission allerdings deutlich besser als in der aktiven Erkrankungssituation (Schub) [51]. Und genau deshalb hat die Apotheke in der CED-Behandlung einen besonderen Stellenwert [52]! |
Literatur
[1] Baumgart DC, Sandborn WJ. Crohn’s disease. Lancet 2012;380(9853):1590-1605
[2] Danese S, Fiocchi C. Ulcerative colitis. New Engl J Med 2011;365(18):1713-1725
[3] Radke M. Chronisch entzündliche Darmerkrankungen – Transition von der Jugend- zur Erwachsenenmedizin. Dtsch Med Wochenschr 2015;140(09):673-678
[4] Ng SC et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet 2018;390(10114):2769-2778
[5] Schoepfer AM et al. IBD Cohort Study Group. Diagnostic delay in Crohn’s disease is associated with a complicated disease course and increased operation rate. Am J Gastroenterol 2013;108(11):1744-53
[6] Münch A et al. Microscopic colitis: Current status, present and future challenges: statements of the European Microscopic Colitis Group. J Crohns Colitis 2012;6(9):932-45
[7] Keiner D. AMTS-Pyramide – ein Management-Tool für Closed Safety am Beispiel von Morbus Crohn. 5. Deutscher Kongress für Patientensicherheit bei medikamentöser Therapie; Berlin, 18. – 19. Oktober 2018 (Abstract I-25)
[8] Gispert JP, Chaparro M. Systematic review with meta-analysis: inflammatory bowel disease in the elderly. Aliment Pharmacol Ther 2014;39(5):459-477
[9] Zelinkova Z, van der Woude CJ. Gender and Inflammatory Bowel Disease. J Clin Cell Immunol 2014;5:245
[10] Onuk V et al. Etablierung einer Datenbank zur Charakterisierung von Manifestation, Medikation und Therapie bei Patienten mit CED in einem tertiären Zentrum. Gastroenterologie 2017;12(3):264
[11] Requeiro M et al. Etiology and Treatment of Pain and Psychosocial Issues in Patients With Inflammatory Bowel Diseases. Gastroenterology 2017;152(2):430-439
[12 Kane SV et al. Prevalence of nonadherence with maintenance mesalamine in quiescent ulcerative colitis. Am J Gastroenterol 2001;96(10):2929-2933
[13] Schwartz JB. The influence of sex on pharmacokinetics. Clin Pharmacokinet. 2003;42(2):107-121
[14] Pose S. Epidemiologische Untersuchung zum Impfstatus von Patienten mit chronisch-entzündlicher Darmerkrankung (CED) im Universitätsklinikum Jena. Dissertation FSU Jena 2015. http://d-nb.info/1074139151/34
[15] Gröchenig H et al. Use and predictors of complementary and alternative medicine (CAM) in patients with inflammatory bowel disease – results of a multicenter study of the Austrian IBD Study Group (ATISG). Z Gastroenterol 2016;54-V03
[16] Zhan YL et al. Is a low FODMAP diet beneficial for patients with inflammatory bowel disease? A meta-analysis and systematic review. Clin Nutr 2018;37(1):123-129
[17] Lakatos PL. Prevalence, predictors, and clinical consequences of medical adherence in IBD: How to improve it? World J Gastroenterol 2009;15(34):4234-4239
[18] Michetti P et al. Impact of Treatment-Related Beliefs on Medication Adherence in Immune-Mediated Inflammatory Diseases: Results of the Global ALIGN Study. Adv Ther 2017;34(1):90-108
[19] Wenthworth BJ et al. Nonadherence to Biologic Therapies in Inflammatory Bowel Disease. Inflamm Bowel Dis 2018;24(9):2053-2061
[20] Wolf DC et al. Adherence rates and health care costs in Crohn‘s disease patients receiving certolizumab pegol with and without home health nurse assistance: results from a retrospective analysis of patient claims and home health nurse data. Patient Prefer Adherence 2018;12:869-878
[21] van der Have M et al. Non-adherence to Anti-TNF Therapy is Associated with Illness Perceptions and Clinical Outcomes in Outpatients with Inflammatory Bowel Disease: Results from a Prospective Multicentre Study. J Crohns Colitis 2016;10(5):549-55
[22] Norouzinia M et al. Biomarkers in inflammatory bowel diseases: insight into diagnosis, prognosis and treatment. Gastroenterol Hepatol Bed Bench 2017;10(3):155-167
[23] Vetter M et al. Chronisch entzündliche Darmerkrankungen. Biomarker verbessern Versorgung des M. Crohn. MMW 2017;159(3):63-67
[24] Jacke CO et al. Arzneimittelversorgung von Privatversicherten 2018. Zahlen, Analysen, PKV-GKV-Vergleich. WIP-Analyse 3/2018
[25] Grandt D et al. Arzneimittelreport 2018. Schriftenreihe zur Gesundheitsanalyse. Band 10
[26] Wiland P et al. Biosimilar switching – current state of knowledge. Reumatologia 2018;56(4):234-242
[27] Sullivan E et al. Assessing gastroenterologist and patient acceptance of biosimilars in ulcerative colitis and Crohn‘s disease across Germany. PloS One 2017;12(4):e0175826
[28] Armuzzi A et al. Nurses are Critical in Aiding Patients Transitioning to Biosimilars in Inflammatory Bowel Disease: Education and Communication Strategies. J Crohns Colitis 2019;13(2):259-266
[29] Tweehuysen L et al. Higher acceptance and persistence rates after biosimilar transitioning in patients with a rheumatic disease after employing an enhanced communication strategy. Poster FRI0200, Annual European Congress of Rheumatology 2017; http://dx.doi.org/10.1136/annrheumdis-2017-eular.2889
[30] Hanauer SB. Heading Back to the Trough (Levels of Biologics in IBD). Clin Gastroenterol Hepatol 2015;13(3):548-551
[31] Zeit J et al. Pain in IBD Patients: Very Frequent and Frequently Insufficiently Taken into Account. PLoS One 2016;11(6):e0156666
[32] Harbord M et al. The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis 2016;10(3):239-254
[33] Kabbani TA et al. Association of Vitamin D Level With Clinical Status in Inflammatory Bowel Disease: A 5-Year Longitudinal Study. Am J Gastroenterol 2016;111(5):712-719
[34] Rigterink T et al. Vitamin D therapy in children with inflammatory bowel disease: A systematic review. World J Clin Pediatr 2019;8(1):1-14
[35] Winter RW et al. Higher 25-hydroxyvitamin D levels are associated with greater odds of remission with anti-tumour necrosis factor-alpha medications among patients with inflammatory bowel diseases. Aliment Pharmacol Ther 2017;45(5):653-659
[36] Del Pinto R et al. Vitamin D Axis in Inflammatory Bowel Diseases: Role, Current Uses and Future Perspectives. Int J Mol Sci 2017;18(11):2360
[37] Jinzhong L et al. Efficacy of vitamin D in treatment of inflammatory bowel disease. A meta-analysis. Medicine 2018;97(46):e12662
[38] Li J et al. Efficacy of vitamin D in treatment of inflammatory bowel disease. A meta-analysis. Medicine (Baltimore) 2018;97(46):e12662
[39] Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel) 2018;11(4):pii:E98
[40] Farrag K et al. Neue Optionen der oralen Eisensubstitution. Arzneimitteltherapie 2019;37:105-112
[41] Nielsen OH et al. Rational Management of Iron-Deficiency Anaemia in Inflammatory Bowel Disease. Nutrients 2018;10(1):pii:E82
[42] Patil SA, Cross RK. More Skin in the Game: Screening for Skin Cancer in IBD Patients. Dig Dis Sci 2018;63(10):2497-2499
[43] Hagen JW, Pugliano-Mauro MA. Nonmelanoma Skin Cancer Risk in Patients With Inflammatory Bowel Disease Undergoing Thiopurine Therapy: A Systematic Review of the Literature. Dermatol Surg 2018;44(4):469-480
[44] Louis E et al. Maintenance of Remission Among Patients With Crohn’s Disease on Antimetabolite Therapy After Infliximab Therapy Is Stopped. Gastroenterology 2012;142(1):63-70
[45] Helwig U et al. Proposal for an anti-TNF-exit strategy based on trough serum level. Biologicals 2017;47:81-85
[46] Papamichael K, Vermeire S. Withdrawal of anti-tumour necrosis factor α therapy in inflammatory bowel disease. World J Gastroenterol 2015;21(16):4773-4778
[47] Hartmann P, Bokemeyer B. Anti-TNF-alpha-Wirkstoffe bei chronisch entzündlichen Darmerkrankungen. Pharmakon 2017;5(5):356-363
[48] Neurath MF. Current and emerging therapeutic targets for IBD. Nat Rev Gastroenterol Hepatol 2017;14(5):269-278
[49] Le Berre C et al. Combination Therapy With Vedolizumab and Tofacitinib in a Patient With Ulcerative Colitis and Spondyloarthropathy. Clin Gastroenterol Hepatol 2019;17(4):794-796
[50] Petzer V et al. Established and Emerging Concepts to Treat Imbalances of Iron Homeostasis in Inflammatory Diseases. Pharmaceuticals (Basel) 2018;11(4):pii:E135
[51] Hueppe A et al. Inviting patients with inflammatory bowel disease to active involvement in their own care: a randomized controlled trial. Inflamm Bowel Dis 2014;20(6):1057-1069
[52] Atreya R, Keiner D. Chronisch entzündliche Darmerkrankungen. Schriftenreihe der Bayerischen Landesapothekerkammer – Band 95, Avoxa Verlag 2017

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.