
- DAZ.online
- DAZ / AZ
- DAZ 41/2018
- Alles „nur“ eine ...
Arzneimittel und Therapie
Alles „nur“ eine Momentaufnahme
Ilse Zündorf und Theo Dingermann kommentieren den diesjährigen Chemie-Nobelpreis
Der Optimierungsansatz
Es ist das geistige Vermächtnis des genialen Charles Darwin an die Naturwissenschaften, dass Evolution auf zwei generellen Prinzipien beruht: Mutation, also leichte oder auch größere Änderungen am genetischen Programm eines Lebewesens, und Selektion – der Fähigkeit, in einer bestimmten Umgebung die Programmänderungen vorteilhaft gegenüber „Konkurrenten“ einzusetzen. Genau das ist auch die Basis für die Arbeiten der drei ausgezeichneten Wissenschaftler. Will man die Leistungen der drei frisch gekürten Nobelpreisträger vor diesem Hintergrund auf den Punkt bringen, so war es George P. Smith, der ein extrem nützliches Selektionssystem entwickelt hat. Gregory P. Winter hat mithilfe dieses Selektionssystems gezeigt, dass sich tatsächlich durch kleine Programmänderungen an einem Ausgangsmolekül, das gewissermaßen als eine Art Rohling fungiert, enorme Verbesserungen erzielen lassen. Letztlich soll das dazu führen, dass die weiterentwickelten Molekülvarianten bei der Interaktion mit einem anderen Molekül sowohl bezüglich Selektivität als auch bezüglich Bindungsstärke dramatisch gewinnen. Frances H. Arnold hingegen hat dieses Prinzip noch einmal erweitert. Ihr Ansatz besteht unter anderem darin, sich nicht nur auf die schrittweise Variation der Buchstaben eines Ausgangsmoleküls zu beschränken, sondern ein Prinzip der Evolution mit einzubringen, das wir als Rekombination bezeichnen. Dabei werden ganze Molekülabschnitte ähnlicher Moleküle aus unterschiedlichen Organismen ausgetauscht, so dass das Optimierungspotenzial noch einmal drastisch steigt.
Der „Goldschürfer“ unter den Molekularbiologen
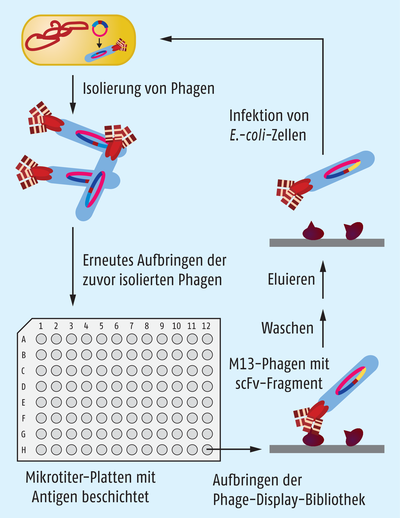
George P. Smith entwickelte ein Verfahren, das sehr treffend als „panning“ bezeichnet wird. Vielleicht inspiriert durch das geduldige Schwenken der Schürfpfannen der Abenteurer in der Zeit des Wilden Westens, durch das langsam Spuren von Gold aus dem Geröll eines wilden Flusses angereichert werden, konstruierte Smith eine eigene Schürfpfanne in Form ganz normaler Petrischalen, auf deren Oberfläche er bestimmte Antikörper fixierte. In diese Schalen schüttete er dann Suspensionen von Phagen, die auf ihrer Oberfläche unterschiedliche Strukturen trugen, die gegebenenfalls an die fixierten Antikörper auf der Petrischale binden konnten. Durch sorgfältiges Abwaschen der nicht gebundenen Phagen, Lösen der gebundenen Phagen unter geeigneten Bedingungen und Infektion von Bakterien konnten die Phagen selektioniert und auch vermehrt werden (Abb. 1). Durch mehrfaches Wiederholen dieser Bindungs- und Ablöseprozesse „selektionierte“ Smith auf diese Weise eine Phagen-Population, die eine hohe Affinität zu den an der Petrischale fixierten Antikörpern besaßen. Das war eine geniale Methode – einfach, aber sehr effizient, die unter anderem Gregory (Greg) Winter die Möglichkeit eröffnete, seine bahnbrechenden Ideen zu realisieren.
Die Translation der experimentellen Evolution in die Klinik
Winters Idee war es, mithilfe der „panning“-Selektionsmethode statt nach Proteinstrukturen auf der Oberfläche von Phagen, die an fixierte Antikörper binden, nach Antikörpern zu suchen, die sich gegebenenfalls für einen therapeutischen Einsatz eignen könnten. Hierzu wandelte er das von Smith etablierte System dahingehend um, dass er nicht etwa Antikörper, sondern interessante Zielstrukturen für eine pharmakotherapeutische Intervention auf der Oberfläche der Petrischale fixierte. Auf der anderen Seite modifizierte er die für den Selektionsprozess verwendeten Phagen dahingehend, dass er in deren Genom Teile eines für einen Antikörper kodierenden Gens so integrierte, dass die resultierenden antigenbindenden Antikörperfragmente auf der Phagen-Oberfläche exponiert wurden.
Das war eine geniale Idee, denn nun konnte er diese Phagen benutzen, um zufällige Mutationen in das Genfragment des Antikörpers einzuführen. Diese Mutationen resultierten in Antikörper-Fragmenten, die entweder besser oder schlechter von den auf der Petrischale fixierten Strukturen festgehalten wurden. Durch viele Mutations-/Selektionsrunden näherte sich Greg Winter so Antikörpervarianten, die derart fest und selektiv an ganz bestimmte menschliche Moleküle binden, dass wir sie heute als hochwirksame Arzneimittel einsetzen können. Auf diese Art wurde der Blockbuster Adalimumab (Humira®) aus einer Phagenbank mit einer Vielzahl unterschiedlicher Antikörperfragmente aus dem Blut humaner Spender gewonnen.
Die Turbomethode
Frances H. Arnold ging einen eigenständigeren, eventuell auch einen effizienteren Weg. Vielleicht wurde ihr auch deshalb die eine Hälfte des diesjährigen Preises zuerkannt, während sich die andere Hälfte die beiden männlichen Preisträger teilen müssen. Arnold arbeitete auch nicht mit Peptidstrukturen oder Antikörpern, sie wählte Enzyme als Objekt ihrer Evolutionsstrategien.
Ausgehend von einem Startenzym nutzte sie nicht nur das Variationspotenzial, das zufällige Punktmutationen bieten. Sie setzte darüber hinaus die gewaltigen Möglichkeiten ein, die eine Rekombination zwischen DNA-Fragmenten erlaubt. In einem Ansatz, der als „DNA-shuffling“ bezeichnet wird (Abb. 2), werden einige Gene, die für bestimmte Modell-Enzyme codieren, völlig unspezifisch in kleinere Stücke geschnitten. Anschließend werden diese Stücke mithilfe einer DNA-Polymerase willkürlich zusammengesetzt. Derartige Neukombinationsmethoden wurden im Labor von Frances Arnold noch zur Perfektion weiterentwickelt. Als Ergebnis entstanden Gene für Proteine, die zufällig einzelne Eigenschaften der anfangs ausgewählten Modell-Enzyme vereinigten. Danach sind es wiederum geeignete Selektionsmethoden, mit denen in Richtung einer gezielten Evolution optimiert wird. Ideal sind Selektionen, die der verwendeten (Bakterien-)Zelle in einem bestimmten Medium einen Überlebensvorteil verschaffen, also beispielsweise die Inaktivierung eines Giftstoffes durch das neue Enzym. Dabei muss natürlich darauf geachtet werden, die Selektionsbedingungen nur schrittweise von Evolutionsrunde zu Evolutionsrunde zu erhöhen.
So konnte Frances H. Arnold Enzyme selektionieren, die nicht nur in einem wässrigen, sondern auch in einem lipophilen Milieu aktiv sind. Und es gelang ihr, Enzyme zu isolieren, die auch bei für Enzyme ungewöhnlichen Temperaturen funktionieren. Die von Arnold entwickelten Methoden werden heute bereits routinemäßig zur Entwicklung von Biokatalysatorenzymen eingesetzt, die ganz besonders in technischen Prozessen Anwendung finden.
Im Prinzip lassen sich unendlich viele Szenarien vorstellen, in denen diese designten Proteine zum Einsatz kommen können, was natürlich bereits Begehrlichkeiten weckt, dass bald alle Treibstoff- oder Abfallprobleme dieser Welt damit gelöst werden könnten. Wichtig bei der Methode ist, zu Beginn die richtigen Enzyme auszuwählen, die bereits eine (geringe) Aktivität in der gewünschten späteren Reaktion aufweisen. Der Erfolg steht und fällt jedoch mit geeigneten Selektionsmechanismen für die Auswahl der Bakterien, die das richtige Enzym produzieren.
Eine sehr gute Wahl
Nicht immer sind die Entscheidungen des Nobelkomitees unumstritten. In diesem Jahr besteht hier allerdings kein Zweifel. Zudem macht die Vergabe der diesjährigen Nobelpreise für Chemie deutlich, wie sehr die Chemie heute den Charakter einer Lebenswissenschaft angenommen hat, was auch das Ergebnis einer evolutiven Entwicklung ist. |
Literatur
www.nobelprize.org Scientific Background on the Nobel Prize in Chemistry 2018: DIRECTED EVOLUTION OF ENZYMES AND BINDING PROTEINS
Michnick, S.M., Arnold, F.H.: “Itching” for new strategies in protein engineering. Nature Biotechn. 17(1999),1159-1160.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.