
- DAZ.online
- DAZ / AZ
- DAZ 36/2018
- Präzisionswaffen ...
Arzneimittel und Therapie
Präzisionswaffen zugelassen
Grünes Licht für CAR-T-Zelltherapien in Europa
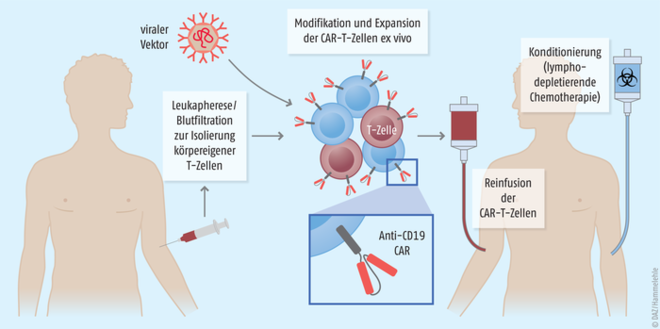
Das Prinzip der CAR-T-Zelltherapie beruht auf der Umprogrammierung körpereigener Immunzellen. Die Herstellung der CAR-T-Zellen ist aufwendig und erfolgt für jeden Patienten individuell (s. Abbildung). In einem ersten Schritt werden körpereigene T-Zellen des Patienten durch Leukapherese isoliert. Diese werden dann ex vivo durch Einschleusen eines viralen Vektors mit einem chimären Antigen-Rezeptor (CAR) ausgestattet und so zu „Scharfschützen des Immunsystems“ gemacht: Werden die genetisch veränderten T-Zellen dem Patienten wieder infundiert, erkennen und eliminieren sie gezielt Tumorzellen mit einem spezifischen Oberflächenmarker. Bei den beiden nun zugelassenen Therapien ist es das B-Lymphozytenantigen CD19. Damit die T-Zellen ihre zerstörerische Wirkung entfalten können, benötigen sie ein aktivierendes Signal. Daher enthält der rekombinante chimäre Antigen-Rezeptor neben der Antigenbindungsstelle (Antikörperfragment) eine kostimulatorische Domäne: Bei Tisagenlecleucel 4-1BB, bei Axicabtagen Ciloleucel CD28. Damit die CAR-T-Zellen vom Körper des Patienten besser angenommen werden, wird die Anzahl der weißen Blutkörperchen vor der Reinfusion in der Regel durch eine lymphodepletierende Chemotherapie (z. B. Cyclophospamid und Fludarabin) reduziert.
Indiziert bei B-Zell-Lymphomen und -Leukämien
Beide Gentherapien sind bei erwachsenen Patienten mit rezidiviertem oder refraktärem diffus großzelligem B-Zell-Lymphom (r/r DLBCL) nach zwei oder mehr Linien einer systemischen Therapie indiziert. Sie haben aber jeweils noch eine weitere Indikation: Tisagenlecleucel kann zusätzlich zur Behandlung von pädiatrischen und jungen erwachsenen Patienten im Alter bis zu 25 Jahren mit refraktärer oder rezidivierter (Rezidiv nach Transplantation oder zweites oder späteres Rezidiv) akuter lymphatischer B-Zell-Leukämie (r/r ALL) eingesetzt werden. Axicabtagen Ciloleucel ist außerdem zur Behandlung erwachsener Patienten mit primärem mediastinalem grosszelligem B-Zell-Lymphom (r/r PMBCL) zugelassen, bei denen zwei oder mehr systemische Therapielinien versagt haben.
Hohe Ansprechraten
Die Zulassung von Tisagenlecleucel beruht auf zwei klinischen Phase-2-Studien: In der ELIANA-Studie sprachen mehr als 80% der 75 r/r ALL-Patienten, die mit den CAR-T-Zellen behandelt wurden, auf die Therapie an: 60% der Patienten erreichten nach drei Monaten eine komplette Remission, 21% eine komplette Remission mit unvollständiger Wiederherstellung des hämatopoetischen Systems. Eine Resterkrankung war dann nicht mehr nachweisbar. Nach sechs Monaten lebten noch 90% der Patienten, nach zwölf Monaten 76%.
Patienten mit r/r DLBCL wurden in der JULIET-Studie untersucht. Bei etwa der Hälfte (52%) der 111 mit Tisagenlecleucel behandelten Patienten war die Therapie erfolgreich: 40% der Patienten hatten eine komplette Remission, 12% eine partielle Remission. Das Gesamtüberleben betrug nach zwölf Monaten 49%.
Die Wirksamkeit von Axicabtagen Ciloleucel wurde in der Phase-2-Studie ZUMA-1 bei erwachsenen Patienten mit refraktärem aggressivem Non-Hodgkin-Lymphom belegt. Von 101 Patienten (77 mit DLBCL, 24 mit PMBCL oder transformiertem Follikel-Lymphom), die mit CAR-T-Zellen behandelt wurden, sprachen nach einer medianen Beobachtungsdauer von 8,7 Monaten 82% auf die Therapie an, 54% hatten eine komplette Remission. Nach 18 Monaten betrug das Gesamtüberleben 52%.
Ein direkter Vergleich zu anderen Therapien existiert zwar weder für Tisagenlecleucel noch für Axicabtagen Ciloleucel, jedoch belegen retrospektive Studiendaten, dass die Prognose von Patienten mit refraktärem DLBCL sehr schlecht ist. So wird mit den üblichen Therapien eine objektive Ansprechrate von 26% erreicht, eine vollständige Remission lediglich bei 7% der Patienten.
Nicht ohne Risiko
Ganz ungefährlich sind die neuen Therapien jedoch nicht: Als potenziell lebensbedrohliche Nebenwirkung kann ein Zytokin-Freisetzungssyndrom auftreten. Dieses Phänomen ist auch im Zusammenhang mit anderen Tumortherapien (z. B. Rituximab) bekannt. Dabei werden von massenhaft zerfallenden Krebszellen schlagartig große Mengen an Zytokinen wie Interleukin-6 freigesetzt. Grippeähnliche Symptome wie Fieber, Übelkeit, Schüttelfrost und Herz-Kreislauf-Störungen sind die Folge. Unter Tisagenlecleucel trat bei 77% der ALL-Patienten in der ELIANA-Studie ein Zytokin-Freisetzungssyndrom auf; in der JULIET-Studie bei 55% der DLBCL-Patienten. In der ZUMA-1-Studie waren 93% der Patienten unter Axicabtagen Ciloleucel betroffen. Mit Tocilizumab (Actemra®) kann ein Zytokin-Freisetzungssyndrom behandelt werden. In den USA ist der Interleukin-6-Rezeptor-Antagonist in dieser Indikation bereits zugelassen, in Europa wird die Zulassung in Kürze erwartet.
Als weitere häufige Nebenwirkungen können neurologische Symptome (z. B. Enzephalopathie, Verwirrtheit, Somnolenz) auftreten.
Zum Weiterlesen
Ausführliche Informationen zum CAR-T-Konzept finden Sie im Beitrag „CAR-T-Zellen: Lizenz zum Töten“ von Prof. Dingermann und Dr. Zündorf in der DAZ 2018, Nr. 34, S. 34.
Nur an Spezialzentren
Wie Novartis, der Zulassungsinhaber von Tisagenlecleucel, bekannt gab, wird die Gentherapie in Deutschland schrittweise eingeführt werden: Zuerst zur Behandlung der pädiatrischen ALL, später dann auch zur Behandlung von Patienten mit DLBCL. Eine Therapie mit CAR-T-Zellen sollten jedoch nur spezialisierte Kliniken durchführen. Novartis qualifiziert derzeit entsprechende Spezialzentren. Nähere Angaben dazu, wo die Therapie zukünftig angeboten werden könnte, gab Novartis bisher noch nicht bekannt. Auch ist unklar, welche Kosten hierzulande auf die Versicherer zukommen. In den USA liegt der Preis für eine Behandlung mit Tisagenlecleucel bei 475.000 Dollar. Die Therapie mit Axicabtagen Ciloleucel kostet dort 373.000 Dollar. In Großbritannien hat sich das National Institute for Health and Care Excellence (NICE) bereits gegen den Einsatz von Axicabtagen Ciloleucel ausgesprochen. Die Therapie wird dort in den zugelassenen Indikationen somit nicht generell erstattet. Nach Einschätzung des NICE kann ein Nutzen der CAR-T-Zelltherapie nicht eindeutig abgeschätzt werden, da die zulassungsrelevante ZUMA-1-Studie ohne entsprechenden Vergleichsarm (d. h. eine Salvage-Chemotherapie) durchgeführt wurde. Eine Bewertung von Tisagenlecleucel steht noch aus. |
Quelle
Novartis Oncology Pressemitteilung vom 27. August 2018. www.novartis.de; Abruf am 30. August 2018
Gilead Sciences Pressemitteilung vom 27. August 2018. www.gilead.com; Abruf am 30. August 2018 Dingermann T, Zündorf I. CAR-T-Zellen: Lizenz zum Töten. DtschApothZtg 2018;158(34):3394-3401
Klebanoff CA et al. Immunotherapy: Treatment of aggressive lymphomas with anti-CD19 CAR T cells. Nat Rev Clin Oncol. 2014 Dec;11(12):685-6
Maude SL et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Eng J Med 2018; 378: 439-448
Borchmann P et al. An Updated Analysis of JULIET, a Global Pivotal Phase 2 Trial of Tisagenlecleucel in Adult Patients With Relapsed or Refractory Diffuse Large B-Cell Lymphoma. EHA Learning Center, 2018;214521
Neelapu SS et al. Axicabtagene Ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 2017;377(26):2531-2544
Crump M et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 2017; 130(16): 1800-1808
DAZ.online. Gentherapie bei Leukämie: Novartis erhält EU-Zulassung für Kymriah. www.deutsche-apotheker-zeitung.de; Abruf am 30. August 2018
National Institute for Health and Care Excellence (NICE). Appraisal consultation document. Axicabtagene ciloleucel for treating diffuse large B-cell lymphoma and primary mediastinal B-cell lymphoma after 2 or more systemic therapies. August 2018. www.nice.org.uk; Abruf am 30. August 2018






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.