
- DAZ.online
- DAZ / AZ
- DAZ 31/2018
- Valsartan, Nelfinavir und...
DAZ aktuell
Valsartan, Nelfinavir und der Umgang mit genotoxischen Verunreinigungen
Eine etwas andere Herangehensweise zur Einordnung des gesundheitlichen Risikos
Eine ähnliche Rückrufaktion gab es bereits vor rund zehn Jahren, damals war ein Präparat zur Behandlung von HIV-infizierten Patienten betroffen. Die Situation war auf den ersten Blick ähnlich, obwohl in einigen wesentlichen Punkten auch deutliche Unterschiede bestanden.
EMS in Nelfinavir
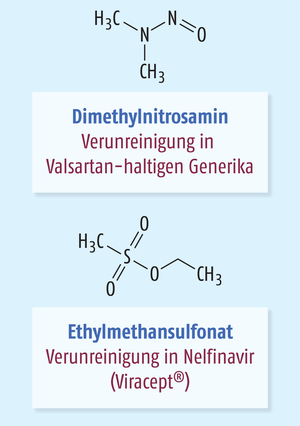
Nelfinavir-Mesylat (Viracept®) ist ein Proteaseinhibitor, der seit Ende der 1990er-Jahre zur antiretroviralen Therapie in Kombination mit anderen Wirkstoffen bei Patienten mit HIV-Infektion eingesetzt wurde. Im Mai 2007 erreichten den Hersteller Roche Berichte über einen ungewöhnlichen Geruch der Tabletten. Als Ursache konnte eine Kontamination mit Ethylmethansulfonat (EMS) identifiziert werden. Einige Chargen waren betroffen, sie waren während eines kurzen Zeitraumes zwischen März und Mai 2007 produziert worden. Die höchste Konzentration, die nachgewiesen wurde, betrug 920 ppm. Eine retrospektive Analyse aller Chargen seit 1998 zeigte, dass bereits zuvor einige Chargen mit Konzentrationen bis zu 100 ppm kontaminiert waren. Bei Einnahme der empfohlenen Tagesdosis von 2500 mg Nelfinavir hatte ein Patient im ungünstigsten Fall täglich 2,75 mg EMS (oder 0,055 mg/kg) aufgenommen. Da EMS direkt mit der DNA reagiert und im Tierexperiment mutagen und kanzerogen wirkt, wurde Nelfinavir im Juni 2007 weltweit zurückgerufen. Anschließend wurde eine umfangreiche Risikoanalyse durchgeführt [1, 2].
Parallelen zu Valsartan
Man erkennt einige Parallelen zu der aktuellen Situation mit dem Nachweis von NDMA in Valsartan. In beiden Fällen handelt es sich um ein Medikament zur Dauertherapie, das mit einem potenziell kanzerogenen, DNA-alkylierenden Stoff verunreinigt war. Beide Chemikalien, EMS und NDMA können unter anderem die Base Guanin am Sauerstoff in Position 6 alkylieren und eine GC-AT-Transition durch eine fehlerhafte Paarung von O6-Ethylguanin bzw. O6-Methylguanin mit Thymin während der DNA-Replikation verursachen. Sie wirken mutagen und kanzerogen. Die tägliche maximal aufgenommene Dosis von EMS (2,75 mg) war im Vergleich zu der täglichen Dosis von NDMA (ca. 0,02 mg) sogar deutlich höher.
Unterschiede zwischen EMS und NDMA
Trotzdem gibt es einige wichtige Unterschiede zwischen diesen beiden Ereignissen:
- Das Antihypertensivum Valsartan wird von sehr vielen Patienten eingenommen, das Virustatikum Nelfinavir dagegen nur von einer begrenzten Gruppe von HIV-infizierten Patienten.
- Die Verunreinigung von Nelfinavir entstand durch einen Fehler im Produktionsprozess, der offenbar relativ rasch entdeckt wurde. Beim Valsartan scheint es sich um die Folge der Umstellung des Syntheseverfahrens zu handeln. Die Umstellung könnte bereits vor Jahren erfolgt sein.
- EMS ist eine direkt alkylierende Substanz, NDMA muss zunächst durch CYP-abhängige Enzyme aktiviert werden. Die metabolische Kapazität unterscheidet sich in verschiedenen Organen und zeigt auch gewisse Speziesunterschiede. Dies erschwert eine Übertragung von tierexperimentellen Daten auf den Menschen.
- EMS ist deutlich weniger potent als NDMA, d. h. es sind deutlich höhere Dosierungen notwendig, um im Tierexperiment eine mutagene/kanzerogene Wirkung mit EMS hervorzurufen. EMS wirkt genotoxisch im Tierexperiment nach Dosierungen im Bereich von Milligramm pro kg Körpergewicht, für NDMA sind mutagene und kanzerogene Wirkungen bereits nach Dosierungen einiger Mikrogramm pro kg Körpergewicht bekannt.
- Kanzerogene Dosen von EMS verursachen auch andere toxische Wirkungen, NDMA wirkt bereits kanzerogen nach Dosierungen, die noch keine anderen toxischen Wirkungen hervorrufen.
DNA-Reparatur
Menschliche Zellen verfügen über verschiedene Abwehrmechanismen, um DNA-Schäden zu verhindern. Neben der metabolischen Inaktivierung und Elimination geschädigter Zellen durch Apoptose oder Nekrose gibt es verschiedene DNA-Reparaturmechanismen zur Beseitigung endogen oder exogen entstandener Veränderungen. Bereits durch endogene Stoffwechselvorgänge kommt es täglich zu etwa 10.000 DNA-Schäden pro Zelle, im Gleichgewichtszustand liegen etwa 500 veränderte Basen vor, was die hohe Effizienz der Reparatursysteme belegt. Die Wirkung wird durch Hemmung der Zellproliferation verstärkt. Dadurch ergibt sich einerseits mehr Zeit für die Reparatur, andererseits wird verhindert, dass Schäden des Genoms durch die Zellteilung weitergegeben werden. Es muss auch bedacht werden, dass die Bildung von Addukten nicht zwangsläufig zu Mutationen führt. Addukte sind als Biomarker einer Exposition anzusehen, die sich linear bis zu niedrigster Exposition verfolgen lassen und dann niedriger sind als die spontane Adduktrate.
Mutationen als Biomarker für Genotoxizität werden erst bei höherer Dosis induziert und korrelieren erst dann mit der Exposition, wenn sie die spontane Mutationsrate übersteigen. Vor dem Hintergrund der Abwehrmechanismen der Zelle auf genotoxische Kanzerogene, wird eine Wirkungsschwelle für solche Stoffe durchaus plausibel. Sie muss für jeden Stoff einzeln ermittelt werden [3]. Obwohl generell zunächst angenommen wurde, dass es für genotoxische, DNA-verändernde Kanzerogene eine lineare Dosis-Wirkungskurve gibt und keine Wirkungsschwelle besteht, konnte für EMS eine solche Wirkschwelle nachgewiesen werden. Sie liegt im Tierexperiment bei 25 mg/kg und damit um Größenordnungen höher als die Menge, die ein Patient mit den verunreinigten Nelfinavir-Tabletten aufgenommen hat. Als Ursache für diese Schwelle wird eine effektive DNA-Reparatur durch das Enzym MGMT (O6-Methylguanin-Methyltransferase) angesehen. Dieses Enzym überträgt die Methyl- oder Ethylgruppe vom Guanin auf einen Cysteinrest im Zentrum des Enzyms. In diesen Versuchen wurde zum Vergleich Ethylnitrosoharnstoff (ENU) untersucht. Diese verwandte Substanz verursacht ein ähnliches Spektrum von DNA-Addukten wie EMS. Für diesen Stoff konnte aber keine entsprechende Schwellendosis ermittelt werden. Das Nitrosamin NDMA wurde in diesen Versuchen nicht zum Vergleich eingesetzt. Für NDMA wird jedoch aufgrund anderer Untersuchungen von einem linearen Zusammenhang zwischen Dosis und Wirkung ausgegangen.
Reaktion der Behörden
Wie sich die zuständigen Arzneimittelbehörden in diesem Fall abschließend äußern werden, ist derzeit nicht abzusehen. Eine gründliche Aufarbeitung des Falls benötigt einige Zeit. Bemerkenswert ist, dass die US-amerikanische FDA vor wenigen Tagen eine Stellungnahme publizierte, in der eine erste Abschätzung eines Risikos vorgenommen wurde. Demnach könnte bei Patienten durch die Einnahme eines belasteten Valsartan-Präparates in hohen Tagesdosen von 320 mg über vier Jahre eine zusätzliche Krebserkrankung unter 8000 Patienten hervorgerufen werden. Dieses sei der Grund, so die FDA, weshalb die betroffenen Chargen zurückgerufen wurden [4]. Eine gewisse Skepsis gegenüber solchen Berechnungen ist durchaus angebracht. Die Mathematik ist exakt, aber die zugrunde liegenden Annahmen sind aufgrund mangelnder biologischer Kenntnisse meist nicht im Detail geklärt. Erschreckend ist die Tatsache, dass es sich wohl um Hunderttausende von Patienten handelt, die regelmäßig NDMA mit ihrem Medikament aufgenommen haben.
Auffällig ist bei dieser Meldung, dass hier überhaupt eine derartige Zahl von einer Behörde in einer frühen Phase der Bewertung publiziert wird. Im Fall der Nelfinavir-Rücknahme stand die Frage im Raum, ob ein Register eingerichtet werden sollte, um die betroffenen Patienten weiter zu verfolgen und hinsichtlich eines erhöhten Krebsrisikos über Jahre und Jahrzehnte zu verfolgen. Aufgrund des Nachweises der Schwellendosis für mutagene Effekte von EMS im Tierexperiment hat man dieses Vorhaben fallen gelassen. Erstmals hatte die EMA damals ein Schwellendosis-Konzept für eine mutagene, mit der DNA reagierende Substanz akzeptiert [2]. |
Quellen
[1] Pozniak A, Müller L, Salgo M, Jones JK, Larson P, Tweats D. Elevated ethyl methanesulfonate (EMS) in nelfinavir mesylate (Viracept, Roche): overview. AIDS Res Ther. 2009 Aug 6;6:18
[2] Walker VE, Casciano DA, Tweats DJ. The Viracept-EMS case: impact and outlook. Toxicol Lett. 2009 Nov 12;190(3):333-9
[3] Greim H., Albertini R.A. Zur Frage einer unwirksamen Dosis genotoxischer Agenzien. In: Das Toxikologiebuch. Grundlagen, Verfahren, Bewertung. Hrsg. Helmut Greim. Wiley VCH 2017. S. 173-185
[4] FDA updates on valsartan recalls. Update July 27, 2018 https://www.fda.gov/Drugs/DrugSafety/ucm613916.htm






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.