
- DAZ.online
- DAZ / AZ
- DAZ 31/2018
- Blick in die Zukunft
Dermatologie
Blick in die Zukunft
Neue Wirkstoffe gegen atopische Dermatitis im Markt und in der Pipeline
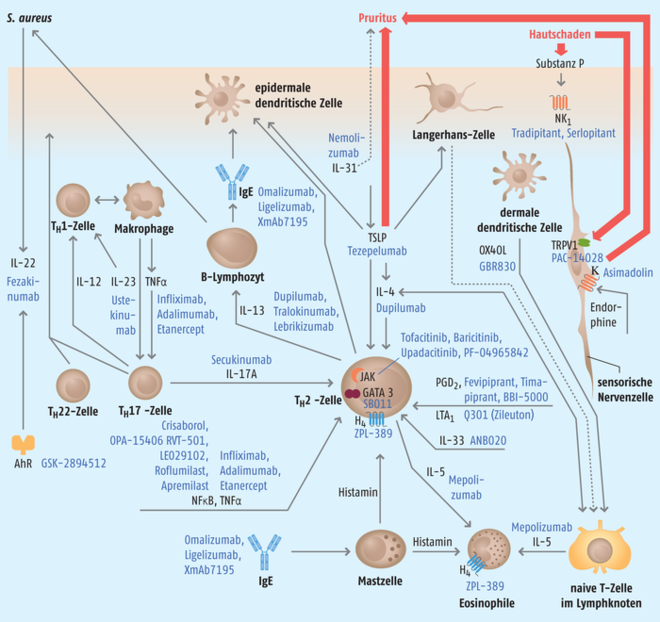
Die spezifische Immunantwort des Körpers wird durch Antigen-präsentierende Zellen ausgelöst und besteht in der Bildung von Antikörpern durch B-Zellen und die Differenzierung von naiven T-Zellen in zytotoxische T-Zellen und T-Helferzellen. T-Helferzellen sind in verschiedene Signalwege aufgeteilt und stimulieren durch die Freisetzung spezifischer Zytokine die Aktivierung von zytolytischen T-Zellen und Markrophagen (TH1-Signalweg), die Differenzierung von B-Zellen und Eosinophilen (TH2-Signalweg) und die Aktivierung von Neutrophilen (TH17-Signalweg). Zwischen den einzelnen Signalwegen findet zudem ein Cross-Talk statt, sodass es zu Überschneidungen und Verschiebungen der Effekte kommen kann (Abb. 1).
Übersicht über mögliche sowie in Studien untersuchte Therapieoptionen
medikamentöse Therapie
- topische Basistherapie
- topische Glucocorticosteroide
- topische Calcineurinantagonisten
- Antipruriginosa und andere antientzündliche Externa
- antimikrobielle und antiseptische Substanzen
- Antihistaminika
- Mastzellstabilisatoren (Cromoglicinsäure) und
- Ketotifen
- spezifische Immuntherapie
- orale Glucocorticosteroide
- Ciclosporin1
- Azathioprin2
- Mycophenolat Mofetil (MMF)2
- Methotrexat2
- Biologika
- Alitretinoin2
nichtmedikamentöse Verfahren
- Immunabsorption
- extrakorporale Photopherese
- Laktobazillen
- Phototherapie
- Neurodermitisschulung
- Eliminationsdiäten
- essenzielle Fettsäuren
- Hausstaubmilbenreduktion
- psychologische Behandlung
1 für die Indikation „Neurodermitis“ zugelassen
2 Off-label-Anwendung
Quelle
Neurodermitis (atopisches Ekzem; atopische Dermatitis). S2k-Leitlinie, AWMF-Registernummer: 013-027, letzte Überarbeitung: 03/2015, verlängert bis 31. Dezember 2018
TH2-Signalweg
IL-4/IL-13 Rezeptor
Die Zytokine IL-4 und IL-13 zählen zu den wichtigsten Signalmolekülen der TH2-Zell-Aktivierung. Dupilumab (Dupixent®) ist ein humaner monoklonaler Antikörper gegen den IL-4- und den IL-13-Rezeptor und wurde im März 2017 durch FDA und im Oktober 2017 durch die EMA für Erwachsene mit mittel- bis schwergradiger atopischer Dermatitis zugelassen. Die häufigsten unerwünschten Arzneimittelwirkungen (UAW) sind Hautreaktionen an der Einstichstelle, Konjunktivitis, Blepharitis (Lidrandentzündung) und Fieberbläschen [9].
IL-13
Ausschließlich gegen das Zytokin IL-13 richtet sich der humanisierte monoklonale Antikörper Tralokinumab. Er befindet sich derzeit in klinischen Studien der Phase III bei Asthma und atopischer Dermatitis und in Phase II bei Alopezia areata [10, 11]. Ein weiterer Arzneistoff für diese Zielstruktur ist Lebrikizumab, der sich für atopische Dermatitis und idiopathische pulmonale Fibrose in Phase II befindet. In Kombination mit 0,1%iger Triamcinolonacetonid-Creme konnte bei Patienten, deren atopische Dermatitis ausschließlich mit Glucocorticoiden nicht kontrollierbar war, eine signifikante Verbesserung beobachtet werden [12]. Phase-III-Studien, in denen die Arzneistoffe als Monotherapie getestet werden, stehen noch aus [7].
IL-31-Rezeptor
Interleukin 31, auch als Pruritus-Zytokin bekannt, ist bei akuter und chronischer atopischer Dermatitis deutlich erhöht. Der humanisierte monoklonale Antikörper Nemolizumab richtet sich gegen den IL-31-Rezeptor A. Nemolizumab (subkutan) zeigt in einer Phase-II-Studie eine signifikante Linderung des Juckreizes und befindet sich aktuell in Phase III. Über UAW des Arzneistoffs lassen sich aufgrund der limitierten Studienpopulation und Dauer noch keine Aussagen treffen [13, 14].
Thymic stromal lymphopoietin protein
TSLP (Thymic stromal lymphopoietin protein) ist ein Zytokin, das hauptsächlich von Keratinozyten und Epithelzellen bei allergischen Reaktionen ausgeschüttet wird. Es stimuliert die Produktion von IL-4 und damit den TH2-Signalweg, der wiederum zu einer erhöhten Expression des TSLP-Rezeptors führt und so das positive Feedback selbst verstärkt [16]. Tezepelumab ist in Phase II der klinischen Entwicklung am weitesten in seiner Klasse, konnte allerdings in der Indikation atopische Dermatitis anders als bei Asthma in einer Studie nicht überzeugen [17].
OX40
OX40 (CD134) ist ein Rezeptor der Tumor-Nekrose-Faktor-Familie. Stimulation durch seinen Liganden, dessen Produktion wiederum durch TSLP induziert wird, aktiviert die Produktion von IL-4, IL-5 und IL-13 durch CD4-naive T-Zellen und somit den TH2-Signalweg [18]. Glenmark, der Hersteller des Antikörpers GBR830, der sich gegen den OX40-Rezeptor richtet, teilte im August 2017 auf einer Pressekonferenz mit, dass in einer Phase-IIa-Studie der Eczema Area and Severity Index (EASI) bei 17 von 23 Patienten um mindestens 50% reduziert werden konnte. Um eine gesicherte Aussage über die Wirksamkeit im Vergleich zu einem Placebo-Präparat zu treffen war die Studienpopulation aber zu klein [19].
Prostaglandin-PGD2-Rezeptor
Der physiologische Ligand des DP2-Rezeptors (DP2R, CRTH2), Prostaglandin 2 (PGD2), wird durch die Cyclooxygenase 1 (COX-1) und COX-2 aus Arachidonsäure gebildet. Er wird auf TH2-Zellen exprimiert und besonders durch eine vermehrte PGD2-Ausschüttung bei allergischen Reaktionen stimuliert. Diese Stimulation führt zur Induktion der Einwanderung anderer Immunzellen wie zum Beispiel Eosinophile, Basophile und andere TH2-Zellen in das betroffene Gewebe. Es befinden sich mehrere Arzneistoffe für dieses Target für unterschiedliche entzündliche Erkrankungen in klinischer Entwicklung. Fevipiprant (QAW039) und Timapiprant in Phase II und BBI-5000 in Phase I sind oral bioverfügbare small molecules und Antagonisten am DP2-Rezeptor [20, 21]. Die meisten Studien zu dieser Wirkstoffklasse zeigen derzeit keinen signifikanten Effekt bei atopischer Dermatitis [22, 23].
GATA-3
Die Gruppe der GATA Transkriptionsfaktoren sind nach ihrer Fähigkeit benannt, an die DNA-Sequenz GATA (Guanin-Adenin-Thymidin-Adenin) zu binden. GATA-3 wird in TH2-Zellen exprimiert und ist ein Induktor der Differenzierung von CD4-Zellen und der Produktion mehrere Zytokine des TH2-Signalweges [24]. Die Adressierung dieser Zielstruktur findet durch ein DNAzym, den Wirkstoff hgd40, statt. DNAzyme sind Einzelstrang-DNA, die eine katalytische Einheit enthalten, die nach der Bindung des Targets die mRNA spalten und so die Zytokin-Produktion inhibieren. SB010 wird auch für andere entzündliche Erkrankungen wie Asthma, COPD, Colitis ulcerosa und Psoriasis in unterschiedlichen Formulierungen in klinischen Studien untersucht. Als W/O/W-Emulsion (SB011) befindet es sich bei atopischer Dermatitis in der Phase II und konnte in früheren humanen Studien bereits die Zytokin-Produktion senken [25, 26].
IL-5
Das Zytokin IL-5 wirkt auf Wachstum und Differenzierung von eosinophilen Granulozyten [27]. Mepolizumab (Nucala®) ist ein humanisierter monoklonaler Antikörper und seit 2015 für die eosinophile Form des Asthmas zugelassen. In einer 16-tägigen Studie mit 40 Patienten mit atopischer Dermatitis führte Mepolizumab zu keiner signifikanten klinischen Verbesserung gegenüber Placebo, obwohl die Eosinophilen-Zahl im peripheren Blut signifikant gesunken war [28]. Eine neue Phase-II-Studie mit mehr Probanden und längerem Interventionszeitraum wird durchgeführt [29, 30].
IL-33
IL-33 ist ein Zytokin, das von vielen unterschiedlichen Zellen exprimiert wird, die beim Entzündungsgeschehen eine Rolle spielen. Es erhöht die Expression weiterer TH2-Zytokine und wird daher als ein zusätzlicher Mediator bei atopischen Erkrankungen betrachtet. ANB020 ist ein monoklonaler humanisierter Antikörper, der in einer Phase-IIa-Studie den EASI-Score bei zwölf Patienten senken konnte und nun in einer Phase-IIb-Studie mit einer größeren Patienten-Population untersucht wird [31].
TH17/IL-23-Signalweg
IL-12/23
Der TH17-Signalweg ist ein erst kürzlich entdeckter Faktor in der Pathogenese der atopischen Dermatitis. Es wird angenommen, dass er sowohl im Remodeling-Geschehen der Haut, als auch im TH2- zu TH1-Shift von akuter zu chronischer atopischer Dermatitis involviert ist. Des Weiteren ist ein Cross-Talk zwischen den verschiedenen Klassen der T-Helferzellen wahrscheinlich. IL-23 aus der IL-12-Familie ist an der Differenzierung von TH17-Zellen beteiligt und stellt daher ein interessantes Target für entzündliche Erkrankungen dar. IL-12 und IL-23 besitzen die Untereinheit p40, die durch den monoklonalen humanen Antikörper Ustekinumab gebunden wird [32]. Die Ergebnisse einiger Phase-II-Studien konnten keine signifikanten Effekte von Ustekinumab gegenüber Placebo zeigen, sind aber aufgrund der geringen Studienpopulation und der gleichzeitig erlaubten Anwendung von topischen Glucocorticoiden in ihrer Aussagekraft eingeschränkt [22]. Für die Indikation Morbus Crohn, Plaque-Psoriasis und Psoriasis-Arthritis ist Ustekinumab als Stelara® bereits am Markt.
IL-17 A
TH17-Zellen schütten nach Stimulation eine Vielzahl von Interleukinen aus, die untereinander ähnliche Strukturen und ähnliche biologische Funktionen haben. Die Rolle eines dieser Zytokine, IL-17A, in der Pathogenese der atopischen Dermatitis ist nicht vollkommen aufgeklärt. Es gibt Hinweise, dass IL-17A ein Element des Cross-Talks zwischen dem TH17- und dem TH2-Signalweg ist, da in mehreren IL-17A-Knockout-Maus-Experimenten eine Reduktion von IL-4-Spiegeln nachgewiesen werden konnte [32, 33]. Die Ergebnisse einer Phase-II-Studie mit dem monoklonalen Antikörper Secukinumab (Cosentyx®) stehen noch aus [34]. Er ist für die Indikationen Plaque-Psoriasis, Psoriasis-Arthritis und Spondylitis ankylosans seit 2015 zugelassen.
TH22-Signalweg
IL-22
TH22-Zellen tragen vermutlich nicht direkt zur allergischen Reaktion bei atopischen Erkrankungen bei. Trotzdem zeigen von atopischer Dermatitis betroffene Hautareale erhöhte IL-22-Werte, die auf eine erhöhte Konzentration an TH22-Zellen schließen lassen und die Entzündungsreaktion allergen-unabhängig beeinflussen können. Zusätzlich kann die IL-22-Produktion durch Toxine induziert werden, die von Staphylococcus aureus gebildet werden. Dieser Erreger besiedelt häufig die Haut von Patienten mit atopischer Dermatitis. Bei Asthma wurde gezeigt, dass der TH22-Signalweg am Remodeling des Gewebes und dem Wechsel von der aktiven zur chronischen Krankheitsform beteiligt ist [35].
Ein monoklonaler Antikörper gegen IL-22, Fezakinumab, bewirkte in einer zwölfwöchigen Studie bei Patienten mit schwerer atopischer Dermatitis eine signifikante Verbesserung gegenüber Placebo und war gut verträglich [36]. Derzeit befindet sich Fezakinumab in einer Phase-II-Studie [37].
IgE
Das Immunglobulin IgE ist der molekulare Vermittler der allergischen Sofort-Reaktion. Es bindet mit seinem FC-Fragment z. B. an Mastzellen und stimuliert bei Antigen-Kontakt unter anderem die Ausschüttung von Histamin, Enzymen und chemotaktischen Stoffen. Die übermäßige Freisetzung von IgE bei Patienten mit atopischer Dermatitis geschieht nach Kontakt mit verschiedenen Umweltallergenen, aber auch autoallergen. Im Fall eines Staphylococcus-aureus-Befalls werden meist IgE-Antikörper gegen vom Bakterium sekretierte Toxine (sogenannte Superantigene) produziert. Die hervorgerufene allergische Reaktion bewirkt die Entzündung und Schädigung des betroffenen Gewebes, sodass die Hautbarriere zusätzlich erniedrigt und das Eindringen weiterer Antigene möglich ist.
Mehrere monoklonale Antikörper, die sich gegen das FC-Fragment des IgE richten und die IgE-Spiegel senken sollen, befinden sich in der klinischen Forschung und für andere Indikationen im Markt. Der für chronische Urtikaria und allergisches Asthma zugelassene IgE-Antikörper Omalizumab (z. B. Xolair®) wurde und wird in mehreren Studien hinsichtlich seiner Wirksamkeit bei der atopischen Dermatitis untersucht. Die Ergebnisse deuteten bisher nicht auf einen Zusatznutzen von Omalizumab bei atopischer Dermatitis hin, sodass die deutsche Leitlinie keine Empfehlung für diesen Arzneistoff ausspricht [1]. Die Studienergebnisse für Ligelizumab (Phase II) und XmAb7195 (Phase I) sind noch nicht veröffentlicht [38, 39].
Die Ergebnisse von Omalizumab weisen darauf hin, dass IgE nur eine von vielen Komponenten in der Pathophysiologie der atopischen Dermatitis ist. Seine Rolle in der Pathogenese wird in weiteren Studien zur Erstmanifestation untersucht.
Weitere Zielstrukturen
Phosphodiesterase 4
Der NFκB-Signalweg ist ein Hauptmediator inflammatorischer Prozesse in Leukozyten. Eine Möglichkeit, die Aktivierung des Transkriptionsfaktors NFκB (nukleärer Faktor-kappa B) zu unterdrücken, ist die Phosphorylierung der Proteinkinase C, die über hohe cAMP-Konzentrationen gesteuert wird. Der cAMP-Abbau wird in Leukozyten vornehmlich durch die Isoform 4 der Phosphodiesterase (PDE-4) gesteuert. Inhibitoren dieses Enzyms führen zu einer erhöhten cAMP-Konzentration und einer Unterdrückung der NFκB-vermittelten Entzündungsreaktion in der Zelle [40].
PDE-4-Inhibitoren werden topisch und peroral verabreicht und in mehreren Studien zur Behandlung der atopischen Dermatitis untersucht. Im Dezember 2016 ließ die FDA Crisaborol (Eucrisa™) als ersten PDE-4-Inhibitor als 2%ige Salbe zur Therapie der leichten bis moderaten atopischen Dermatitis für Patienten ab zwei Jahren zu. Schmerzen am Applikationsort waren die häufigste unerwünschte Arzneimittelwirkung, die beobachtet wurde. Im Oktober 2017 erschienen die Ergebnisse einer Studie zur Langzeitbehandlung, die die Sicherheit Crisaborols bestätigte [41]. Angaben über eine mögliche Zulassung in Europa sind nicht bekannt. Weitere in Phase II befindliche PDE-4-Inhibitoren sind OPA-15406 (geplante Phase-III-Studien) sowie RVT-501 und LEO29102, deren Ergebnisse einer Phase-II-Studie noch nicht veröffentlicht sind [42, 43, 44]. Roflumilast (Daxas®), das bereits 2010 für die Therapie der COPD durch die EMA zugelassen wurde, verfehlte in topischer Zubereitung die Studienendpunkte in einer Phase-II-Studie [45, 46]. Der peroral angewendete PDE-4-Inhibitor Apremilast (Otezla®) ist für die Therapie der Psoriasis-Arthritis und der Plaque-Psoriasis zugelassen und wird in Phase II hinsichtlich seiner Wirksamkeit bei atopischer Dermatitis getestet. Es konnte eine signifikante Reduktion des Eczema Area and Severity Index (EASI) festgestellt werden [47].
Tumor-Nekrose-Faktor α
Der Tumor-Nekrose-Faktor α (TNF-α) ist ein proinflammatorisches Zytokin, das hauptsächlich von Makrophagen gebildet wird. Es stimuliert vor allem den TH1/TH17 Signalweg und ist daher ein potenzielles Target zur Therapie der atopischen Dermatitis. In einigen Fallberichten und kleinen Studien mit den Antikörpern Infliximab (z. B. Remicade®), Adalimumab (z. B. Humira®) und Etanercept (z. B. Enbrel®, Fc-Fragment eines Antikörpers), die zur Behandlung der Psoriasis und Psoriasis-Arthritis zugelassen sind, konnte nur eine anfängliche und keine über die Therapiedauer anhaltende Verbesserung der Symptome der atopischen Dermatitis festgestellt werden [48, 49]. In anderen Fallberichten wurde sogar eine Verschlimmerung berichtet, die nach Interventionsende wieder abklang. Es konnte bisher jedoch keine sichere Korrelation für alle Fälle nachgewiesen werden [50]. Eine Erklärung dieser unerwartet enttäuschenden Ergebnisse könnte ein durch die TNF-α-Blockade hervorgerufener TH2-Shift sein, der bei der TH2-betonten Pathophysiologie der atopischen Dermatitis kontraproduktiv ist [51]. Es werden keine weiteren Studien mit TNF-α-Inhibitoren bei der atopischen Dermatitis erwartet [4].
Janus-Kinase
Janus-Kinasen (JAK) phosphorylieren intrazellulär proinflammatorische Zytokin-Rezeptoren (z. B. γc-Typ) und aktivieren diese für eine Bindung des endogenen Liganden. Eine JAK-Inhibition vermindert die intrazelluläre Fortsetzung des proinflammatorischen Signals. Die bereits letztes Jahr für rheumatoide Arthritis zugelassenen JAK-Inhibitoren Tofacitinib (topisch bei AD) und Baricitinib (peroral bei AD) befinden sich derzeit in Phase II und Phase III der klinischen Entwicklung für den Einsatz bei der atopischen Dermatitis. Beide Arzneistoffe konnten den Schweregrad der atopischen Dermatitis in Phase-II-Studien deutlich senken [52, 53]. Tofacitinib war in der Therapie der atopischen Dermatitis sogar effektiver als bei der Behandlung einer Plaque-Psoriasis [54]. Für Baricitinib werden derzeit Phase-III-Studien zur Langzeitanwendung bei atopischer Dermatitis durchgeführt [55, 56]. Noch nicht im Markt befindliche JAK Inhibitoren wie zum Beispiel Upadacitinib (peroral bei AD) und PF-04965842 werden in klinischen Studien hinsichtlich ihrer Wirksamkeit und der optimalen Dosierung bei atopischer Dermatitis geprüft [57]. Mit Upadacitinib konnte in der höchsten Dosis eine 90%ige Reduktion des Schweregerades der atopischen Dermatitis erreicht werden [7]. PF-04965842 erhielt durch die amerikanische Zulassungsbehörde FDA kürzlich den Breakthrough-Therapy-Status und befindet sich nun in Phase III [58].
Histamin-H4-Rezeptor
Patienten mit einer atopischen Dermatitis haben einen höheren Histamin-Spiegel als gesunde Menschen. Über diese Erkenntnis gelangte man zu der Hypothese, dass diese Erkrankung im Gesamten und vor allem der starke Juckreiz durch Antihistaminika gut behandelbar sein müsste. Die ungenügende Reduzierung des Juckreizes durch H1- und H2-Antihistaminika-Gabe legt allerdings die Vermutung nahe, dass der Histamin-induzierte Juckreiz nicht nur über diese beiden Rezeptoren vermittelt werden könne. Der um 2000 entdeckte Histamin-H4-Rezeptor, der vornehmlich auf Immunzellen exprimiert ist und die Chemotaxis von Leukozyten beeinflusst, rückte somit in den Fokus. Phase-II-Studien mit dem Histamin-H4-Rezeptor-Antagonisten ZPL-389 verfehlten zwar den primären Endpunkt der Pruritus-Reduktion, konnten aber den Schweregrad der atopischen Dermatitis senken [22, 59]. Dies zeigte, dass der Pruritus bei der atopischen Dermatitis weniger über Histamin, als über andere pruritogene Faktoren hervorgerufen wird. Histamin-H4-Rezeptor-Antagonisten haben eine antiinflammatorische Wirkung. In präklinischen Untersuchungen senkten H4-Antagonisten die IL-4-Konzentration im Gewebe und somit die Stimulation des TH2-Signalweges [60, 61]. Daher sind Histamin-H4-Rezeptor-Antagonisten weiterhin vielversprechende Arzneistoffe in der Pipeline.
Aryl-Hydrocarbon-Rezeptor
Der Aryl-Hydrocarbon-Rezeptor (AhR) ist ein Transkriptionsfaktor, dessen Rolle bei Entzündungsprozessen nicht vollständig geklärt ist. Er ist im Hautgewebe stark exprimiert und wird mit der Aufrechterhaltung der Hautbarriere und der Balance zwischen Zellen des TH17-Signalweges und regulatorischen T-Zellen (TREG) in Verbindung gebracht. Das Naturstoffderivat GSK-2894512 (Topinarof, Benvitimod, WBI-100) ist ein direkter Aktivator des AhR-Signalweges. Mit einer topischen Zubereitung konnten sowohl bei Psoriasis (Phase III) und Plaque-Psoriasis, als auch bei der atopischen Dermatitis (Phase II) vielversprechende Ergebnisse erzielt werden [62, 63].
5-Lipoxygenase
Leukotriene sind an allergischen und entzündlichen Reaktionen beteiligt. Im Zusammenhang mit der atopischen Dermatitis wurde eine verstärkte Freisetzung von Leukotriene B4 und C4 aus Leukozyten berichtet [64, 65]. Zileuton ist ein 5-Lipoxygenase(5-LO)-Inhibitor, der die Bildung von Leukotrienen reduziert. Mit der Zileuton Creme Q301 wurde eine Phase-II-Studie beendet, deren Daten aber noch nicht veröffentlicht sind [66].
Neurokinin-Rezeptor 1
Neurokinin-Rezeptor-1(NK1)-Antagonisten sind bereits im Markt. Zur Therapie der starken Übelkeit nach einer Chemotherapie oder Operation stehen Aprepitant, Fosaprepitant, Netupitant und Rolapitant zur Verfügung. NK1-Rezeptoren sind im zentralen Nervensystem und der Haut zu finden, wo der bekannteste endogene Ligand, Substanz P, als Reaktion auf Hautschäden ausgeschüttet wird. Hohe Substanz-P-Spiegel sind mit Juckreiz bei der atopischen Dermatitis assoziiert. Tradipitant und Serlopitant werden in Phase-III-Studien untersucht [66 – 70].
κ-Rezeptoren
Opioid-Rezeptoren spielen eine Rolle in der Pruritus-Genese im ZNS und im peripheren Nervensystem. Es wird vermutet, dass µ-Rezeptoren den Juckreiz verstärken, während κ-Rezeptoren ihn mindern [71]. Asimadolin ist ein selektiver κ-Rezeptor-Agonist, der die Blut-Hirn-Schranke nicht übertritt und somit keine zentralen Effekte auslöst. Einer Pressemitteilung des Herstellers Tioga Pharmaceuticals aus dem Dezember 2017 zufolge verbesserte Asimadolin nächtlichen Juckreiz bei Patienten mit atopischer Dermatitis signifikant [72]. Die Ergebnisse einer Phase-II-Studie wurden noch nicht veröffentlicht [73].
TRPV1-Rezeptor
Der TRPV1-Rezeptor (Transient Receptor Potential Vanilloid Type 1) ist ein nicht selektiver Kationen-Kanal, der an der Homöostase der epidermalen Barriere und der Neurotransmission des Pruritus bei der atopischen Dermatitis beteiligt ist [74]. PAC-14028 ist ein TRPV1-Antagonist, dessen 1%ige halbfeste Zubereitung sich in der Phase III befindet. Daten aus Phase-II-Studien stehen noch nicht zur Verfügung [75]. In Tierversuchen konnte die topische PAC-14028-Formulierung das Kratzverhalten reduzieren, das durch TRPV1-Agonisten verursacht wurde [74].
Vitamin D
Da die Symptome der atopischen Dermatitis in den Wintermonaten in der Regel zunehmen und die Prävalenz in Regionen mit geringer UV-B-Exposition höher ist, wird ein Zusammenhang zwischen atopischer Dermatitis und geringer Vitamin-D-Versorgung vermutet. Weiterhin haben Tiermodelle suggeriert, dass Vitamin D sowohl die Barriere-Funktion der Haut durch höhere Filaggrin-Produktion als auch die Immunität gegen Staphylococcus aureus erhöht, sowie die TH2-vermittelte Autoimmunreaktion vermindert. Eine Metaanalyse mehrerer Studien legt zwar einen positiven Effekt einer Vitamin-D-Gabe auf die atopische Dermatitis nahe, es konnte jedoch keine Signifikanz nachgewiesen werden, sodass weitere Studien nötig sind [76].
Melatonin
Das in der Epiphyse produzierte Hormon Melatonin ist an der Steuerung des Schlaf-Wach-Rhythmus beteiligt und hat zusätzlich antioxidative und immunmodulatorische Effekte. Eine verminderte Melatonin-Sekretion in der Nacht hat in Studien mit Patienten, die auch an Schlafstörungen litten, zu einer Symptomverschlimmerung geführt. Daher wird die Melatonin-Supplementierung auch als adjuvante Therapie bei einer atopischen Dermatitis untersucht. In einer Studie konnten die Schlafstörungen und der Schwereindex der atopischen Dermatitis bei Kindern verbessert werden. Zwar sind die Verbesserungen des Schweregrades der atopischen Dermatitis trotz der geringen Studienpopulation von 48 Teilnehmern signifikant, aber vom Gesamteffekt her nur moderat [16, 77]. Weitere Studien sind nötig, um eine Wirksamkeit abschließend nachweisen zu können.
Fazit
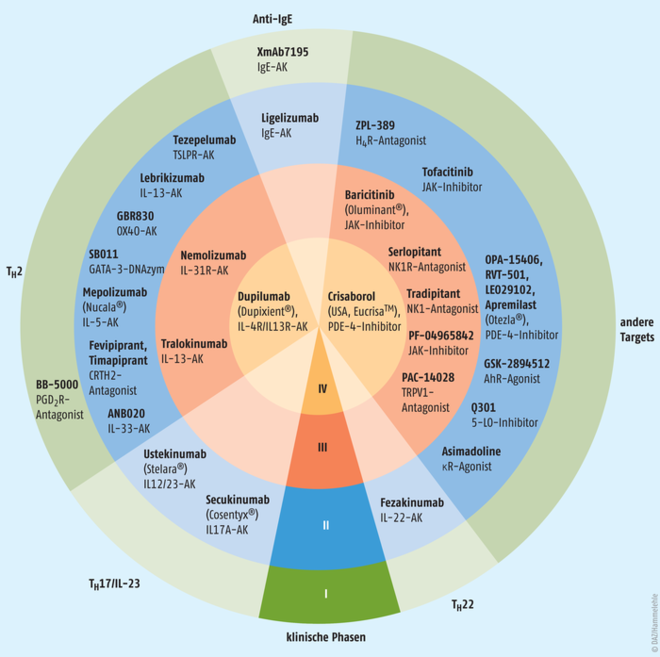
Die derzeit in den Leitlinien empfohlene Therapie der atopischen Dermatitis basiert hauptsächlich auf der topischen Anwendung von Glucocorticoiden. Durch die Zulassung von Dupilumab und vielen Biologicals, die sich in der klinischen Forschung für diese Indikation befinden, ist zu erwarten, dass sich insbesondere bei schweren Erkrankungsformen der Therapieschwerpunkt verlagern wird (Abb. 2). Auch einige small molecules haben in Studien vielversprechende Ergebnisse gezeigt und könnten in wenigen Jahren neue Möglichkeiten zur Kontrolle der atopischen Dermatitis liefern. Aufgrund ihrer guten Wirksamkeit und der langjährigen Erfahrung mit Wirkstoffen dieser Klasse werden Glucocorticoide auch zukünftig bei der Behandlung eine wesentliche Rolle spielen. |
Literatur
[1] Werfel T, Aberer W, Frank A. Kurzversion der Leitlinie Neurodermitis [atopisches Ekzem; atopische Dermatitis] Entwicklungsstufe: S2k. Kurzversion der Leitlinie Neurodermitis 2015;1–24, doi:DOI 10.1007/s00103- 014 -1975-7
[2] Weidinger S, Novak N. Atopic dermatitis. Lancet 2016;387:1109–1122
[3] Leung DYM, Boguniewicz M, Howell MD, Nomura I, Hamid QA. New insights into atopic dermatitis. J Clin Invest 2004;113:651–657
[4] Renert-Yuval Y, Guttman-Yassky E. Systemic therapies in atopic dermatitis: The pipeline. Clin Dermatol 2017;35:387–397
[5] Brunner PM, Guttman-Yassky E, Leung DYM. The immunology of atopic dermatitis and its reversibility with broad-spectrum and targeted therapies. J Allergy Clin Immunol 2017;139:65-76
[6] Czarnowicki T, Krueger JG, Guttman-Yassky E. Skin barrier and immune dysregulation in atopic dermatitis: An evolving story with important clinical implications. J Allergy Clin Immunol Pract 2014;2:371–379
[7] Pantazi E, Valenza G, Hess M, Hamad B. The atopic dermatitis market. Nat. Rev. Drug Discov 2018;17:237–238
[8] CHMP. Zusammenfassung des EPAR für die Öffentlichkeit: Dupixent. www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_Summary_for_the_public/human/004390/WC500236510.pdf, Abruf 11. January 2018
[8a] Wollenberg A et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatology Venereol 2018;32:657–682
[9] Dupixent Approval FDA. FDA and Center for Drug Evaluation and Research (CDER), www.accessdata.fda.gov/drugsatfda_docs/label/2017/761055lbl.pdf, Abruf 11. Januar 2018
[10] Tralokinumab Monotherapy for Moderate to Severe Atopic Dermatitis - ECZTRA 2 (ECZema TRAlokinumab Trial no. 2). www.clinicaltrials.gov/ct2/show/NCT03160885, Abruf 11. Januar 2018
[11] Tralokinumab - Leo Pharma. www.adisinsight.springer.com/drugs/800019573, Abruf 11. Januar 2018
[12] Simpson EL et al. Efficacy and safety of lebrikizumab (an anti-IL-13 monoclonal antibody) in adults with moderate-to-severe atopic dermatitis inadequately controlled by topical corticosteroids: A randomized, placebo-controlled phase II trial (TREBLE). Journal of the American Academy of Dermatology, in Press 2018, doi:10.1016/Jjaad.2018.01.017
[13] Ruzicka T et al. Anti–Interleukin-31 Receptor A Antibody for Atopic Dermatitis. N Engl J Med 2017;376:826–835
[14] A Phase 2 Study of CIM331(Nemolizumab) for Atopic Dermatitis Patients. www.clinicaltrials.gov/ct2/show/NCT01986933?cond=NCT01986933&rank=1, Abruf 15. Januar 2018
[15] Wollenberg A et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatology Venereol 2018;32:850–878
[16] Eichenfield, L. F, Friedlander, S. F, Simpson, E. L, Irvine, A. D. Assessing the New and Emerging Treatments for Atopic Dermatitis. Semin Cutan Med Surg 2016;35:92-96
[17] After asthma success, AstraZeneca and Amgen’s tezepelumab misses in atopic dermatitis. www.fiercebiotech.com/biotech/after-asthma-success-astrazeneca-and-amgen-s-tezepelumab-misses-atopic-dermatitis, Abruf 11. Januar 2018
[18] Croft M, So T, Duan W, Soroosh P. The significance of OX40 and OX40L to T-cell biology and immune disease. Immunol Rev 2009;229:173–191
[19] Tidwell WJ, Fowler JF. T-Cell Inhibitors for Atopic Dermatitis. J Am Acad Dermatol 2017;78:67–70
[20] A Pharmacokinetic Study to Evaluate BBI-5000 Capsules and Food Effect in Healthy Adult Subjects - Full Text View - ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02590289?cond=BBI-5000&rank=1, Abruf 15. Januar 2018
[21] Atopix Therapeutics, L. Effect of OC000459 on Moderate to Severe Atopic Dermatitis. www.clinicaltrials.gov/show/NCT02002208, Abruf 15. Januar 2018
[22] Paller AS, Kabashima K Bieber T. Therapeutic pipeline for atopic dermatitis: End of the drought? JACI 2017;140:633–643
[23] Communications CS, Fennell A, Gardner C, Neville L. Update on Phase 2 clinical trial with OC459 in patients with moderate to severe atopic dermatitis. (2016). www.atopixtherapeutics.com/press-releases/Atopix - OC459 Ph2 Atopic Dermatitis Study Final - 17Feb16.pdf, Abruf 12. Januar 2018
[24] Barnes PJ. Role of GATA-3 in Allergic Diseases. Curr Mol Med 2008;8:330–334
[25] Significant progress achieved in SB011 development programme | Press Releases. www.sterna-biologicals.com/de/press-releases/significant-progress-achieved-in-sb011-development-programme.html, Abruf 12. Januar 2018
[26] Efficacy, Safety, Tolerability, Pharmacokinetics and Pharmacodynamics Study of the Topical Formulation SB011 Applied to Lesional Skin in Patients With Atopic Eczema. Sterna Biologicals GmbH & Co KG. 2014
[27] Simon D, Braathen LR. Review article Eosinophils and atopic dermatitis. Allergy 2004;59:561–570.
[28] Oldhoff JM et al. Anti-IL-5 recombinant humanized monoclonal antibody (Mepolizumab) for the treatment of atopic dermatitis. Allergy Eur. J Allergy Clin Immunol 2005;60:693–696
[29] Assessment Report: Nucala, INN-mepolizumab. Committee for Medicinal Products for Human Use (CHMP) 2015, www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003860/WC500198038.pdf, Abruf 12. Januar 2018
[30] FDA approves first drug for Eosinophilic Granulomatosis with Polyangiitis, a rare disease formerly known as the Churg-Strauss Syndrome. www.fda.gov/newsevents/newsroom/pressannouncements/ucm588594.htm, Abruf 12. Januar 2018
[31] AnaptysBio Presents Updated Data from ANB020 Phase 2a Atopic Dermatitis Trial at AAD Annual Meeting Nasdaq:ANAB. www.globenewswire.com/news-release/2018/02/17/1361150/0/en/AnaptysBio-Presents-Updated-Data-from-ANB020-Phase-2a-Atopic-Dermatitis-Trial-at-AAD-Annual-Meeting.html, Abruf 4. April 2018
[32] Toussirot E. The IL23/Th17 Pathway as a Therapeutic Target in Chronic Inflammatory Diseases. Inflamm. Allergy-Drug Targets 2012;11:159–168
[33] Tan Q, Yang H, Liu E, Wang H. Establishing a role for interleukin-17 in atopic dermatitis-related skin inflammation. J Cutan Med Surg 2017;21:308–315
[34] Secukinumab for Treatment of Atopic Dermatitis - Full Text View - ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02594098, Abruf 12. Januar 2018
[35] Eyerich K, Eyerich S. Th22 cells in allergic disease. Allergo J Int 2015;24:1–7
[36] Guttman-Yassky E et al. 313 A pathogenic role for Th22/IL-22 in atopic dermatitis is established by a placebo-controlled trial with an anti IL-22/ILV-094 mAb. J Invest Dermatol 2017;137:53
[37] Guttman E. Randomized Placebo Controlled Study to Determine Safety , Pharmacodynamics and Efficacy of ILV-094 in Atopic Dermatitis. Clinical Trials gov, 2013, www.clinicaltrials.gov/ct2/show/NCT01941537?cond=fezakinumab&draw=2&rank=1, Abruf 12. Januar 2018
[38] A Study Evaluating the Safety and Efficacy of QGE031 in Atopic Dermatitis Patients - Full Text View - ClinicalTrials gov. www.clinicaltrials.gov/ct2/show/NCT01552629?cond=Ligelizumab&rank=2, Abruf 15. Januar 2018
[39] Safety and Tolerability of XmAb®7195 in Adult Healthy Volunteers and Adult Subjects With a History of Allergic Rhinitis and/or Allergic Conjunctivitis and/or Atopic Dermatitis - Full Text View - ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02148744, Abruf 23. März 2018
[40] Ahluwalia J, Udkoff J, Waldman A, Borok J, Eichenfield LF. Phosphodiesterase 4 Inhibitor Therapies for Atopic Dermatitis: Progress and Outlook. Drugs 2017;77, 1389–1397
[41] Atopische Dermatitis: Endgültige Ergebnisse aus Phase-3-Studien. arznei-news.de/crisaborol/10.01.2018, Abruf 10. Januar 2018
[42] Hanifin JM et al. OPA-15406, a novel, topical, nonsteroidal, selective phosphodiesterase-4 (PDE4) inhibitor, in the treatment of adult and adolescent patients with mild to moderate atopic dermatitis (AD): A phase-II randomized, double-blind, placebo-controlled study. J Am Acad Dermatol 2016;75:297–305
[43] Study of RVT-501 in Adult and Adolescent Subjects With Atopic Dermatitis - Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02950922, Abruf 10. Januar 2018
[44] LEO 29102 Cream in the Treatment of Atopic Dermatitis – Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT01037881, Abruf 10. Januar 2018
[45] European Medicines Agency – Find medicine – Daxas. www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/001179/human_med_001363.jsp&mid=WC0b01ac058001d124, Abruf 10. Januar 2018
[46] Topical Roflumilast in Adults With Atopic Dermatitis - Study Results - ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/results/NCT01856764?sect=X75#outcome1, Abruf 10. Januar 2018
[47] Efficacy and Safety Study of Apremilast in Subjects With Moderate to Severe Atopic Dermatitis – Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/study/NCT02087943?sect=X256, Abruf 10. Januar 2018
[48] Yayli S, Irla N, Yawalkar N. Adalimumab in recalcitrant severe psoriasis associated with atopic dermatitis. Case Rep. Dermatol 2013;5:332–335
[49] Jacobi A, Antoni C, Manger B, Schuler G, Hertl M. Infliximab in the treatment of moderate to severe atopic dermatitis. J Am Acad Dermatol 2005;52:522–526
[50] Begum T, Davies R, Kearsley-Fleet L, Southwood T. R, Hyrich,KL. AB0915 No Association between Etanercept and New or Worsening Atopic Dermatitis in Children with Jia: an Analysis from the BSPAR Etanercept Cohort Study: Table 1. Ann. Rheum. Dis. 2014;73:1103.1-1103
[51] Pires MC, Lopes RS, Libonati TT, Pscheidt M, R.M, G. P. Atopic dermatitis as a side effect of anti-TNFa. Dermatitis 2013;24(4):12
[52] Bissonnette R et al. Topical tofacitinib for atopic dermatitis: a phase IIa randomized trial. Br J Dermatol 2016;175: 902–911
[53] Baricitinib Meets Primary Endpoint in Phase 2 Study of Patients with Moderate-to-Severe Atopic Dermatitis (NYSE:LLY). investor.lilly.com/releasedetail.cfm?ReleaseID=1040434, Abruf 11. Januar 2018
[54] Ports WC et al. A randomized phase 2a efficacy and safety trial of the topical Janus kinase inhibitor tofacitinib in the treatment of chronic plaque psoriasis. Br J Dermatol 2013;169:137–145
[55] A Study of Long-term Baricitinib (LY3009104) Therapy in Atopic Dermatitis – Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT03334435, Abruf 11. Januar 2018
[56] Study of Baricitinib (LY3009104) in Adults With Moderate to Severe Atopic Dermatitis – Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT03334422, Abruf 11. Januar 2018
[57] Phase 2b AD Dose Ranging Study (40wk) N=160 –Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02925117, Abruf 11. Januar 2018
[58] Pfizer Receives Breakthrough Therapy Designation from FDA for PF-04965842, an oral JAK1 Inhibitor, for the Treatment of Patients with Moderate-to-Severe Atopic Dermatitis | Pfizer Pharmaceutical News and Media | Pfizer: the world’s largest research-based pharmaceutical company. www.press.pfizer.com/press-release/pfizer-receives-breakthrough-therapy-designation-fda-pf-04965842-oral-jak1-inhibitor-t, Abruf 4. April 2018
[59] Ziarco Pharma Ltd: Ziarco reports positive Phase 2a study results with ZPL-389 in moderate to severe atopic dermatitis patients. www.globenewswire.com/news-release/2016/06/13/847881/10163430/en/Ziarco-Pharma-Ltd-Ziarco-reports-positive-Phase-2a-study-results-with-ZPL-389-in-moderate-to-severe-atopic-dermatitis-patients.html, Abruf 11. Januar 2018
[60] Blandina P, Passani MB (Eds). Histamine Receptors: Preclinical and Clinical Aspects. The Receptors 2016;28
[61] Bäumer W et al. Histamine H4 receptor a Novel Drug Target For Immunoregulation and Inflammation Chapter 6: Histamine in Atopic Disorders: Atopic Dermatitis and Prutitus.
[62] Bissonnette R et al. Efficacy and safety of topical WBI-1001 in patients with mild to severe atopic dermatitis: Results from a 12-week, multicentre, randomized, placebo-controlled double-blind trial. Br J Dermatol 2012;166:853–860
[63] Benvitimod – Welichem Biotech – AdisInsight. www.adisinsight.springer.com/drugs/800018462, Abruf 12. Januar 2018
[64] Rackal J. The Treatment of Atopic Dermatitis and Other Dermatoses with Leukotriene Antagonists. Skin Therapy Lett. 2004;9:1–5
[65] Yanes DA, Mosser-Goldfarb JL. Emerging Therapies for Atopic Dermatitis: The Prostaglandin/Leukotriene Pathway Title: Emerging Therapies for Atopic Dermatitis: The Prostaglandin/Leukotriene 2 Pathway 3. J Am Acad Dermatology Yanes DA J Am Acad Dermatology 2017;78:71–75
[66] Clinicaltrials.gov. Safety and Efficacy Study of Q301 in Moderate to Severe Atopic Dermatitis Patients. www.clinicaltrials.gov/ct2/show/NCT02426359?cond=Q301&rank=1, Abruf 15. Januar 2018
[67] A phase III trial to investigate tradipitant for atopic dermatitis – AdisInsight. www.adisinsight.springer.com/trials/700290291, Abruf 15. Januar 2018
[68] Tradipitant in Treatment-resistant Pruritus Associated With Atopic Dermatitis – Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02651714, Abruf 15. Januar 2018
[69] Vanda’s Tradipitant Improves Itch and Disease Severity in Patients with Atopic Dermatitis. www.prnewswire.com/news-releases/vandas-tradipitant-improves-itch-and-disease-severity-in-patients-with-atopic-dermatitis-300519177.html, Abruf 15. Januar 2018
[70] Study of the Efficacy, Safety, and Tolerability of Serlopitant for Pruritus (Itch) in Atopic Dermatitis – Full Text View – ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02975206, Abruf 15. Januar 2018
[71] Tey HL, Yosipovitch G. Targeted treatment of pruritus: A look into the future. Br J Dermatol 2011;165:5–17
[72] Tioga Pharmaceuticals’ Asimadoline Reduces Nighttime Itching and Improves Disease-Related Quality. www.prnewswire.com/news-releases/tioga-pharmaceuticals-asimadoline-reduces-nighttime-itching-and-improves-disease-related-quality-of-life-in-patients-with-atopic-dermatitis-300566114.html, Abruf 15. Januar 2018
[73] Safety, Pharmacokinetics and Preliminary Efficacy of Asimadoline in Pruritus Associated With Atopic Dermatitis - Full Text View - ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02475447, Abruf 15. Januar 2018
[74] Bonchak JG, Swerlick RA. Emerging Therapies for Atopic Dermatitis: TRPV1 Antagonists. J Am Acad Dermatol 2017;78:63–66
[75] CAPTAIN-AD: Clinical Study of AmorePacific’s TRPV1 Antagonist PAC-14028 cream in Atopic Dermatitis – Full Text View - ClinicalTrials.gov. www.clinicaltrials.gov/ct2/show/NCT02965118?cond=NCT02965118&rank=1, Abruf 15. Januar 2018
[76] Kim G, Bae, J-H. Vitamin D and atopic dermatitis: A systematic review and meta-analysis. Nutrition 2016;32: 913–920
[77] Chang Y-S et al. Melatonin Supplementation for Children With Atopic Dermatitis and Sleep Disturbance. JAMA Pediatr 2016;170:35
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.