
- DAZ.online
- DAZ / AZ
- DAZ 27/2018
- Millimetergenau gegen das...
Medizin
Millimetergenau gegen das Prostatakarzinom
Patienten profitieren von innovativer Strahlentherapie
Zeit für die optimale Therapiewahl nehmen
Wenn die Diagnose eines Prostatakarzinoms nach einer Stanzbiopsie gestellt wurde, muss gewöhnlich nicht sofort eine Therapieentscheidung getroffen werden und die Behandlung umgehend starten, sondern es besteht ausreichend Zeit, um in Ruhe und ggf. erst nach einer Zweitmeinung die geeignetste Therapieform auszuwählen.
Individuelles Risiko gibt Behandlungsrichtung vor
Generell gilt, dass die Behandlung des lokalisierten, noch nicht auf Lymphknoten oder andere Organe übergreifenden, Prostatakarzinoms von folgenden Faktoren abhängig ist: Größe (TNM-Stadium), Aggressivität (Gleason-Score) und PSA-Wert (prostataspezifisches Antigen), ein Gewebsmarker für die Prostata, der bei Vorliegen eines Prostatakarzinoms oft erhöht ist und im Blut nachgewiesen werden kann. Entscheidend für die Frage der Therapiewahl ist die Einteilung der Erkrankung in Risikogruppen, die durch diese wichtigen prognostischen Faktoren definiert sind.
Der amerikanische Strahlentherapeut d’Amico teilte das lokalisierte Prostatakarzinom in drei Risikogruppen ein, die in Deutschland angewendet werden (Tab. 1).
Risiko für Rezidiv |
low |
intermediate |
high |
|---|---|---|---|
Gleason-Score |
bis 6 |
7 |
8 bis 10 |
und |
oder |
oder |
|
PSA-Wert |
bis 10 |
> 10 bis 20 |
> 20 |
und |
oder |
oder |
|
Stadium |
cT1-2a |
cT2b |
ab cT2c |
Radiotherapie-Optionen |
perkutane Radiotherapie der Prostata* |
perkutane Radiotherapie der Prostata* mit Samenblasenbasis (1 cm) |
perkutane Radiotherapie der Prostata* mit Samenblasenbasis (2 cm ggf. ganze Samenblasen bei Befall) Ggf. Einschluss des pelvinen Lymphabflusses |
begleitende Hormontherapie |
keine |
+/-neoadjuvante/ adjuvante Kurzzeithormonablation für 3 – 6 Monate |
+/- neoadjuvante/ adjuvante Langzeithormonablation für 2 – 3 Jahre |
* kann auch mit einem Brachytherapie-Boost durchgeführt werden [4] | |||
Welche heilenden Therapieoptionen gibt es?
Die wichtigsten und evidenzbasierten Verfahren sind hier aufgeführt:
- Active Surveillance, also eine engmaschige Überwachung (PSA-Wert alle 3 Monate und regelmäßige erneute Stanzbiopsien), die für Low-risk-Patienten (bis 2 Stanzen mit weniger als 50% Tumoranteil) geeignet ist.
- Die Radiotherapie eignet sich für alle Stadien des Prostatakarzinoms, wobei risikogruppenabhängig die Behandlung intensiviert wird. So wird beispielsweise bei Intermediate-risk- und High-risk-Patienten zusätzlich eine zeitlich begrenzte hormonablative Therapie (medikamentöse Unterdrückung der männlichen Sexualhormone) unterschiedlicher Länge begleitend durchgeführt, die zusätzlich das Wachstum der Krebszellen unterdrückt und die Behandlungsergebnisse der Bestrahlung weiter verbessert. Bei High-risk-Patienten kann darüber hinaus eine Bestrahlung der Beckenlymphknoten sinnvoll sein.
- Operation (radikale Prostatektomie), eine gleichwertige kurative Behandlungsoption des Prostatakarzinoms in den niedrigen und mittleren Stadien, die die identische Heilungsrate wie die Strahlentherapie aufweist. Wenn bei High-risk-Patienten schon vor der OP feststeht, dass hinterher eine Bestrahlung notwendig wird (z. B. bei Samenblasenbefall), muss der Patient über diese Situation ausführlich beraten werden. Falls zwei lokale Therapieverfahren notwendig werden, treten gewöhnlich höhere Nebenwirkungen auf (vor allem Inkontinenz und Impotenz). In diesem Fall ist die schonendere Alternative die Strahlentherapie mit Langzeithormontherapie, die in großen Studien als Therapieform abgesichert ist [5].
Gibt es einen Vergleich der Therapien?
Die einzige Studie, die diese Therapieoptionen beim lokal-begrenzten Prostatakarzinom (T1c-2, PSA bis 20 ng/ml) randomisiert auf Heilungsraten und Nebenwirkungen untersuchte, ist die ProtecT-Studie. Hier wurde bei 82.429 Männern der Wert des Prostata-spezifischen Antigens (PSA) untersucht. Bei 2664 Männern wurde ein Prostatakarzinom nachgewiesen, von denen im Rahmen der Studie 1643 Männer zufällig auf einen von drei Therapiearmen verteilt werden konnten: Aktive Überwachung, Operation oder Strahlentherapie. Nach zehn Jahren waren in jedem Therapiearm nur 1% der Patienten an dem Prostatakrebs verstorben. Es wurden signifikant weniger Nebenwirkungen bei der Radiotherapie nach sechs Jahren im Vergleich zu Operation und Active Surveillance beobachtet. Dies betraf vor allem das Symptom Inkontinenz: Einlagen tragen mussten sechs Monate nach OP noch 46% der Patienten, nach Radiotherapie nur 4% der Patienten; auch Impotenz trat nach Radiotherapie seltener auf. Insgesamt beurteilten die Patienten ihre Lebensqualität als gut, unabhängig von der durchgeführten Therapieform [6, 7].
Gemeinsame Beratung ist wichtig
Im klinischen Alltag sollte die Entscheidung, welche Therapieoption für den einzelnen Patienten ausgewählt wird, in einer Tumorkonferenz oder in einer interdisziplinären Sprechstunde mit Strahlentherapeut und Urologe erfolgen und die Erfolgsaussichten, die Nebenwirkungen, den Gesundheitszustand des Patienten und besonders den Wunsch des Patienten berücksichtigen. In unseren Tumorzentren wird in Tübingen und Reutlingen eine gemeinsame Beratung durch Urologen und Strahlentherapeuten angeboten.
Allgemeine Vorteile der Radiotherapie
Die Radiotherapie ist eine ambulante Behandlung. Ein stationärer Aufenthalt, eine Narkose und sämtliche operative Risiken (Transfusion, Fistel usw.) entfallen. Im Gegensatz zur Operation handelt es sich um ein organerhaltendes Verfahren, bei dem der Tumor in der Prostata abgetötet wird. Die Heilungsraten von Operation und Strahlentherapie sind gleich.
Wie eine Radiotherapie geplant wird
Zunächst werden in einem Aufklärungsgespräch (ca. 60 Minuten lang) ausführlich der individuelle Nutzen sowie mögliche Risiken mit dem Patienten diskutiert. Nach ausreichender Bedenkzeit werden dann ein Planungs-CT und ein Planungs-MRT (eine Computertomografie und eine Magnetresonanztomografie, jeweils in der späteren Bestrahlungsposition) durchgeführt. Zusätzlich werden Hautmarkierungen im Beckenbereich angebracht, die später der genauen, lasergestützten Reproduzierbarkeit dieser Körperposition dienen.
Dann beginnt der Bestrahlungsplanungsprozess. Dafür wird vom Strahlentherapeuten in den einzelnen Schichtbildern des CTs (2 bis 3 mm Dicke) die Prostata definiert und festgelegt, wo überall eine hohe Strahlendosis notwendig ist. Die Fusion der MRT-Bilder hilft hier, das Organ und den Tumor noch genauer darzustellen. Außerdem kann der Strahlentherapeut die genaue Lage der strahlenempfindlichen Organe des Beckens markieren und so dafür sorgen, dass diese später möglichst wenig Strahlungsdosis erhalten.
Modernste Bestrahlungsprogramme berechnen nun, welcher Teil dieser Strahlendosis von welcher Seite und aus welchem Winkel auf die Prostata abgestrahlt werden sollte, damit am Tumor eine ausreichende Dosis zur abtötenden Wirkung erreicht wird, gleichzeitig aber die empfindlichen umliegenden Organe (vor allem Harnblase und Enddarm, aber auch Hüftgelenke, Dünndarm und Peniswurzel) so gut wie möglich geschont werden. Diese Bestrahlungstechnik nennt man intensitätsmodulierte Radiotherapie (IMRT).
So entsteht in einem mehrtägigen Prozess für jeden Patienten ein individueller, an die persönliche Anatomie angepasster Bestrahlungsplan, der im Vergleich zu früheren Bestrahlungstechniken höhere Dosen am Tumor ermöglicht und dabei weniger Nebenwirkungen an den umliegenden Organen verursacht als eine konventionelle 3D-Technik. Jeder Bestrahlungsplan wird vor der ersten Bestrahlung stets noch einmal von einem Facharzt der Strahlentherapie sowie einem Medizinphysik-Experten geprüft. Steht der optimale Plan fest, kann mit der Radiotherapie begonnen werden.
Wie eine Strahlentherapie abläuft
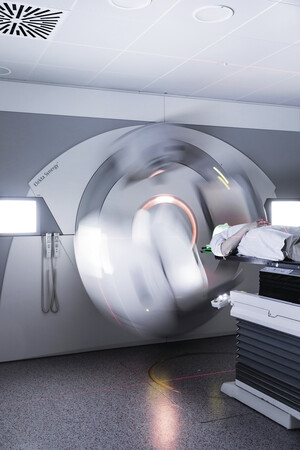
Der Patient wird nun täglich für jede Fraktion der Bestrahlung auf einen Bestrahlungstisch in einem Raum mit dem Bestrahlungsgerät, dem so genannten Linearbeschleuniger, genau so positioniert, wie es beim Planungs-CT vorgesehen war (Abb. 1). Zur Reproduzierbarkeit sollte dabei die Blase stets ungefähr gleich voll sein. Dafür können auf dem Bestrahlungstisch vor Beginn der Bestrahlung auch Kontrollaufnahmen durchgeführt werden, um auch „innerlich“ anhand der anatomischen Strukturen sicherzustellen, dass sich Prostata und Tumor an der richtigen Position befinden. Dies geschieht in Tübingen per „Cone-Beam CT“, um eine dreidimensionale Darstellung der inneren Organe regelmäßig zu ermöglichen (Image-Guided Radiotherapie = IGRT). Diese Kontrolle dauert wenige Minuten und ermöglicht es, dass die Sicherheitssäume, die die (unvermeidbare) Organbeweglichkeit im Körper sowie kleine Abweichungen bei der Lagerung ausgleichen sollen, besonders klein gewählt werden können. Dies bedeutet wiederum noch weniger Nebenwirkungen vor allem an Blase und Darm. Erst wenn eine millimetergenaue Treffsicherheit gegeben ist, erfolgt die eigentliche Bestrahlung, welche nochmal ca. drei Minuten dauert und für den Patienten völlig schmerzlos ist.
Die Dauer einer Strahlentherapie
Es ist bereits bekannt, welche Strahlendosis am Prostatakrebs mindestens erreicht werden muss, um eine gute Heilungschance bei niedrigen Nebenwirkungsraten zu erreichen (ca . 74 – 80 Gray [Gy = Einheit der Strahlendosis [3]]). Zur Schonung der umgebenden Organe wird die geplante Gesamtstrahlendosis auf mehrere, „verträgliche“ Einzeldosen pro Tag (= Fraktion) aufgeteilt. Daher dauert eine gesamte Strahlenbehandlung mit üblicher Fraktion von 2 Gy/Tag sieben bis acht Wochen. Neuere Studienergebnisse lassen aber auch für bestimmte Patienten größere Einzeldosen von ca. 3 Gy/Tag bei gleicher Wirksamkeit und ähnlich niedrigen Nebenwirkungsraten zu (= Hypofraktionierung). Damit verkürzt sich die Behandlungsdauer auf insgesamt vier Wochen [8, 3].
Das Prostatakarzinom kann gleichwertig auch mit Protonen bestrahlt werden, einen Vorteil für die Heilungschance oder die Nebenwirkungen konnte man dafür aber nicht feststellen [3].
Nebenwirkungen der Radiotherapie
Es können im Verlauf der Behandlung Nebenwirkungen auftreten. Typischerweise sind dies meist eine milde Zystitis (Entzündung der Blase, führt zu Brennen beim Wasserlassen) oder eine milde Proktitis (Entzündung im Enddarmbereich, kann zu Durchfall und Druckgefühl führen). Gegebenenfalls können vom Strahlentherapeuten dann Medikamente zur Symptomlinderung verabreicht werden. Nach Abschluss der Radiotherapie heilen diese Akuttoxizitäten gewöhnlich wieder ab. Um dies beurteilen zu können, erfolgt bei Patienten in Tübingen deshalb in den ersten fünf Jahren nach der Radiotherapie regelmäßig eine Nachsorgeuntersuchung vom Strahlentherapeuten.
Laufende Studien für Patienten
In Tübingen bieten wir aktuell die Teilnahme an der MBase-Studie (ClinicalTrials.gov ID: NCT02724670) an, welche testet, ob durch die MR-gestützte Anpassung des Bestrahlungsplans eine noch stärkere Absenkung der Nebenwirkungsraten ermöglicht werden kann.
Des Weiteren ist eine ähnliche Folgestudie mit hypofraktionierter Bestrahlung bereits geplant.
Eine weitere Studie untersucht, ob bei Patienten, welche bereits einzelne Knochenmetastasen eines Prostatakarzinoms aufweisen, eine Heilung durch Radiotherapie möglich ist (Oli-P-Studie, NCT02264379).
Die Zukunft der Strahlentherapie
Durch technische Verbesserungen sind weitere Optimierungen im Bereich der Strahlentherapie zu erwarten, die einen Einfluss auf die Heilungsraten und die Senkung der Nebenwirkungen haben werden.
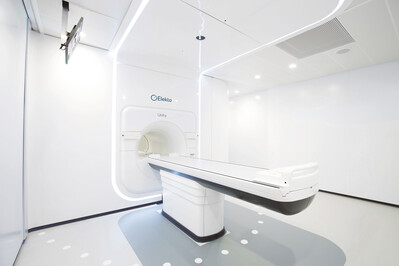
Ein vielversprechender Ansatz ist ein neuartiges Hybrid-Bestrahlungsgerät, welches zurzeit in Tübingen installiert wird. Dabei sind ein 1,5 Tesla MRT und ein Linearbeschleuniger in einem Gerät verbunden, sodass täglich ein MRT zur Bestrahlungsplanung durchgeführt werden kann und der Bestrahlungsplan täglich individuell anhand dieser Bilder angepasst werden kann [9] (Abb. 2). |
Literatur:
[1] Robert Koch-Institut ZfK (2017) Krebs in Deutschland für 2013/2014. Krebs in Deutschland 11. Auflage: 92-93
[2] Robert Koch-Institut ZfK (2016) Bericht zum Krebsgeschehen in Deutschland 2016.40-43. doi:0.17886/rkipubl-2016-014
[3] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft DK, AWMF) (2018) Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms. Langversion 5.0:394. doi:AWMF Registernummer: 043/022OL
[4] Müller AC HT (2015) Stellenwert der Fraktionierung, Strahlenart und Wahl der Zielvolumenkonzepte bei der perkutanen Radiotherapie. Der Onkologe (21):815–824. doi:DOI 10.1007/s00761-014-2901-1
[5] Bolla M, Van Tienhoven G, Warde P, Dubois JB, Mirimanoff RO, Storme G, Bernier J, Kuten A, Sternberg C, Billiet I, Torecilla JL, Pfeffer R, Cutajar CL, Van der Kwast T, Collette L (2010) External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. The Lancet Oncology 11 (11):1066-1073. doi:10.1016/s1470-2045(10)70223-0
[6] Hamdy FC, Donovan JL, Lane JA, Mason M, Metcalfe C, Holding P, Davis M, Peters TJ, Turner EL, Martin RM, Oxley J, Robinson M, Staffurth J, Walsh E, Bollina P, Catto J, Doble A, Doherty A, Gillatt D, Kockelbergh R, Kynaston H, Paul A, Powell P, Prescott S, Rosario DJ, Rowe E, Neal DE (2016) 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. The New England journal of medicine 375 (15):1415-1424. doi:10.1056/NEJMoa1606220
[7] www.aerztezeitung.de (2016) Prostata-Ca: Pluspunkte für Radiatio. Ärzte Zeitung online
[8] Dearnaley D, Syndikus I, Mossop H, Khoo V, Birtle A, Bloomfield D, Graham J, Kirkbride P, Logue J, Malik Z, Money-Kyrle J, O‘Sullivan JM, Panades M, Parker C, Patterson H, Scrase C, Staffurth J, Stockdale A, Tremlett J, Bidmead M, Mayles H, Naismith O, South C, Gao A, Cruickshank C, Hassan S, Pugh J, Griffin C, Hall E (2016) Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. The Lancet Oncology 17 (8):1047-1060. doi:10.1016/s1470-2045(16)30102-4
[9] Raaymakers BW, Jurgenliemk-Schulz IM, Bol GH, Glitzner M, Kotte A, van Asselen B, de Boer JCJ, Bluemink JJ, Hackett SL, Moerland MA, Woodings SJ, Wolthaus JWH, van Zijp HM, Philippens MEP, Tijssen R, Kok JGM, de Groot-van Breugel EN, Kiekebosch I, Meijers LTC, Nomden CN, Sikkes GG, Doornaert PAH, Eppinga WSC, Kasperts N, Kerkmeijer LGW, Tersteeg JHA, Brown KJ, Pais B, Woodhead P, Lagendijk JJW (2017) First patients treated with a 1.5 T MRI-Linac: clinical proof of concept of a high-precision, high-field MRI guided radiotherapy treatment. Phys Med Biol 62 (23):L41-L50. doi:10.1088/1361-6560/aa9517
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.