
- DAZ.online
- DAZ / AZ
- DAZ 26/2018
- Das Ende der Tablette
Feuilleton
Das Ende der Tablette
... ist nicht das Ende der Apotheke
Die moderne pharmazeutische Technologie begann vor ca. 150 Jahren mit der Entwicklung von Arzneimitteln aus den neu gefundenen synthetischen Farbstoffen [1]. Wirkstoffe der frühen Jahre waren Lokalanästhetika, Hypnotika und Mittel, die gegen körperfremde Organismen gerichtet waren, wie Malaria oder Bakterien. Schnelle Fortschritte ergaben sich im 19. Jahrhundert durch Erkenntnisse aus der sich rasant entwickelnden Chemie. Schmerz- und Schlafmittel für den Menschen wurden an Säugetieren, Antiparasitika an den Parasiten getestet. Diese erste Blüte der Pharmazie würden wir heute wohl als „Pharmakologie 1.0“ bezeichnen.
Durch – teils gezielt, teils zufällig – neu entdeckte chemische Verbindungen oder durch Modifikation bereits bekannter Ausgangsstoffe konnte Einfluss auf biologische Regelkreise genommen werden. Wirkungen wurden „im Screening gefunden“ und bildeten den Grundstock für die „Pharmakologie 2.0“. Diese führte zu spezifischeren Wirkstoffen, geringeren Dosierungen und einer verbreiterten Basis von behandelbaren Erkrankungen.
Letztlich konnten in dieser Phase nur mono-dysfunktionale Erkrankungen durch meist chemisch-synthetische Monopräparate beeinflusst werden. Die (teils schlechten) Erfahrungen hierbei führten zur Forderung nach randomisierten klinischen Studien (RCT), evidenzbasierter Medizin und komplexen Zulassungsverfahren – verkörpert in den Industriestaaten durch Behörden wie BfArM, EMA oder FDA.
Ein Wirkstoff soll mehr nutzen als schaden – eine zentrale Forderung, die sich nicht nur im Schwur des Hippokrates, sondern auch im modernen Arzneimittelrecht wiederspiegelt. Doch Bezugspunkt ist immer das Patientenkollektiv, also Menschen mit demselben Krankheitsbild. Es geht um statistische Mittelwerte, die Verallgemeinerung häufig unspezifischer Symptome und das Prinzip „One size fits all“. Komplizierte Erkrankungen entziehen sich meist der niedermolekular-chemisch-synthetischen Pharmakologie.
Evidenzbasierte Medizin als Kompromiss
Die individuelle, tatsächliche Ursache einer Erkrankung konnte in vielen Fällen vom Arzt nicht gefunden werden, die Diagnosen waren mangels analytischer Methoden noch begrenzt. In unzähligen Fällen sind die Symptome verschiedener Erkrankungen bekanntlich sogar ähnlich. Nur die statistisch signifikante Besserung eines Patientenkollektivs mit gleicher Symptomatik erbrachte der Gesellschaft den Bonus von mehr „Geheilten“ als Leidenden. Das individuelle Leid wurde hingegen nicht betrachtet.
Evidenzbasierte Medizin [2] ist also ein Kompromiss, bei dem eine statistisch mehrheitliche Gesundung im Kollektiv akzeptiert wird und der einzelne Patient durch die für ihn ggf. schädliche Therapie nicht mehr oder weniger leiden muss. Eine individuelle Diagnose ist auch heute in vielen Fällen nicht möglich oder unter Umständen zu teuer und daher nicht realisierbar.
Dass Patienten nicht alle gleich sind, dass Kinder und ältere Menschen häufig geringere Wirkstoffmengen benötigen, dass geschlechtsspezifische Unterscheidungen notwendig sind, wurde bereits früh bei den niedermolekularen Wirkstoffen erkannt. Heute finden Patientenmerkmale in der Pharmakogenetik und Pharmakometrie erst recht Beachtung, wie von Prof. Dr. Sebastian Wicha erst kürzlich in der DAZ vorgestellt wurde [3]. Die personalisierte Medizin erfordert einen ungleich größeren Aufwand an diagnostischen Untersuchungen, um beispielsweise die individuelle enzymatische Ausstattung eines Patienten festzulegen und daraus die pharmakokinetischen und -dynamischen Konsequenzen für die Behandlung zu ziehen. Ein Arzt leistet diese Untersuchungen nicht in seiner eigenen Praxis – er beauftragt ein spezialisiertes Labor. Die „Laborwerte“ kommen dann mit einer Vielzahl von Interpretationshilfen an ihn zurück. Obwohl die Diagnose letztendlich dem Arzt überlassen ist, kommt er nicht drumherum, seine Entscheidung von vielen „pharmako…“-Methoden abhängig zu machen. Und hier können und müssen sich die Apotheker profilieren, denn sie erhalten bekanntlich eine „umfassende Ausbildung unter anderem zu den Themen: Arzneimittel, Arzneimittelherstellung, Arzneimittelprüfung, Arzneimittelwirkungen inklusive Wechsel- und Nebenwirkungen sowie Physiologie und klinischer Pharmazie“ [4]. Die aus gesellschaftlicher Sicht sinnvolle Trennung von Arzt und Apotheker, von Verordnung und Abgabe, die wichtigste Säule für das deutsche Apothekenwesen, kommt hierbei also zum Tragen.
Seit 30 Jahren biotechnologische Arzneimittel
1982 begann dann die Zeit der „Pharmakologie 3.0“: Insulin, schon zuvor aus Schweinepankreas isoliert, konnte nun biotechnologisch hergestellt werden. Heute sind biotechnologische Arzneimittel [5] für etliche Krankheitsbilder unverzichtbar [6 – 8]. In Deutschland sind aktuell 244 Arzneimittel mit 192 Wirkstoffen zugelassen, die biotechnologisch hergestellt werden [9]. Nahezu alle neuen Therapieoptionen sind auf Innovationen mit solchen Arzneimitteln zurückzuführen. Der Marktanteil der Biopharmazeutika unter den Top-100-Präparaten beträgt zurzeit ca. 50% – weltweit [10]. Selbst „Die Grünen“ überdenken mittlerweile ihr Konzept zum Umgang mit Gentechnik [11].
Biotechnologisch produzierte Wirkstoffe haben neben ihrem therapeutischen Nutzen auch weitere Vorteile.
Synthetische niedermolekulare Substanzen wurden zwar seit dem Arzneimittelgesetz von 1961 auf ihre „Qualität, Wirksamkeit und Unbedenklichkeit“ (§ 1 AMG) [12] untersucht, langfristige Auswirkungen auf Mensch, Tier und Umwelt werden in den Zulassungsverfahren aber nicht berücksichtigt. Pharmazeutische Produkte sind daher auch von Regularien wie der EU-Chemikalien-Verordnung [13] oder Gesetzen zu Bioziden, Pflanzen- und Umweltschutz ausgenommen. Der Gedanke dahinter ist, dass menschliches Leben einen besonderen und bevorzugten Schutz genießt. Die unbeachteten Auswirkungen auf die Umwelt sind häufig langfristig und betreffen meistens das gesamte Ökosystem. Schädliche „Spurenstoffe“ im Wasser treten daher fast ausschließlich im Zusammenhang mit Arzneimitteln auf [14]. Da viele Wirkstoffe hochgradig lipophil sind und als schwer abbaubar bzw. in Kläranlagen als schwer eliminierbar gelten, sind zunehmend vierte Stufen für kommunale Kläranlagen in der Diskussion [15] – die dritte Klärstufe wurde zur Elimination von Phosphat eingebaut, welches alle Oberflächengewässer in Europa gefährdet.
Biotechnologisch hergestellte Wirkstoffe sind hingegen Antikörper und Proteine, hochwirksam und gering dosiert und zudem auch sehr leicht biologisch abbaubar. Niedermolekulare Wirkstoffe zeigen gelegentlich endokrine Disruptorwirkung auf Mensch [16 – 19] und Tier [20 – 21]. Das heißt, sie haben eine hormonartige, schädliche Wirkung bei einer therapeutischen Dosierung. Diese ist fast unvermeidbar, wenn man berücksichtigt, dass es sich um „Wirk“-Stoffe handelt, deren Rezeptorselektivität ganz unterschiedlich ausgeprägt sein kann. Targetproteine werden oft identisch oder sehr ähnlich auch anderswo von der Natur „verbaut“. Sie sind die Sensoren zu unterschiedlichen Aktoren, der sensitive Punkt von verschiedenen biochemischen Reaktionen im Körper, wie Prof. Dr. Hanns Hatt von der Ruhr-Universität Bochum in vielen Arbeiten gezeigt hat [22]. Maiglöckchenduft wird beispielsweise in Spermien wahrgenommen, und Duftrezeptoren konnten auch in Leberkrebszellen nachgewiesen werden.
Applikationsart |
Applikationsform |
Distribution |
postulierter Mechanismus |
Bewertung |
gesellschaftliche Grundlage |
Typ |
Ethik |
Diagnose maßgeblich geprägt durch |
Entscheidung zum Wirkstoff maßgeblich geprägt durch |
Kriterien von Wirkung / Schaden |
Fokus der Wirkung |
Fokus auf |
Testsysteme (Wirkung / Nebenwirkung |
Kostenmodell (Grundlagen und Trends) |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
vor 1880 |
oral |
Pulver / Säfte |
Apotheke |
gesammeltes Erfahrungswissen |
Eid des Hippokrates (Gewissen) |
Extrakt / Isolat |
philosophisch |
Mediziner |
Mediziner |
Dosis |
symptomatisch adjuvant akut |
ein Mensch (Individuum) |
Zufallsbeobachtungen Mensch |
Individuum zahlt |
||
1883 |
Tablette |
synthetisch chemisch |
sozial |
symptomatisch akut |
Menschen (Kollektive) |
studienbasiert Mensch |
Krankenversicherung (Bismarck) zahlt |
|||||||||
Schlüssel-Schloss |
empirisch Patientenkollektive |
Pharmaindustrie |
zusätzlich: Kind / Erwachsener und Körpergewicht |
symptomatisch akut kurativ |
Patientenkollektive |
Säugetiere (Tierversuche) |
||||||||||
1961 |
evidenzbasiert statistisch Patientenkollektive |
AMG |
zusätzlich: teratogene mutagene |
kalkuliert kurativ |
Krankenkasse zahlt für Behandlung |
|||||||||||
1982 |
s.c. / i.m. / i.v. |
Injektion / Infusion |
Apotheke / direkt an Patient |
„Rezeptor“ |
biotechnologisch
(keine Humanzellen)
|
sozial rational |
Labormediziner |
Leitlinien auf Basis EbM => Pharmaindustrie |
zusätzlich: (Blut-) Analytik Stoffwechsel |
kurativ |
Krankenkasse zahlt für Behandlung / Zusatznutzen IQWIG |
|||||
beginnend seit 2010 |
Klinik / direkt an Patient |
Rezeptorprotein |
individueller Heilungserfolg |
gentechnisch (Humanzellen oder im Patient) |
naturwissenschaftlich rational |
Humangenetiker |
molekular-biologischer Pharmazeut |
zusätzlich: endokrine Disruptoren bei Mensch und anderen Organismen; ökotoxikologisch akzeptabel |
präventiv kausal |
holobiotisch: Mensch und Umwelt / Arzneimittel ökologisch verträglich und biologisch abbaubar |
Mensch / keine Tierversuche |
Krankenkasse zahlt nur bei Erfolg |
Wirkung und disruptive Nebenwirkungen sind die zwei Seiten einer Medaille
Paracelsus hat noch immer Recht: Die Dosis macht die Wirkung. Doch an welchem Ort die Wirkung eintritt, welcher Rezeptor kurzfristig oder langfristig stimuliert wird, hat er nicht berücksichtigt. In der Natur sind die sekundären Pflanzenstoffe, die in den ersten Jahrhunderten die wesentliche Quelle für Arzneimittel waren, in den Pflanzen weder im Energiestoffwechsel noch in anabolem oder katabolem Stoffwechsel notwendig [23]. Diese Phytamine dienen überwiegend der Beeinflussung anderer Organismen – um sie anzulocken oder abzuwehren. Was leicht gelingt, wenn eine Wirkung speziesübergreifend möglich ist. Das dürfte auch der Grund sein, warum die meisten niedermolekularen Wirkstoffe „breitere Wirkung“ als beabsichtigt besitzen.
Die modernen Biologika zeigen hingegen eine hohe Spezifität. Physiologische Regelkreise sind gezielter steuerbar. Dazu kommt, dass biotechnologisch hergestellte Arzneimittel sowohl intra- als auch vor allem extrakorporal leicht abbaubar sind. Die Wirkdauer und Reichweite sind also zeitlich und räumlich begrenzt. Damit sind ökologische Probleme durch Biologika nicht zu erwarten. Und auch die zurzeit zwingend vorgeschriebenen Tierversuche in der Arzneimittelzulassung sind bei der hohen Spezifität der Biologika nur noch eingeschränkt sinnvoll, wie Prof. Dr. Ute Schepers vom Institut für Toxikologie und Genetik des Karlsruher Instituts für Technologie [24] argumentiert. In Zukunft werden also die Versuche eher in Menschen stattfinden, unterhalb der therapeutischen Dosierung und streng pharmakologisch, pharmakodynamisch und analytisch begleitet. „Menschenversuche“ ergeben bei humanspezifischen Wirkstoffen Sinn, Tierversuche verlieren dagegen an Aussagekraft.
Die Patientenkollektive werden bei Biologika kleiner, da die Wirkung dieser Mittel individuell ist. Um dem Arzneimittelgesetz zum Nachweis der Wirksamkeit gerecht zu werden und trotzdem die Zulassung individueller Therapien voranzutreiben [25], wird die Liste der Ausschlusskriterien bei klinischen Studien der Pharmaindustrie immer länger.
Doch welche Konsequenzen haben diese neuen Arzneimittel für die Apotheke? Niedermolekulare Wirkstoffe besitzen eine lange Haltbarkeit. Sie können oft bei Raumtemperatur gelagert werden und in Form von Tabletten zum Arzneimittel weiterverarbeitet werden. Da sie oral eingenommen werden, sind sie für Patienten, nach kurzer Beratung, auch selbst applizierbar.
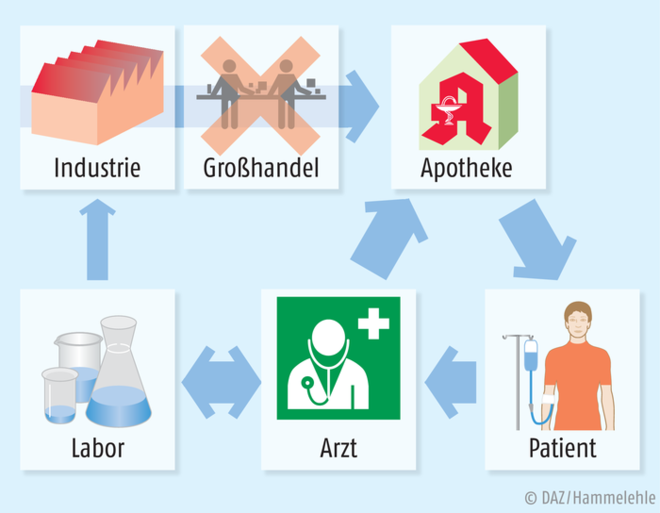
Biologika erfordern Kühltransporte und ein strenges Regime der Logistik. Oft werden sie ohne Zwischenhandel direkt vertrieben oder erst in letzter Minute „hergestellt“, wenn man die Rekonditionierung als Teil der Herstellung begreift. Eine Prüfung ist notwendig, ob das Arzneimittel applizierbar ist und, je nach Wirkstoff, speziell für den Patienten geeignet ist. Mögliche Wechsel- und Nebenwirkungen beispielsweise aufgrund der Genetik des Patienten müssen vor Applikation geprüft werden.
Invasive Applikationen durch Helfer, Pfleger und Apotheker
Die Applikation von Biologika verläuft meistens invasiv, subkutan oder intramuskulär, aber auch intravenös. Betrachten wir die Qualifikation der Apotheker erneut: Zu Themen wie Arzneimittelherstellung, -prüfung, -wirkungen sowie Physiologie und klinische Pharmazie werden die Apotheker ausgebildet. Nur die invasiven Applikationen wie Impfungen oder Infusionen sowie Blutentnahmen sind den Ärzten überlassen. Doch Apotheker bestimmen auch heute schon Glucose-, Cholesterin- und andere Blutwerte mittels Lanzette invasiv. Ärzte delegieren diese invasiven Tätigkeiten in der Regel (nicht in der Ausnahme) an ihre Mitarbeiter, was sie seit 1975 auch dürfen [26]. Auch in der ambulanten Pflege sind die subkutanen und intramuskulären Injektionen Standard. Und Impfen geschieht in der Regel nicht intravenös. Eine Ergänzung der apothekerlichen Ausbildung – auch als Fortbildung – könnte diese ebenfalls zu ausreichend qualifiziertem Personal machen, so wie in der Schweiz und Frankreich bereits üblich.
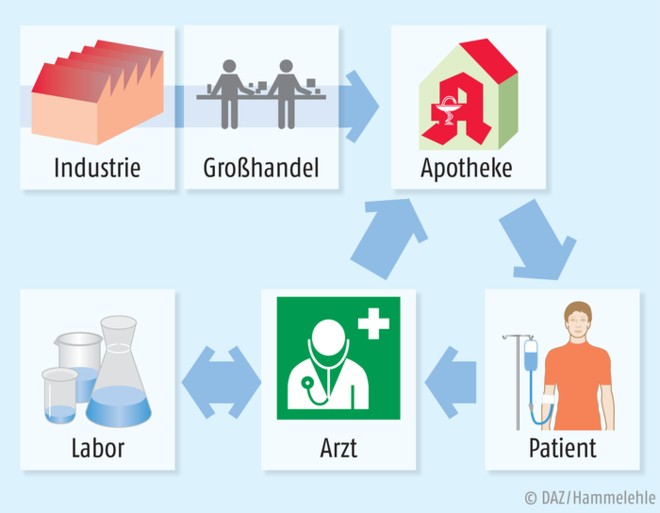
Apotheker sind seit jeher für die zum Teil aufwendige Beschaffung von Arzneimitteln zuständig – ein Aspekt, der in den letzten Jahrzehnten durch das Netz der pharmazeutischen Großhandlungen eher in den Hintergrund geraten ist. Biotech-Firmen sind jedoch global aufgestellt, produzieren an einem Ort und liefern bevorzugt an den Verbraucher direkt. Die logistische Leistung kommt also zurück zum Verwender. Auch gehen immer mehr pharmazeutische Hersteller dazu über, die Krankenkassen nur zu belasten, wenn der zugesicherte Heilerfolg auch eintritt – eine Folge der immens teuren individuellen Therapeutika. Optimale Kontrolle aller mit der Herstellung und Applikation verbundenen Tätigkeiten liegen also im Interesse der Hersteller und der Krankenkassen. Ein Apotheker kann hier viel mehr leisten und weit mehr garantieren als eine Sprechstundenhilfe.
So bleiben die Gegenargumente der Ärzte, wie: „Ein anaphylaktischer Schock nach invasiver Applikation könnte unmittelbares ärztliches Eingreifen hervorrufen.“ Sieht man mal davon ab, dass diese sehr selten sind und eine Apotheke meistens in der Nähe von einem Arzt zu finden ist, wären beide Aspekte auch organisatorisch leicht lösbar. So könnte die Erstapplikation eines Biologikums beim Arzt erfolgen. Und die weiteren Applikationen durch einen Apotheker könnten zu festen Zeitpunkten und in Absprache mit einem Arzt in der Nähe geplant werden (zum Beispiel: jeden Werktag zwischen 8 und 10 Uhr). Die Patienten werden das ärztliche Wartezimmer sicher nicht vermissen.
Sollten darüber hinaus regelmäßige Kontrollen zur Dosierung notwendig werden, könnten dies auch die Apotheker besser begleiten, vor allem dann, wenn die Daten eines Patienten bald nicht mehr auf Karteikarten archiviert werden. Gleiches gilt für den Kontakt zu den Herstellern und die Patientenberatung zur Dosierung und Dauer. Auch die genetische Disposition könnte durch naturwissenschaftlich ausgebildete Apotheker leichter interpretiert werden als durch Ärzte.
Zusammenfassung
Die Tablette ist die wesentliche Basis des heutigen Distributionsmodells „Apotheke“. Doch Tabletten werden als Therapeutikum weiter an Einfluss verlieren. Biotechnologische Präparate gewinnen derweil an Marktanteil und fordern andere Distributionswege zum Patient. Amazon & Co. werden bei Biologika nicht erfolgreich tätig sein können.
Ärzte werden weiterhin Diagnosen stellen und die Therapien festlegen. Apotheker stellen das Arzneimittel bereit und beraten die Patienten zur Applikation. Die Apothekerausbildung muss um die invasiven Applikationen und um Blutentnahme ergänzt werden. Damit steht der Apotheker dann wieder an relevanter Stelle im Gesundheitswesen.
Versandhandel und seit Kurzem auch ärztliche Fernbehandlung trennen die medizinische Fachkompetenz vom Patienten ab. Beides scheint aktuell unvermeidlich – und von der deutschen Ärzteschaft gewollt und unterstützt [27]. Bei invasiv zu applizierenden Biologika unterstützt diese Abwendung vom Patienten aber die Rückkehr zur Trennung von Verordnung und Abgabe der Arzneimittel. Zurück also zum Modell von Arzt und Apotheker, wie es seit Jahrhunderten gelebt wurde und wie es als zentrale Säule des Apothekenwesens verstanden wird. Apotheker sind der letzte Kontakt zum Patienten vor der Anwendung des Arzneimittels und nicht der Postbote oder der verschreibende Arzt. |
Literatur
[1] Heuer L: Meilenstein der pharmazeutischen Industrie, DtschApothZtg 2018;158(11):1102-1108; https://www.deutsche-apotheker-zeitung.de/daz-az/2018/daz-11-2018/meilenstein-der-pharmazeutischen-industrie
[2] EbM-Netzwerk Homepage: Vision und Mission; https://www.ebm-netzwerk.de/wer-wir-sind/satzung
[3] Wicha S: Hype oder Hoffnung, DtschApothZtg 2018;158(18):1816-1820; https://www.deutsche-apotheker-zeitung.de/daz-az/2018/daz-18-2018/hype-oder-hoffnung
[4] Wikipedia Eintrag „Apotheker“; https://de.wikipedia.org/wiki/Apotheker
[5] Heuer, H, Heuer L: „Rot mischt sich mit „weiß“ und „grün“, DtschApothZtg 2011;151(28):3301-3302; https://www.deutsche-apotheker-zeitung.de/daz-az/2011/daz-28-2011/rot-mischt-sich-mit-weiss-und-gruen
[6] Biotechlercenter Homepage: Herstellung von Medikamenten 3. Vorteile von Biopharmazeutika; http://biotechlerncenter.interpharma.ch/arzneimittelproduktion/2241-vorteile-von-biopharmazeutika
[7] Blasius, H: Besondere Arzneimittelgruppen, 2. Teil: Biologische Arzneimittel, DtschApothZtg 2015;155(16):1534-1539; https://www.deutsche-apotheker-zeitung.de/daz-az/2015/daz-16-2015/besondere-arzneimittelgruppen
[8] Coch, C: Besonderheiten bei Biologischen und Immunologischen Arzneimitteln in der (Prä-)klinischen Prüfung, Ringvorlesung Klinische Prüfungen von Arzneimitteln Wintersemester 2016/2017, Universitätsklinikum Bonn; https://www.bfarm.de/SharedDocs/Downloads/DE/Service/Termine-und-Veranstaltungen/ringvorlesungen/2016_Winter/Coch3101.pdf?__blob=publicationFile&v=3
[9] transparenz Gentechnik Stand vom 2018.03-15: Arzneimittel: Ohne Gentechnik kaum noch vorstellbar; http://www.transgen.de/aktuell/2579.arzneimittel-wirkstoff-gentechnik.html
[11] Meldung der Frankfurter Allgemeine Zeitung: Grüne wollen neues Grundsatzprogramm, 16. April 2018
[12] Bundesministerium der Justiz und für Verbraucherschutz: Gesetz für den Verkehr mit Arzneimitteln; https://www.gesetze-im-internet.de/amg_1976/__1.html
[13] Europäische Union: REACh-Verordnung: Artikel 5a der 1907/2006 „REACh-Verordnung“ http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2006R1907:20121009:DE:PDF
[14] Wikipedia Beitrag „Spurenstoffe“; https://de.wikipedia.org/wiki/Spurenstoff
[15] Youtube Film 4. Stufe für Kläranlagen; https://www.youtube.com/watch?v=8meXqkutw3w
[16] Jungmayr R: Haarwuchs mit Folgen, DtschApothZtg 2018;158(16):1580-1582; https://www.deutsche-apotheker-zeitung.de/daz-az/2018/daz-16-2018/haarwuchs-mit-folgen sowie Heuer, Heike https://www.uni-due.de/zmb/members/heuer/overview.php [Namenvetter der Autorin, nicht verwandt]
[17] Maier L et al.: Extensive impact of non-antibiotic drugs on human gut bacteria, Nature (2018) 555, 623; https://www.nature.com/articles/nature25979
[18] Marchant J: When antibiotics turn toxic, Nature 555 (2018) https://www.nature.com/articles/d41586-018-03267-5
[19] Heuer, H: Arzneistoffe und das Mikrobiom, DtschApothZtg 2016;156(45):4500-4506; https://www.deutsche-apotheker-zeitung.de/daz-az/2016/daz-45-2016/arzneistoffe-und-das-mikrobiom
[20] Touraud E, Roig B, Sumpter JP, Coetsier C.: Drug residues and endocrine disruptors in drinking water: risk for humans? Int J Hyg Environ Health. 2011 Nov;214 (6):437-41. doi: 10.1016/j.ijheh.2011.06.003. Epub 2011 Aug 31. https://www.ncbi.nlm.nih.gov/pubmed/21885334
[21] Paul, K. B., J. M. Hedge, M. J. Devito, and K. M. Crofton. Triclosan and endocrine disruption: evidence for alterations in thyroid hormone homeostasis. Presented at SETAC, Milwaukee, WI, November 11 - 15, 2007. https://cfpub.epa.gov/si/si_public_record_Report.cfm?dirEntryID=175343
[22] Hatt, H: Homepage Professor Dr. Dr. Dr. med. Hatt; http://www.cphys.ruhr-uni-bochum.de/
[23] Wikipedia Artikel „Sekundäre Pflanzenstoffe“; https://de.wikipedia.org/wiki/Sekund%C3%A4re_Pflanzenstoffe
[24] Schepers, U, Beckers J; Blickwinkel – Sind Tierversuche unverzichtbar? Beitrag auf der Homepage der Helmholtz Gesellschaft 19.03.2018: https://www.helmholtz.de/gesundheit/sind-tierversuche-unverzichtbar/
[25] Ledford H: Cancer researchers push to relax rules for clinical trials, Nature 556, S. 12-13, (2018) https://www.nature.com/articles/d41586-018-03355-6 und Promising cancer drug hits snags, Nature 556, S. 161, 2018
[26] Bundesgerichtshof (BGH) 24. Juni 1975 – Aktenzeichen VI ZR 72/74; https://dejure.org/dienste/vernetzung/rechtsprechung?Gericht=BGH&Datum=24.06.1975&Aktenzeichen=VI%20ZR%2072/74
[27] Rohrer, B: Ärzte kippen Fernbehandlungsverbot, DAZ.online-News vom 20. April 2018; https://www.deutsche-apotheker-zeitung.de/news/artikel/2018/04/20/aerzte-beschliessen-fernbehandlungsverbot
Alle Links wurden zuletzt am 6. Juni 2018 besucht.
Autorin
Heike Heuer, Apothekerin, studierte Pharmazie an der Technischen Universität Braunschweig. Sie schreibt gelegentlich Beiträge für die DAZ, insbesondere zum Thema Lebende Arzneimittel und Mikrobiom.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.