
- DAZ.online
- DAZ / AZ
- DAZ 21/2018
- High-Tech-Anbau von ...
Pflanzenanbau
High-Tech-Anbau von Cannabis
Gesteuerte Wachstumsbedingungen sichern gleichmäßige Blütenqualität
Seit dem 10. März 2017 ist in Deutschland das Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften in Kraft, welches den Einsatz von Medizinalcannabis in Form von Blüten oder Extrakten regelt.
Derzeit werden Cannabisblüten aus den Niederlanden und Kanada importiert. In Zukunft soll der Bedarf zusätzlich durch in Deutschland angebautes Cannabis gedeckt werden. Zu diesem Zweck hat das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) die sogenannte Cannabisagentur eingerichtet, welche den Anbau von Cannabis zu medizinischen Zwecken in Deutschland steuern und kontrollieren wird. Neben dem Anbau wird die Cannabisagentur die Ernte, Verarbeitung, Qualitätsprüfung, Lagerung, Verpackung sowie die Abgabe von in Deutschland erzeugten Cannabisblüten an Großhändler und Apotheker oder Hersteller kontrollieren. Diese Aufgaben werden von Unternehmen, die in einem Ausschreibungsverfahren ausgewählt und von der Cannabisagentur beauftragt werden, ausgeführt. Das BfArM hatte im April 2017 eine Ausschreibung über den Anbau veröffentlicht, die jedoch durch einen Beschluss des Oberlandesgerichts Düsseldorf vom 28.03.2018 gestoppt wurde. Die vom BfArM angestrebte Versorgung mit in Deutschland angebautem Cannabis ab 2019 wird sich nun durch eine voraussichtliche Neuausschreibung verzögern.
In der ursprünglichen Ausschreibung forderte das BfArM, dass der Anbau in einer geschlossenen Produktionsanlage stattfinden soll. Diese müsste den hohen Sicherungsanforderungen der Bundesopiumstelle genügen [1 – 3].
Viele Arzneidrogen stammen aus Wildsammlungen. Einige Hersteller pflanzlicher Arzneimittel bevorzugen jedoch Drogen aus dem Anbau, da durch Sortenwahl und andere pflanzenbauliche Maßnahmen qualitativ hochwertigere Drogen gewonnen werden können. Bei der wiederentdeckten Arzneipflanze Cannabis ist das anders. Medizinalcannabis stammt derzeit überwiegend aus dem Anbau in geschlossenen Produktionssystemen und ist vermutlich die einzige Arzneipflanze, die so im industriellen Maßstab kultiviert wird. Zur Einhaltung der pharmazeutischen Qualität und der von der Cannabisagentur ursprünglich geforderten Spezifikationen für Cannabisblüten als pflanzliches Arzneimittel eignet sich aber auch der Anbau in hochtechnisierten Gewächshäusern.
Botanik und Inhaltsstoffe von Cannabis
Die Pflanzengattung Cannabis (Hanf) gehört, wie Hopfen (Humulus), zur Familie der Cannabaceae (Hanfgewächse) [4]. Es wird schon lange darüber diskutiert, ob die Gattung Cannabis nur aus der Art Cannabis sativa L. oder aus mehreren Arten, darunter C. indica Lam. und C. ruderalis Jan., besteht [5, 6]. Botanische Fachgesellschaften führen Cannabis sativa L. in ihrer taxonomischen Datenbank „The Plant List“ als monotypische Art [7]. In der DAB-Monografie „Cannabisblüten“ wird Cannabis sativa L. als Stammpflanze genannt.
Cannabis ist eine einjährige Pflanze. Die meisten Cannabis-Genotypen sind Kurztagpflanzen und beginnen im Sommer zu blühen, wenn die Tage kürzer werden. Dieses Phänomen wird im Medizinalcannabisanbau genutzt, um den Lebenszyklus und somit die Kulturdauer der Pflanzen zu steuern [8, 9]. Die medizinisch genutzten Cannabissorten sind diözisch (zweihäusig), d. h. die Blüten sind entweder männlich oder weiblich und werden auf unterschiedlichen Pflanzen gebildet [9]. Es gibt auch monözische (einhäusige) Cannabissorten, die jedoch für den Anbau von Nutzhanf verwendet werden. Die weiblichen Blüten stehen in dicht gedrängten Blütenständen (Abb. 1).
Cannabis ist eine allogame Pflanze (Fremdbefruchter), d. h. der Pollen wird von einer männlichen auf eine weibliche Blüte übertragen. Die Bestäubung geschieht bei Hanf hauptsächlich durch den Wind. Dies hat weitreichende Konsequenzen für den Anbau und die Vermehrung von medizinischem Cannabis (s. u.).
Cannabis synthetisiert charakteristische terpenophenolische Verbindungen, sogenannte Cannabinoide, von denen über 100 bekannt sind [10]. Die meisten sind pharmakologisch inaktive Cannabinoidcarbonsäuren (z. B. Δ9 -Tetrahydrocannabinolsäure, THCA). Erst durch Trocknung, Lagerung oder Erhitzung des Pflanzenmaterials werden die Cannabinoidcarbonsäuren teilweise oder komplett decarboxyliert, wobei aktive Verbindungen entstehen; z. B. wird THCA zu Δ9‑Tetrahydrocannabinol (THC) umgewandelt, das neben Cannabidiol (CBD) der Hauptwirkstoff von getrockneten Cannabisblüten ist. Die Cannabinoide werden in Drüsenhaaren, den sogenannten Trichomen, synthetisiert und zusammen mit anderen Stoffen als Harz ausgeschieden (Abb. 2). Trichome werden in einer für die medizinische Nutzung relevanten Dichte lediglich auf den Blüten weiblicher Cannabispflanzen gebildet. Cannabinoide können bis etwa 30% der Trockenmasse weiblicher Cannabisblüten ausmachen [11]. Blätter weiblicher Pflanzen und die männlichen Pflanzen weisen hingegen nur eine geringe Harzproduktion auf [8].
Cannabis bildet neben Cannabinoiden noch ein ätherisches Öl, welches zahlreiche Terpene, hauptsächlich Mono- und Sesquiterpene, enthält. Einige dieser Terpene sind pharmakologisch wirksam, und es wird vermutet, dass sie zusammen mit den Cannabinoiden die Wirkung von Cannabis modulieren [12, 13].
Cannabis-Chemotypen
Der Gehalt an Cannabinoiden im getrockneten Pflanzenmaterial unterscheidet sich quantitativ und qualitativ. Der Gesamtgehalt wird durch mehrere Gene reguliert und stark durch die Umwelt beeinflusst. Dagegen wird die Zusammensetzung der Cannabinoidfraktion vererbt. Generell werden drei chemische Phänotypen (Chemotypen) unterschieden, die sich hinsichtlich ihres THC / CBD-Verhältnisses unterscheiden (Tab. 1) [14 – 16].
Chemo-typ |
THC- und CBD-Gehalte |
THC / CBD-Verhältnis |
|---|---|---|
I |
hoher THC- und niedriger CBD-Gehalt |
> 1 |
II |
THC- und CBD-Gehalte etwa gleich hoch |
≈ 1 |
III |
niedriger THC- und hoher CBD-Gehalt |
< 1 |
Pflanzen des intermediären Chemotyps II entstehen durch Kreuzung von Pflanzen des Chemotyps I mit Pflanzen des Chemotyps III. Die Kreuzung der intermediären F1-Generation untereinander führt zu einer Mendel’schen Spaltung in der F2-Generation [15]. Aus diesem Grund ist für den Anbau von standardisiertem Medizinalcannabis der Einsatz von stabilem pflanzengenetischem Ausgangsmaterial essenziell. Innerhalb dieser drei Chemotypen gibt es verschiedene Cannabis-Varietäten mit unterschiedlichen THC- und CBD-Gehalten. Zudem gibt es Chemotypen, die durch andere Cannabinoide definiert sind, sie sind aber momentan eher zu Forschungszwecken relevant.
Standardisierte und qualitätsgesicherte Cannabisblüten
Grundlegend für die Produktion von Arzneimitteln mit einheitlicher pharmazeutischer Qualität sind Standardisierungsmaßnahmen auf allen Stufen der Herstellung, um einen definierten Standard zu erreichen, der durch Monografien der Arzneibücher oder andere offizielle Sammlungen (z. B. des DAC) und betriebsinterne Spezifikationen vorgegeben wird [17]. Im Fall von Cannabisblüten sind vor allem die DAB-Monografie „Cannabisblüten“ und die allgemeine Monografie „Pflanzliche Drogen“ des Europäischen Arzneibuchs (Ph. Eur. 9.0/1433) maßgebend.
Gemäß Definition der DAB-Monografie sollen Cannabisblüten mindestens 90,0 und höchstens 110,0 Prozent der in der Beschriftung angegebenen Mengen an Cannabinoiden, wie THC- und CBD-Äquivalenten, enthalten [18]. D. h. innerhalb einer Charge wird eine Schwankungsbreite von ±10% toleriert, um eine korrekte Dosierung zu ermöglichen. Für Cannabisblüten gelten also vergleichbare Kriterien wie für eingestellte Extrakte, die gemäß Europäischem Arzneibuch im Allgemeinen akzeptable Toleranzen in einem Bereich von ±5 bis ±10% aufweisen (Ph. Eur. 9.0/0765).
Die Hauptinhaltsstoffe THC und CBD werden nicht auf einen Mindest- oder Maximalgehalt begrenzt. Diese Definition ist auf der einen Seite begrüßenswert, da eine hohe Therapievielfalt ermöglicht wird. Die genetische Diversität von Cannabis ist sehr groß, und es gibt eine Vielzahl von Sorten mit verschiedenen Cannabinoidgehalten und -zusammensetzungen. Auf der anderen Seite können die Cannabinoidgehalte eines Produktes von Charge zu Charge erheblich schwanken, wenn keine Gehaltsbereiche in den betriebsinternen Produktspezifikationen definiert worden sind.
Die richtige Dosierung von Cannabisblüten ist trotzdem sehr simpel, da der Cannabinoidgehalt der Droge jeweils auf der Beschriftung angegeben wird. Die anzuwendende Dosis ergibt sich aus dem Cannabinoidgehalt und kann mit einem Dreisatz berechnet werden.
Damit die in der Bundesrepublik hergestellten Cannabisblüten keine starken Schwankungen im Cannabinoidgehalt von Charge zu Charge aufweisen, hatte die Cannabisagentur die Produktion von drei verschiedenen Cannabis-Typen mit unterschiedlich definierten THC- und CBD-Gehaltsbereichen ausgeschrieben [1, 19]. Der Cannabinoid-Gehalt dieser drei Cannabis-Typen wurde durch das BfArM auf einen Gehaltsbereich, der maximal 4% THC bzw. CBD umfasst, begrenzt (Tab. 2).
Typ |
THC-Gehalt |
CBD-Gehalt |
|---|---|---|
Typ 1 |
18 – 22% |
< 1% |
Typ 2 |
12 – 16% |
< 1% |
Typ 3 |
5 – 9% |
5 – 9% |
Einen Gehaltsbereich, der absolut 4% Cannabinoide umfasst, scheint sinnvoll zu sein, denn eine starre relative Schwankungsbreite von beispielsweise ±10% um den mittleren Cannabinoidgehalt würde einen viel zu engen Gehaltsbereich für Cannabissorten mit niedrigen Cannabinoidgehalten bedeuten (z. B. 7% THC ±10%, d. h. 6,3 – 7,7% THC). Konsistente Chargen solcher Sorten zu produzieren, wäre schwer bis unmöglich und würde daher die Produktion von Cannabisblüten mit höheren Cannabinoidgehalten favorisieren.
In der Rahmenmonografie „Pflanzliche Drogen“ (Ph. Eur.) sind allgemeine Anforderungen definiert, die eine Droge erfüllen muss, wenn keine Abweichungen in den Einzelmonografien dargelegt sind. Besonders wichtig in diesem Zusammenhang sind die Anforderungen an die Reinheit (u. a. Fremdbestandteile, Feuchtigkeit, Pestizidrückstände, Schwermetalle, Mykotoxine und mikrobielle Verunreinigung) [20].
Wird die Droge als pflanzliches Arzneimittel verwendet, ist die Standardisierung auf der Ebene des Anbaus von besonderer Bedeutung. Die GACP-Richtlinie (Good Agricultural and Collection Practice for Starting Material of Herbal Origin) der EU sieht vor, dass ein adäquates Qualitätssicherungssystem für Anbau, Wildsammlung, Ernte und Primärverarbeitung von Arzneipflanzen implementiert wird. Ein solches System beinhaltet u. a. Angaben zum pflanzengenetischen Ausgangsmaterial, zur Düngung und Bewässerung, zu Kultivierungstechniken und Pflanzenschutzmaßnahmen und zur Ernte und Primärverarbeitung, inklusive der Trocknung [21]. Für Weiterverarbeitungsschritte gelten zusätzlich die GMP-Richtlinien. Anhang 7 zum EU-GMP-Leitfaden regelt den Übergang von GACP zu GMP.
Cannabisanbau
Grundsätzlich können drei verschiedene Anbausysteme für medizinisches Cannabis unterschieden werden: Der Feldanbau (Outdoor-Anbau), der Gewächshausanbau und der Anbau in geschlossenen Räumen unter künstlicher Beleuchtung und klimakontrollierten Bedingungen (Indoor-Anbau). Ein wichtiges Ziel beim Arzneipflanzenanbau ist es, neben hohen Erträgen, einheitliche Pflanzen mit entsprechender pharmazeutischer Qualität zu generieren. So wie bei allen biologischen Systemen hängen die Merkmalsausprägung (Phänotyp) und somit die Qualitätseigenschaften von Arzneipflanzen von der Interaktion zwischen den beiden Faktoren Genotyp und Umwelt ab. Nach der Ernte nehmen Trocknung, Weiterverarbeitung und Lagerungsbedingungen Einfluss auf die Drogenqualität. Wesentliche Umweltfaktoren, die das Pflanzenwachstum beeinflussen, sind: Lichtquantität, Lichtqualität, Beleuchtungsdauer (Photoperiode), Wasser- und Nährstoffangebot, CO2 -Konzentration der Luft, Temperatur und Luftfeuchtigkeit. Auf den Faktor Genotyp kann durch Auswahl von geeignetem pflanzengenetischem Ausgangsmaterial Einfluss genommen werden.
Pflanzengenetisches Ausgangsmaterial und Vermehrung
Saatgut von genetisch stabilen Medizinalcannabissorten ist kommerziell derzeit schwer erhältlich. In den meisten Fällen werden für die Kultur von medizinischem Cannabis Pflanzenstecklinge, auch Klone genannt, verwendet. Die vegetative (asexuelle) Vermehrung der Pflanzen bringt genetisch identische Nachkommen hervor, die unter gleichen Kulturbedingungen einheitliche Pflanzen mit vergleichbaren Inhaltsstoffmustern und mit gleichem Geschlecht erzeugen. Letzteres ist von großem Vorteil, da nur weibliche Pflanzen ausreichende Mengen an Cannabinoiden produzieren. Die Anwesenheit männlicher Pflanzen würde nicht nur kostbare Anbaufläche belegen, sondern auch eine unerwünschte Bestäubung und Samenbildung zur Folge haben. Unbefruchtete Pflanzen bilden in der Hoffnung, sich fortpflanzen zu können, bis zur Seneszenz kontinuierlich Blüten, die obendrein reicher an Cannabinoiden sind. Medizinalcannabisblüten werden wegen diesen Produktivitätsvorteilen fast ausschließlich als sogenanntes Sinsemilla (spanisch: samenlos) hergestellt.
Die für die vegetative Vermehrung verwendeten Stecklinge werden von weiblichen Mutterpflanzen gewonnen. Da Cannabis eine Kurztagpflanze ist, werden Mutterpflanzen unter Langtagbedingungen (18 Stunden Licht oder länger) kultiviert, um die Blühinduktion zu hemmen. Stecklinge können fortlaufend entnommen, bewurzelt und unter Langtagbedingungen kultiviert werden, um unbegrenzt ältere Mutterpflanzen zu ersetzen. Wenn Mutterpflanzen frei von Viren und anderen Pathogenen bleiben, findet selbst nach mehreren Vermehrungszyklen kein Vitalitätsverlust statt. Hintereinander vermehrte Klone wurden so schon über 20 Jahre erhalten [11].
Eine weitere Technik, Pflanzen klonal zu vermehren und zu erhalten, ist die sterile In-vitro-Kultur. Mittels Gewebekulturtechniken wird Pflanzenmaterial präpariert und in sterilem Nähragarmedium kultiviert (Abb. 3). Aus Achselknospen oder Meristemen lassen sich durch geeignete Medien genetisch identische Pflanzen regenerieren. Durch Meristemkulturen kann man sogar Pflanzen herstellen, die frei von phytopathogenen Viren, Bakterien und Pilzen sind. Ein weiterer Vorteil der In-vitro-Vermehrung ist der geringe Platzbedarf. Neben der Vermehrung von pathogenfreiem Pflanzenmaterial kann die In-vitro-Kultur auch für den Erhalt genetischer Ressourcen in Genbanken nützlich sein [22].
Feldanbau (Outdoor-Anbau)
Cannabis ist eine lichtliebende Pflanze, die vom Frühjahr bis in den Herbst hinein wächst. Wenn im Sommer die Tage wieder kürzer werden, beginnt die Blüte. In den nördlichen Hemisphären sind die Blüten, je nach Sorte, zwischen August und November erntereif. Um Pilzbefall in den kalten und feuchten Tagen hiesiger Breiten zu vermeiden, eignen sich frühreifende Sorten mit weniger dichtgedrängten Blütenständen und anderen Resistenzmechanismen. Der Feldanbau erlaubt durch den natürlichen Lebenszyklus der Cannabispflanze eine Ernte im Jahr.
Die Vermeidung von Bestäubung und Samenbildung auf dem Feld stellt eine Herausforderung dar. Die Kultivierung von weiblichen Pflanzen aus klonaler Vermehrung oder, wenn verfügbar, aus feminisiertem Saatgut erspart das Entfernen männlicher Pflanzen. Die Wahrscheinlichkeit einer Befruchtung durch Pollenflug kann durch entsprechende Entfernung zu Industriehanffeldern reduziert, aber nicht ausgeschlossen werden [23].
Obwohl der Anbau von Arzneipflanzen gegenüber der Wildsammlung eine erhebliche Steigerung der Standardisierung darstellt, unterliegen Pflanzen auf dem Feld den klimatischen Bedingungen des Anbaugebiets, die von Jahr zu Jahr variieren.
Umweltparameter, die auf dem Feld beeinflusst werden können, sind Wasserangebot, Bodenbedingungen und Nährstoffverfügbarkeit: das Wasserangebot durch Bewässerung und Drainage, die Bodeneigenschaften und Nährstoffverfügbarkeit durch Bodenbearbeitung, Fruchtfolge und Düngung. Auf die Photoperiode, Lichtquantität und -qualität sowie auf Temperatur und Luftfeuchtigkeit kann auf offenem Feld kaum Einfluss genommen werden. Die Photoperiode hängt vom Breitengrad des Standorts und der Jahreszeit ab. Die Lichtintensität zeigt einen tages- und jahreszeitlichen Verlauf und kann von Tag zu Tag und von Jahr zu Jahr stark variieren. Auch die Lichtqualität, also die spektrale Zusammensetzung des Sonnenlichts, variiert stark und lässt sich nicht steuern. Sie wird von Faktoren wie Wolken und anderen Faktoren in der Atmosphäre sowie von der Tages- und Jahreszeit beeinflusst. Auf einem offenen Feld betreiben Pflanzen einen freien Gasaustausch mit der Atmosphäre. Ihre CO2 -Konzentration beträgt konstant ca. 400 ppm.
Ob sich der Feldanbau eignet, um Cannabisblüten herzustellen, die von Charge zu Charge Cannabinoide in einem sehr engen Gehaltsbereich bilden, wurde wissenschaftlich noch nicht ausreichend untersucht. Wird das Pflanzenmaterial jedoch zur Isolierung von Reinsubstanzen wie CBD und Dronabinol verwendet oder zu Zubereitungen wie Extrakten weiterverarbeitet, ist der Anbau von Arzneipflanzen auf dem Feld, besonders aus wirtschaftlichen Gründen, eine interessante Option.
Gewächshausanbau
Im Gewächshaus können mehr Umweltfaktoren kontrolliert und die Anbaubedingungen somit besser standardisiert werden als auf dem Feld. Die wichtigsten Parameter, die im Gewächshaus zusätzlich gesteuert werden können, sind Photoperiode, Lichtintensität und Temperatur.
Die Möglichkeit, die Photoperiode im Gewächshaus mit Zusatzbeleuchtung zu verlängern oder mit einer Verdunkelungsanlage zu verkürzen, ermöglicht die Steuerung der Entwicklung der Cannabispflanzen. In (semi-)kontrollierten Umgebungen werden häufig vier Entwicklungsphasen unterschieden: Das vegetative Wachstum von Mutterpflanzen, die Bewurzelung von Klonen, das vegetative Wachstum von Jungpflanzen und die Blütephase. Für die ersten drei genannten Entwicklungsphasen ist die Verlängerung der Photoperiode in den dunklen Jahreszeiten essenziell, um die Cannabispflanzen im vegetativen Stadium zu halten und um das Wachstum zu fördern. Die Verkürzung der Hell-Phase auf 12 Stunden mittels Verdunkelung ermöglicht die Induktion der Blüte auch im Sommer. Durch räumliche Trennung von vegetativ wachsenden und blühenden Pflanzen in Produktionsbereiche mit unterschiedlichen Tageslängen können somit, je nach Sorte, drei bis sieben (bei den meisten Sorten 4 – 5) Ernten pro Jahr und Fläche im Blütenbereich eingefahren werden [11, 23].
Die Lichtintensität lässt sich im Gewächshaus auch in beide Richtungen steuern. Im Winter ergänzt die Zusatzbeleuchtung die mangelnde photosynthetische Photonenflussdichte. Ist die Sonneneinstrahlung im Sommer zu hoch, kann die Lichtintensität im Gewächshaus durch Schattierung mit Schirmen reduziert werden.
Durch den Treibhauseffekt und Beheizung im Winter kann im Glashaus den kalten Temperaturen entgegengewirkt werden. Wird es im Gewächshaus zu heiß, wird in der Regel durch Öffnen der Fenster und Austausch der wärmeren Gewächshausluft mit der kühleren Außenluft gekühlt. Eine genaue Temperaturreglung ist in einem solchen Gewächshaus nicht möglich. Einige moderne, hochtechnisierte Gewächshäuser sind jedoch vollklimatisiert. Am Tag kann durch die photosynthetische Aktivität der Pflanzen die Luft im Gewächshaus schnell an CO2 verarmen. Um Ertragseinbußen durch CO2 -Mangel zu verhindern, wird die Luft regelmäßig ausgetauscht, oder es wird CO2 zugesetzt. Eine solche CO2 -Düngung wird im Cannabisanbau oft betrieben.
Durch die Verwendung von qualitätsgesicherten Kultursubstraten mit einheitlicher Wasserhalte- und Ionenaustauschkapazität und von qualifiziertem Wasser und Nährstoffen werden die Anbaubedingungen extrem standardisiert. Zudem kann eine Akkumulation von Schwermetallen in der Droge praktisch ausgeschlossen werden. Die Bewässerung und Düngung mit definierten Nährlösungen, die für die einzelnen Entwicklungsstadien angepasst sind, gewährleistet eine standardisierte und bedarfsgerechte Pflanzenernährung.
In einem Gewächshaus lassen sich also sämtliche Umweltfaktoren wie Lichtquantität, Beleuchtungsdauer, Wasser, Nährstoffe und CO2 -Gehalt der Luft reproduzierbar einstellen. Bei hochtechnisierten Gewächshäusern kommen präzise Temperatur- und Luftfeuchtigkeitsregelungen hinzu.
Der Anbau von medizinischem Cannabis in Gewächshäusern ist bestens geeignet, um standardisiertes Ausgangsmaterial für die Herstellung von normierten pflanzlichen Zubereitungen, wie Extrakten, zu erzeugen. GW Pharmaceuticals kultiviert ihr Cannabis für die Herstellung des Cannabisextrakts Sativex® in Gewächshäusern. Auch wenn dem Autor keine Studien bekannt sind, ist es durchaus denkbar, dass es mit modernen, hochtechnisierten und vollklimatisierten Gewächshäusern möglich ist, Cannabisblüten zu kultivieren, die von Charge zu Charge Cannabinoide in einem engen Gehaltsbereich bilden.
Indoor-Anbau
Unter Indoor-Anbau von medizinischem Cannabis versteht man die Kultur in geschlossenen Räumen unter künstlicher Beleuchtung und klimakontrollierten Bedingungen. Das Foto auf Seite 36 zeigt blühende Cannabispflanzen in einem Pflanzenkulturraum des kanadischen Herstellers Aurora Cannabis Inc. Während im Gewächshausanbau eine Mischung aus Kunst- und Sonnenlicht angewendet wird, wird in klimakontrollierten Pflanzenkulturräumen reines Kunstlicht verwendet. Dadurch lässt sich die spektrale Zusammensetzung des Lichtes definieren und reproduzieren. Diese Standardisierungsmaßnahme ist nicht unbedeutend, denn die Synthese vieler Sekundärmetaboliten wird durch die Lichtqualität beeinflusst [24]. So stimuliert und beeinflusst beispielsweise UV-Strahlung die Akkumulation von THC in Cannabis [25].
In Pflanzenkulturräumen lassen sich auch Temperatur und Luftfeuchtigkeit mittels Klimatechnik das ganze Jahr über, nach Wunsch, reproduzierbar kontrollieren. Die Kontrolle dieser beiden Parameter stellt eine wichtige Maßnahme zur Minimierung der Gefahr von Schimmelbefall dar. Wie im Gewächshaus muss auch in einer Indoor-Produktionsanlage eine optimale CO2 -Versorgung durch regelmäßigen Luftaustausch bzw. CO2 -Zufuhr gewährleistet sein. Ebenso können die Bewässerung und Ernährung der Pflanzen mit definierten Nährlösungen und geeigneten Kultursubstraten optimal standardisiert werden.
In geschlossenen Produktionsanlagen wachsen die Pflanzen in der Regel in unterschiedlichen Pflanzenkulturräumen mit den jeweils optimalen Wachstumsbedingungen für das entsprechende Entwicklungsstadium. So können auch indoor, je nach Sorte, drei bis sieben Ernten (i.d.R. 4 – 5) pro Jahr gefahren werden.
Ein weiterer Vorteil von geschlossenen Produktionsanlagen ist, dass durch Schleusensysteme und ein entsprechendes Qualitätssicherungssystem sehr hohe Hygienestandards eingehalten werden können. Dadurch können das Risiko von Kontamination und die Ausbreitung von Pflanzenschädlingen und -krankheiten erheblich verringert und der Einsatz von Pflanzenschutzmitteln auf ein Minimum reduziert werden oder sogar ganz entfallen.
Durch die Möglichkeit, sämtliche Umweltfaktoren in klimakontrollierten Pflanzenkulturräumen zu messen und zu steuern, lassen sich die Anbaubedingungen komplett unabhängig vom Klima des Standortes kontrollieren. Mit dem gleichen genetischen Pflanzenmaterial und den gleichen Kultur- und Verarbeitungsverfahren können somit einheitliche Pflanzen mit einheitlichem phytochemischem Profil kultiviert werden. Der Anbau von Cannabis in geschlossenen Produktionsanlagen ist bestens geeignet, um standardisierte Cannabisblüten herzustellen, die von Charge zu Charge gleichbleibende Qualitäten aufweisen [26].
Ernte- und Nachernteverfahren
Zur Herstellung von standardisierten Cannabisblüten sind neben stabilem pflanzengenetischem Material und standardisierten Kulturverfahren ebenfalls standardisierte Ernte- und Nachernteverfahren notwendig. Nach der Blüteninduktion wachsen und reifen die Cannabisblüten, je nach Sorte, in etwa sieben bis 14 Wochen [11]. Die Festlegung des richtigen Erntezeitpunkts ist sehr wichtig. Wird zu früh geerntet, kann die Cannabinoidsynthese nicht vollständig abgeschlossen werden und niedrigere Cannabinoidgehalte sind die Folge. Wird zu spät geerntet, werden Cannabinoide wieder abgebaut und unerwünschte Abbauprodukte, wie Cannabinol (CBN), können akkumulieren.
Bei der Ernte werden der gesamte Spross, einzelne Triebe oder einzelne Blütenstände von der Pflanze entfernt. Die geernteten Pflanzenteile werden dann entweder zuerst getrocknet und anschließend getrimmt oder umgekehrt. Beim Trimmen, auch als Maniküre bezeichnet, werden die Sprossteile in Blütenstände geeigneter Größe unterteilt und die Tragblätter entfernt oder eingekürzt [23, 27]. Dieser Prozess hat großen Einfluss auf die Qualität der Droge, da Blätter, Tragblätter und Stängel einen niedrigeren Cannabinoidgehalt als Blütenblätter haben. Die Vereinheitlichung dieses Vorganges ist essenziell für die Gewinnung von Cannabisblüten mit gleichbleibenden Cannabinoidgehalten.
Um mikrobielles Wachstum auf der Droge und den Abbau von qualitätsbestimmenden Inhaltsstoffen zu vermeiden, müssen die Blüten unter ausreichender Luftzirkulation und bei geeigneter Temperatur und Luftfeuchtigkeit getrocknet werden. Auch die Lagerung nimmt Einfluss auf die Drogenqualität. Cannabisblüten sollen gemäß DAB-Monografie in einer dicht verschlossenen Verpackung, vor Licht geschützt und unterhalb von 25 °C gelagert werden.
Vergleich der Anbausysteme
Mit allen drei Anbausystemen kann man qualitativ hochwertige Drogen gewinnen. Welches Anbausystem am besten geeignet ist, hängt von verschiedenen Faktoren ab. Die gesetzlichen und regulatorischen Vorgaben im Anbauland spielen eine entscheidende Rolle. Die deutsche Cannabisagentur forderte beispielsweise in ihrer ursprünglichen Ausschreibung, dass medizinisches Cannabis in der Bundesrepublik in geschlossenen und hochgesicherten Produktionsanlagen angebaut werden soll, und schloss somit die hiesige Produktion in Gewächshäusern oder auf dem Feld aus. Die Anwendung der Arzneidroge bzw. die Arzneiform, die aus der pflanzlichen Droge hergestellt werden soll, ist einer der wichtigsten Faktoren. Werden z. B. Cannabisblüten direkt nach dem Zerkleinern zur Inhalation mit einem Verdampfer angewendet, sollten die Cannabinoidgehalte von Charge zu Charge nicht stark schwanken.
Um Cannabisblüten zu produzieren, die Cannabinoide in einem definierten Gehaltsbereich enthalten, war der Anbau in geschlossenen Räumen bisher der Goldstandard. In diesem Anbausystem können sämtliche Umweltfaktoren präzise reguliert und pflanzliche Drogen mit dem höchsten Standardisierungsgrad erzeugt werden (Tab. 3).
Umweltfaktor |
Feld |
Gewächshaus |
Indoor |
|---|---|---|---|
Photoperiode |
abhängig von Breitengrad und Jahreszeit |
Regulierung mit Zusatzbeleuchtung und Verdunkelungsanlage |
einfache Regulierung mit künstlicher Beleuchtung |
Lichtquantität |
variiert im Verlauf des Tages und Jahres |
Regulierung mit Zusatzbeleuchtung und Schirmen |
|
Lichtqualität |
Mischung aus konstanter Zusatzbeleuchtung und variablem Sonnenlicht |
||
Wasser |
abhängig von Bodenbedingungen und Niederschlag; beeinflussbar durch Bewässerung und Drainage |
Regulierung über Substrat, Bewässerungssystem und Drainage |
|
Nährstoffverfügbarkeit |
abhängig von Bodenbedingungen; beeinflussbar durch Bodenbearbeitung, Fruchtfolge und Düngung |
Regulierung über Substrat und Düngung/Nährlösung |
|
CO2 -Gehalt der Luft
|
stets ca. 400 ppm |
regelmäßiger Luftaustausch oder CO2-Zufuhr, sonst CO2-Mangel
|
|
|
Temperatur und
Luftfeuchtigkeit
|
abhängig vom Klima am Standort |
meist nur grobe Regulierung; in High-Tech-Gewächshäusern präzise Regulierung |
präzise Regulierung mittels Klimatechnik |
Momentan scheint der Trend dahin zu gehen, standardisierte Cannabisblüten in hochtechnisierten und vollklimatisierten Gewächshäusern zu produzieren. So baut der kanadische Hersteller Aurora Cannabis Inc. zurzeit zwei hochmoderne Gewächshausanlagen, Aurora Sky in Kanada und Aurora Nordic in Dänemark, die EU-GMP konform sein werden.
Für die Herstellung von pflanzlichen Zubereitungen wie Extrakten, die durch Mischen von verschiedenen Drogen- bzw. Extraktchargen oder mit inerten Hilfsstoffen normiert werden können, sind Drogen aus dem Feld oder Gewächshaus völlig ausreichend. Die Isolierung von Reinsubstanzen stellt den geringsten Anspruch an eine einheitliche Drogenqualität (Tab. 4).
Feld |
Gewächshaus |
Indoor |
|
|---|---|---|---|
Standardisierungsgrad |
hoch |
höher |
am höchsten |
Produktionskosten |
niedrig: niedrige Investitions- und Energiekosten |
mittel: hohe Investitionskosten und mittlere Energiekosten |
hoch: hohe Investitions- und Energiekosten |
Produktionssystem optimal für |
Isolierung von Reinsubstanzen und Herstellung von Zubereitungen |
Herstellung von standardisierten Medizinalcannabisblüten und -zubereitungen |
Herstellung von standardisierten Medizinalcannabisblüten |
Weitere wichtige Faktoren sind die Produktionskosten und das Klima des Produktionsstandorts. In Regionen mit hoher Sonneneinstrahlung, gutem Klima und fruchtbaren, nicht schwermetallbelasteten Böden ist die Nutzung natürlicher Ressourcen auf dem Feld ökonomischer und ökologischer. Die Nutzung des Sonnenlichts, auch in Gewächshäusern, senkt die Produktionskosten erheblich. Die Indoor-Produktion mit ausschließlich künstlicher Beleuchtung ist sehr energieintensiv, da Lampen mit mehreren Hundert Watt pro Quadratmeter verwendet werden und die Hitze, die sie erzeugen, wieder abgeführt werden muss.
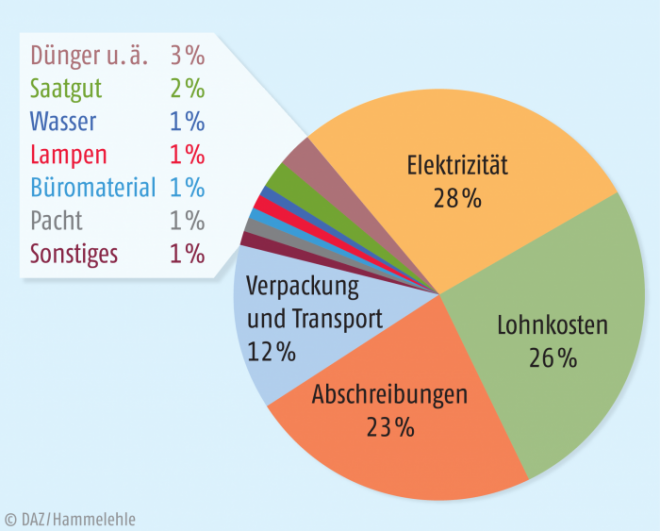
Abbildung 4 zeigt, wie sich die Produktionskosten für Salatköpfe in einer japanischen Indoor-„Pflanzenfabrik“ auf die einzelnen Kostenblöcke verteilen. 28% der Produktionskosten fallen für Energie an [28]. Der Energiebedarf für den Indoor-Cannabisanbau liegt in der gleichen Größenordnung. Auf der einen Seite ist die Produktion in geschlossenen Anlagen momentan kostenintensiv, auf der anderen Seite lassen sich hohe Erträge in hoher und standardisierter Qualität, unabhängig vom Klima, erzielen. Es wird jedoch postuliert, dass der Energieverbrauch in vielen geschlossenen Pflanzenproduktionsanlagen relativ einfach um 20 bis 30% und theoretisch sogar um 50 bis 80% reduziert werden kann. Als eine der aussichtsreichsten Innovationen, Energie zu sparen, gilt die Implementierung von neuen LED-Beleuchtungssystemen, die elektrische Energie effizienter in Lichtenergie umwandeln und ein für das Wachstum und die Qualität der Pflanzen optimiertes Lichtspektrum aufweisen [28]. Um in Zukunft solche Systeme effizient nutzen zu können, sind Forschungs- und Entwicklungsarbeiten auf diesem Gebiet essenziell, denn jede Pflanzenspezies oder -sorte hat individuelle Optima für Lichtqualität und -quantität [29].
Die Investitionskosten der betreffenden Systeme unterscheiden sich ebenfalls erheblich. So sind die Investitionskosten für die Produktion in Gewächshäusern und geschlossenen Produktionsanlagen erheblich höher als auf dem Feld.
Fazit
Welches Anbausystem sich für die Herstellung welcher Cannabisarzneimittel eignet und welche Faktoren die Eignung der aufgeführten Systeme beeinflussen, ist in Tabelle 4 zusammengefasst. Für die Herstellung von isolierten Reinsubstanzen beispielsweise ist der Feldanbau ideal. Es würde wenig Sinn machen, Drogen aus dem kostenintensiven Anbau in (semi-)kontrollierten Umgebungen für die Isolierung zu verwenden. Durch den Einsatz von High-Tech können hingegen standardisierte Cannabisblüten mit tolerierbaren Schwankungen im Inhaltsstoffspektrum erzeugt werden. Dieses von Patienten geschätzte pflanzliche Arzneimittel kann somit den Ansprüchen eines modernen Pharmakons genügen und neben Fertigarzneimitteln, Zubereitungen und isolierten Reinsubstanzen, wie Dronabinol, den Arzneischatz bereichern. |
Literatur
[1] Ausschreibungsdetails: Anbau, Weiterverarbeitung, Lagerung, Verpackung und Lieferung von Cannabis zu medizinischen Zwecken; www.evergabe-online.de/tenderdetailstml?1&id=156533 - abgerufen 2017-04
[2] Häußermann, Klaus; Grotenhermen, Franjo; Milz, Eva. Cannabis – Arbeitshilfe für die Apotheke. 2. Auflage. Deutscher Apotheker Verlag, 2018
[3] Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften. Bundesgesetzblatt Jahrgang 2017 Teil I Nr. 11, 9. März 2017
[4] Frohne, D; Jensen, U. Systematik des Pflanzenreichs – unter besonderer Berücksichtigung chemischer Merkmale und pflanzlicher Drogen. 5. Auflage. Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998
[5] Schultes, Richard Evans; Klein, William M; Plowman, Timothy; Lockwood, Tom E. CANNABIS: AN EXAMPLE OF TAXONOMIC NEGLECT. Botanical Museum Leaflets, Harvard University vol. 23 (1974), Nr. 9, pp. 337–367
[6] Small, Ernest; Cronquist, Arthur. A Practical and Natural Taxonomy for Cannabis. Taxon vol. 25 (1976), Nr. 4, pp. 405–435
[7] The Plant List: Version 1.1.; www.theplantlist.org (2013)
[8] Potter, David J. Cannabis Horticulture. In: Pertwee, Roger G (ed.). Handbook of Cannabis. Oxford University Press, 2014, pp. 65–88
[9] Clarke, Robert Connell. Marijuana botany: An advanced study: The propagation and breeding of distinctive cannabis. Ronin publishing, 1981
[10] ElSohly, Mahmoud; Gul, Waseem. Constituents of Cannabis Sativa. In: Pertwee, Roger G (ed.). Handbook of Cannabis. Oxford University Press, 2014, pp. 3–22
[11] Clarke, Robert C; Watson, David P. Cannabis and Natural Cannabis Medicines. In: ElSohly, M. A. (ed.). Marijuana and the Cannabinoids, Forensic Science and Medicine. Humana Press Inc., 2007, pp. 1–15
[12] Russo, Ethan B. Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. Br J Pharmacol vol. 163 (2011), Nr. 7, pp. 1344–1364
[13] McPartland, John M; Russo, Ethan B. Cannabis and cannabis extracts: greater than the sum of their parts? Journal of Cannabis Therapeutics vol. 1 (2001), Nr. 3-4, pp. 103–132
[14] De Meijer, Etienne. The Chemical Phenotypes (Chemotypes) of Cannabis. In: Pertwee, Roger G (ed.). Handbook of Cannabis. Oxford University Press, 2014, pp. 89–110
[15] De Meijer, Etienne PM; Bagatta, Manuela; Carboni, Andrea; Crucitti, Paola; Moliterni, VM Cristiana; Ranalli, Paolo; Mandolino, Giuseppe. The inheritance of chemical phenotype in Cannabis sativa L. Genetics vol. 163 (2003), Nr. 1, pp. 335–346
[16] ElSohly, Mahmoud A; Radwan, Mohamed M; Gul, Waseem. Phytochemistry of Cannabis sativa L. In: Kinghorn, AD; Falk, H; Gibbons, S; Kobayashi, J (eds.). Phytocannabinoids - Unraveling the Complex Chemistry and Pharmacology of Cannabis sativa. Springer International Publishing, 2017, pp. 1–36
[17] Teuscher, Eberhard; Melzig, Matthias F; Lindequist, Ulrike. Biogene Arzneimittel – Ein Lehrbuch der Pharmazeutischen Biologie. 7. Auflage. Wissenschaftliche Verlagsgesellschaft Stuttgart, 2012
[18] Bekanntmachung zu: Deutsches Arzneibuch – Monographie Cannabisblüten. BAnz AT 12.05.2017 B7, Seite 1 von 9
[19] Zwei Tonnen Medizinalcannabis sollen bis 2021 in Deutschland angebaut werden; www.aerzteblatt.de/nachrichten/74133/Zwei-Tonnen-Medizinalcannabis-sollen-bis-2021-in-Deutschland-angebaut-werden - abgerufen 2017-04
[20] Europäisches Arzneibuch 9. Ausgabe. Allgemeine Monographie: Pflanzliche Drogen – Plantae medicinales (9.0/1433). Deutscher Apotheker Verlag, 2017
[21] Committee on Herbal Medicinal Products (HMPC) of the European Medicines Agency. Guideline on Good Agricultural and Collection Practice for Starting Material of Herbal Origin. EMEA/HMPC/246816/2005
[22] Chandra, Suman; Lata, Hemant; Khan, Ikhlas A; ElSohly, Mahmoud A. The Role of Biotechnology in Cannabis sativa Propagation for the Production of Phytocannabinoids. In: Chandra, Suman; Lata, Hemant; Varma, Ajit (eds.). Biotechnology for Medicinal Plants: Micropropagation and Improvement. Springer Berlin Heidelberg, 2013, pp. 123–148
[23] Cervantes, Jorge. Marijuana Horticulture - The Indoor/Outdoor Medical Grower’s Bible. Van Patten Publishing, 2006
[24] Ouzounis, Theoharis; Rosenqvist, Eva; Ottosen, Carl-Otto. Spectral Effects of Artificial Light on Plant Physiology and Secondary Metabolism: A Review. HortScience vol. 50 (2015), Nr. 8, pp. 1128–1135
[25] Lydon, John; Teramura, Alan H; Coffman, C Benjamin. UV-B RADIATION EFFECTS ON PHOTOSYNTHESIS, GROWTH and CANNABINOID PRODUCTION OF TWO Cannabis sativa CHEMOTYPES. Photochemistry and Photobiology vol. 46 (1987), Nr. 2, pp. 201–206
[26] Fischedick, Justin Thomas; Hazekamp, Arno; Erkelens, Tjalling; Choi, Young Hae; Verpoorte, Rob. Metabolic fingerprinting of Cannabis sativa L., cannabinoids and terpenoids for chemotaxonomic and drug standardization purposes. Phytochemistry vol. 71 (2010), Nr. 17, pp. 2058–2073
[27] Rosenthal, Ed. Marijuana Grower’s Handbook. Quick American Publishing, 2010
[28] Kozai, Toyoki; Niu, Genhua. ROLE OF THE PLANT FACTORY WITH ARTIFICIAL LIGHTING (PFAL) IN URBAN AREAS. In: Kozai, Toyoki; Niu, Genhua; Takagaki, Michiko (eds.). Plant Factory - An Indoor Vertical Farming System for Efficient Quality Food Production. Elsevier, 2016, pp. 7–33
[29] Urrestarazu, Miguel; Nájera, Cinthia; Gea, María del Mar. Effect of the Spectral Quality and Intensity of Light-emitting Diodes on Several Horticultural Crops. HortScience vol. 51 (2016), Nr. 3, pp. 268–271


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.