
- DAZ.online
- DAZ / AZ
- DAZ 2/2018
- MRT und Kontrastmittel
Diagnostika
MRT und Kontrastmittel
Wie funktioniert Magnetresonanztomografie (MRT) und welche Rolle spielt Gadolinium?
Die DAZ berichtete kürzlich über Nierenschäden durch Kontrastmittel bei CT- bzw. MRT-Untersuchungen, vor denen Statine schützen können [1]. Auch Gadolinium-Verbindungen bewirken diese Schäden [1]. Das BfArM empfahl Ende 2017, nach Möglichkeit makrozyklische statt lineare Gadolinium-Chelate zu verwenden [2], und ab 1. März 2018 wird die Zulassung von drei Präparaten ruhen (s. S. 102).
Befassen wir uns zunächst mit den wichtigsten physikalischen Grundlagen der MRT:
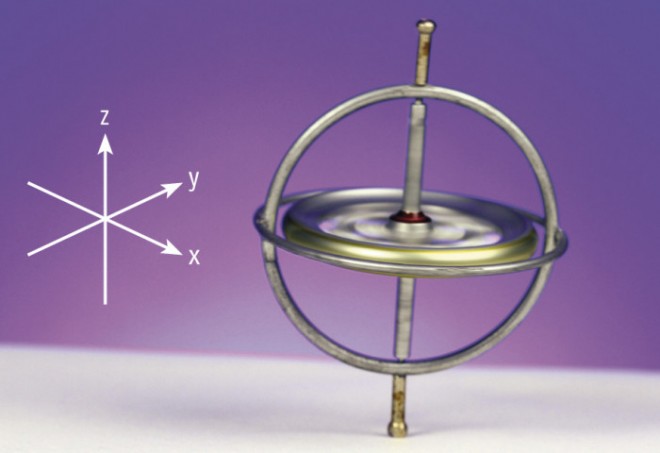
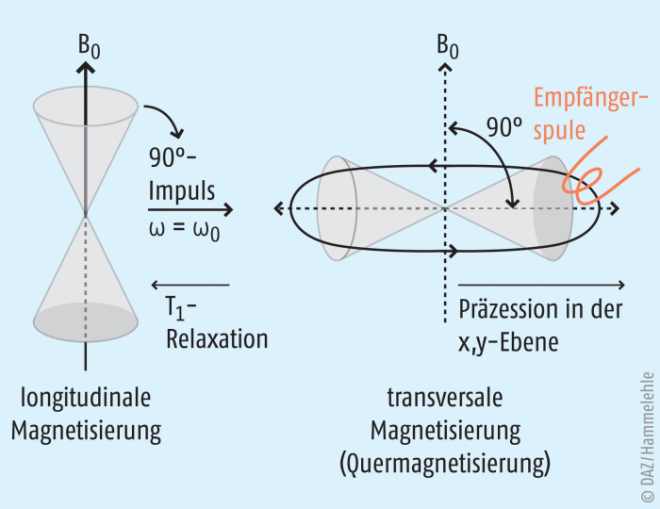
Der Kinderkreisel. Rotiert der Kreisel sehr schnell, steht seine Rotationsachse in z-Richtung senkrecht auf der x,y-Ebene. Stößt man den Kreisel sanft an, gerät die Achse aus der Senkrechten, und ihr oberes Ende beschreibt einen Kreis. Diese Kreisbewegung, d. h. das Fortschreiten der Kreiselspitze auf der Kreislinie, nennt man Präzession (Abb. 1). Später wird die Präzession nachlassen, der Kreisel umkippen und auf der Seitenfläche – senkrecht zur Drehachse – weiterrollen. Die Präzession (und das Kippen um 90°) eines rotierenden Kreisels werden uns begegnen, um das Verhalten des Protons bei 1H-NMR- bzw. MRT-Messungen anschaulich – und damit stark vereinfacht – zu beschreiben.
Magnetismus. Ferromagnetisches metallisches Eisen wird besonders stark von einem Magneten angezogen, es ist somit auch paramagnetisch. Paramagnetisches Verhalten setzt die Einwirkung eines äußeren Magnetfeldes voraus. Auch Gadolinium ist paramagnetisch (s. u.).
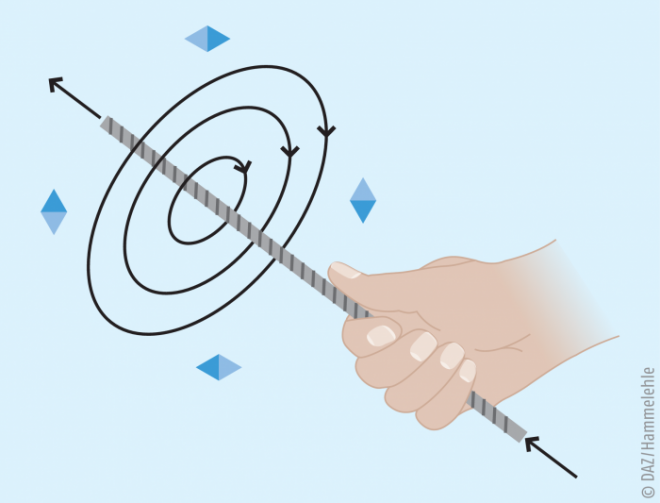
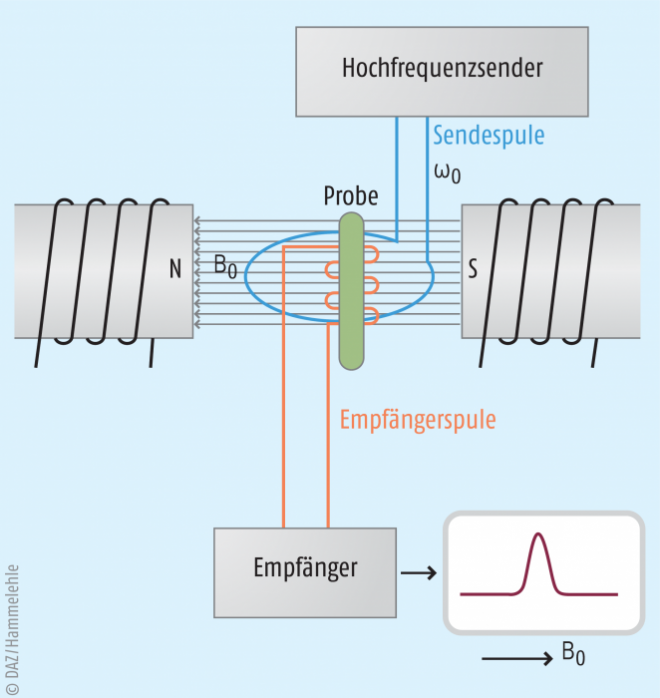
Magnetfeld und Stromleiter stehen in einem Zusammenhang: Fließt elektrischer Strom durch einen Leiter, bildet sich ein Magnetfeld, das nach der Rechte-Hand-Regel senkrecht zur Fließrichtung des Stroms steht (Abb. 2). Bewegen wir ein Magnetfeld in einer feststehenden Spule oder eine Spule in einem feststehenden Magnetfeld, fließt elektrischer Strom. Die Erzeugung des Stromflusses heißt „Induktion“.
Protonen im Magnetfeld
Die 1H-Nuklearmagnetische-Resonanz(NMR)-Spektroskopie ist die Grundlage der MRT [3 – 5]. Dabei entspricht dem Kreisel das Proton (1H+), und dem leichten Anstoß des Kreisels entspricht ein starkes äußeres Magnetfeld. Die Kreisbewegung des Protons, der Spin, wird als Rotationskegel dargestellt. In Formeln zur Berechnung ihrer Frequenz verwendet man das gyromagnetische Verhältnis γ (gamma), das für jedes NMR-aktive Isotop eine charakteristische Konstante ist.
Grundlage dafür ist die Larmor-Gleichung (benannt nach dem irischen Physiker Joseph Larmor, 1857 – 1942): Ω0 = γ ⋅ B0
Das heißt: Die Präzessionsfrequenz Ω0 des rotierenden Atomkerns (hier: Proton) ist das Produkt seines gyromagnetischen Verhältnisses γ und der Stärke des Magnetfelds B0 .
Atome sind NMR-aktiv,
- wenn ihre Massen- und Ordnungszahl ungerade sind (11 H, 199 F),
- wenn ihre Ordnungszahl gerade und ihre Massenzahl ungerade ist (136 C) oder
- wenn ihre Ordnungszahl ungerade und ihre Massenzahl gerade ist (147 N).
Atome mit gerader Massen- und Ordnungszahl wie 126 C und 168 O können daher nicht NMR-spektroskopisch vermessen werden.
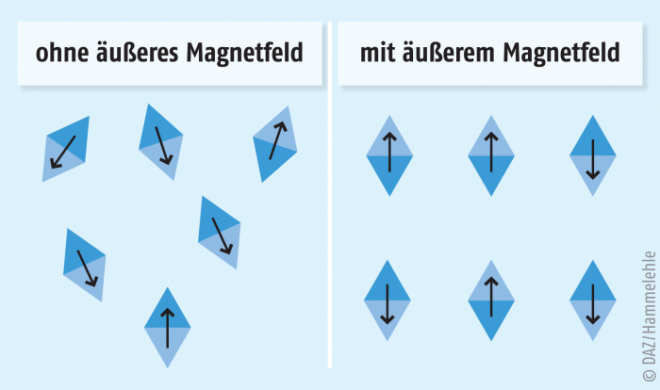
Für NMR-Messungen müssen die Spektrometer auf die Resonanzfrequenzen der ausgewählten Atomkerne und ein konstantes, homogenes Magnetfeld der Stärke B0 eingestellt werden. Im Folgenden beschränken wir uns auf die 1H-NMR-Spektroskopie. Als rotierendes Teilchen mit elektrischer Ladung erzeugt jedes Proton ein eigenes Magnetfeld. Die Magnetfelder aller Protonen in einer NMR-Probe sind anfangs ungerichtet (Abb. 3).
Ein starkes äußeres Magnetfeld bewirkt, dass sich die Protonen entweder parallel zu diesem Feld ausrichten und damit energiearm sind (E1) oder dass sie sich antiparallel ausrichten und energiereich sind (E2). Die Energiedifferenz ΔE zwischen beiden Zuständen hängt sowohl von der Stärke des Magnetfelds B0 als auch vom gyromagnetischen Verhältnis γ ab.
Nach der Boltzmann-Verteilung liegen z. B. bei der Feldstärke 1,4 Tesla (entspr. 60 MHz) nur zehn von zwei Millionen Protonen im energieärmeren Niveau E1 vor; nur diese sind der Kernresonanz zugänglich [3].
Kernresonanz
Zur Kernresonanz kommt es, wenn eine Probe in einem Magnetfeld mit hochfrequenten elektromagnetischen Wellen bestrahlt wird. Protonen im Zustand E1 werden dabei durch Aufnahme von Energie unter Umdrehen des Protonenspins auf den Zustand E2 gehoben: Der Protonenkreisel präzediert nach wie vor in Richtung des magnetischen Feldes (z-Richtung), aber die Richtung ist entgegengesetzt, sie ist umgeklappt („wie ein Regenschirm im Wind“ [3]). Voraussetzung ist, dass die von dem Hochfrequenzsender eingestrahlte Energie ΔE genau der Energie der Präzessionsfrequenz entspricht. Zudem muss die Spule des Senders senkrecht zum Magnetfeld B0 stehen (Rechte-Hand-Regel). Die Empfängerspule, in der das Probenröhrchen rotiert, steht senkrecht zum Magnetfeld und senkrecht zur Sendespule. Die Empfängerspule registriert den Betrag der von den Protonen aufgenommenen bzw. wieder abgegebenen Energie (s. u. Relaxation). Dies wird als NMR-Spektrum aufgezeichnet (Abb. 4).
Relaxation
Sind alle Protonen im Zustand E2 , kann ihnen keine weitere Energie durch die Sendespule zugeführt werden: Das Resonanzsignal erlischt. Protonen sind aber wie andere elektrisch geladenen Teilchen bestrebt, durch Energieabgabe in den Grundzustand – hier E1 – zurückzufallen. Dies wird als Relaxation bezeichnet. Bei der 1H-NMR-Spektroskopie relaxieren die Protonen entlang der z-Achse (sog. longitudinale Relaxation): Der „Regenschirm“ klappt zurück. Danach kann wieder in das regenerierte ΔE eingestrahlt werden. Um ein stabiles Signal zu erhalten, muss folglich ständig so viel elektromagnetische Energie zugeführt werden, wie als thermische Energie an die Umgebung, das sogenannte „Gitter“, abgegeben wird.
Wichtig: Anregung und Relaxation verlaufen bei der analytischen NMR-Spektroskopie beide in z-Richtung, d. h. longitudinal. Dies ist bei der MRT nicht der Fall (s. u.).
Transversale Magnetisierung
Wir wenden uns nun der MRT oder Kernspintomografie zu. Zusätzlich zu den physikalischen Grundlagen der 1H-NMR-Spektroskopie benötigen wir dafür einige Zusatzinformationen.
Man kann das Proton, das durch die Bestrahlung mit hochfrequenten elektromagnetischen Wellen in den Zustand E2 gehoben wurde, durch weitere Bestrahlung um 90° kippen und aus der z-Richtung in die x,y-Ebene zwingen, wo es weiter präzediert (90°-Impuls). Dabei ist die Magnetisierung ebenfalls um 90° gekippt (transversale Magnetisierung), und durch die Umlaufbewegung der Protonen wird in einer Empfängerspule ein Strom erzeugt, der als Signal registriert wird.
T1 -Relaxation
Bei der folgenden Relaxation wird die transversale Magnetisierung des Protons (Präzession in der x,y-Ebene) zugunsten der longitudinalen Magnetisierung (in z-Richtung) rückgängig gemacht (T1 -Relaxation; Abb. 5). Dabei verliert das Proton Energie. Je weiter sich das Magnetfeld aus der x,y-Ebene aufrichtet, desto kleiner wird seine Projektion in der x,y-Ebene, bis es dort schließlich ganz erlischt, d. h. dass dort kein Stromsignal mehr erzeugt wird. In der z-Ebene sinkt das Proton darauf vom angeregten Zustand E2 wieder auf das Niveau E1 .
Wichtig für die MRT-Bildgebung ist, dass unterschiedliche Gewebe zu unterschiedlichen Relaxationszeiten führen (s. u.).
T2 -Relaxation und Phasenverschiebung
Neben dieser Spin-Gitter-Relaxation läuft eine Spin-Spin-Relaxation ab, bei der keine Energie an das „Gitter“ abgegeben wird. Vielmehr stärken oder schwächen sich die magnetischen Momente der Protonen als Folge ihrer Spins gegenseitig in den Volumenausschnitten des zu analysierenden – uneinheitlichen – Gewebes (T2 -Relaxation).
Die genannten Abläufe – Ausrichtung in der z-Achse, Anregung von E1 zu E2, 90°-Impuls in die x,y-Ebene und dortige Präzession – können bei einzelnen Protonen zu einer Phasenverschiebung führen. Anfangs präzedieren sie alle synchron in der x,y-Ebene. Dem summierten Magnetfeld voranlaufende Spins verstärken das Magnetfeld, nachhinkende Spins schwächen es. Damit geht die sogenannte Phasenkohärenz verloren, und das x,y-Magnetfeld bricht zusammen: kein x,y-Magnetfeld, kein Stromfluss, kein Signal. Wichtig ist, dass keine Energie nach außen abgegeben wird: Die Spins haben ihre Energie durch die o. a. Spin-Spin-Wechselwirkung ausgeglichen. Das äußere Magnetfeld beeinflusst diese Wechselwirkung fast nicht, dieser Anteil des Phasenverlustes (Dephasierung) wird T2 genannt. Hinzu kommen konstante (apparative) Inhomogenitäten, die als T2* bezeichnet werden. Diese Inhomogenitäten müssen ständig durch Veränderungen des Magnetfelds bzw. der Radiofrequenz kompensiert werden. Die Schaltvorgänge bedingen den MRT-Lärmpegel.
Nach Weishaupt [4] sind T1- und T2 -Prozesse unabhängig voneinander; durch T2 -Prozesse ist das MRT-Signal bereits nach 100 bis 300 ms zerfallen, während für T1 eine halbe bis mehrere Sekunden vergehen. Der Radiologe kann T1 und T2 zur Untersuchung des jeweiligen Gewebes einstellen, „gewichten.“ Stoffe mit langen T2 -Zeiten, z. B. der Liquor im Schädel, erscheinen hell, solche mit kurzen T2 -Zeiten, z. B. die Hirnsubstanz, erscheinen dunkel. Es gibt Tabellen zur Signalintensität bei T1 - bzw. T2 -durchgeführten MRT-Untersuchungen von Organen.
Drei Parameter bestimmen die Helligkeit im MRT-Bild und damit den Bildkontrast:
- die Protonendichte hauptsächlich von Blut und Fett; sie folgt aus dem 1H-NMR-Prinzip.
- Die T1 -Zeit eines Gewebes (!) legt fest, wie schnell die Protonenspins aus dem angeregten Zustand relaxieren, um erneut zu E2 angeregt werden zu können. Fett- und Blut-Protonen relaxieren durch Gd-Komplexe sehr viel schneller (s. u.).
- T2 beschreibt das Abklingen der transversalen Magnetisierung durch die Dephasierung: Jeder Spin erzeugt ein kleines Magnetfeld, das die Felder der Nachbarprotonen beeinflusst. Das bewirkt lokale Änderungen des Magnetfeldes.
Trotz der Dephasierung brauchen wir homogene Magnetfelder, aber – abgesehen von Spin-Spin-Wechselwirkung und Organbewegungen – auch die magnetischen Eigenschaften des Menschen sind nicht einheitlich. Um nur ein Beispiel zu nennen: Ist an das Fe2+ im Hämoglobin kein O2 gebunden (Desoxyhämoglobin), ist das Fe2+ wegen seiner vier ungepaarten Elektronen in je einem seiner fünf 3d-Orbitale paramagnetisch (das fünfte 3d-Orbital des Fe2+ ist mit zwei umgekehrten Elektronen-Spins besetzt, daher ist es nicht magnetisch).
Ist O2 an Hämoglobin gebunden, können Elektronen des uns umgebenden paramagnetischen Triplett-Sauerstoffs (3O2) die freien Plätze in den nur halbgefüllten 3d-Orbitalen des Fe2+ besetzen (3O2 enthält in zwei energiegleichen antibindenden Molekülorbitalen je ein Elektron; diese Elektronen haben parallelen Spin: 3O2 ist paramagnetisch):
Oxygeniertes Hämoglobin trägt O2 axial am Fe2+, die vier N‑Atome des Porphyrins sind äquatorial angeordnet, und die vorher energiegleichen d-Orbitale des Fe2+ sind nicht mehr energiegleich. Als Folge ist oxygeniertes Hämoglobin diamagnetisch! Daraus folgt, dass der O2 -Gehalt des Patientenblutes bei MRT-Untersuchungen berücksichtigt werden muss, denn Desoxyhämoglobin trägt durch sein Magnetfeld zur Dephasierung bei. Die O2 -Bindung verändert zudem die Hämoglobin-Konformation (vgl. Farben des venösen bzw. arteriellen Blutes). Änderungen der Gestalt oder Konformation großer Proteine verändern die Relaxationszeit T1 .
Gadolinium und seine Komplexe
In die T1 - und T2 -Relaxation greifen MRT-Kontrastmittel ein, die trotz desselben Wortes nichts mit Kontrastmitteln für Röntgen- und CT-Untersuchungen zu tun haben. Weit verbreitet ist Gadolinium (Gd), ein Lanthanoid und eine Seltene Erde mit der Ordnungszahl 64, d. h.: Es besitzt 64 Protonen und im Elementarzustand 64 Elektronen. Im Vergleich mit Xenon und seinen 54 Elektronen besitzt Gadolinium also zehn Elektronen mehr, die sich gemäß dem Orbitalmodell auf die vierte bis sechste Hauptquantenzahl verteilen. Diese Elektronen werden mit der Nummer der Hauptquantenzahl sowie den historischen Bezeichnungen s (sharp), p (principal), d (diffus) und f (fundamental) versehen; die Anzahl der Elektronen wird durch eine Hochzahl angegeben. Für Gd gilt daher die Konfiguration [Xe] 4f7, 5d1, 6s2.
Gadolinium in der Reihe der Seltenen Erden
62Sm: Samarium
63Eu: Europium
64Gd: Gadolinium
65Tb: Terbium
66Dy: Dysprosium
Gd ist dreiwertig, d. h. die kernfernen Orbitale der Hauptquantenzahlen 5 und 6 verlieren drei Elektronen zu Gd3+ mit der Konfiguration [Xe] 4f7, 5d0, 6s0. Die drei leeren Orbitale können durch nichtbindende Elektronenpaare der Komplexbildner gefüllt werden.
Alle zugelassenen Gd-Kontrastmittel sind Komplexe mit hoher Stabilität. Freies Gd3+ ist sehr toxisch [7], weil sein Ionenradius etwa demjenigen des Ca2+ entspricht (Ca2+ : 0,97 ⋅ 10‑10 m; Gd3+ : 0,94 ⋅ 10-10m). Im 4f-Orbital kann es maximal 14 Elektronen, im 5d-Orbital maximal zehn Elektronen und im 6s-Orbital maximal zwei Elektronen geben. Die 4f7-Besetzung bedeutet, dass sieben Elektronen in sieben Orbitalen ungepaart (!) kreisen. Das erklärt den ausgeprägten Paramagnetismus von Gd3+.
Ein Elektron erzeugt als bewegte (negative) elektrische Ladung ebenfalls ein magnetisches Feld (magnetisches Moment, µ). Dessen Stärke beträgt 1 µB (Bohrsches Magneton), was etwa 200-mal mehr ist als das magnetische Feld des Protons [5]. Letzteres wird als Kernmagneton (µK) gemessen; der Wert beträgt 2,79 µK .
Die Toxizität des Gd3+ wird durch seine Bindung in Chelat-Komplexen so weit gemindert, dass diese als Diagnostika angewendet werden können. Dabei wird unterschieden zwischen
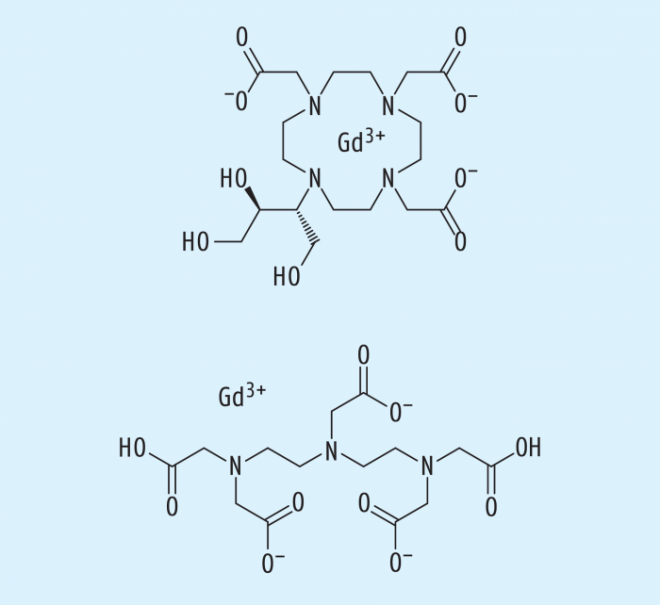
- linearen Chelaten wie Gadopentetat-Dimeglumin (z. B. in Magnevist®, Abb. 6; Dimeglumin: zwei Moleküle 1-Desoxy-1-methylaminosorbit als Basen für zwei R‑COOH-Gruppen des Gadopentetat) und
- makrozyklischen Chelaten wie Gadobutrol (in Gadovist®, Abb. 6).
Olchowy et al. [6] referieren in einem Beitrag zur Toxizität von Gd-Kontrastmitteln verschiedene Beobachtungen nach der Anwendung linearer bzw. makrozyklischer Präparate. So schreiben sie über Patienten, die früher schon Gd-Chelat-Injektionen erhalten hatten, sinngemäß: „Eine höhere Signalintensität im Nucleus dentatus gegenüber dem Cerebellum war signifikant assoziiert mit linearen Gadolinium-Chelaten.“
Bei zwei Patientengruppen, von denen die eine mit Gadobutrol (makrozyklisch), die andere mit linearem Gadopentetat-Dimeglumin behandelt wurde, zeigte sich folgendes Ergebnis: In der Gadopentetat-Gruppe stieg die Signalintensität im N. dentatus nach sechs Vorbehandlungen signifikant, in der Gadobutrol-Gruppe dagegen nicht signifikant. Daraus folgt, dass Gd3+ aus linearen Chelaten leichter freigesetzt wird als aus makrozyklischen Chelaten und danach im Gehirn verbleibt.
Olchowy et al. berichten auch über unlösliche Gd-Phosphat-Ablagerungen im Gehirn, die bereits 2011 bei einer Autopsie gefunden wurden. Weiter referieren sie Untersuchungen von Multipler Sklerose, arteriosklerotischen Hirnfunktionsstörungen, Neurotoxizität und Niereninsuffizienz im Zusammenhang mit der Gabe von Gd-Diagnostika [6].
Mutschler et al. verweisen auf Gd-Präparate, die zusätzlich das mit Ethylendiamintetraessigsäure (EDTA) verwandte lineare Ca-Chelat Calteridol (in ProHance®
, Abb. 7) enthalten: Es ist labiler als die Gd-Chelate und kann Gd3+, das aus diesen gegebenenfalls freigesetzt wird, durch Austausch von Ca2+ gegen Gd3+ abfangen [7]. Zudem nennen sie zahlreiche Gd-Komplexe und deren Anwendungen. Der Chelatbildner Diethylentriaminpentaessigsäure (DTPA) z. B. ist ein lineares Molekül, das sich an Gd3+ schrittweise mit mindestens drei nichtbindenden Elektronenpaaren bindet. Bei DOTA (1,4,7,10-Tetraazacyclodecan-1,4,7,10-tetraessigsäure, z. B. in Dotarem®) ist ein vierzähniger Makrozyklus vorgefertigt.
Das BfArM empfiehlt, möglichst makrozyklische statt lineare Gadolinium-Chelate zu verwenden [2]. Ab 1. März 2018 wird die Zulassung der linearen Gd-Kontrastmittel Gadopentetsäure (i.v.), Gadodiamid und Gadoversetamid ruhen (s. S. 102).
Gd-Chelate werden unverändert ausgeschieden, sofern sie das Gd nicht freigesetzt haben. Sie überstehen die Abbauprozesse in Kläranlagen, und Gd kann in deren Abläufen massenspektrometrisch in Spuren (< 1 ng/l) nachgewiesen werden. Dabei wird Gd zusammen mit den übrigen Seltenen Erden bestimmt; ein anthropogener Gd-Anteil verändert die natürliche Zusammensetzung der Seltenen Erden und wird durch Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS) ermittelt [9].
Ist MRT-Strahlung gefährlich?
Nein, wenn folgende Anordnungen und Kontraindikationen beachtet werden: Alle Metallteile am Körper müssen abgelegt werden, denn sie können das Magnetfeld stören oder als Spulen in einem bewegten Magnetfeld zur Induktion führen (s.o.). Kontraindikationen für MRT-Untersuchungen sind Herzschrittmacher, einige Typen von Herzklappen, Defibrillatoren und bestimmte Cochlea-Implantate. Externe Insulin- bzw. Schmerzmittel-Pumpen müssen abgelegt, fest implantierte Pumpen auf Kompatibilität mit dem Magnetfeld geprüft werden.
Die heute zur Strukturaufklärung chemischer Verbindungen eingesetzten 1H-NMR-Geräte verwenden routinemäßig eine Frequenz von 100 Megahertz (MHz); dies entspricht der Wellenlänge λ = 3 m, also einer Radio-Kurzwelle, und einer Magnetfeldstärke von 2,35 Tesla (T) [3]. Mikrowellenherde arbeiten mit 2455 MHz, entsprechend λ = 12 cm.
MRT-Geräte arbeiten mit Magnetfeldern von 0,35 bis 3,0 T, was 15 bis 127 MHz entspricht und somit ebenfalls im Kurzwellenbereich liegt. Die Energie dieser vergleichsweise langwelligen Strahlungen ist so gering, dass sie – im Gegensatz zu energiereicher Strahlung (fälschlich: „radioaktive Strahlung“) – keine Ionisierung bewirken kann. |
Literatur
[1] Rausch R. Wie Statine Nieren retten können. Dtsch Apoth Ztg 2017;157(26):2472-2473
[2] BfArM. Risikobewertungsverfahren Gadolinium-haltige Kontrastmittel: Gadoliniumablagerungen im Gehirn und anderen Geweben, 15.12.2017
[3] Rücker/Neugebauer/Willems. Instrumentelle pharmazeutische Analytik. 5. Aufl. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2013, S. 237 ff, speziell S. 245
[4] Weishaupt D, Köchli VD, Marincek B. Wie funktioniert MRI? [= MRT], 7. Aufl., Springer, Heidelberg 2014
[5] Ehlers E. Analytik II, 12. Aufl., Deutscher Apotheker Verlag, Stuttgart 2016, S. 457
[6] Olchowy C et al. The presence of the gadolinium-based contrast agent depositions in the brain and symptoms of gadolinium neurotoxicity – A systematic review. PLoS One 2017;12(2):e0171704
[7] Mutschler E, Geisslinger G, Kroemer HK, Menzel S, Ruth P. Arzneimittelwirkungen, 10. Aufl., Wissenschaftliche Verlagsgesellschaft, Stuttgart 2013
[8] Haas U. Physik für Pharmazeuten, Mediziner und Studierende mit Physik als Nebenfach, 7. Aufl., Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012
[9] www.lfu.bayern.de/analytik_stoffe/analytik_anorg_stoffe_grundwasser/gadolinium/index.htm























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.