
- DAZ.online
- DAZ / AZ
- DAZ 19/2018
- Eine wohltemperierte ...
Logistik
Eine wohltemperierte Angelegenheit
Arzneimittel GDP-konform transportieren
Arzneimittel werden hinsichtlich der Anforderungen beim Transport und bei der Lagerung generell in Kühlware und Raumtemperaturware („ambiente“ Ware) unterteilt. Ob ein Arzneimittel thermolabil ist oder ob es unter ambienten Bedingungen gelagert und transportiert werden darf, entscheiden die Arzneimittelhersteller aufgrund von Stabilitätsuntersuchungen. Welche Transport- und Lagerbedingungen einzuhalten sind, ist in der Regel auf den äußeren Umverpackungen der Arzneimittel aufgedruckt.
Kühlware
Kühlpflichtige Arzneimittel müssen in einem Temperaturkorridor zwischen 2 und 8 °C gelagert und transportiert werden. Üblicherweise wird der Mittelwert von 5 °C gewählt, um einen größtmöglichen Puffer für Abweichungen in beide Richtungen zu gewährleisten.
Arzneimittelgroßhändler unterhalten für Kühlware aktiv gekühlte Kühlkammern, die mit Sicherheitsfunktionen wie Redundanz der Kühlelemente und Notstromaggregaten ausgestattet sind. Die Einhaltung der geforderten Temperatur wird durch mehrere Thermometer überwacht. Gemäß der GDP-Leitlinie sollten diese Messwerte dokumentiert und regelmäßig evaluiert werden [1].
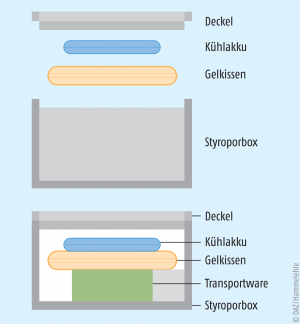
Für den Transport von kühlpflichtigen Arzneimitteln ist die aktive Kühlung in den meisten Fällen nicht nötig. In der Regel ist die Transportdauer so kurz, dass eine passive Kühlung ausreicht. Dafür wird zumeist eine Styroporbox (aus expandiertem Polystyrol, EPS) mit unterschiedlicher Wandstärke (für Winter bzw. Sommer) als Transportbehältnis verwendet. In dieser Isolierbox befinden sich ein oder mehrere Kühlakkus, ein Gelkissen und das Transportgut (Abb. 2).
Die Kühlakkus werden in einem eigenen Kühlraum des Großhändlers z. B. auf -20 °C gekühlt, wobei ein validiertes Messverfahren zum Einsatz kommt. Benutzte und aufgewärmte Kühlakkus müssen vor der nächsten Nutzung wieder so lange gekühlt werden, bis sie erneut -20 °C erreicht haben.
Das Gelkissen sollte dieselbe Temperatur wie die zu transportierenden Arzneimittel (2 – 8 °C) aufweisen und wird zwischen den Arzneimitteln und dem Kühlakku platziert. Es verhindert, dass die Temperatur der Arzneimittel durch den direkten Kontakt mit dem Kühlakku unter den Gefrierpunkt fällt, wodurch die Qualität und Wirksamkeit des Arzneimittels beeinträchtigt würden. Die Forderung nach einer Trennung von Kühlakku und Arzneimitteln findet sich auch in der GDP-Leitlinie:
„Werden Kühlakkus in Isolierbehältern verwendet, müssen sie so platziert werden, dass die Arzneimittel nicht in direkten Kontakt mit den Kühlakkus kommen. Das Personal muss in den Verfahren für die Montage von Isolierbehältern (unterschiedlich je nach Jahreszeit) und der Wiederverwendung von Kühlakkus geschult sein.“ [2, S. 11]
Zur Kühlung werden die Gelkissen gewöhnlich in der Kühlkammer für die kühlpflichtigen Arzneimittel gelagert.
Zum Schutz vor Kühlakku-bedingtem Kondenswasser sollte das Transportgut zusätzlich in eine geschlossene und wasserdichte Folie oder Tüte verpackt werden.
Was heißt „Raumtemperatur“?
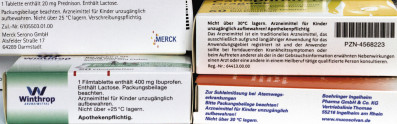
Bei nicht kühlpflichtigen Arzneimitteln hat sich ein Temperaturkorridor von 15 bis 25 °C als „Raumtemperatur“ etabliert. Die Obergrenze von 25 °C ist auf vielen Arzneimittelumverpackungen als Lagerhinweis zu finden (z. B. „Nicht über 25 °C lagern“, Abb. 3) und ist einzuhalten. Die Untergrenze von 15 °C ist jedoch nur selten in den Herstellerangaben zu finden. Häufig wird davon ausgegangen, dass der Temperaturkorridor von 15 bis 25 °C „GDP-konform“ oder vorgeschrieben ist. Dies stimmt jedoch nicht. Vielmehr sieht § 7 AMWHV in Verbindung mit Ziffer 9.1 GDP-Leitlinie die konkrete Bewertung der Transportbedingungen eindeutig bei dem jeweiligen Unternehmen bzw. dem Zulassungsinhaber [2, 3].
Die Interpretation der Raumtemperatur als Temperaturkorridor von 15 bis 25 °C könnte darauf zurückzuführen sein, dass das Europäische Arzneibuch bei analytischen Verfahren die Angabe „Raumtemperatur“ entsprechend definiert [4, 5]. In der WHO-Leitlinie „Guide to good storage practices for pharmaceuticals“ (GSP) wird jedoch explizit aufgeführt, dass der Lagerhinweis „Nicht über +25 °C lagern“ auf der Umverpackung einem tolerierbaren Temperaturkorridor von 2 bis 25 °C entspricht [6]. Da jedoch Arzneimittel mit dem Lagerungshinweis „Nicht im Kühlschrank lagern“ (d. h. über 8 °C lagern) in Verkehr sind, sollte ein Temperaturkorridor von 9 bis 25 °C gewählt werden [7].
Eine Erweiterung des zulässigen Temperaturkorridors auf 9 bis 25 °C würde sich durch die reduzierte Klimatisierung kostensparend auf die Lagerung und Logistik auswirken und auch die Umwelt schonen. Wegen der Arzneimittelsicherheit darf dieser Temperaturkorridor jedoch nicht den Herstellerangaben zu den jeweiligen Arzneimitteln widersprechen. Zudem ist generell nachzuweisen, dass er die Qualität und Sicherheit der Arzneimittel nicht beeinträchtigt. Ein entsprechendes Pilotprojekt wird zurzeit bei der Firma kohlpharma durchgeführt [7].
Neben der Forderung, die Temperatur beim Transport in einem „akzeptablen Bereich“ zu halten, fordert die GDP-Leitlinie den Schutz der Arzneimittel vor Bruch, Beeinträchtigung und Diebstahl [2, Kap. 9.1]. Deswegen werden Arzneimittel vor dem Versand vom Großhändler in Kunststoffwannen mit Deckel verpackt. Diese Plastikcontainer sind zudem abwaschbar und stapelbar, was die Hygiene und die Transportierbarkeit erheblich verbessert.
Um die Arzneimittel vor Diebstahl oder Manipulation seitens Dritter zu schützen, können die Container und die Styroporboxen der Kühlware mit einer punktverschweißten Plastikbanderole umschlossen oder verplombt werden. Durch die Unversehrtheit dieser Verschlusselemente ist sichergestellt, dass keine unbefugte Person auf dem Transportweg Zugang zu den Arzneimitteln hat. Da bei verplombten Containern eine Überprüfung ihres Inhalts auf dem Transportweg nicht möglich ist, fordert die GDP-Leitlinie, dass sie etikettiert werden:
„Behälter sollten mit Etiketten versehen sein, die ausreichende Informationen über die Handhabungs- und Lagerbedingungen sowie Vorsichtsmaßnahmen enthalten, damit sichergestellt ist, dass die Produkte jederzeit korrekt gehandhabt werden und gesichert sind. Aus der Etikettierung sollte der Inhalt des Behälters und dessen Herkunft hervorgehen.“ [2, S. 11]
Spezielle Arzneimitteltransporter
Gemäß der GDP-Leitlinie sollten ausschließlich dem Arzneimitteltransport vorbehaltene Fahrzeuge und Geräte verwendet werden (Abb. 1). Zu diesem Zweck bieten verschiedene Hersteller „GDP-konform“ umgebaute Transportfahrzeuge an, die auch von ihnen für den Arzneimitteltransport zertifiziert werden. Diese Fahrzeuge besitzen in den meisten Fällen eine Vollisolation, eine Kühlung und Heizung sowie Ösen zur Ladungssicherung. Optional können eine Temperaturanzeige im Fahrerhaus sowie ein Temperaturschreiber mit Drucker eingebaut werden.
Validierung des Gesamtsystems
Auch wenn die Kühlboxen und Arzneimitteltransporter zertifiziert sind, sollte der Besitzer zur Gewährleistung der Arzneimittelsicherheit eine Validierung des Gesamtsystems in Betracht ziehen. An der herstellerseitigen Zertifizierung wird des Öfteren bemängelt, dass die Tests unter Laborbedingungen, welche nicht der Realität entsprechen, durchgeführt werden. Bei einer Validierung des Gesamtsystems würde das Zusammenspiel der einzelnen Bestandteile geprüft, indem ein Arzneimitteltransporter mit Raumtemperaturware und Kühlboxen beladen wird. Das Transportgut sollte dabei mit abgelaufenen Arzneimitteln oder Ausschussware und nicht mit vorgekühlten Wasserflaschen wie in Labortests simuliert werden.
Der befüllte und mit mehreren Thermometern ausgestattete Arzneimitteltransporter kann z. B. in einer zertifizierten Klimakammer geprüft werden, die Temperaturen von +40 °C (Sommer) bis -25 °C (Winter) erreichen und halten kann. Während des mehrstündigen Tests in der Klimakammer sollten häufig die Türen geöffnet, Waren entnommen und leere Boxen zurückgestellt werden, um möglichst realitätsnahe Bedingungen zu erreichen. Nach Beendigung des Tests zeigen die gemessenen Temperaturverläufe, wie lange der vorgeschriebene Temperaturbereich von Kühlware bzw. Raumtemperaturware gehalten wurde. Der so ermittelte Zeitraum (abzüglich eines Puffers) stellt die maximale Transportdauer für den Arzneimitteltransporter dar. |
Literatur
[1] Europäische Kommission. Leitlinien vom 19. März 2015 zu den Grundsätzen der guten Vertriebspraxis für Wirkstoffe von Humanarzneimitteln (2015/C 95/01)
[2] Europäische Kommission. Leitlinien vom 7. März 2013 für die gute Vertriebspraxis von Humanarzneimitteln (2013/C 343/01) (kurz: GDP-Leitlinie)
[3] Verordnung über die Anwendung der Guten Herstellungspraxis bei der Herstellung von Arzneimitteln und Wirkstoffen und über die Anwendung der Guten fachlichen Praxis bei der Herstellung von Produkten menschlicher Herkunft (Arzneimittel- und Wirkstoffherstellungsverordnung – AMWHV) vom 3. November 2006
[4] Europäisches Arzneibuch, 9. Ausgabe 2018, 1.2 Begriffe in Allgemeinen Kapiteln und Monografien sowie Erläuterungen
[5] GMP-Berater –Die GMP-Wissenssammlung für Pharmaindustrie und Lieferanten, inkl. 51. Aktualisierung (Februar 2018). GMP-Verlag, Schopfheim, Kap. 24.F.3.3
[6] WHO. Guide to good storage practices for pharmaceuticals. WHO Technical Report Series No. 908, 2003, S. 136
[7] Autoreninterview Dr. Christoph Frick. GMP-Magazin Logbuch 2017;(4):32-37























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.