
- DAZ.online
- DAZ / AZ
- DAZ 15/2018
- Wann wird der Patient ...
Klinische Pharmazie
Wann wird der Patient dialysepflichtig?
Mittels Risikogleichung KFRE lässt sich die Progression einer Niereninsuffizienz besser abschätzen
Wenn eine Niereninsuffizienz diagnostiziert wird, stellen sich immer mehrere Fragen. Eine davon ist, wie schnell sich beim jeweiligen Patienten die Krankheit entwickeln wird, um zuletzt das Stadium zu erreichen, das im englischen Sprachgebrauch als „End Stage Renal Disease“ (ESRD) bezeichnet wird. Das (nahezu) vollständige Versagen der Nieren ist gleichbedeutend mit Dialyse, Nierentransplantation (sofern diese noch möglich ist) oder Tod durch Urämie. Das Risiko einer schnellen Abnahme der Nierenfunktion kann patientenindividuell erheblich variieren (s. Kasten „Stadieneinteilung der Niereninsuffizienz“).
Stadieneinteilung der Niereninsuffizienz nach KDOGI [1]:
Stadium 1: GFR > 89 ml/min mit Proteinurie: Nierenkrankheit ohne Funktionseinschränkung
Stadium 2: GFR 60 – 89 ml/min ohne Proteinurie: milde Funktionseinschränkung der Niere ~ mit Proteinurie: Nierenkrankheit mit Funktionseinschränkung
Stadium 3: GFR 30 – 59 ml/min: Nierenkrankheit mit moderater Funktionseinschränkung
Stadium 4: GFR 15 – 29 ml/min: Nierenkrankheit mit schwerer Funktionseinschränkung
Stadium 5: GFR < 15 ml/min: chronisches Nierenversagen
Gelingt diese Risikoeinschätzung mit akzeptabler Zuverlässigkeit, bringt dies Vorteile bei der Entscheidung,
- welchen Patienten man genauer beobachten und etwas aufwendiger betreuen sollte,
- wen man diätetisch etwas strenger führen sollte (was ja immerhin eine Einschränkung seiner Lebensqualität sein kann) und
- wer mit welcher Dringlichkeit ein Kandidat für die Transplantationsliste bei Eurotransplant werden könnte.
Serum-Creatinin und Serum-Harnstoff als Kriterien
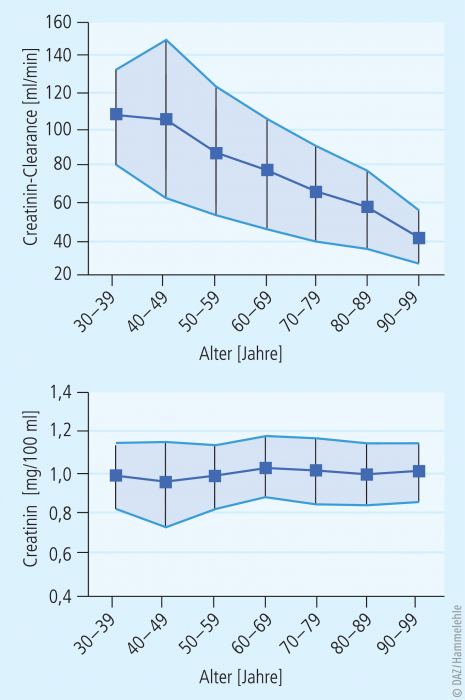
Als man sich mit der Prognose der Krankheitsprogression befasste, zeigte sich schnell, dass die beiden herkömmlichen Retentionsparameter – Serum-Creatinin und Serum-Harnstoff – dafür nur bedingt geeignet waren. Diese Parameter waren zu sehr Momentaufnahmen, beeinflusst durch die Muskelmasse und die aktuelle Nahrungsaufnahme. Allein die Tatsache, dass das Creatinin aus der Muskulatur stammt und daher bei fehlender Muskelmasse in so geringer Menge ins Blut abgegeben wird, dass es auch bei fortgeschrittener Niereninsuffizienz nicht mehr auffällig kumuliert, führte und führt noch heute zu vielen verspäteten Diagnosen (s. Kasten „Problematik des Serum-Creatininwerts“).
Problematik des Serum-Creatininwerts
Creatinin ist ein biologisches Abfallprodukt, das aus Creatinphosphat, einer Energiereserve der Muskelzelle, entsteht. Wenn Creatinphosphat seine Phosphatgruppe an ADP abgegeben hat, wandelt sich das verbleibende Creatin durch spontanen Ringschluss in Creatinin, das keine Phosphatgruppe mehr aufnehmen kann und zur renalen Elimination aus der Muskelzelle entfernt wird. Etwa 1% des Creatins geht pro Tag auf diese Weise verloren.
Creatinin kumuliert bei nachlassender Nierenfunktion im Serum, ist aber auch bei Menschen mit überdurchschnittlicher Muskelmasse wie Bodybuildern trotz normaler Nierenfunktion moderat erhöht. Umgekehrt erlaubt ein (noch) normaler Serum-Creatininwert (< 1,2 mg/dl) bei Menschen mit geringer Muskelmasse nicht den Schluss auf eine voll erhaltene Nierenfunktion. Insbesondere in der Geriatrie wird die GFR immer wieder deutlich überschätzt, weil den Patienten Muskelmasse fehlt.
Unzuverlässige Formeln
Die beiden Formeln, die die klinisch-chemischen Laboratorien zur Umrechnung des Serum-Creatininwerts in die geschätzte glomeruläre Filtrationsrate (eGFR) verwenden, erhöhen die Ungenauigkeit noch. Die MDRD-Formel (Modification of Diet in Renal Disease) und die CKD-EPI-Formel (Chronic Kidney Disease Epidemiology Collaboration) sind nach den Studien benannt, in deren Rahmen sie entwickelt wurden [3, 4], und beide haben eine Gemeinsamkeit: Sie müssen ohne die Muskelmasse und das Körpergewicht auskommen – diese sind dem Labor nämlich nicht bekannt. Das Ergebnis der Berechnung wird, gewissermaßen als Notlösung, auf einen „Durchschnittsmenschen“ mit einer Körperoberfläche von 1,73 m2 bezogen. Anzumerken ist hier, dass die Erhebung, der zufolge die durchschnittliche Körperoberfläche der erwachsenen Bevölkerung in westlichen Ländern 1,73 m2 beträgt, fast ein Jahrhundert alt ist und heute sicher nicht mehr die Realität wiedergibt. Aus all diesen Unschärfen resultiert eine Ungenauigkeit, die zu der Variabilität aufgrund der unterschiedlichen Muskelmassen hinzukommt.
Im Gegensatz zur MDRD- und CKD-EPI-Formel liefert die Cockcroft-Gault-Formel, die das Körpergewicht einbezieht, deutlich verlässlichere Werte [5].
Mit Albumin-Creatinin-Quotient zur Risikogleichung KFRE
Seit 2001 testeten Navdeep Tangri und Mitarbeiter Formeln, um bei niereninsuffizienten Patienten im Stadium 3 bis 5 diejenigen mit einer raschen Progression der Krankheit zu identifizieren (vollständiges Nierenversagen mit Dialysepflicht innerhalb von zwei bis fünf Jahren). Die Studie wurde 2008 abgeschlossen, 2011 publiziert, und die Ergebnisse wurden durch eine 2016 publizierte Metaanalyse bestätigt [6, 7].
Die Autoren erkannten schnell, dass eine nur auf Alter, Geschlecht und eGFR basierende 3-Variablen-Formel das Risiko der Progression nicht hinreichend genau vorhersagen kann. Eine 4-Variablen-Formel nimmt noch den Albumin-Creatinin-Quotienten im Urin hinzu – ähnlich wie bei der Creatinin-Clearance dient hier also das im Urin ausgeschiedene Creatinin als Korrekturfaktor. Eine 8-Variablen-Formel bezieht zusätzlich vier Parameter ein, die im Serum gemessen werden, nämlich Calcium, Phosphat, Hydrogencarbonat und Albumin. Da die Ergebnisse der 4-Variablen-Formel nahezu ebenso akkurat sind wie die der 8-Variablen-Formel, hat sie sich als die einfachere Formel durchgesetzt. Tangri stellt sie in Gestalt eines „Risiko-Rechners“ auf seiner Homepage zur Verfügung: kidneyfailurerisk.com [8].
Wenn heute von der „Kidney Failure Risk Equation“ (KFRE) die Rede ist, kann davon ausgegangen werden, dass die 4-Variablen-Formel gemeint ist. Inzwischen hat eine weitere Studie ergeben, dass die Formel auch auf Kinder mit chronischem Nierenversagen anwendbar ist [9].
Einfache Analytik
Die quantitative Bestimmung von Albumin und Creatinin im Urin sind relativ simple Analysen, die sogar als Point-of-Care-Methoden zur Messung in Praxen oder Apotheken zur Verfügung stehen. Die eGFR kann, da es hier seitens Tangri keine Vorgaben gibt, mittels der Cockcroft-Gault-Formel präziser in die Gleichung eingebracht werden, als dies die klinisch-chemischen Labore mit der MDRD- oder CKD-EPI-Formel vermögen [5]. Damit steht mit der KFRE ein Werkzeug zur Verfügung, um Patienten, denen ein schnelles Voranschreiten ihrer Nierenkrankheit droht, ohne großen Aufwand zu identifizieren.
Diät und problematische Elektrolyte
Die pharmazeutische Betreuung dieser Patienten beginnt bei der sehr anspruchsvollen Beratung zu ihrer Ernährung.
Die Nationale VersorgungsLeitlinie „Nierenerkrankungen bei Diabetes im Erwachsenenalter“ empfiehlt, ohne dabei auf den Grad der Niereninsuffizienz einzugehen, eine tägliche Eiweißaufnahme von 0,8 g pro kg Körpergewicht. Wie die MDRD-Studie gezeigt hat, erhöht eine noch geringere Proteinaufnahme die Sterblichkeit der Patienten aufgrund von Eiweißmangelsymptomen (Kwashiorkor), die sich stärker auswirken als die gleichzeitige Milderung der Urämiesymptome (aufgrund der verminderten Stickstoffzufuhr) [10].
Die für die Ernährung bedeutsamen Serumelektrolyte beim niereninsuffizienten Patienten sind Kalium, Phosphat und meist auch Natrium. Von ihnen ist Kalium der kurzfristig wichtigste Parameter, weil ein schneller Anstieg infolge eines Diätfehlers bei fortgeschrittener Niereninsuffizienz durch Arrhythmien zum Tod führen kann.
Im Unterschied zum Kalium stehen beim Phosphat die langfristigen Folgen im Vordergrund, insbesondere die Gefäßverkalkung durch das bei neutralem pH‑Wert schwerlösliche Calciumphosphat. Der Normwert für Phosphat im Blut liegt zwischen 0,8 und 1,45 mmol/l und muss konstant in diesen Grenzen gehalten werden, um Langzeitschäden zu vermeiden. Richtiges Phosphatmanagement setzt sich aus einer verminderten Phosphataufnahme und der korrekten Anwendung des für den Patienten geeigneten Phosphatbinders zusammen. Hinzu kommt bei den meisten Patienten eine Kochsalzrestriktion auf 5 bis 6 g am Tag, um der zunehmenden Ödemneigung entgegenzuwirken.
Auf mögliche Interaktionen achten
Selbstverständlich ist bei diesen Patienten ein kritischer Umgang mit (verordneten oder zur Selbstmedikation gewünschten) Arzneimitteln, die die Nierenfunktion gefährden können, erforderlich. Dies gilt insbesondere für NSAR, wenn die Patienten Hemmstoffe des Renin-Angiotensin-Systems (ACE-Hemmer oder Sartane) und Diuretika anwenden. Die als „Triple Whammy“ (dreifacher Angriff) bekannte Interaktion ist einer der häufigsten Gründe für ein akutes Nierenversagen in der Geriatrie.
Metformin schon früher absetzen?
Ein Beispiel für die Rolle des Pharmazeuten bei der Betreuung niereninsuffizienter Patienten ist die Beratung zur langfristigen Therapieplanung bei Diabetikern, zumal Diabetes ja eine der vorrangigen Ursachen der chronischen Nierenkrankheit darstellt. Im März 2013 meldete die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) eine deutliche Zunahme der Spontanmeldungen von z. T. tödlichen Lactatazidosen unter Metformin [11]. Metformin war bis vor wenigen Jahren in Deutschland bei einer GFR unter 60 ml/min kontraindiziert und darf heute bis zu einer GFR von 45 ml/min (entsprechend Stadium 3 nach KDOGI) in reduzierter Dosis gegeben werden.
Eine skandinavische Studie zeigt mit ihren Fallberichten von Lactatazidosen die Risiken dieser Praxis bei Patienten mit rasch fortschreitender Niereninsuffizienz. Im Beobachtungszeitraum von zwei Jahren traten bei 5408 Patienten mit Metformin-Therapie drei Fälle von Lactatazidose auf, aber überraschenderweise keiner in der höchsten Altersgruppe. In einem der Fälle lag als Komorbidität ein Pankreaskarzinom mit Lebermetastasen vor, doch die Autoren sahen keinen Bezug zur GFR. In den beiden anderen Fällen, die keine schweren Komorbiditäten aufwiesen, verbesserte sich die GFR nach dem Ereignis deutlich, woraus die Autoren folgerten, dass ein rapider Abfall der Nierenleistung die Lactatazidose ausgelöst hatte [12].
Eine ähnliche Konstellation ist bei Niereninsuffizienten gegeben, die mittels KFRE als Risikopatienten identifiziert wurden. Die Anwendung der Formel bei Diabetikern könnte also helfen, den von der AkdÄ gemeldeten Anstieg der Lactatazidosen zu stoppen, indem diese Patienten eher früher als zu spät von Metformin auf Insulin umgestellt werden. Ob das tatsächlich gelingen kann, muss die Zeit zeigen. |
Literatur
[1] http://kdigo.org/guidelines/ckd-evaluation-and-management
[2] Kolb GF, Leischker AH. Medizin des alternden Menschen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2009
[3] Levey AS et al. A More Accurate Method to Estimate Glomerular Filtration Rate from Serum Creatinine: A New Prediction Equation, Ann Intern Med 1999;130:461-470
[4] Levey AS et al. A New Equation to Estimate Glomerular Filtration Rate. Ann Intern Med 2009;150:604-612
[5] Alter M, Zieglmeier M. Die perfekte Formel. Dtsch Apoth Ztg 2013;153(32):54-58
[6] Tangri N et al. A predictive model for progression of chronic kidney disease to kidney failure. JAMA 2011;305(15):1553-1559
[7] Tangri N et al. Multinational Assessment of Accuracy of Equations for Predicting Risk of Kidney Failure. A Metaanalysis. JAMA 2016;315(2):164-174
[8] http://kidneyfailurerisk.com
[9] Winnicki E et al. Use of the Kidney Failure Risk Equation to Determine the Risk of Progression to End-stage Renal Disease in Children with Chronic Kidney Disease. JAMA Pediatr 2018;172(2):174-180
[10] Nationale VersorgungsLeitlinie Nierenerkrankungen bei Diabetes im Erwachsenenalter; Reg.-Nr. nvl-001d, Stand: 28.09.2015; www.awmf.org
[11] AkdÄ. Zunahme von Spontanberichten über Metformin-assoziierte Laktatazidosen. Dtsch Ärztebl 2013;110(10):A464
[12] Sterner G et al. Renal function in a large cohort of Metformin treated patients with type 2 diabetes mellitus. Br J Diabetes Vasc Dis 2012;12(5):227-231























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.